Similar presentations:
Синтез и исследование метилольных и хлорметильных производных аллантоина
1. Синтез и исследование метилольных и хлорметильных производных аллантоина
Национальныйисследовательский
ЛАБОРАТОРИЯ
ОРГАНИЧЕСКОГО
СИНТЕЗА
Томский
Государственный
университет
ТОМСКОГО ГОСУДАРСТВЕННОГО УНИВЕРСИТЕТА
Химический факультет
Кафедра органической химии
Татаренко Ольга, 5 курс
Студентка группы 08203
Научный руководитель: доцент, к.х.н. Мальков В.С.
Томск 2017 г.
2.
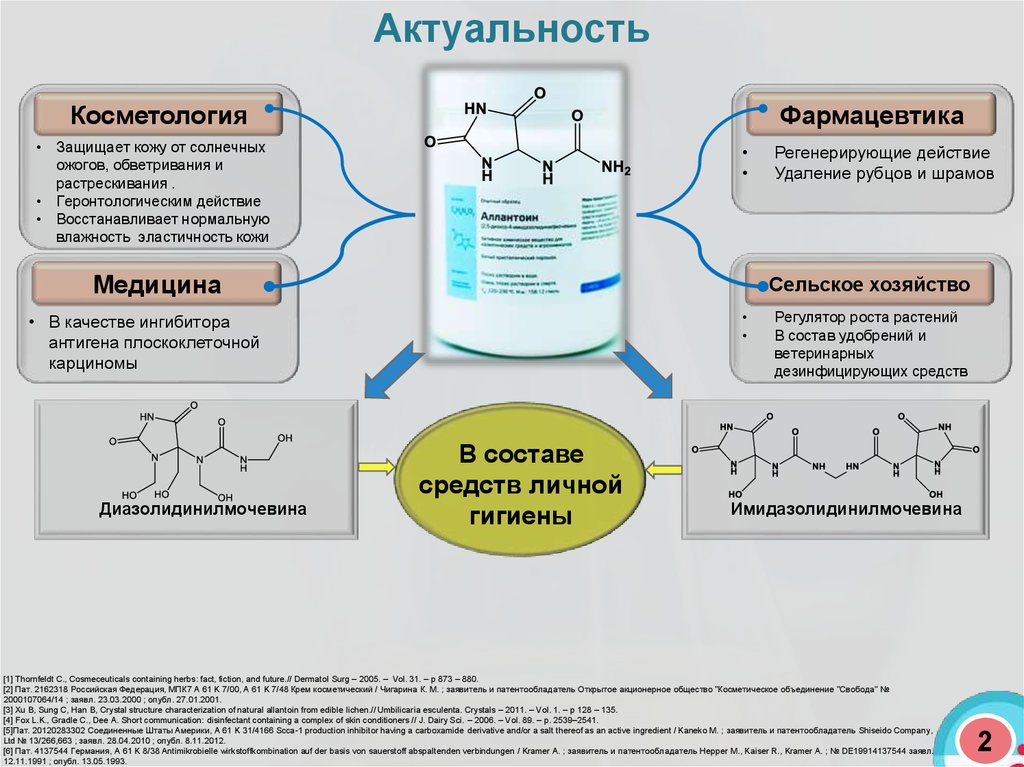
АктуальностьКосметология
Фармацевтика
• Защищает кожу от солнечных
ожогов, обветривания и
растрескивания .
• Геронтологическим действие
• Восстанавливает нормальную
влажность эластичность кожи
Медицина
Сельское хозяйство
• В качестве ингибитора
антигена плоскоклеточной
карциномы
Диазолидинилмочевина
Регенерирующие действие
Удаление рубцов и шрамов
В составе
средств личной
гигиены
Регулятор роста растений
В состав удобрений и
ветеринарных
дезинфицирующих средств
Имидазолидинилмочевина
[1] Thornfeldt C., Cosmeceuticals containing herbs: fact, fiction, and future.// Dermatol Surg – 2005. – Vol. 31. – p 873 – 880.
[2] Пат. 2162318 Российская Федерация, МПК7 A 61 K 7/00, A 61 K 7/48 Крем косметический / Чигарина К. М. ; заявитель и патентообладатель Открытое акционерное общество "Косметическое объединение "Свобода" №
2000107064/14 ; заявл. 23.03.2000 ; опубл. 27.01.2001.
[3] Xu В, Sung С, Han В, Crystal structure characterization of natural allantoin from edible lichen.// Umbilicaria esculenta. Crystals – 2011. – Vol. 1. – p 128 – 135.
[4] Fox L.K., Gradle C., Dee A. Short communication: disinfectant containing a complex of skin conditioners // J. Dairy Sci. – 2006. – Vol. 89. – p. 2539–2541.
[5]Пат. 20120283302 Соединенные Штаты Америки, A 61 K 31/4166 Scca-1 production inhibitor having a carboxamide derivative and/or a salt thereof as an active ingredient / Kaneko M. ; заявитель и патентообладатель Shiseido Company,
Ltd № 13/266,663 ; заявл. 28.04.2010 ; опубл. 8.11.2012.
[6] Пат. 4137544 Германия, A 61 K 8/38 Antimikrobielle wirkstoffkombination auf der basis von sauerstoff abspaltenden verbindungen / Kramer A. ; заявитель и патентообладатель Hepper M., Kaiser R., Kramer A. ; № DE19914137544 заявл.
12.11.1991 ; опубл. 13.05.1993.
2
3.
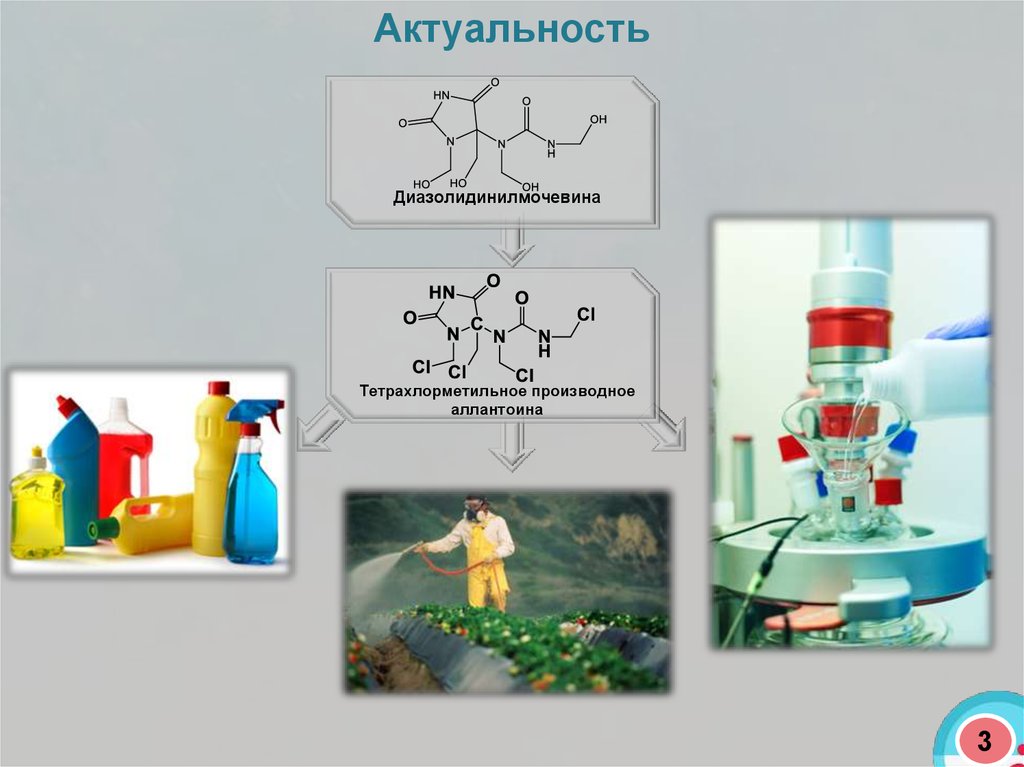
АктуальностьДиазолидинилмочевина
Тетрахлорметильное производное
аллантоина
3
4.
Цель и задачиЦель
- получение метилольных производных аллантоина и синтез
хлорметильного производного аллантоина из диазолидинилмочевины,
выделение указанных соединений и их идентификация различными
физико-химическими методами.
Задачи:
• Обзор литературных данных в области способов синтеза
диазолидинилмочевины и имидазолидинилмочевины, а также реакций
замещения гидроксильных групп на галоген у родственных
гетероциклических азотсодержащий соединений;
• Синтез
и
выделение
диазолидинилмочевины
и
имидазолидинилмочевины;
• Разработка способа синтеза нового хлорметильного производного
аллантоина путем замещения гидроксильной группы на галоген, а
также разработка способа его выделения из реакционной смеси;
Подтверждение структуры полученных соединений различными
физико-химическими методами (ТГА, ВЭЖХ, ТСХ, элементный анализ,
ИК- и ЯМР-спектроскопия).
4
5.
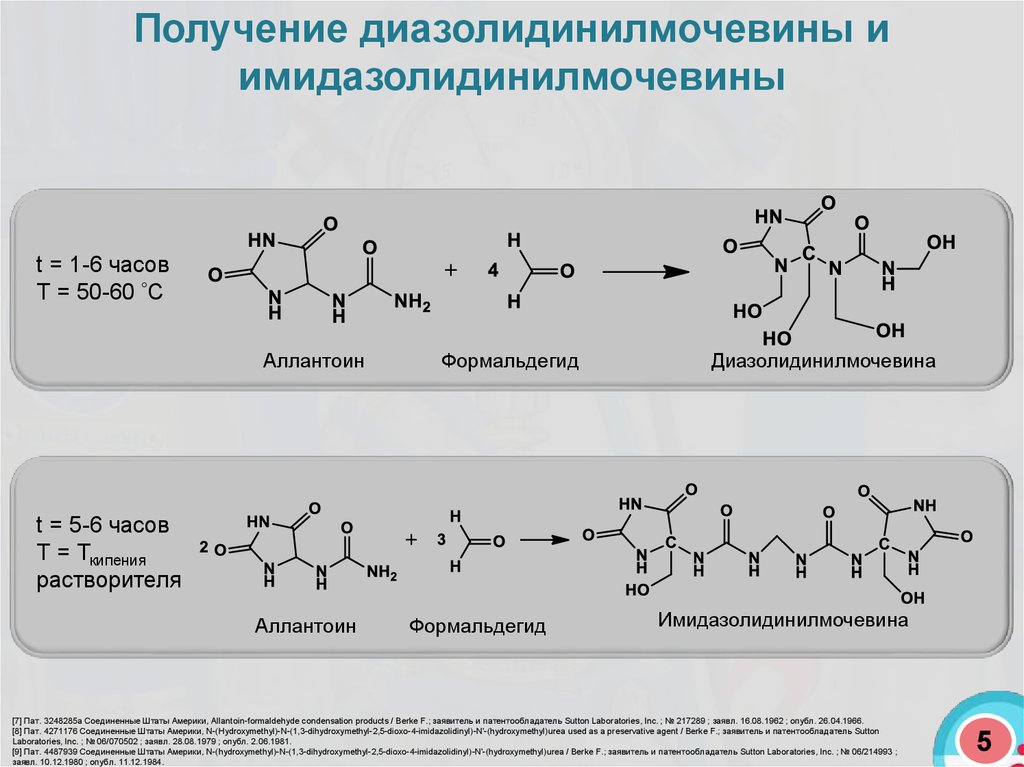
Получение диазолидинилмочевины иимидазолидинилмочевины
t = 1-6 часов
Т = 50-60 С
Аллантоин
Формальдегид
Диазолидинилмочевина
t = 5-6 часов
Т = Ткипения
растворителя
Аллантоин
Формальдегид
Имидазолидинилмочевина
[7] Пат. 3248285a Соединенные Штаты Америки, Allantoin-formaldehyde condensation products / Berke F.; заявитель и патентообладатель Sutton Laboratories, Inc. ; № 217289 ; заявл. 16.08.1962 ; опубл. 26.04.1966.
[8] Пат. 4271176 Соединенные Штаты Америки, N-(Hydroxymethyl)-N-(1,3-dihydroxymethyl-2,5-dioxo-4-imidazolidinyl)-N'-(hydroxymethyl)urea used as a preservative agent / Berke F.; заявитель и патентообладатель Sutton
Laboratories, Inc. ; № 06/070502 ; заявл. 28.08.1979 ; опубл. 2.06.1981.
[9] Пат. 4487939 Соединенные Штаты Америки, N-(hydroxymethyl)-N-(1,3-dihydroxymethyl-2,5-dioxo-4-imidazolidinyl)-N'-(hydroxymethyl)urea / Berke F.; заявитель и патентообладатель Sutton Laboratories, Inc. ; № 06/214993 ;
заявл. 10.12.1980 ; опубл. 11.12.1984.
5
6.
ЯМР - спектроскопияРасшифровка 1H ЯМР-спектра
Расшифровка 13С ЯМР-спектра
Диазолидинилмочевины
2H; 2H; 2H; 2H – 3,5-5
ppm;
NH – 6,7-6,8 ppm;
NH – 7,1 ppm.
4CH2– 61,38-63,71 ppm;
1C – 74,51 ppm;
2C – 155,47-155,74 ppm ;
1C – 171,73 ppm.
Расшифровка 1H ЯМР-спектра имидазолидинилмочевины
O
HN
O
O
O
C
N
H
HO
N
CH2 H
NH
O
O
C
NH
NH
C
H2
N
HH C
2
N
H
OH
4Н – 3,39-3,41 ppm; 2H – 4,66-4,97 ppm; 2H – 5,25-5,33
ppm; 2H – 5,81-5,86 ppm; 2H – 6,94-699 ppm; 2H – 8,41.
6
7.
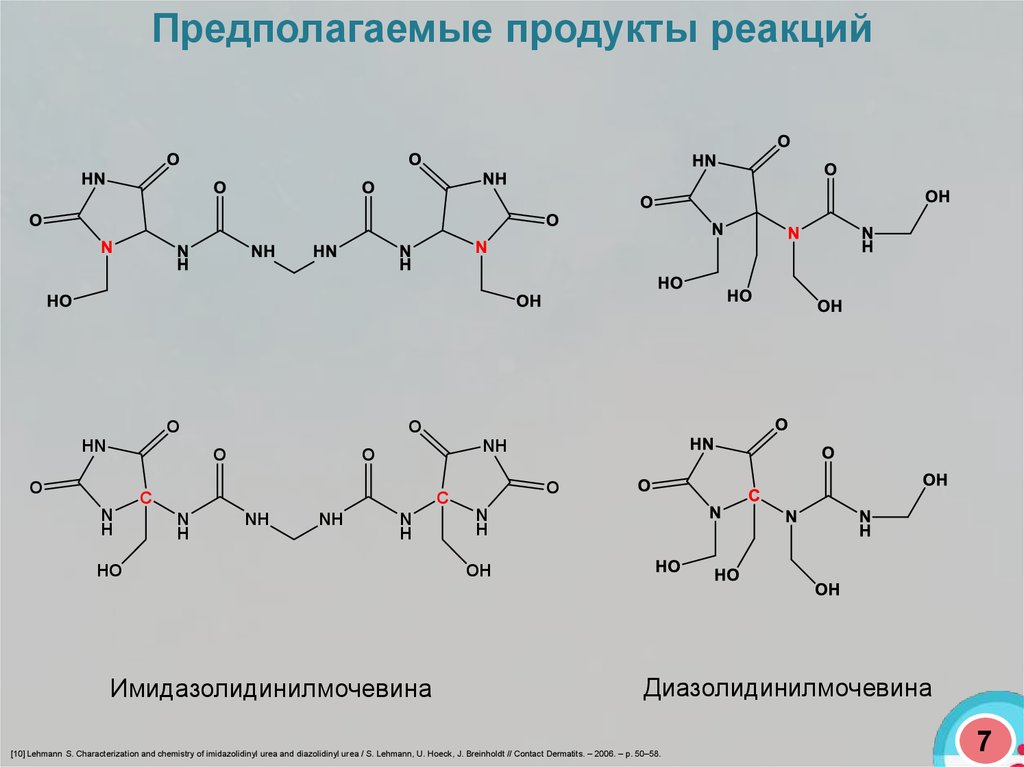
Предполагаемые продукты реакцийO
HN
O
O
O
NH
O
C
N
H
O
C
N
H
NH
NH
N
H
HO
Имидазолидинилмочевина
N
H
OH
Диазолидинилмочевина
[10] Lehmann S. Characterization and chemistry of imidazolidinyl urea and diazolidinyl urea / S. Lehmann, U. Hoeck, J. Breinholdt // Contact Dermatits. – 2006. – p. 50–58.
7
8.
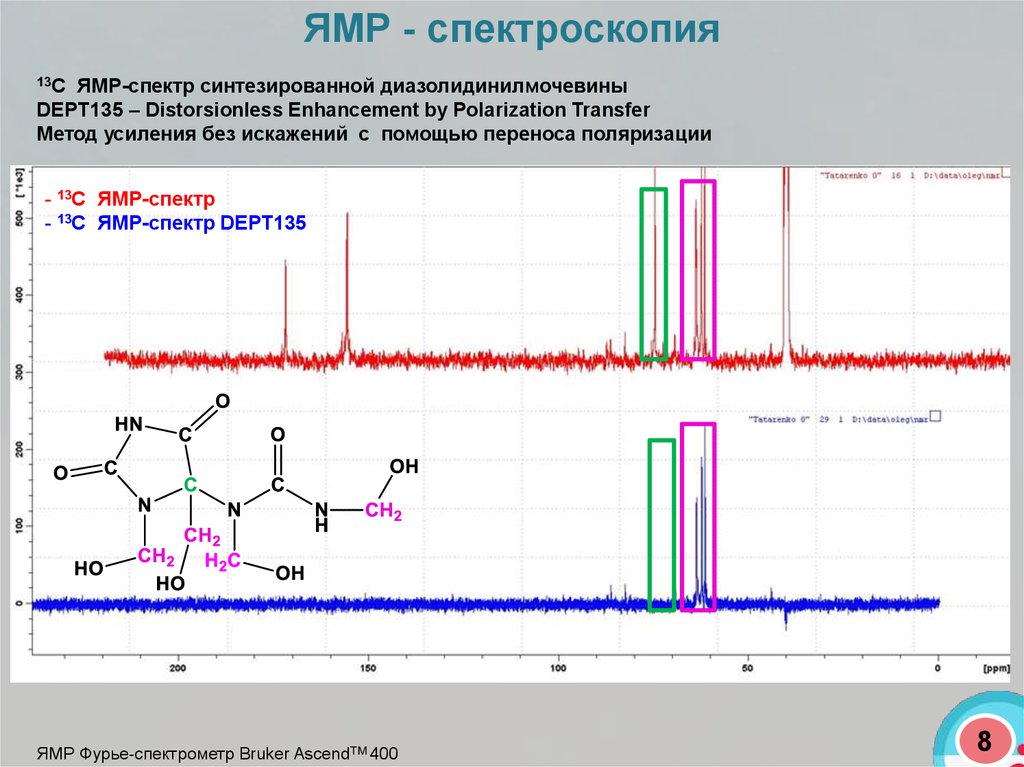
ЯМР - спектроскопия13С
ЯМР-спектр синтезированной диазолидинилмочевины
DEPT135 – Distorsionless Enhancement by Polarization Transfer
Метод усиления без искажений с помощью переноса поляризации
- 13С ЯМР-спектр
- 13С ЯМР-спектр DEPT135
ЯМР Фурье-спектрометр Bruker AscendТМ 400
8
9.
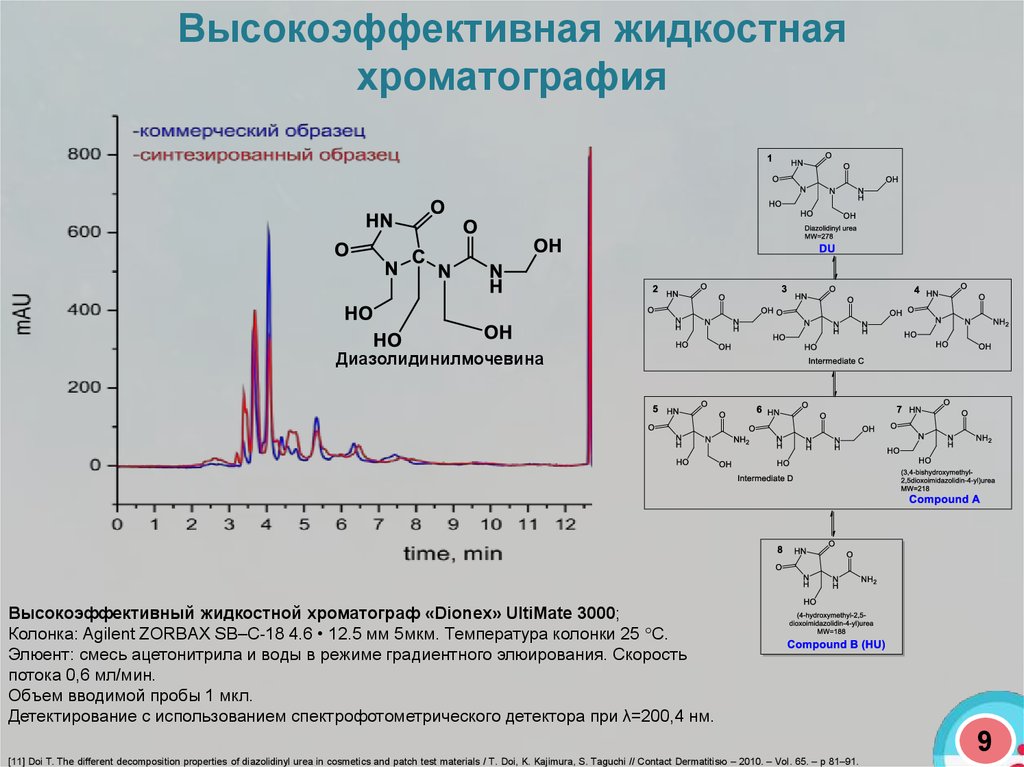
Высокоэффективная жидкостнаяхроматография
Диазолидинилмочевина
Высокоэффективный жидкостной хроматограф «Dionex» UltiMate 3000;
Колонка: Agilent ZORBAX SB–C-18 4.6 • 12.5 мм 5мкм. Температура колонки 25 С.
Элюент: смесь ацетонитрила и воды в режиме градиентного элюирования. Скорость
потока 0,6 мл/мин.
Объем вводимой пробы 1 мкл.
Детектирование с использованием спектрофотометрического детектора при λ=200,4 нм.
[11] Doi T. The different decomposition properties of diazolidinyl urea in cosmetics and patch test materials / T. Doi, K. Kajimura, S. Taguchi // Contact Dermatitisю – 2010. – Vol. 65. – p 81–91.
9
10.
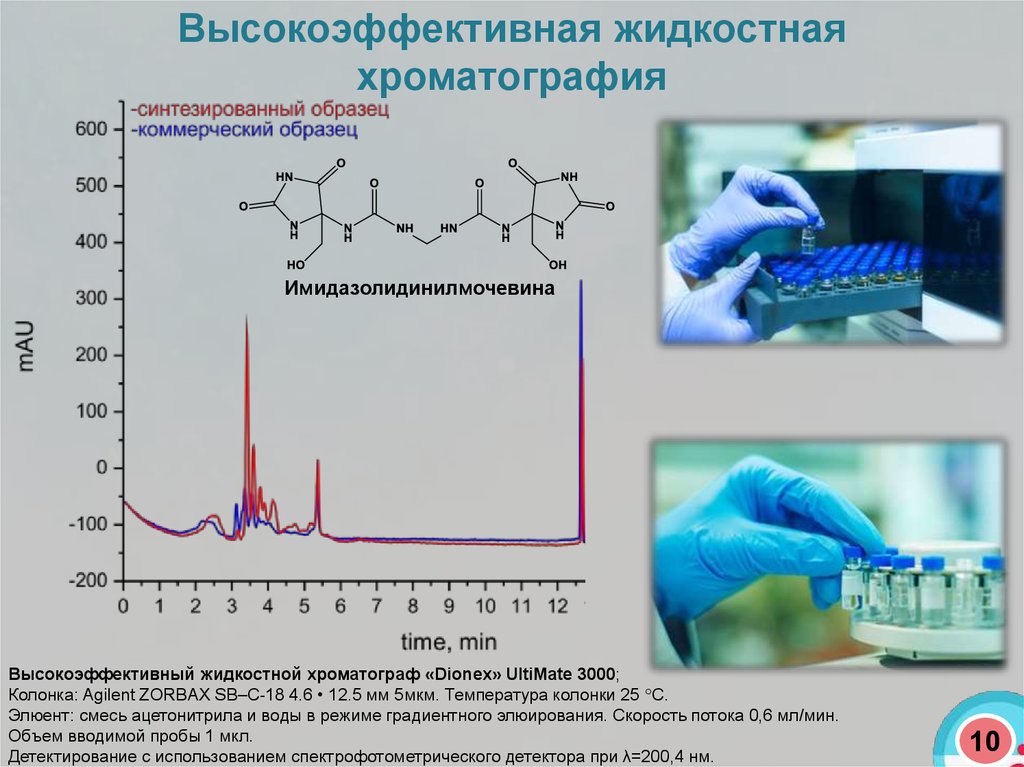
Высокоэффективная жидкостнаяхроматография
Имидазолидинилмочевина
Высокоэффективный жидкостной хроматограф «Dionex» UltiMate 3000;
Колонка: Agilent ZORBAX SB–C-18 4.6 • 12.5 мм 5мкм. Температура колонки 25 С.
Элюент: смесь ацетонитрила и воды в режиме градиентного элюирования. Скорость потока 0,6 мл/мин.
Объем вводимой пробы 1 мкл.
Детектирование с использованием спектрофотометрического детектора при λ=200,4 нм.
10
11.
C=OкольцаOH
CH2
C=O кольца
C-N
N-H амид
О-=С-N
С-ОH
C=O амид
ИК – спектроскопия
Имидазолидинилмочевина
Диазолидинилмочевина
ИК-Фурье-спектрометр Nicolet 6700
11
12.
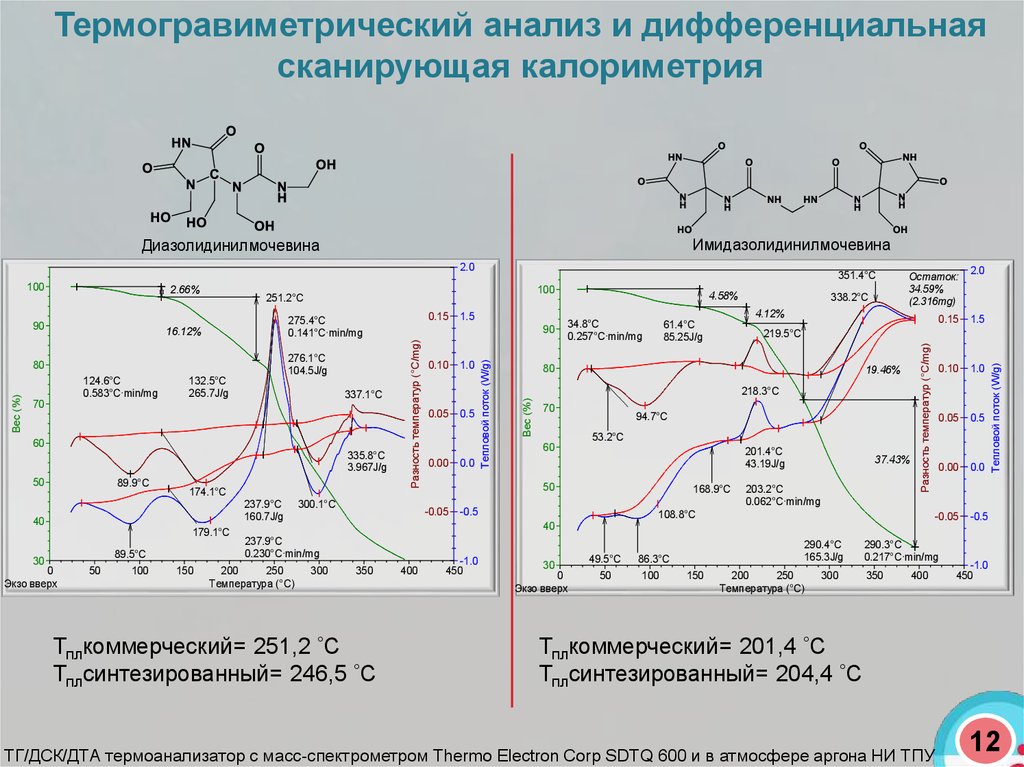
Термогравиметрический анализ и дифференциальнаясканирующая калориметрия
Образец: 5
Размер: 6.6960 mg
Метод: Ramp
Диазолидинилмочевина
Файл: C:\TA\Результаты\ЛКИ ТГУ\Iu - k.001
Оператор: Morozova Tatyana
Дата:: 19-Апр-2017 10:01
Прибор: SDT Q600 V20.9 Build 20
DSC-TGA
Имидазолидинилмочевина
2.0
2.66%
251.2°C
Вес (%)
132.5°C
265.7J/g
337.1°C
70
60
335.8°C
3.967J/g
89.9°C
50
237.9°C
160.7J/g
40
30
174.1°C
179.1°C
0
Экзо вверх
50
89.5°C
100
150
90
300.1°C
0.10
0.05
0.00
1.0
0.5
0.0
338.2°C
4.58%
34.8°C
0.257°C·min/mg
Остаток:
34.59%
(2.316mg)
2.0
0.15
1.5
0.10
1.0
0.05
0.5
0.00
0.0
-0.05
-0.5
4.12%
61.4°C
85.25J/g
219.5°C
80
19.46%
218.3°C
70
94.7°C
53.2°C
60
201.4°C
43.19J/g
50
-0.05
168.9°C
-0.5
37.43%
203.2°C
0.062°C·min/mg
108.8°C
40
237.9°C
0.230°C·min/mg
200
250
Температура (°C)
1.5
Вес (%)
276.1°C
104.5J/g
80
124.6°C
0.583°C·min/mg
0.15
275.4°C
0.141°C·min/mg
16.12%
Тепловой поток (W/g)
90
351.4°C
100
Разность температур (°C/mg)
100
300
350
Тплкоммерческий= 251,2 С
Тплсинтезированный= 246,5 С
400
-1.0
450
30
0
Экзо вверх
49.5°C
50
86.3°C
100
290.4°C
165.3J/g
150
200
250
Температура (°C)
300
290.3°C
0.217°C·min/mg
350
400
Тепловой поток (W/g)
Файл: C:\TA\Результаты\ЛКИ ТГУ\Du - k.001
Оператор: Morozova Tatyana
Дата:: 18-Апр-2017 13:24
Прибор: SDT Q600 V20.9 Build 20
DSC-TGA
Разность температур (°C/mg)
Образец: 2
Размер: 13.3770 mg
Метод: Ramp
-1.0
450
Тплкоммерческий= 201,4 С
Тплсинтезированный= 204,4 С
ТГ/ДСК/ДТА термоанализатор c масс-спектрометром Thermo Electron Corp SDTQ 600 и в атмосфере аргона НИ ТПУ
12
13.
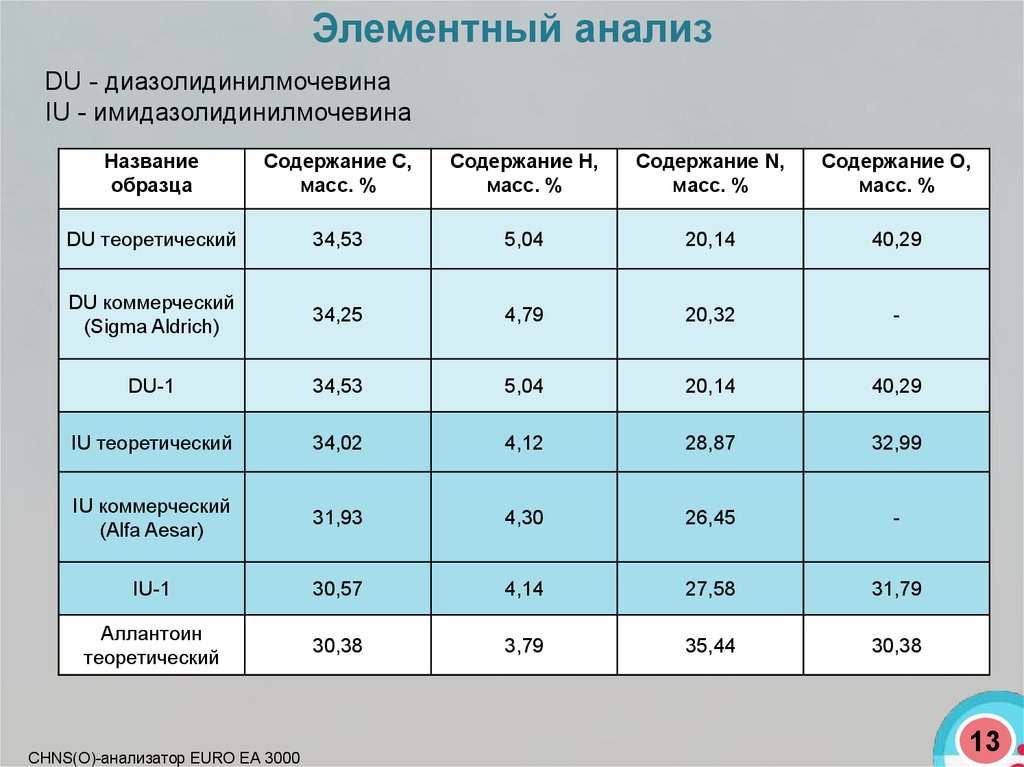
Элементный анализDU - диазолидинилмочевина
IU - имидазолидинилмочевина
Название
образца
Содержание C,
масс. %
Содержание H,
масс. %
Содержание N,
масс. %
Содержание O,
масс. %
DU теоретический
34,53
5,04
20,14
40,29
DU коммерческий
(Sigma Aldrich)
34,25
4,79
20,32
-
DU-1
34,53
5,04
20,14
40,29
IU теоретический
34,02
4,12
28,87
32,99
IU коммерческий
(Alfa Aesar)
31,93
4,30
26,45
-
IU-1
30,57
4,14
27,58
31,79
Аллантоин
теоретический
30,38
3,79
35,44
30,38
CHNS(O)-анализатор EURO EA 3000
13
14.
Рентгеноспектральный микроанализИмидазолидинилмочевина
Диазолидинилмочевина
С
N
O
С
N
O
Название
Cодержание
Cодержание
Cодержание
Название
Cодержание
Cодержание
Cодержани
образца
С, %
N, %
O, %
образца
С, %
N, %
е O, %
Расчет
36,36
21,21
42,42
Расчет
35,48
30,11
34,41
39,53±4,08
22,49±3,23
39,98±5,40
36,66±3,66
28,85±3,73
34,48±4,77
39,85±5,1
22,66±4,71
37,50±6,91
36,76±3,61
31,17±3,88
32,07±4,39
Коммерческий
образец
Синтезированный образец
Коммерческий
образец
Синтезирован-
ный образец
Морфология поверхности: растровый электронный микроскоп Hitachi TM-3000, электронная пушка 5*10–2 Па; камера для образца 30–50 Па;
Элементный анализ: приставка для энергодисперсионного микроанализа Quantax-70.
В рамках данного метода невозможно определение процентного содержания атома водорода в образце, так как данный элемент
является легким и не детектируется прибором.
14
15.
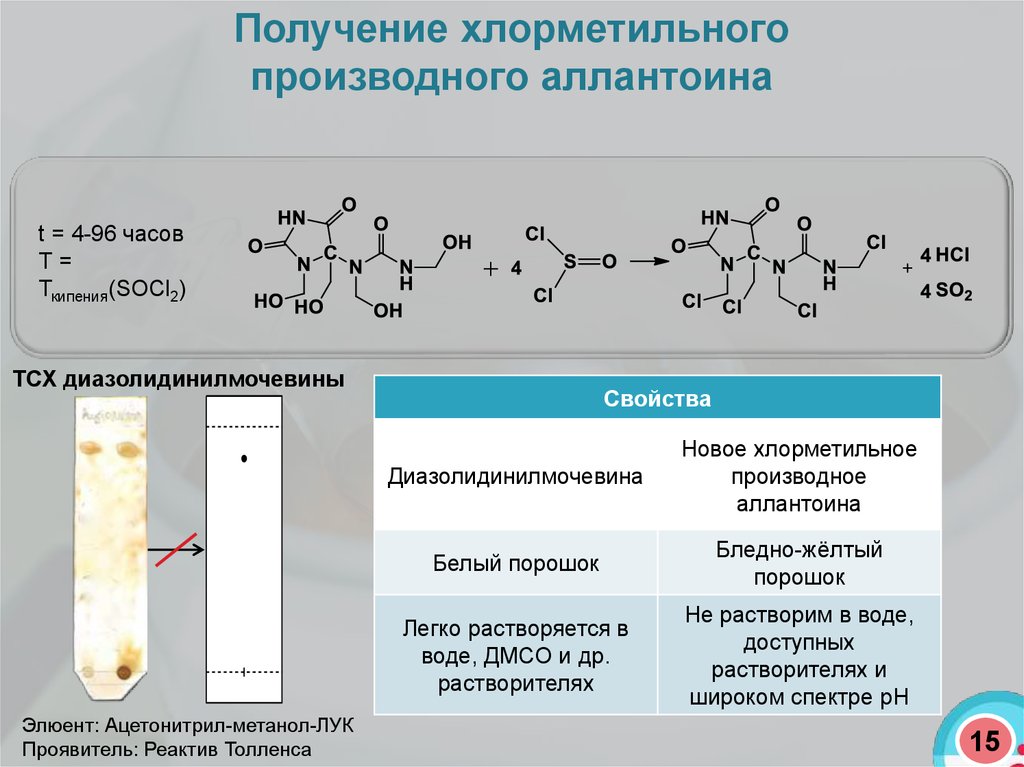
Получение хлорметильногопроизводного аллантоина
t = 4-96 часов
Т=
Ткипения(SOCl2)
ТСХ диазолидинилмочевины
Элюент: Ацетонитрил-метанол-ЛУК
Проявитель: Реактив Толленса
Свойства
Диазолидинилмочевина
Новое хлорметильное
производное
аллантоина
Белый порошок
Бледно-жёлтый
порошок
Легко растворяется в
воде, ДМСО и др.
растворителях
Не растворим в воде,
доступных
растворителях и
широком спектре pH
15
16.
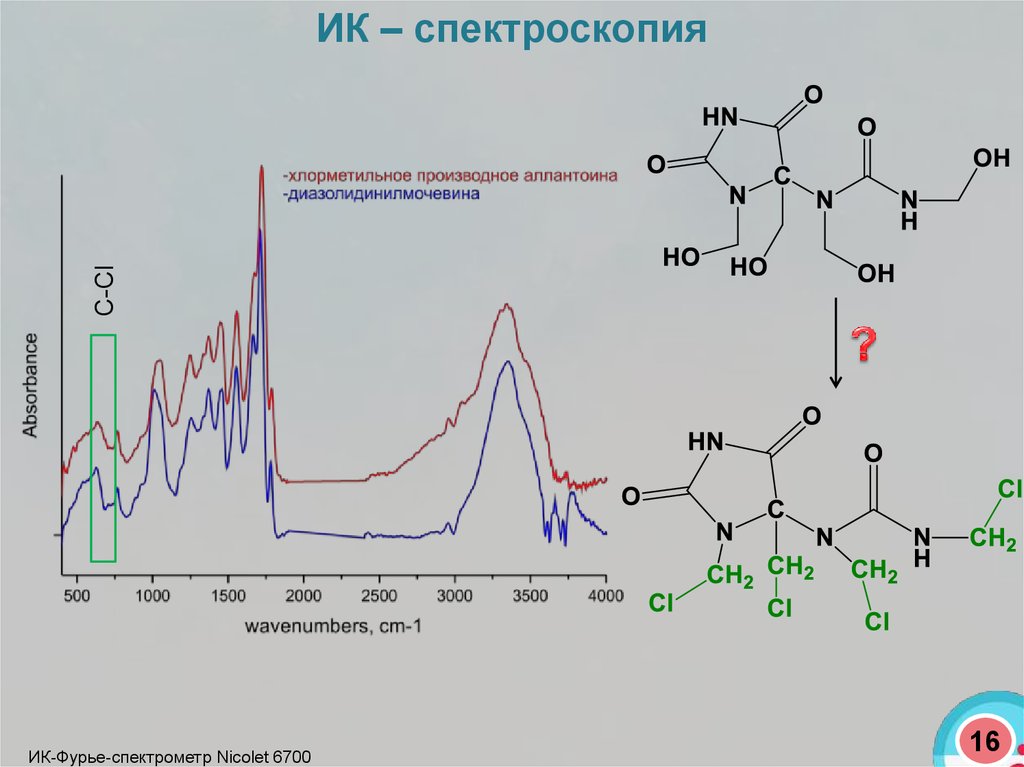
С-СlИК – спектроскопия
ИК-Фурье-спектрометр Nicolet 6700
16
17.
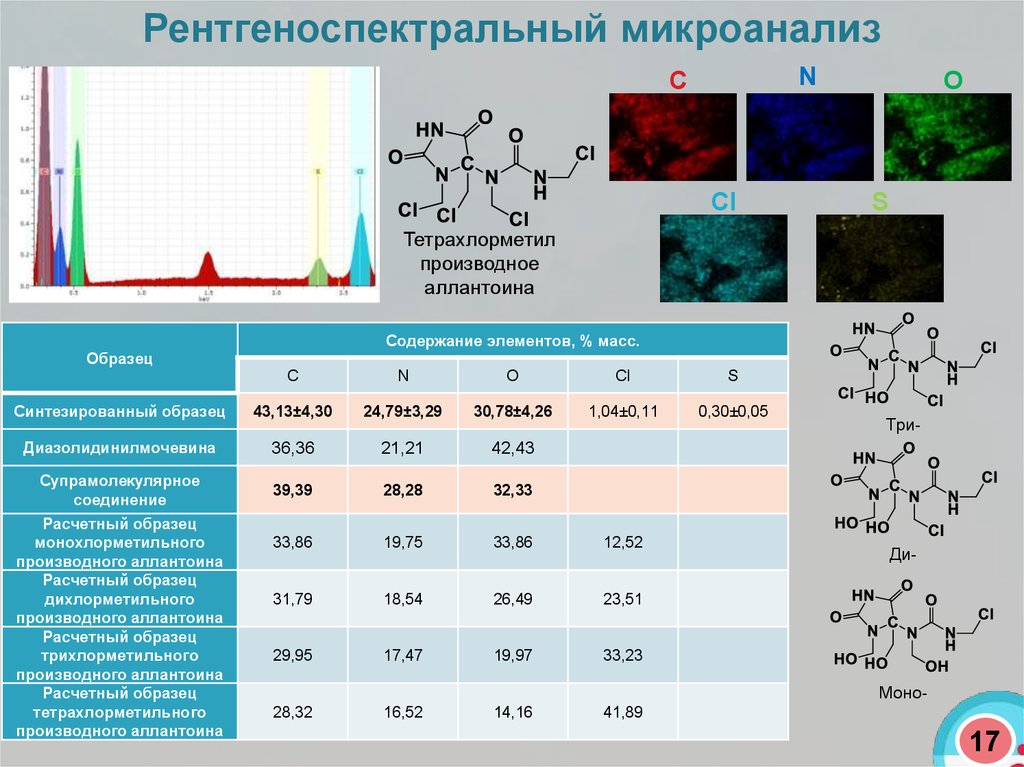
Рентгеноспектральный микроанализС
N
Сl
O
S
Тетрахлорметил
производное
аллантоина
Содержание элементов, % масс.
Образец
C
N
O
Cl
S
Синтезированный образец
43,13±4,30
24,79±3,29
30,78±4,26
1,04±0,11
0,30±0,05
Диазолидинилмочевина
36,36
21,21
42,43
Супрамолекулярное
соединение
39,39
28,28
32,33
33,86
19,75
33,86
12,52
31,79
18,54
26,49
23,51
29,95
17,47
19,97
33,23
28,32
16,52
14,16
41,89
Расчетный образец
монохлорметильного
производного аллантоина
Расчетный образец
дихлорметильного
производного аллантоина
Расчетный образец
трихлорметильного
производного аллантоина
Расчетный образец
тетрахлорметильного
производного аллантоина
Три-
Ди-
Моно-
17
18.
Предполагаемая структураТетраметилолгликолурил
Кукурбит[n]урил
Тетраметилолаллантоин
[12] Chernikova E., Fedorov Yu., Fedorova O., Cucurbituril as a new "host" of organic molecules in inclusion complexes // Russian Chemical Bulletin, International Edition – 2012 – Vol. 61. – № 7. – p. 1363 – 1390.
18
19.
Термогравиметрический анализ и дифференциальнаясканирующая калориметрия
19
20.
ВыводыПроведен анализ литературных данных в области
способов получения и определения структур метилольных
производных аллантоина;
• Синтезированы
диазолидинилмочевина
и
имидазолидинилмочевина путем взаимодействия аллантоина
с формальдегидом, и подтверждена структура полученных
соединений методами ТГА, ВЭЖХ, ТСХ, элементного анализа,
рентгеноспектрального
микроанализа,
ИКи
ЯМРспектроскопией;
Методом DEPT135 ЯМР-спектроскопии подтверждено
положение присоединения метилольной группы к третичному
атому углерода аллантоина;
Задача синтеза хлорметильного производного аллантоина
не выполнена, но предположительно получено новое, ранее
не изученное супрамолекулярное соединение по типу
кукурбит[n]урила.
20
21.
22.
2223.
ЯМР - спектроскопия13С
ЯМР-спектр коммерческой диазолидинилмочевины
DEPT135 – Distorsionless Enhancement by Polarization Transfer
Метод усиления без искажений с помощью переноса поляризации
- 13С ЯМР-спектр
- 13С ЯМР-спектр DEPT135
ЯМР Фурье-спектрометр Bruker AscendТМ 400
23
24.
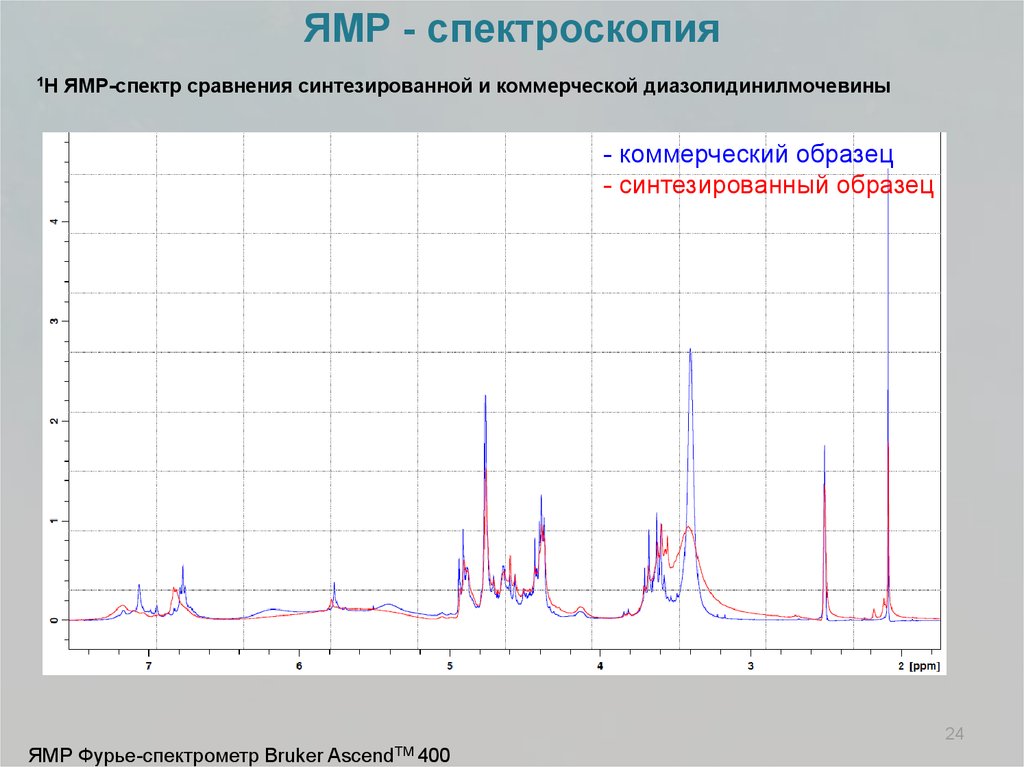
ЯМР - спектроскопия1H
ЯМР-спектр сравнения синтезированной и коммерческой диазолидинилмочевины
- коммерческий образец
- синтезированный образец
24
ЯМР Фурье-спектрометр Bruker
AscendТМ 400
25.
ЯМР - спектроскопия1H
ЯМР-спектр синтезированной диазолидинилмочевины
25
ЯМР Фурье-спектрометр Bruker
AscendТМ 400
26.
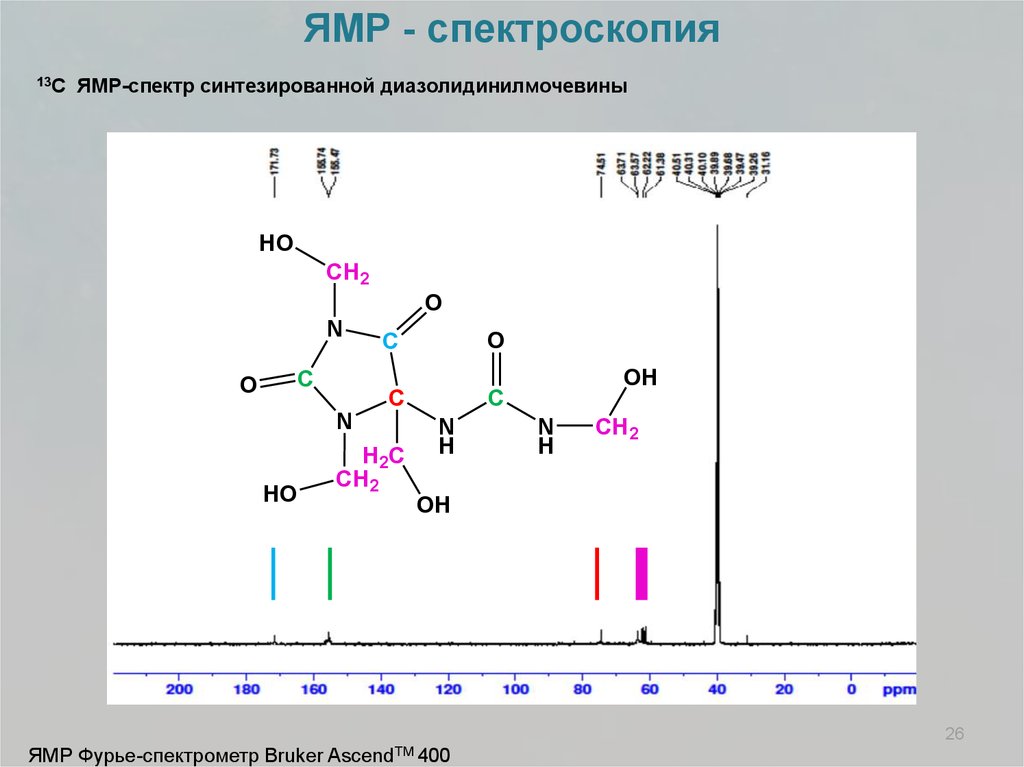
ЯМР - спектроскопия13С
ЯМР-спектр синтезированной диазолидинилмочевины
HO
CH2
O
N
O
C
C
N
HO
O
C
H2 C
CH2
OH
C
N
H
N
H
CH2
OH
26
ЯМР Фурье-спектрометр Bruker
AscendТМ 400
27.
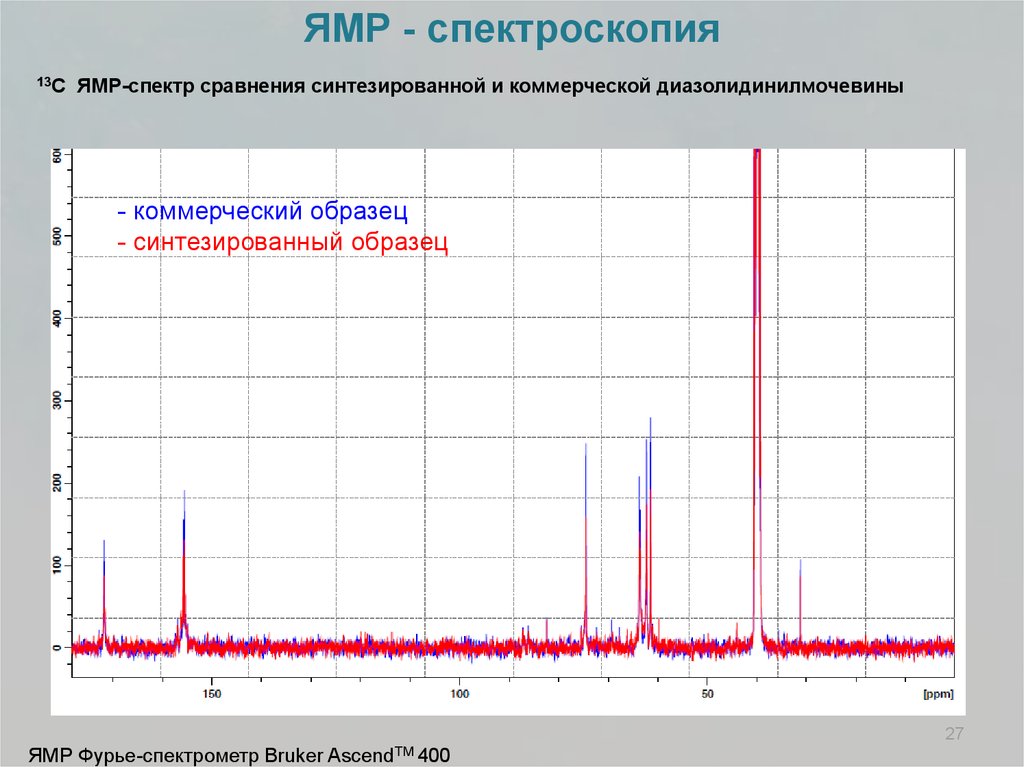
ЯМР - спектроскопия13С
ЯМР-спектр сравнения синтезированной и коммерческой диазолидинилмочевины
- коммерческий образец
- синтезированный образец
27
ЯМР Фурье-спектрометр Bruker
AscendТМ 400
28.
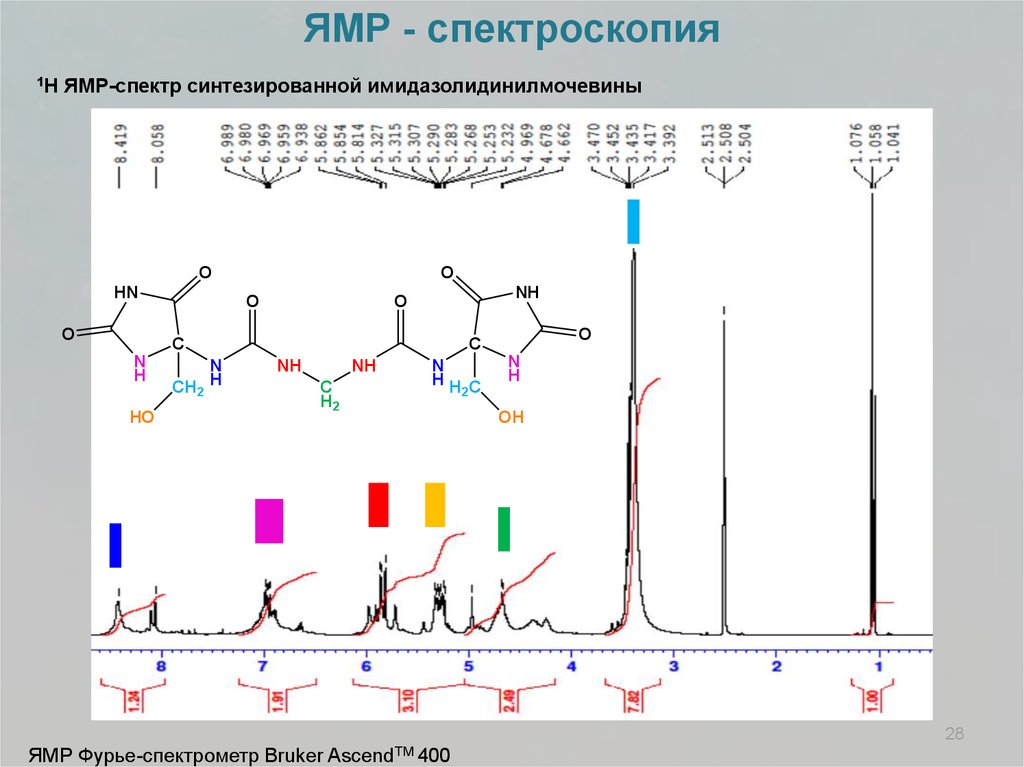
ЯМР - спектроскопия1H
ЯМР-спектр синтезированной имидазолидинилмочевины
O
HN
O
O
O
NH
O
C
N
H
HO
N
CH2 H
O
C
NH
NH
C
H2
N
HH C
2
N
H
OH
28
ЯМР Фурье-спектрометр Bruker
AscendТМ 400
29.
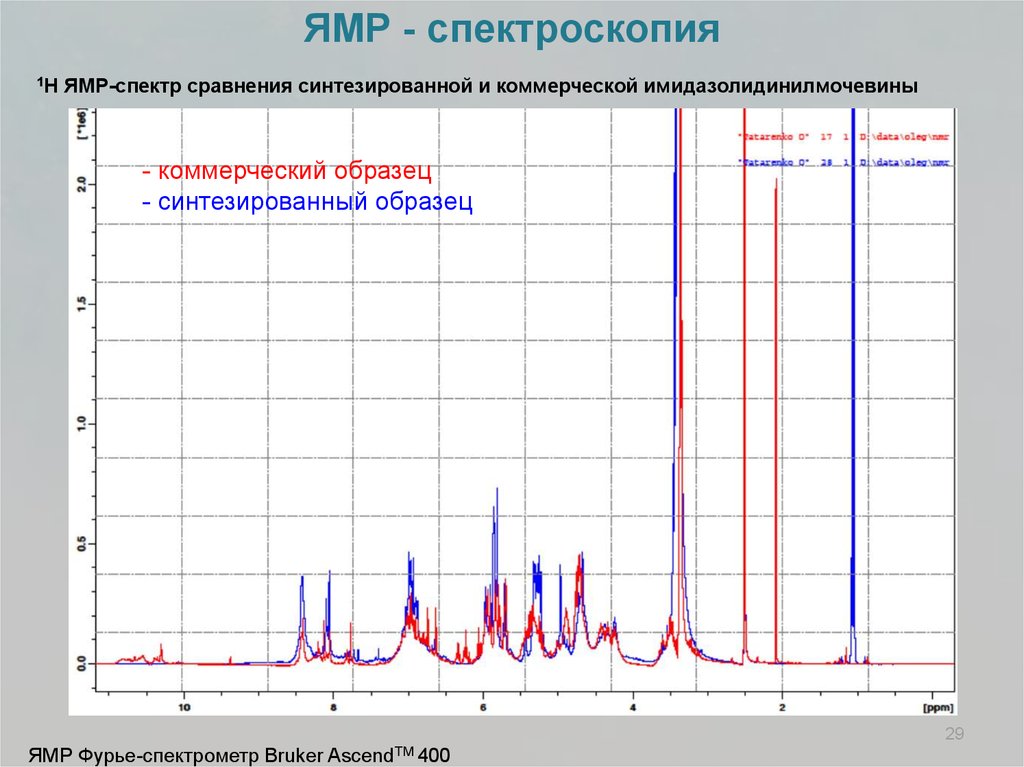
ЯМР - спектроскопия1H
ЯМР-спектр сравнения синтезированной и коммерческой имидазолидинилмочевины
- коммерческий образец
- синтезированный образец
29
ЯМР Фурье-спектрометр Bruker
AscendТМ 400
30.
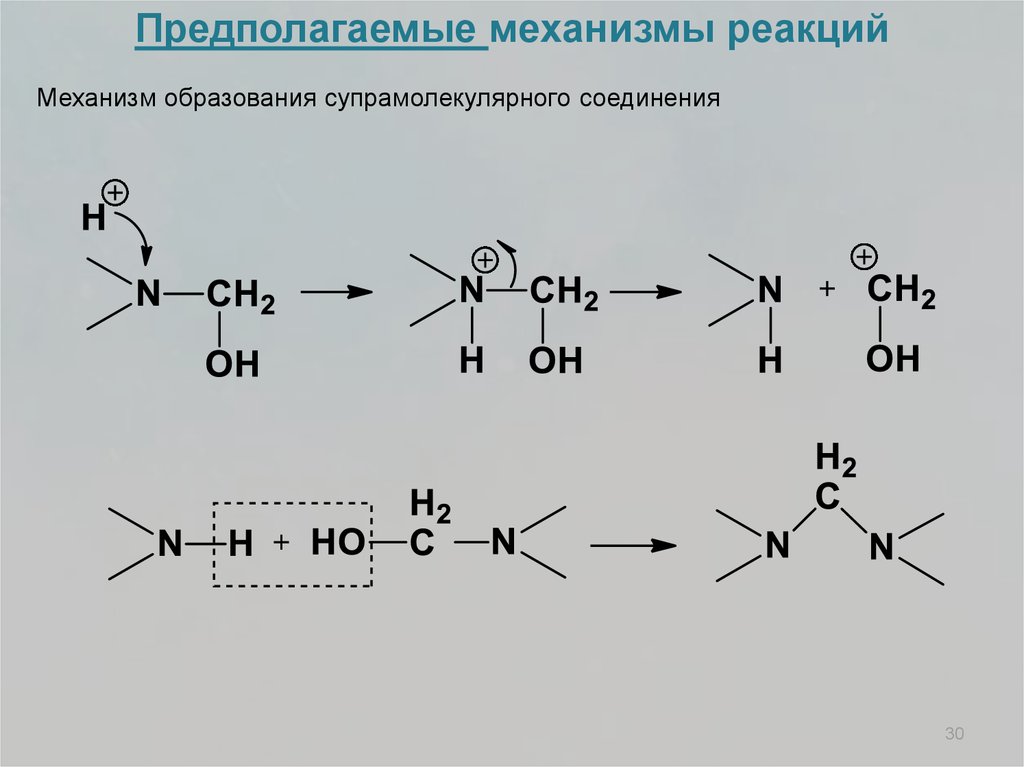
Предполагаемые механизмы реакцийМеханизм образования супрамолекулярного соединения
30
31.
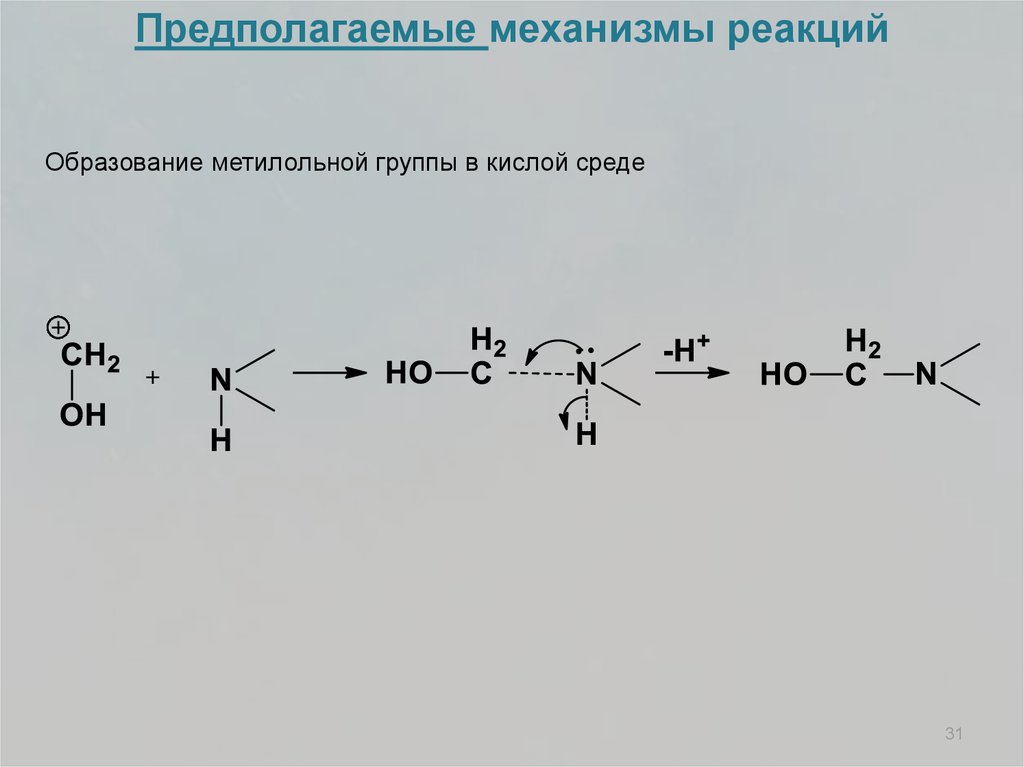
Предполагаемые механизмы реакцийОбразование метилольной группы в кислой среде
31
32.
Предполагаемые механизмы реакций1. Реакция аминометилирования (Реакция Манниха):
H
H
OH
OH
R1
N
C
R2
O
CH2
R2
O
N
C
H
O
OH
R1
R1
N
R2
H
OH
R1
CH2
OH
N
OH
CH2
OH
R2
32
33.
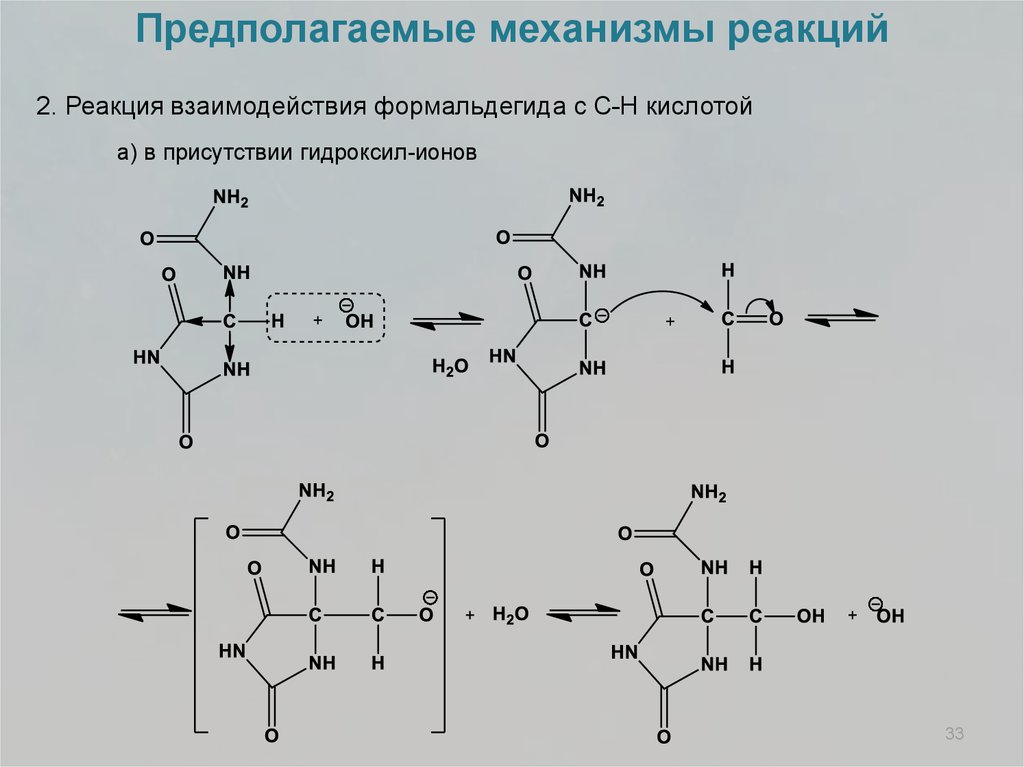
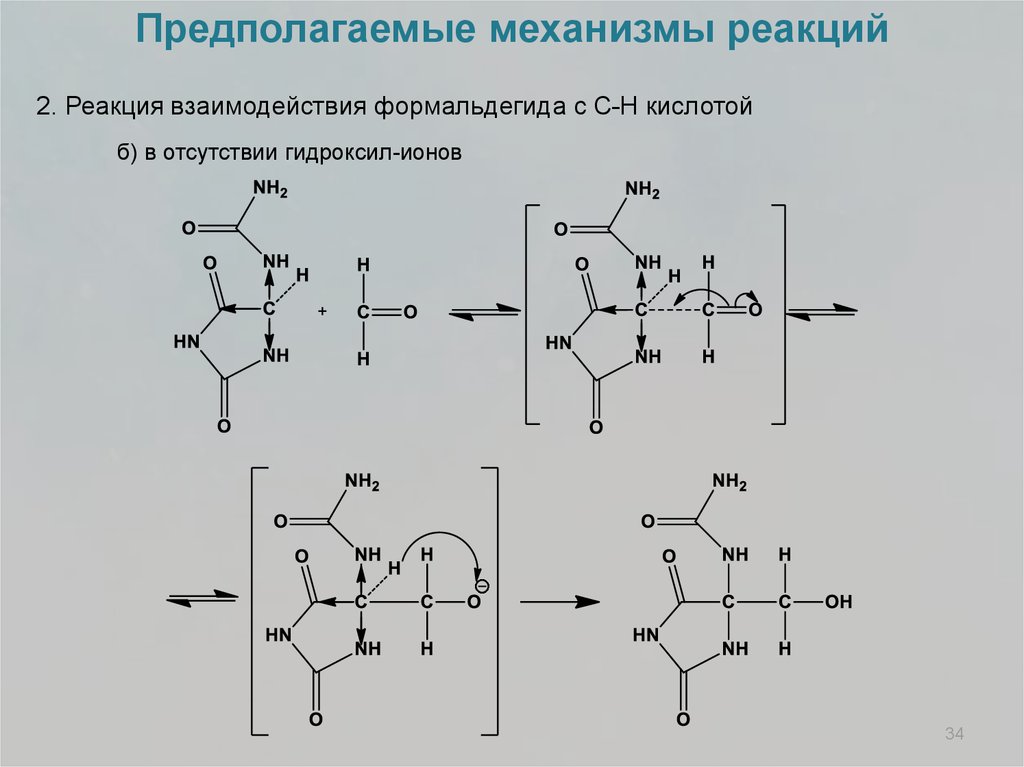
Предполагаемые механизмы реакций2. Реакция взаимодействия формальдегида с С-Н кислотой
а) в присутствии гидроксил-ионов
33
34.
Предполагаемые механизмы реакций2. Реакция взаимодействия формальдегида с С-Н кислотой
б) в отсутствии гидроксил-ионов
34
35.
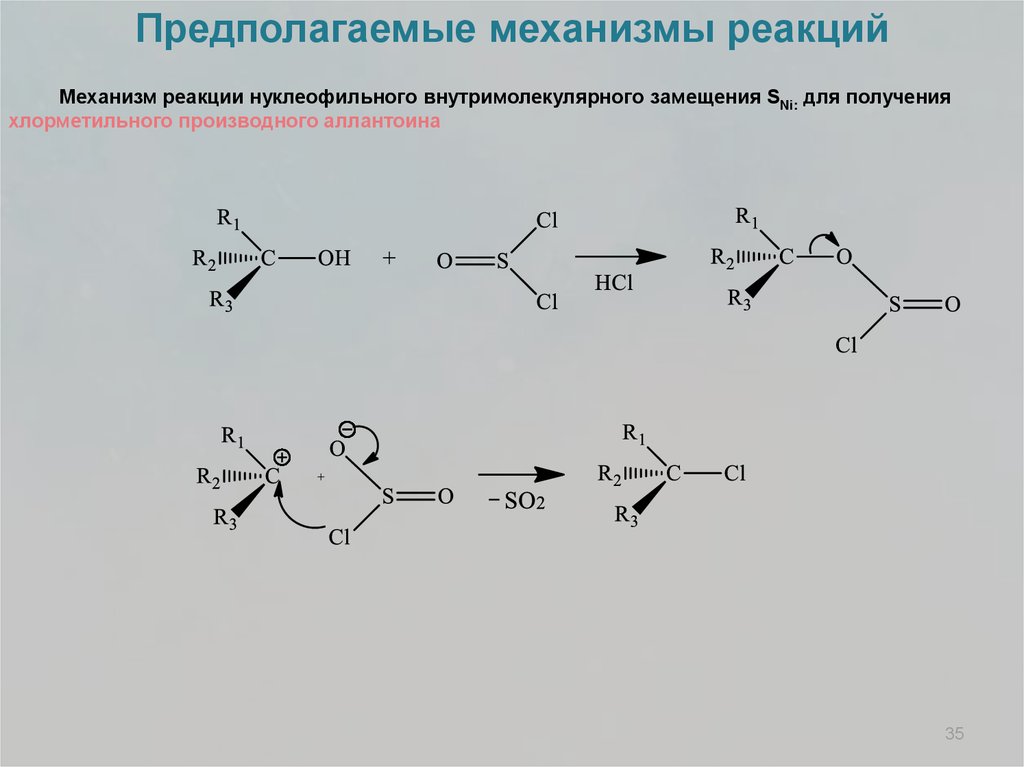
Предполагаемые механизмы реакцийМеханизм реакции нуклеофильного внутримолекулярного замещения SNi: для получения
хлорметильного производного аллантоина
35
36.
C=OкольцаOH
C=O кольца
HO
CH2
N-H амид
О-=С-N
С-ОH
C-N
C=O амид
ИК – спектроскопия
O
N
O
O
OH
C
N
HO
N
H
N
H
OH
диазолидинилмочевин
а
36
ИК-Фурье-спектрометр Nicolet 6700
37.
C=OкольцаOH
2
CH
C=O кольца
N-H амид
С-ОH
О-=С-N
C-N
C=O амид
ИК – спектроскопия
Имидазолидинилмочевина
37
ИК-Фурье-спектрометр Nicolet 6700
38.
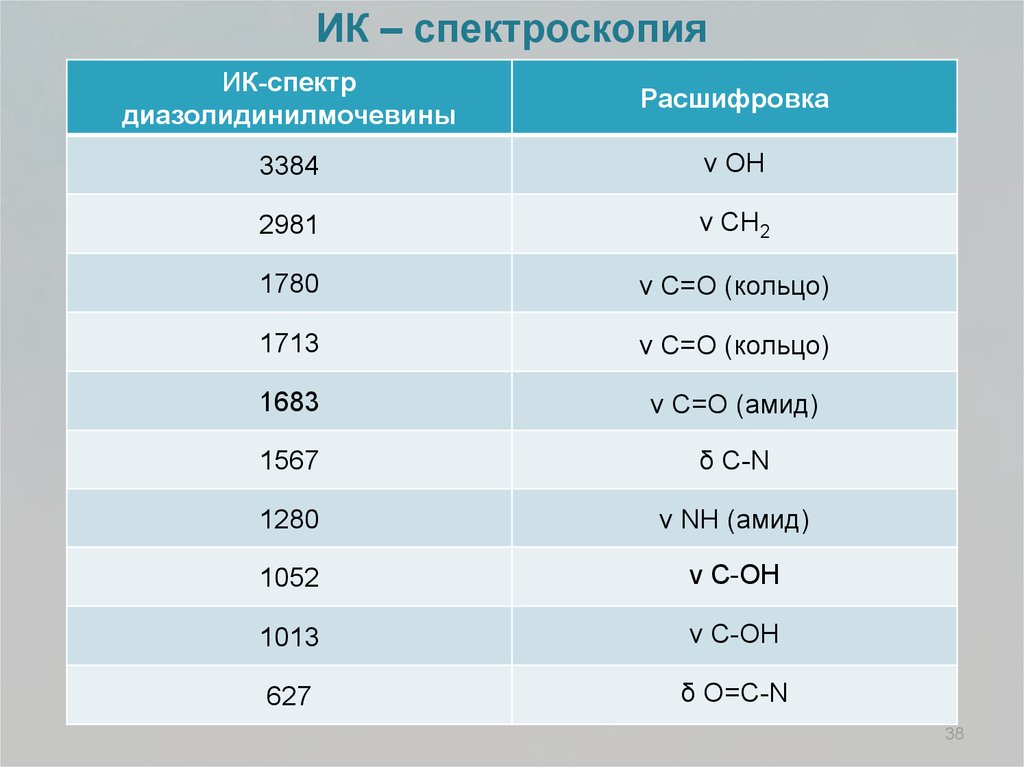
ИК – спектроскопияИК-спектр
диазолидинилмочевины
Расшифровка
3384
ν ОН
2981
ν CН2
1780
ν C=O (кольцо)
1713
ν C=O (кольцо)
1683
ν C=O (амид)
1567
δ С-N
1280
ν NН (амид)
1052
ν С-ОН
1013
ν С-ОН
627
δ О=С-N
38
39.
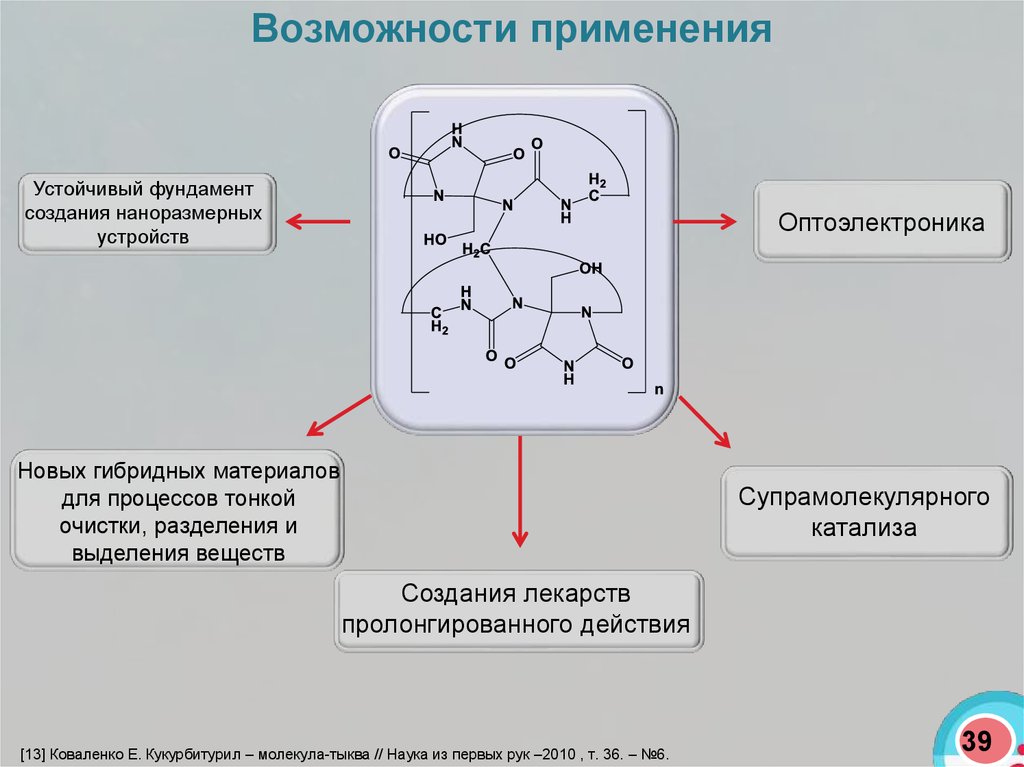
Возможности примененияУстойчивый фундамент
создания наноразмерных
устройств
Оптоэлектроника
Новых гибридных материалов
для процессов тонкой
очистки, разделения и
выделения веществ
Супрамолекулярного
катализа
Создания лекарств
пролонгированного действия
[13] Коваленко Е. Кукурбитурил – молекула-тыква // Наука из первых рук –2010 , т. 36. – №6.
39















 chemistry
chemistry








