Similar presentations:
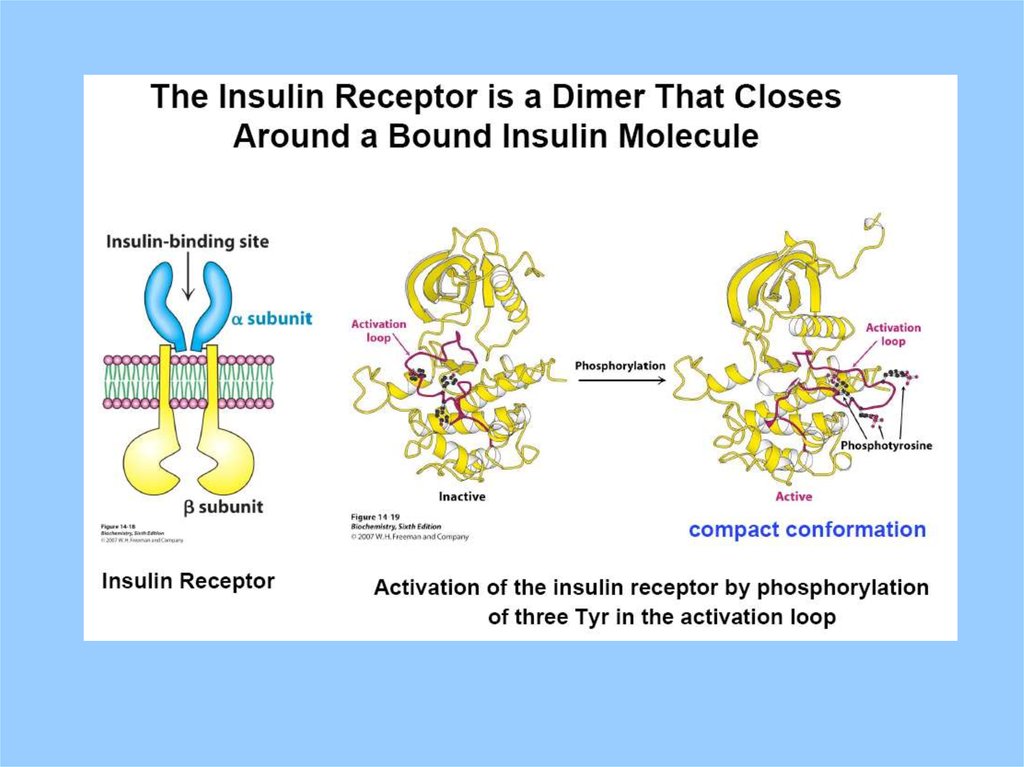
The Insulin Receptor
1.
2.
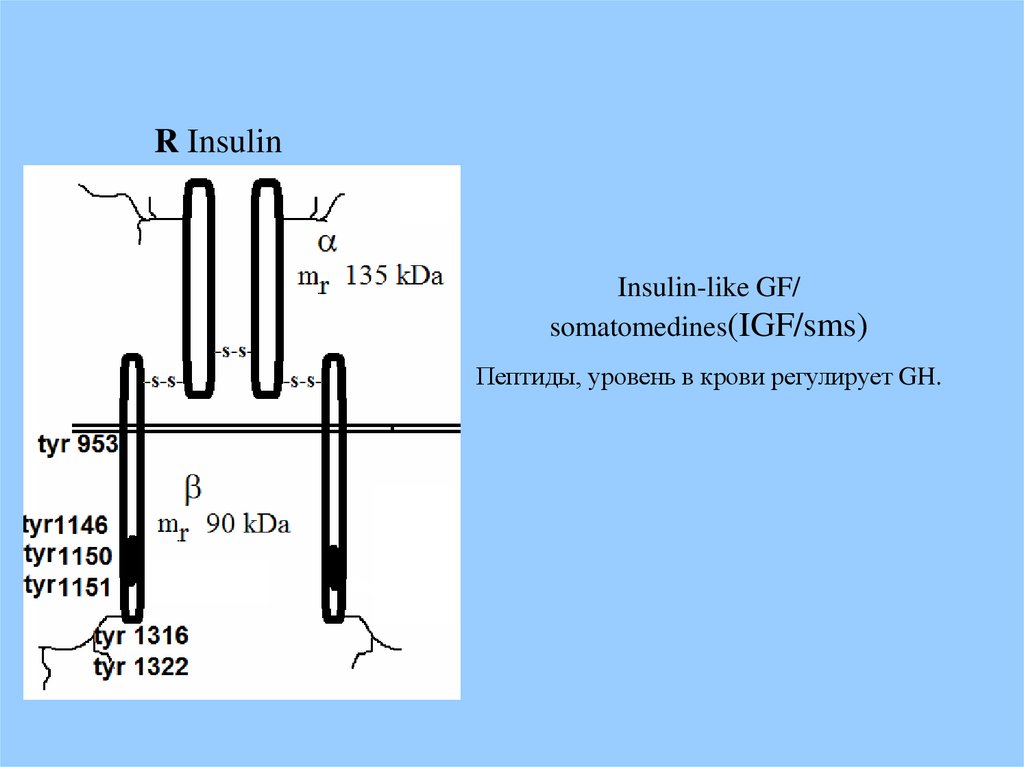
R InsulinInsulin-like GF/
somatomedines(IGF/sms)
Пептиды, уровень в крови регулирует GH.
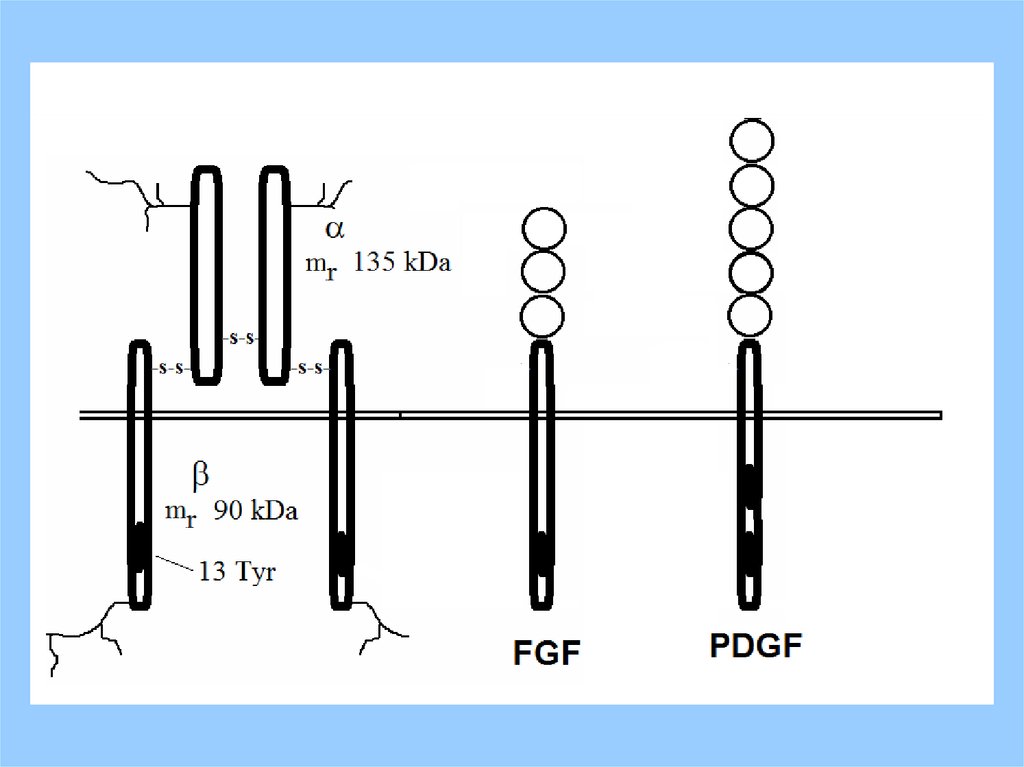
3.
4.
5.
6.
Signal Transducers and Activators of Transcription (STATs)7.
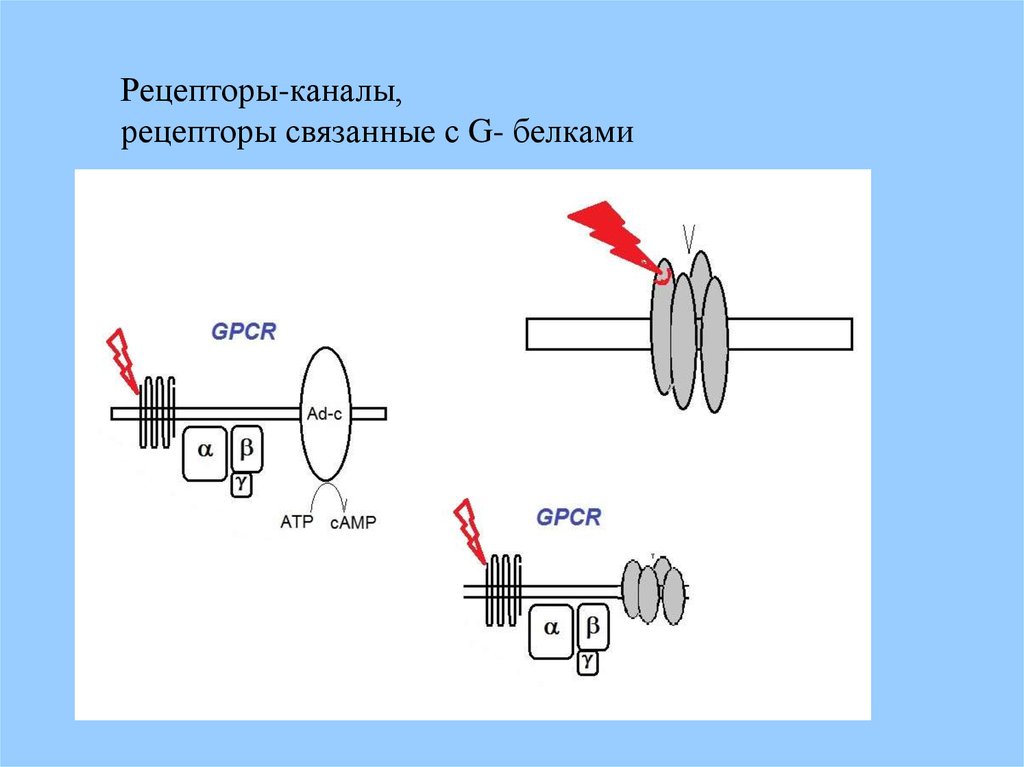
Рецепторы-каналы,рецепторы связанные с G- белками
8.
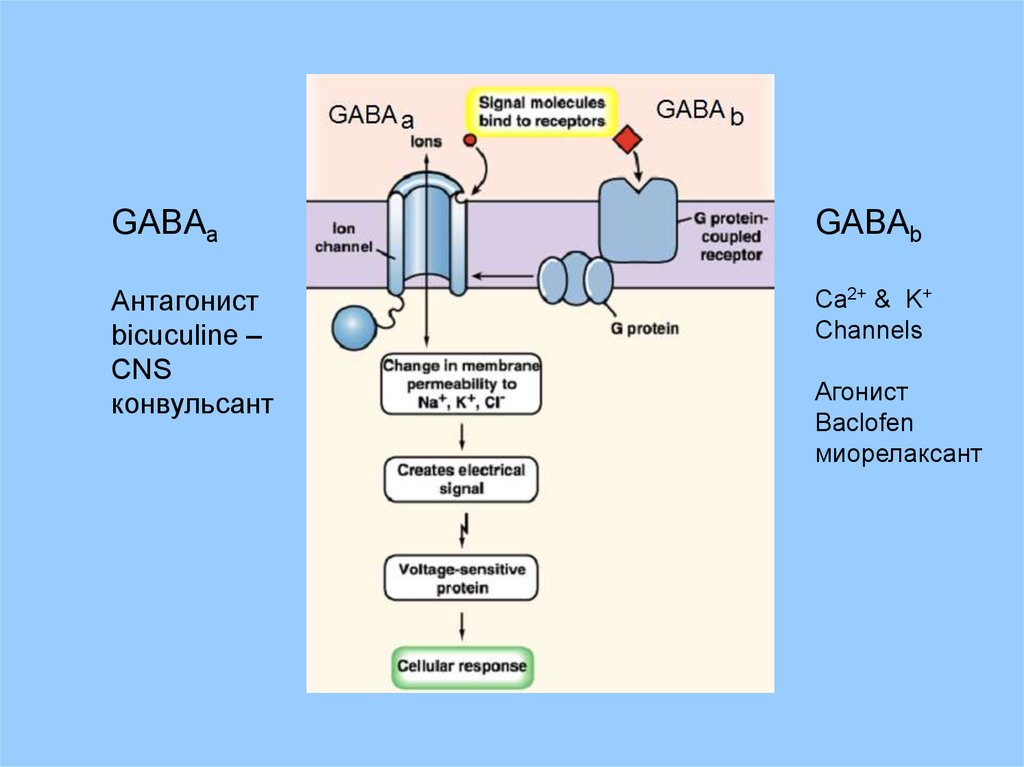
GABAaGABAb
Антагонист
bicuculine –
CNS
конвульсант
Ca2+ & K+
Channels
Агонист
Baclofen
миорелаксант
9.
10.
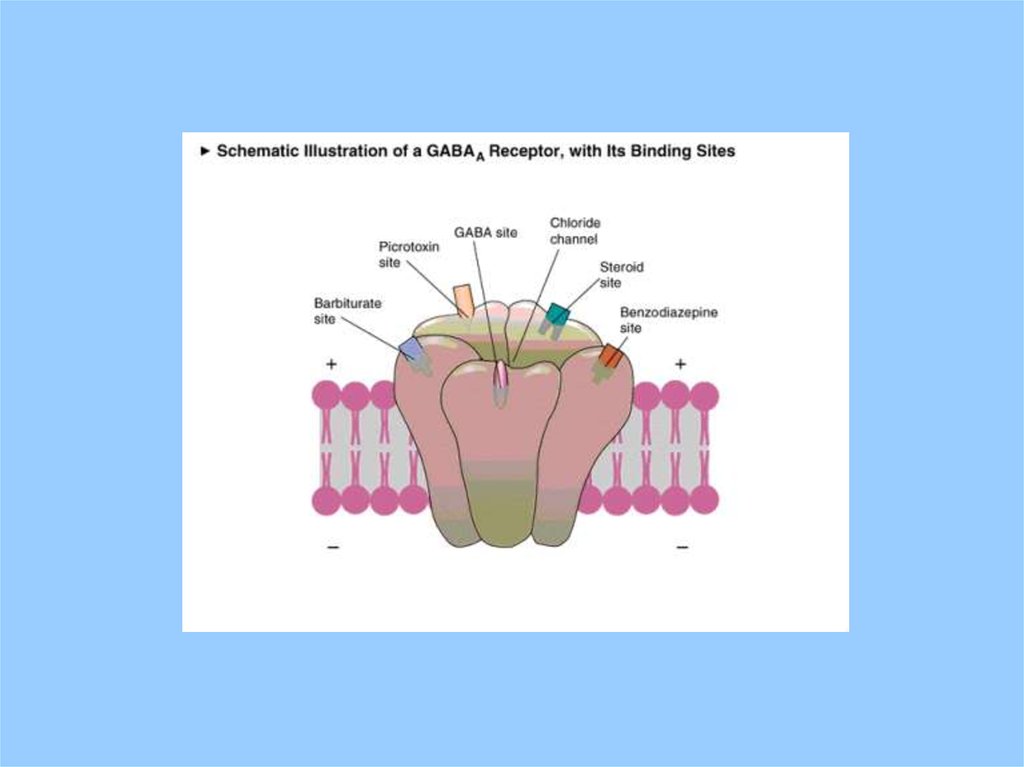
GABAA рецептор – хлоридный каналЛиганды:
Бензодиазепины – anxiolytics ингибируют канал;
Антагонист GABA bicuculine – CNS конвульсант
Барбитураты и депрессанты
11.
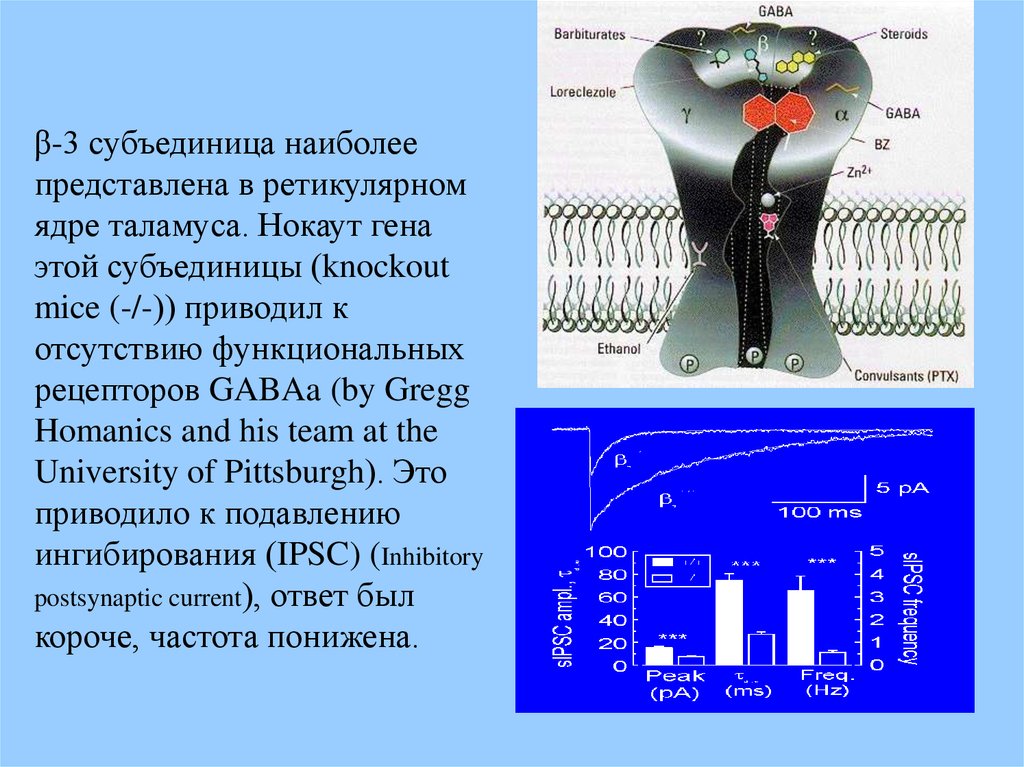
β-3 субъединица наиболеепредставлена в ретикулярном
ядре таламуса. Нокаут гена
этой субъединицы (knockout
mice (-/-)) приводил к
отсутствию функциональных
рецепторов GABAa (by Gregg
Homanics and his team at the
University of Pittsburgh). Это
приводило к подавлению
ингибирования (IPSC) (Inhibitory
postsynaptic current), ответ был
короче, частота понижена.
12.
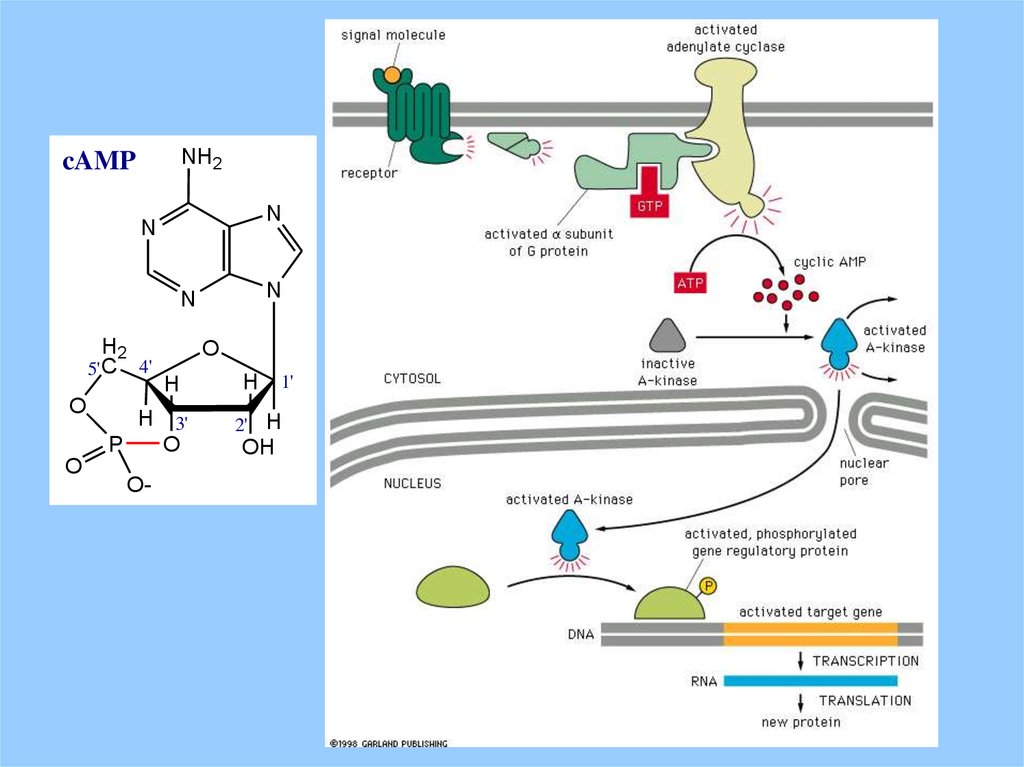
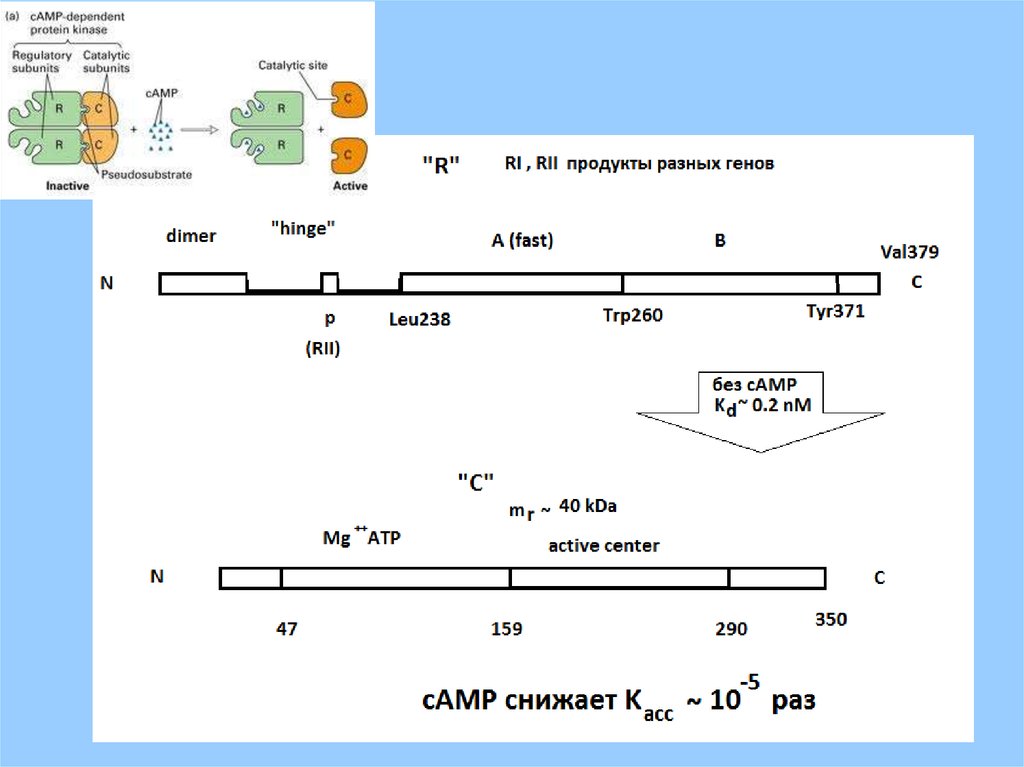
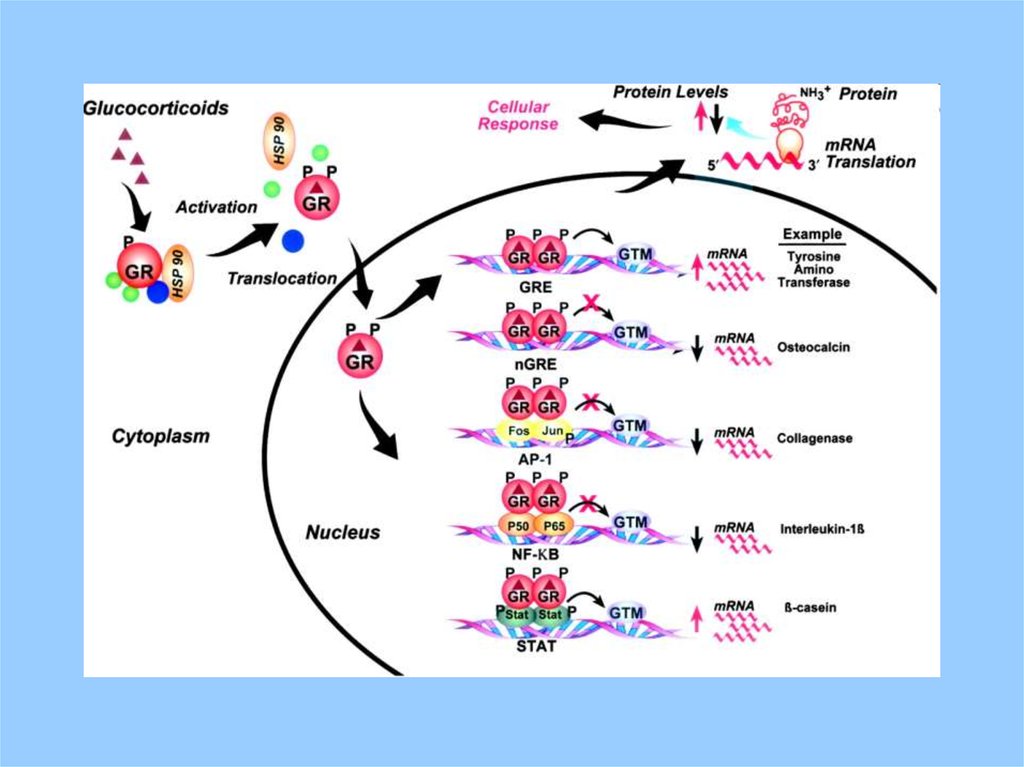
NH2cAMP
N
N
N
N
H2
5' C
O
O
4'
O
H
H 3'
P
O
O-
H
1'
2' H
OH
13.
10 October 1994Nobel Prize in Physiology or Medicine for 1994
jointly to
Alfred G. Gilman and Martin Rodbell
for their discovery of "G-proteins and the role of
these proteins in signal transduction in cells".
14.
hormonesignal
outside
GPCR
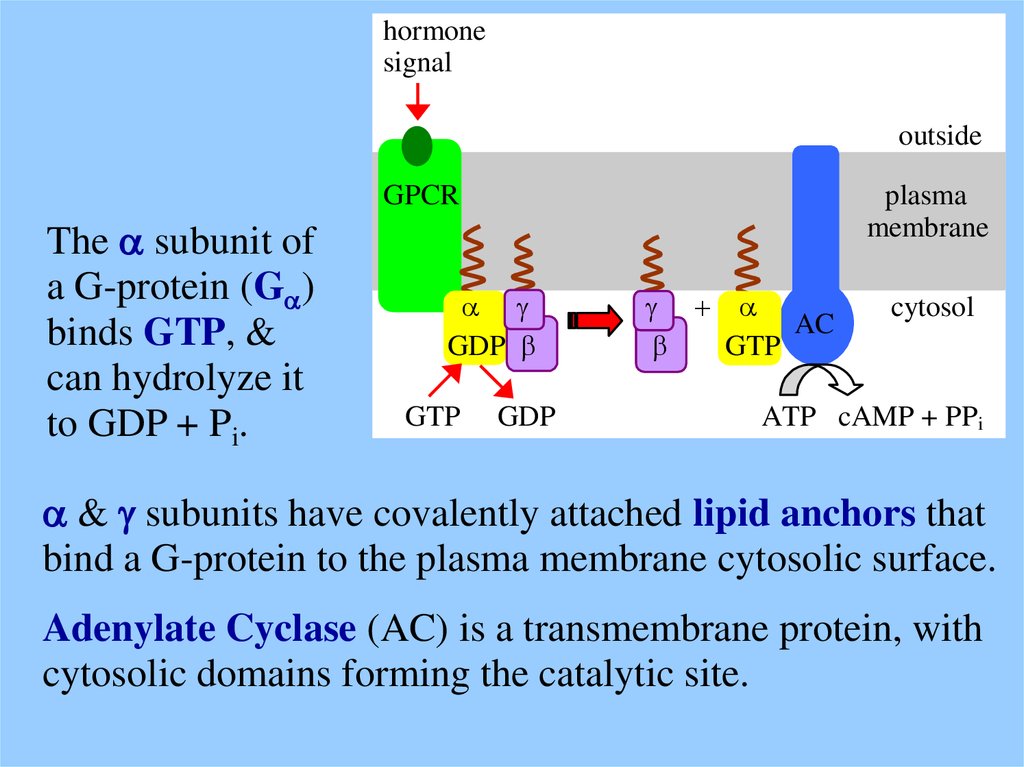
The a subunit of
a G-protein (Ga)
binds GTP, &
can hydrolyze it
to GDP + Pi.
plasma
membrane
a g g a
AC
GDP GTP
GTP
GDP
cytosol
ATP cAMP + PPi
a & g subunits have covalently attached lipid anchors that
bind a G-protein to the plasma membrane cytosolic surface.
Adenylate Cyclase (AC) is a transmembrane protein, with
cytosolic domains forming the catalytic site.
15.
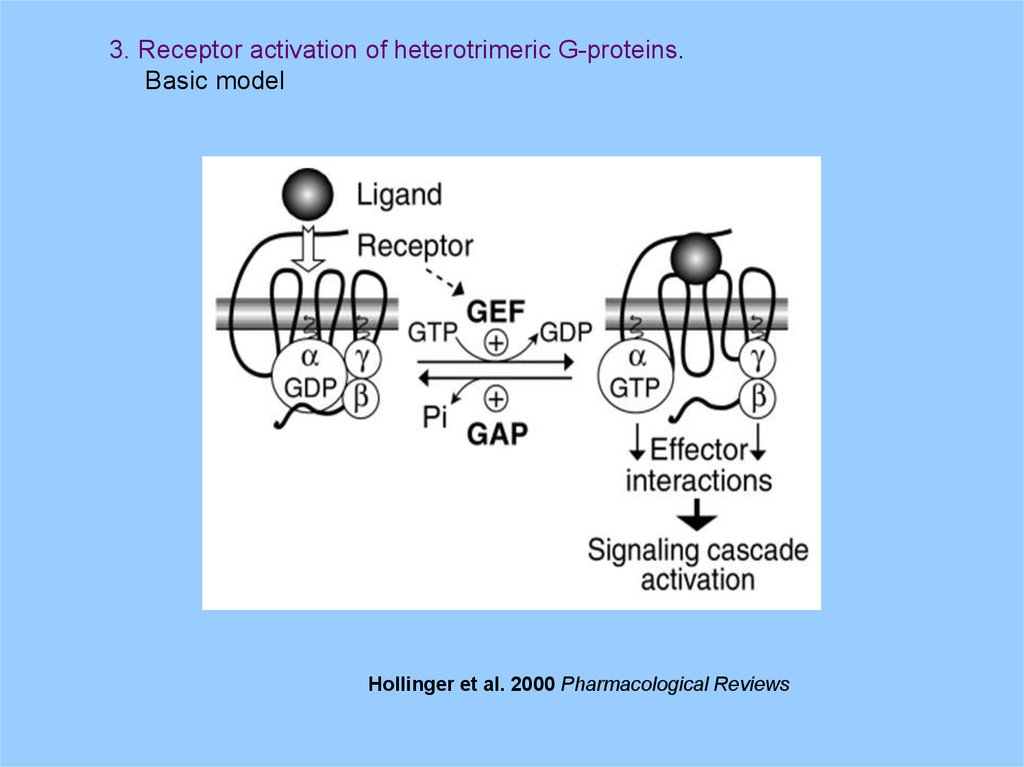
3. Receptor activation of heterotrimeric G-proteins.Basic model
Hollinger et al. 2000 Pharmacological Reviews
16.
Малые G белки. Размер 20 – 30 kDaВыделяют 5 структурно различных семейств:
Ras
Rho/Rac/Cdc 42 (Rho субстраты botulinum toxin)
Rab/YPT1
Sar1/Arf
Ran
Для всех G белков есть управляющие факторы:
GEFs – Guanin Exchange Factor
GAPs – Guanin Acnivation Factor
RGS – Regulator Signaling Factor
17.
Малые G-белки (GTP-binding proteins) обнаружены в:initiation & elongation factors (protein synthesis).
Ras (growth factor signal cascades).
Rab (vesicle targeting and fusion).
ARF (forming vesicle coats).
Ran (transport of proteins into & out of the nucleus).
Rho (regulation of actin cytoskeleton)
конформация G-белков зависит от связанного нуклеотида
GDP или GTP. Обычно связывание GTP означает активное
состояние.
18.
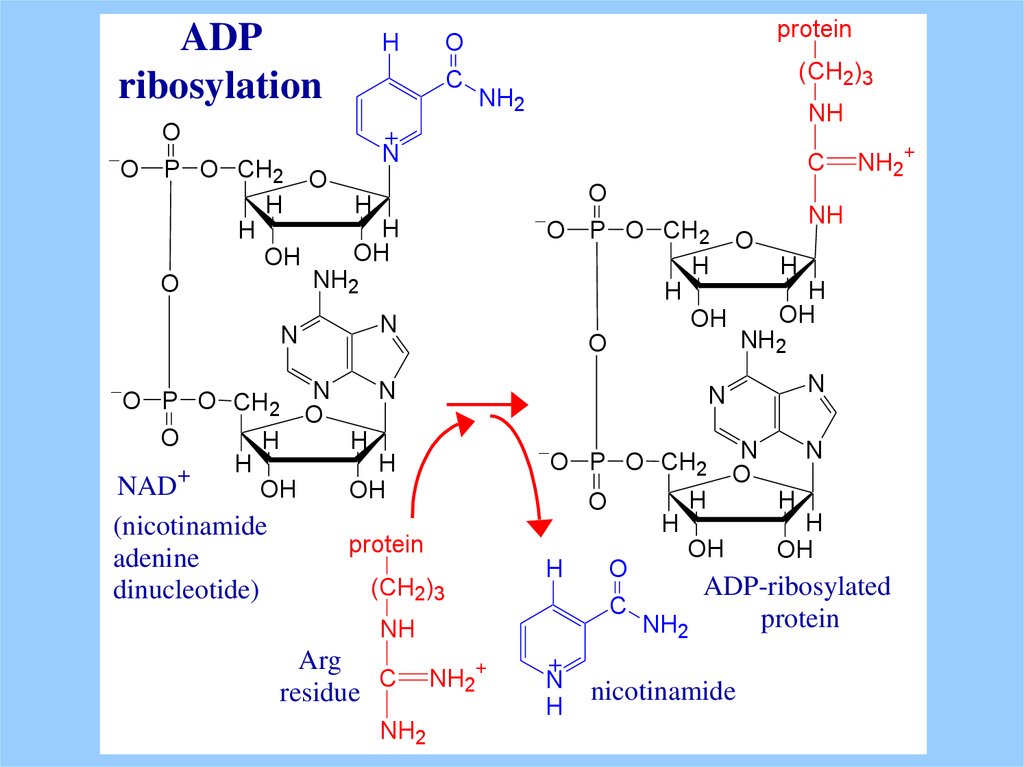
Cholera toxin переносит с NAD+ и ковалентно связываетADP-ribose с остатком аргинина в активном центре
Gsa.
ADP-ribosylation ингибирует GTP гидролитическую
Gsa которая при этом постоянно активирована.
Pertussis toxin (whooping cough disease)
ADP-рибозилирует остаток цистеина Gia, и ингибирует
обмен GDP for GTP, подавляя ингибирующее действие
Gia .
ADP-рибозилирование наиболее общий механизм модификации
активности белков и у прокариот, и у эукариот.
19.
ADPribosylation
O
O
H
protein
O
C
(CH2)3
NH2
NH
+
N
C
P O CH2 O
H
H
H
H
OH
OH
NH2
O
N
O
NH
O P O CH2 O
H
H
H
H
OH
OH
NH2
O
N
N
O P O CH2 N
O
O
H
H
H
H
+
NAD
OH
OH
(nicotinamide
adenine
dinucleotide)
O P O CH2
O
(CH2)3
H
NH2+
+
N
H
N
O
O
N
H
H
OH
H
OH
H
C
NH
NH2
N
N
protein
Arg
C
residue
NH2+
ADP-ribosylated
protein
NH2
nicotinamide
20.
21.
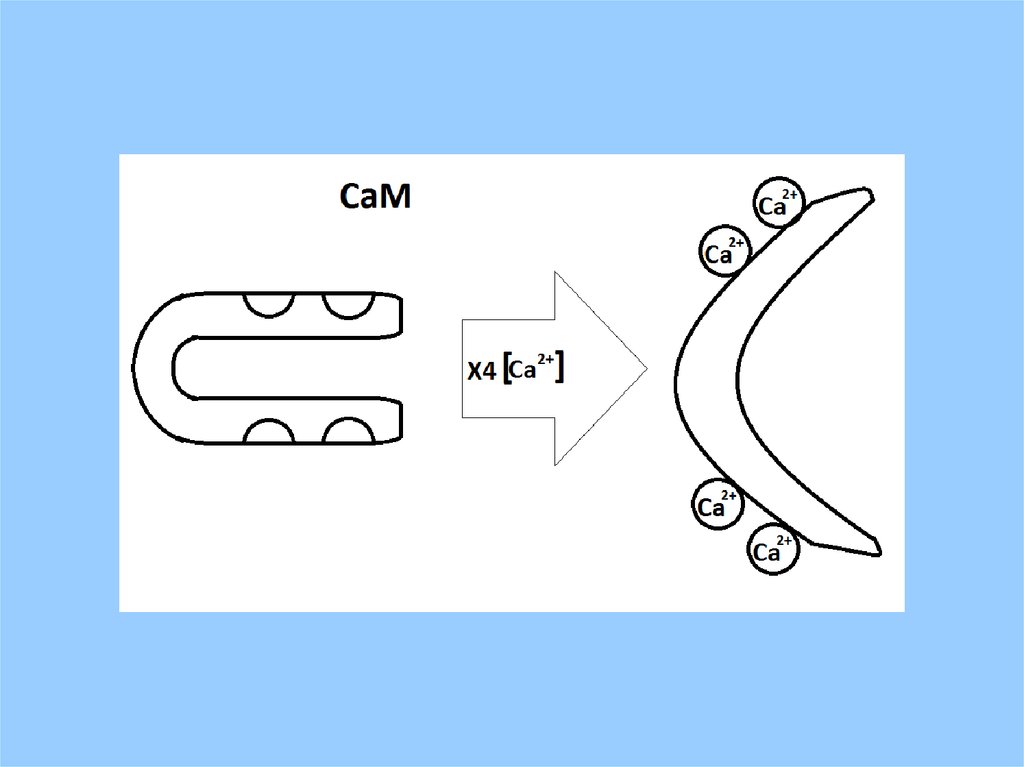
Суперсемейство EF-handбелков
CaM кальмодулин
MW 16,700 ; 148 aa; Kd = 4 – 18 10-6 M;
4 гомологичных домена: I (8-40 aa), II (81-113 aa) низкая аффинность, III
(44-76 aa), IV (117-148 aa) высокая аффинность
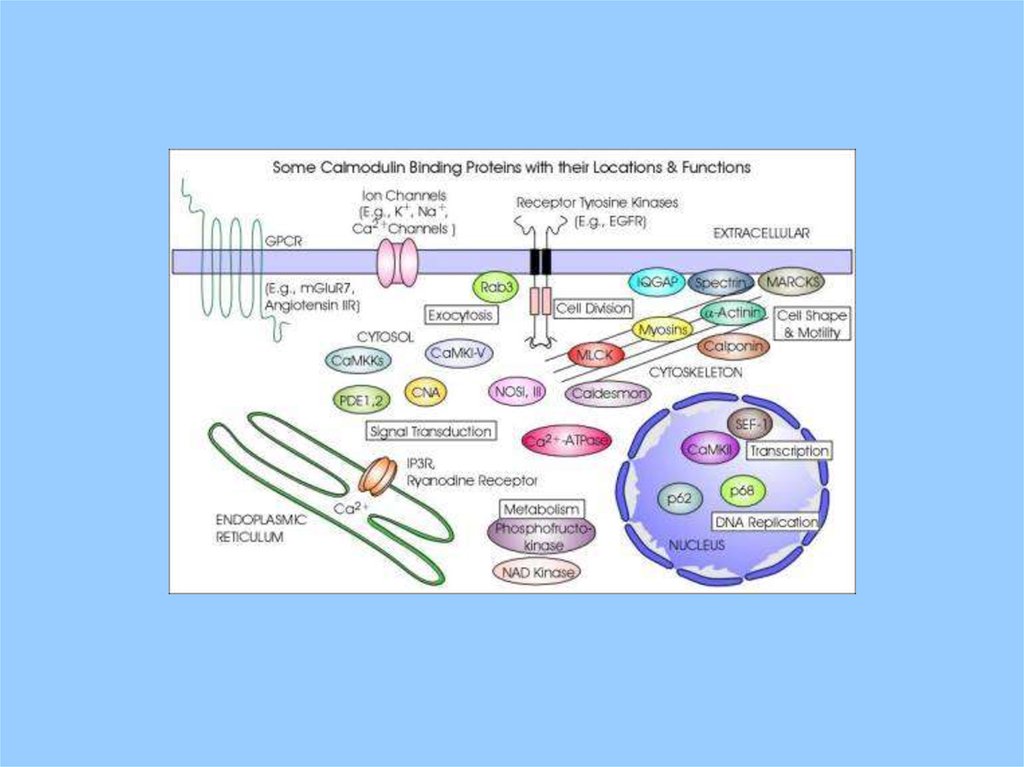
CaM
Фософодиестераза(PDE) , аденилатциклаза, гуанилатциклаза ,
CaATPase ,
диссоциация микротрубочек , ATPase актомиозина гладких
мышц,
Киназа легких цепей миозина
22.
23.
24.
25.
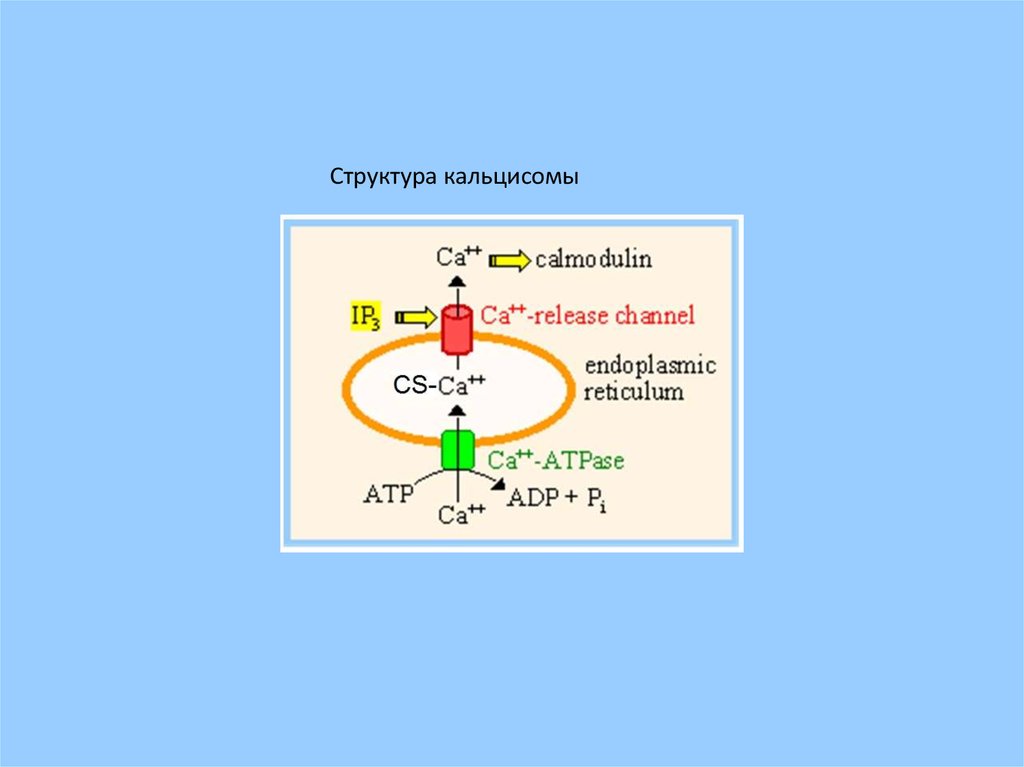
Структура кальцисомы26.
Electron micrographs of frozen hydratedspecimens show the fine structure that is
indicative of well preserved tetrameric
RyR1s
4-fold symmetrized
two-dimensional averages of
RyR1apoCaM, RyR1 control, and
difference map, respectively.
27.
28.
29.
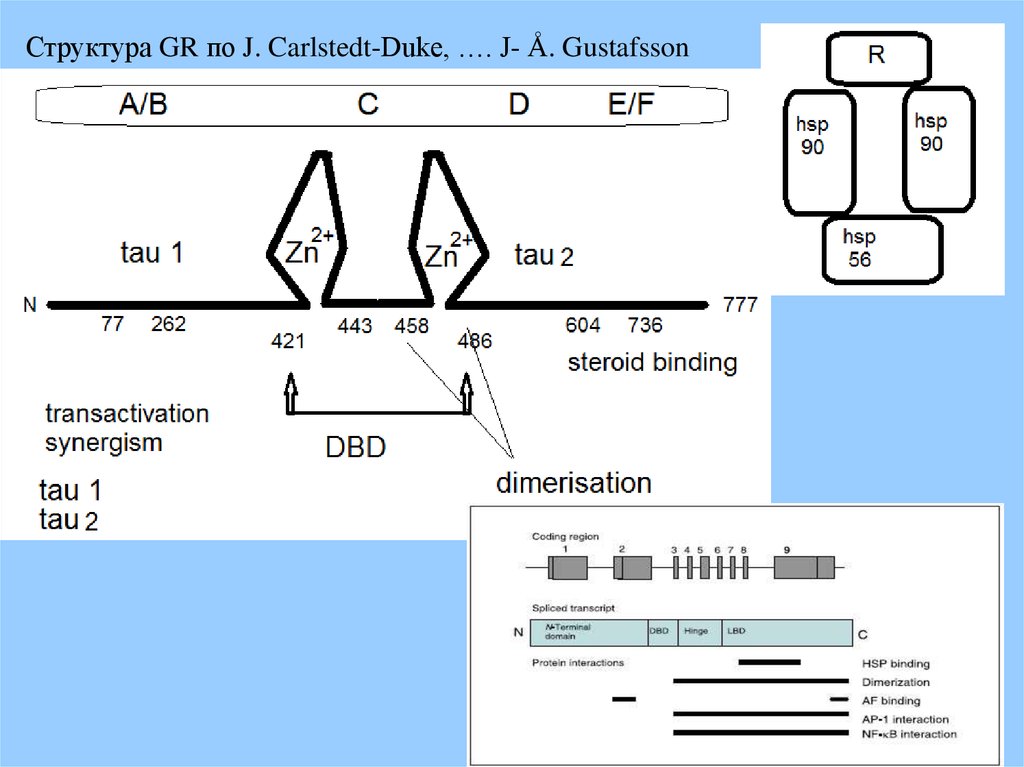
Структура GR по J. Carlstedt-Duke, …. J- Å. Gustafsson30.
Mammalian toll-like receptors(TLRs)diverse pathogen-associated molecular patterns
(PAMPs) that are unique to microorganisms and
therefore absent from host cells makes TLRs wellsuited to act as an early warning system against
invading pathogens. Activation of the TLR signal
transduction pathway leads to the induction of
numerous genes that function in host defense,
including those for inflammatory cytokines, antigenpresenting molecules, and costimulatory molecules
31.
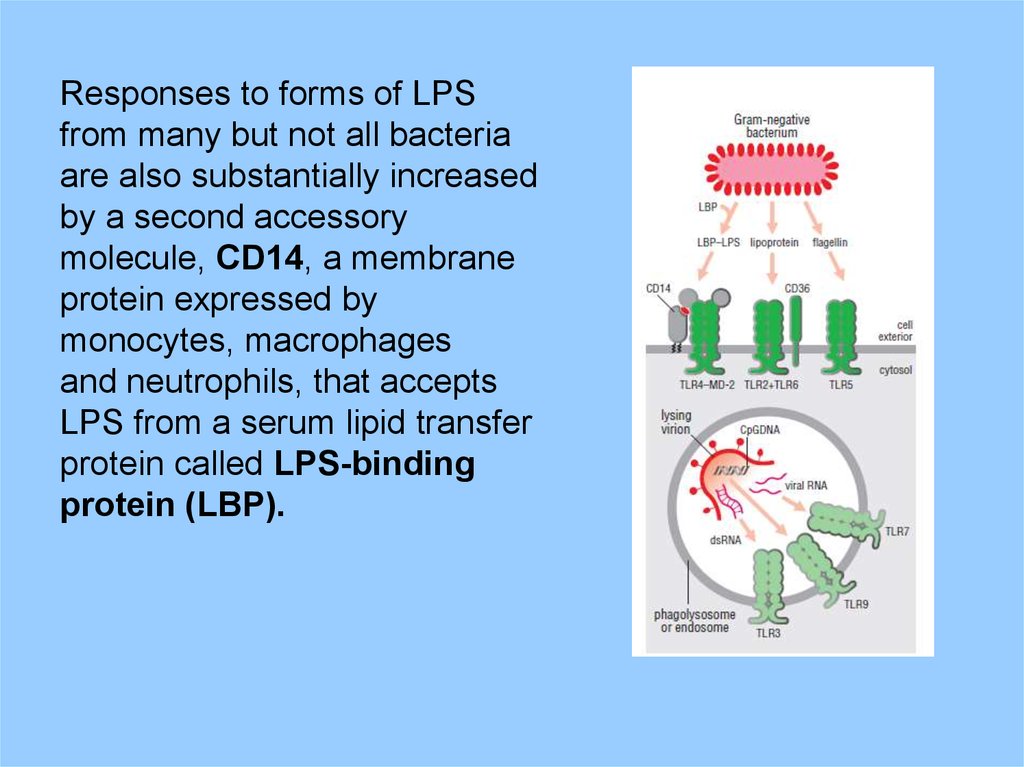
Responses to forms of LPSfrom many but not all bacteria
are also substantially increased
by a second accessory
molecule, CD14, a membrane
protein expressed by
monocytes, macrophages
and neutrophils, that accepts
LPS from a serum lipid transfer
protein called LPS-binding
protein (LBP).
32.
apoptosic trophoblast cellразрушение актиновых нитей сопровождается уменьшением
размеров клетки, на последних стадиях мембрана становится
пузырчатой
Parkinson’s or Alzheimer’s
Diseases apoptosis is thought to
account for much of the cell death
and the progressive loss of neurons.
33.
Сигналы апоптоза всегда множественные.Ростовые факторы (дефицит), внеклеточные лиганды смерти,
например FasL and TNFR (DR), сигналы адгезии (integrins)
часто опосредуются BH3-only белками, которые передают
сигнал на другие bcl-2 белки, например Bax and Bcl-XL
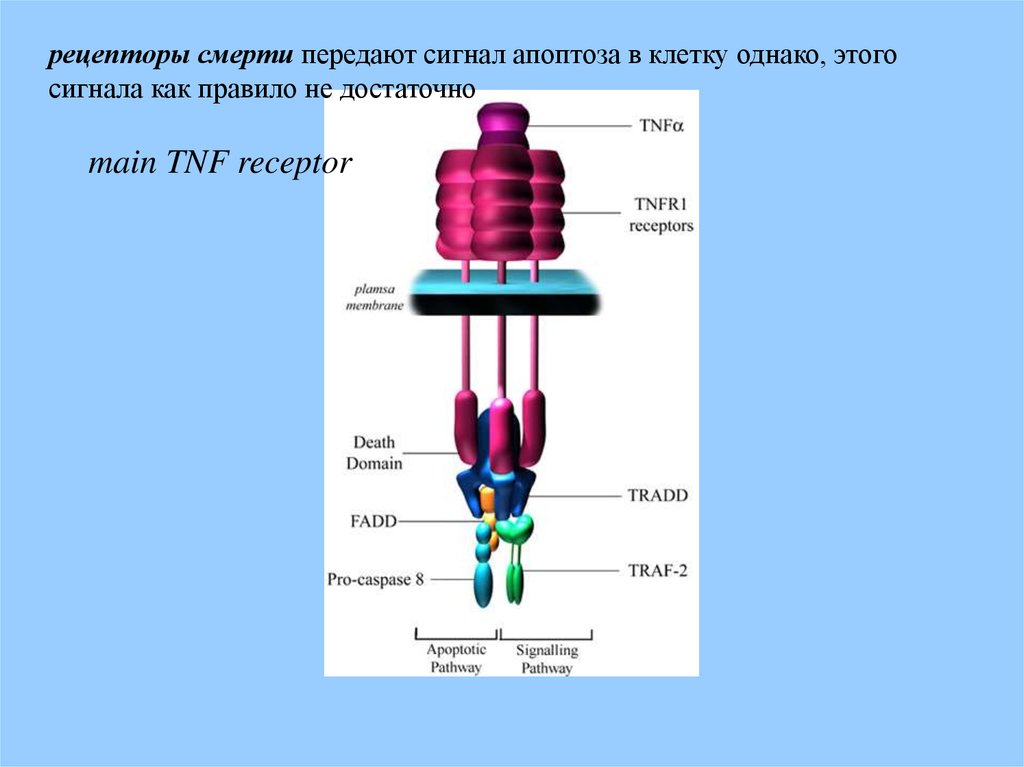
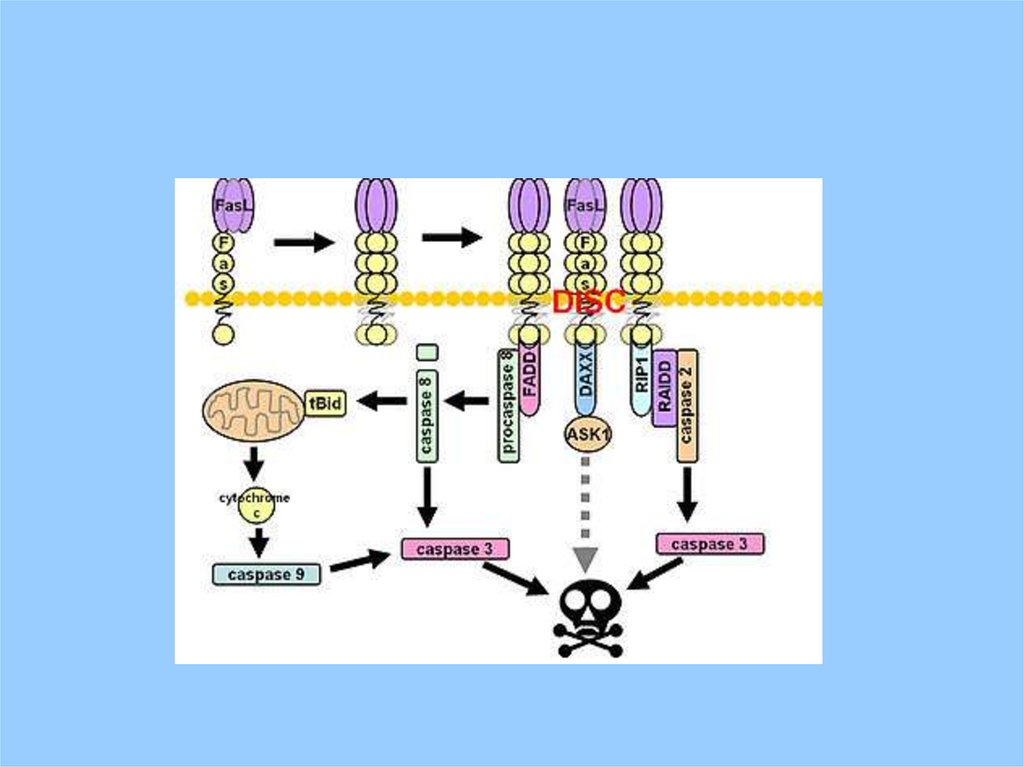
34.
Связывание фактора некроза опухоли (TNF) с «рецепторомсмерти» ведет к тримеризации рецептора и формированию
внутри клетки «кластера смерти», что делает возможным
связывание адапторной молекулы TRADD (TNFR-associated
death domain) который может быть ассоциирован с FADD (Fas
Associated protein with Death Domain) и запустить апоптоз
активировав каспазу-8.
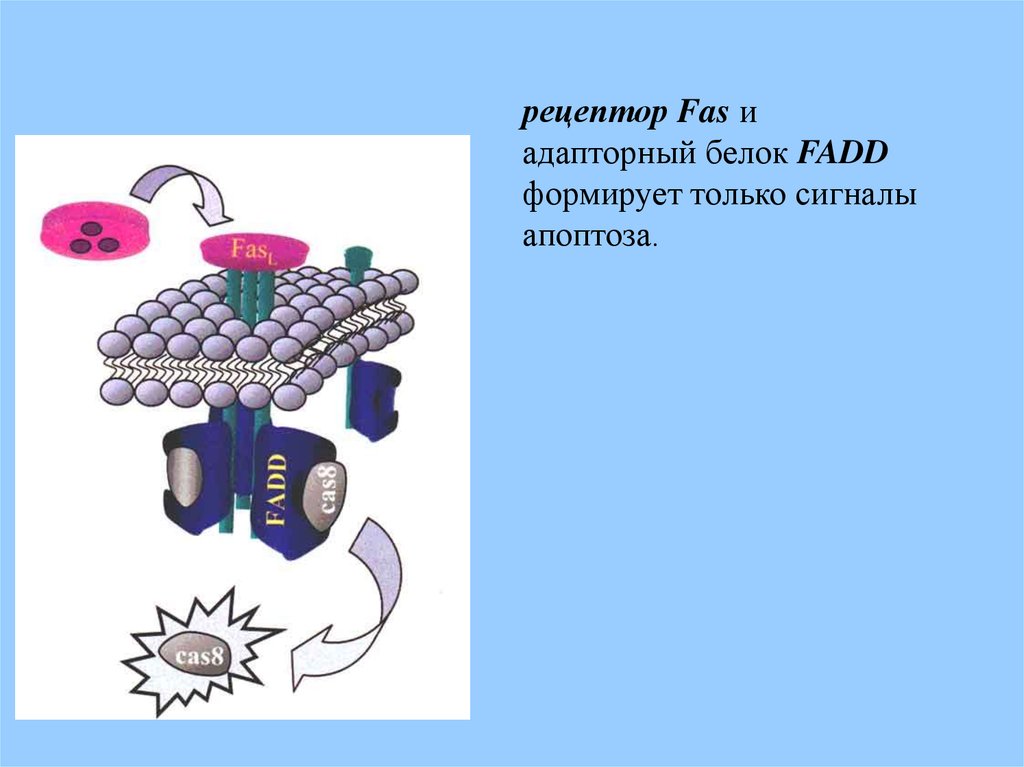
адапторный белок FADD может связываться с рецептором Fas,
который формирует только сигналы апоптоза в отличие от
рецептора TNF.
лиганд Fas белок связанный с мембраной 31 kDa (278 amino
acids) родственный (на основе гомологии) TNF.
Синонимы: FASL; FASLG (approved gene symbol) (CD95 лиганд (abbr.
CD95L); also APO-1 лиганд or APTL [apoptosis antigen ligand]).
35.
рецепторы смерти передают сигнал апоптоза в клетку однако, этогосигнала как правило не достаточно
main TNF receptor
36.
рецептор Fas иадапторный белок FADD
формирует только сигналы
апоптоза.
37.
38.
Митохондрии содержат много про-апоптотических факторовнапример: Apoptosis Inducing Factor (AIF),
Smac/DIABLO (second mitochondria derived activator of
caspase/direct IAP binding protein with low pI), cytochrome C.
Эти факторы выходят при образовании в митохондрии т.н.
поры - Permeability Transition pore, or PT pore.
В формировании поры принимают участие члены семейства
bcl-2 белков. Часть этих белков про-, часть антиапоптотические. Например: bcl-2, bcl-XL анти-апоптотические,
Bad, Bax, Bid про- апоптотические.
pro-apoptotic bcl-2 обнаруживают в цитоплазме, но сигнал
апоптоза вызывает их перемещение на поверхность
митохондрии, где они сдвигают баланс bcl-2 белков в сторону
формирования поры.
39.
40.
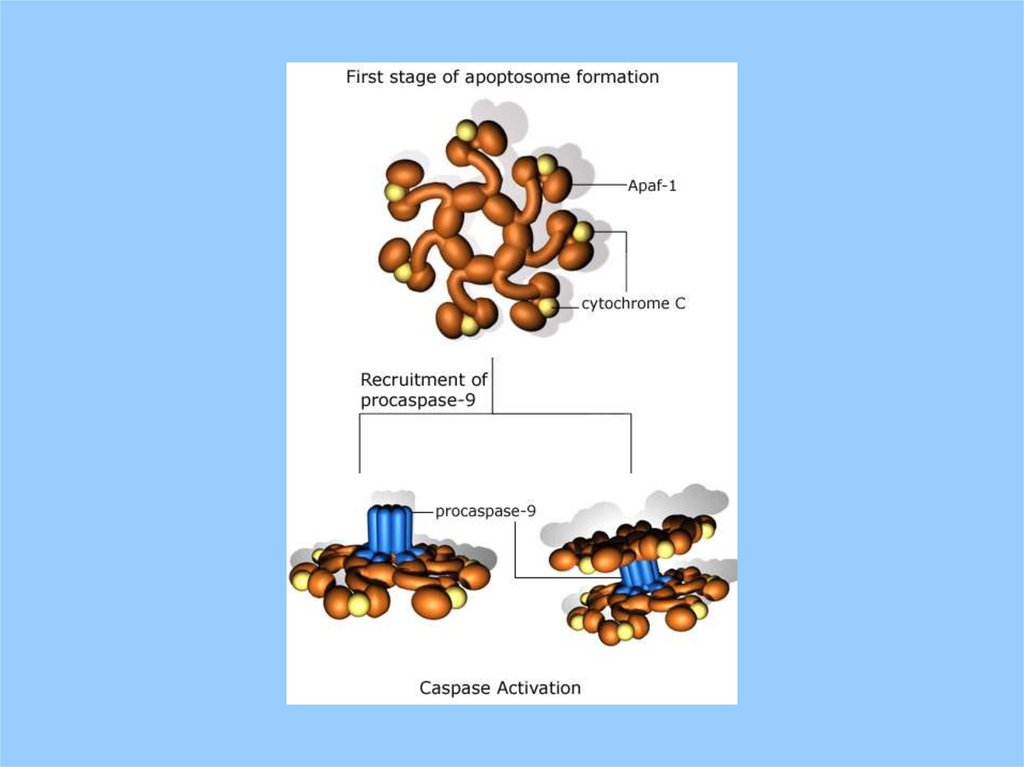
Апоптосома - белковый комплекс , включающий procaspase 9, cytochrome C, Apaf-1Bcl-2 белки несут домены BH (Bcl-2 homology) по
количеству этих доменов выделяют 3 группы.
Анти-апоптотические Bcl-2, его гомологи Bcl-XL и Bcl-w
имеют 4 BH домена (BH 1–4).
Про-апоптотические Bax and Bak - 2 BH домена
Наиболее разнообразная группа BH3-only белки.
Содержат только один домен BH3. Этот домен характерен
для многих про-апоптозных белков.
41.
Каспазы – семейство главным образом цистеиновых протеаз.В клетке находятся в неактивной форме, активируются на
ранних стадиях апоптоза.
Каспазы разрушают ключевые компоненты клетки –
цитоскелет, ферменты репарации ДНК, хроматин, активируют
ДНКазы.
в развитии сигнала апоптоза принимают участие митохондрии
и белки bcl-2 от комбинации которых зависит развитие или
угасание процесса
42.
43.
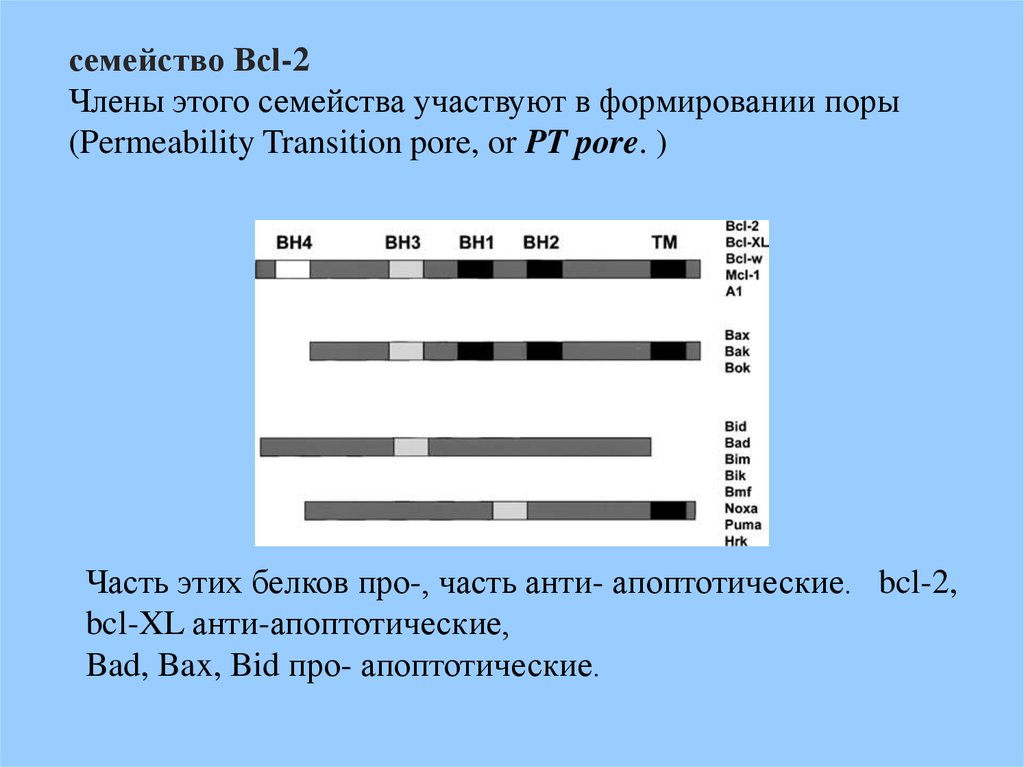
Семейство Bcl-2 белков характеризуется наличием доменов BH(Bcl-2 homology) и по их количеству белки разделяют на 3
подгруппы.
Анти-апоптотические Bcl-2, и его гомологи Bcl-XL and Bcl-w имеют
по 4 BH домена (BH 1–4).
Про-апоптотические Bax and Bak. Содержат два BH домена 1–3
Наиболее разнообразная группа BH3-only белки. Содержат только
один домен BH3. Этот домен характерен для многих проапоптозных белков.
44.
семейство Bcl-2Члены этого семейства участвуют в формировании поры
(Permeability Transition pore, or PT pore. )
Часть этих белков про-, часть анти- апоптотические. bcl-2,
bcl-XL анти-апоптотические,
Bad, Bax, Bid про- апоптотические.
45.
46.
TRAIL (TNF-related apoptosis inducing ligand) Близок поэффекту к FasL.
Рецепторы TRAIL - DR4 или DR5. есть еще и «ложные»
рецепторы, которые не создают сигнал, и возможно
конкурируют с DR4, DR5 .
эффект NO на развитие апоптоза зависит от типа клеток и
концентрации, и может быть противоположным.
Анти-апоптотический эффект может быть связан с
нитрозилированием каспаз и/или повышении концентрации
cGMP и стимуляции экспрессии анти-апоптотических
факторов.
47.
Anoikis - Апоптоз развивающийся при недостатке адгезииECM (extracellular matrix)
Сигналы адгезии.
Интегрины - гетеродимерные рецепторы ЕСМ, формируют
комплексы клетка-ЕСМ (focal complexes).
pp125FAK, adhesion-activated tyrosine kinase, МАР киназы, PI3K
(phosphoinositide 3-kinase), Src – участники сигнальной сети
клетки
48.
49.
• Сигнальные белковые комплексы.• Сигнальные каскады, по-видимому, представляют собой
обширные «твердофазные» комплексы:
• Рецепторов, сопрягающих белков, белков-эффекторов.
Позиционирующие белки входят в такие комплексы как
усиливающий каркас.
• Позиционирующие белки осуществляют связь с
интегральными белками мембран и белками цитоскелета,
осуществляют формирование адаптерного комплекса
клатриновых везикул при эндоцитозе.
• Формирование жесткой структуры сигнальных комплексов,
по-видимому, необходимо для эффективного адресного
прохождения гормонального сигнала.
50.
PDZ доменыПо первым трем «прочитанным» типам белков
имеющим консеснусные участки ~90ак:
P)- белок в синапсах Drosophila (postsynaptic
density PSD-95/SAP90);
D)- Dlg (disk large) белок участвующий в
соединении сегментов Drosophila
Z)- tight junction protein ZO-1
51.
Адаптерные белки (содержащие PDZ) участвующие втранспорте ионов: NHERFs (Na/H Exchanger Regulatory
Factor)
Связываются с более 50 белками: GPCR, PTH receptor,
ионные транспортеры (CFTR, Na,H-ATPase, Na/H
exchanger), PL-C,
В геномах Caenorhabditis elegans, Drosophila, человека ~ 89,
128, and 320 PDZ белков соответственно. Большинство не
имеет трансмембранных доменов.
Создают основу для белковых комплексов в клетке, часто
на мембранах. Также участвуют в межклеточных
соединениях.
52.
53.
54.
55.
56.
57.
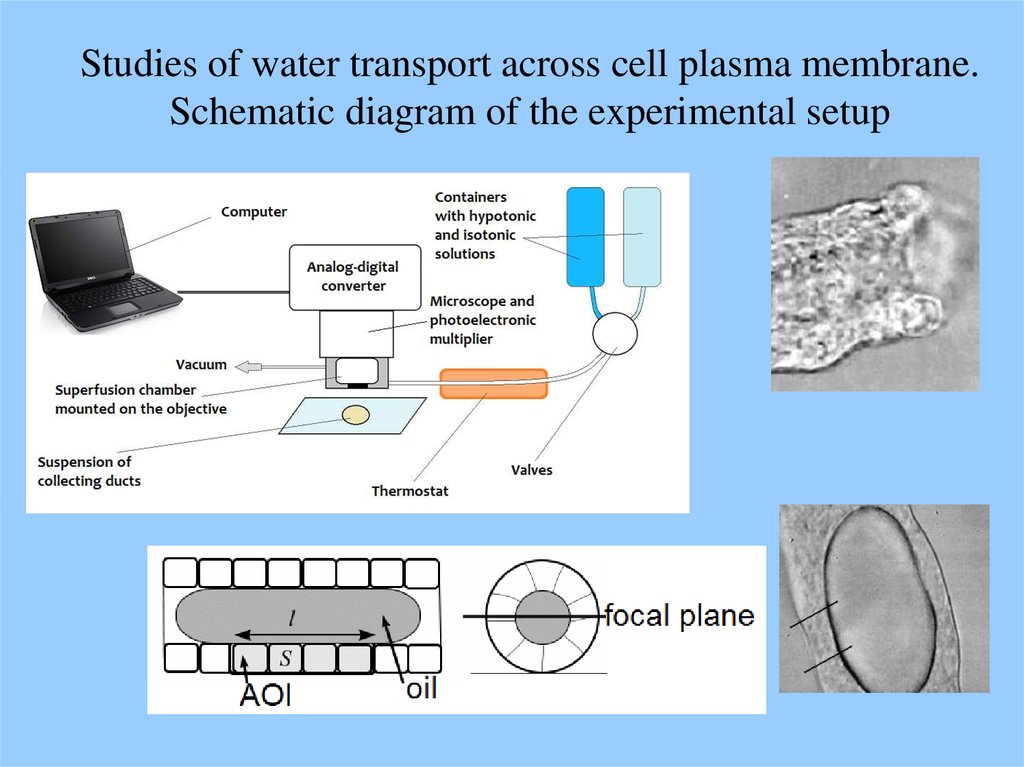
Studies of water transport across cell plasma membrane.Schematic diagram of the experimental setup
58.
Hypotonic medium causes cell swelling and activatesadaptive mechanism of recovery which is termed
Regulatory Volume Decrease (RVD).
H2O
H2O
H2O
H2O
H2O
K+
H2O
H2O
K+
H2O
H2O
H2O
H
O
H2O
Cl- K+ 2
organic
anions
To understand the adaptive reaction better one needs to
use mathematical modeling of osmolytes fluxes.
59.
Following processes were taken into account in the model of thecell response to the hypotonic shock :
The equations of mathematical model
Cell ion content and ion fluxes
dn Na
A 3J pump J Na J NKCC ,
dt
Sodium
dnK
A 2 J pump J K J KCC J NKCC ,
dt
Potassium
dnCl
A( J Cl J KCC 2 J NKCC ),
dt
Chloride
dn X
AJ X ,
dt
Organic anions (X)
Em F (nNa nK nCl zX) / Cm / A, Transmembrane
potential difference
dV
n n K nCl n X
AVW PW Na
П e .
dt
V
Cell volume
Iliaskin AV, e.a. Biofizika. 2011 May-Jun;56(3):550-60.
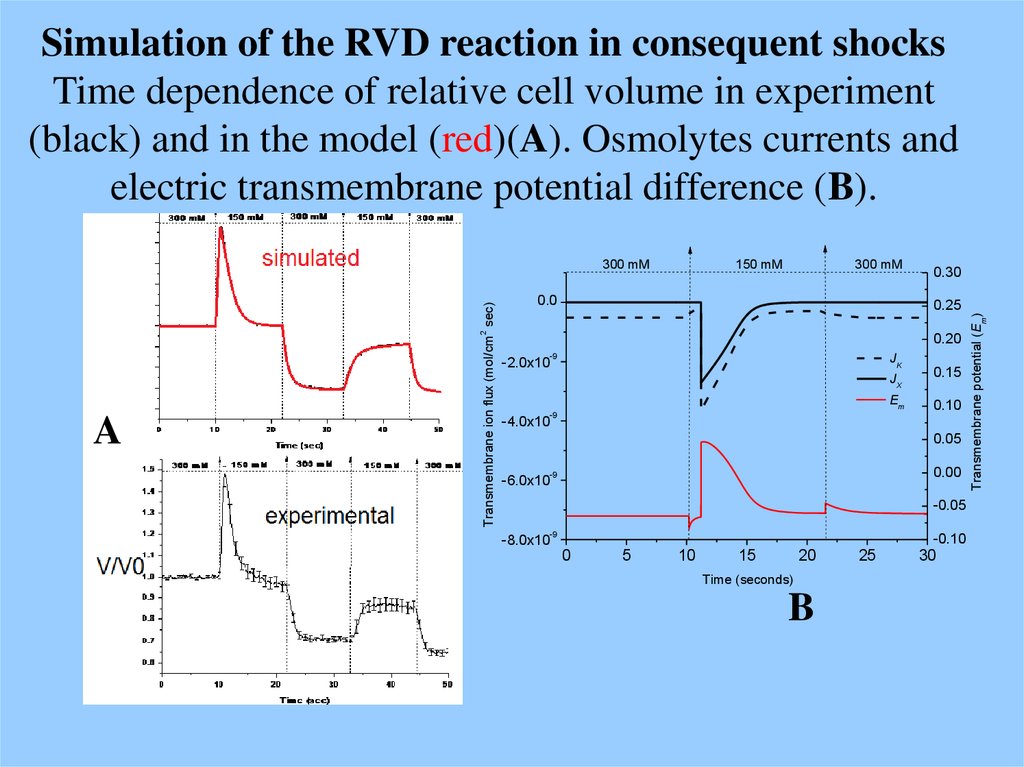
60. Simulation of the RVD reaction in consequent shocks Time dependence of relative cell volume in experiment (black) and in the
model (red)(A). Osmolytes currents andelectric transmembrane potential difference (B).
300 mM
150 mM
0.0
0.20
-9
JK
-2.0x10
JX
Em
-9
0.15
0.10
-4.0x10
0.05
0.00
-9
-6.0x10
-0.05
-9
-0.10
-8.0x10
0
5
10
15
20
Time (seconds)
B
25
30
Transmembrane potential (Em)
A
0.30
0.25
2
Transmembrane ion flux (mol/cm sec)
300 mM
61.
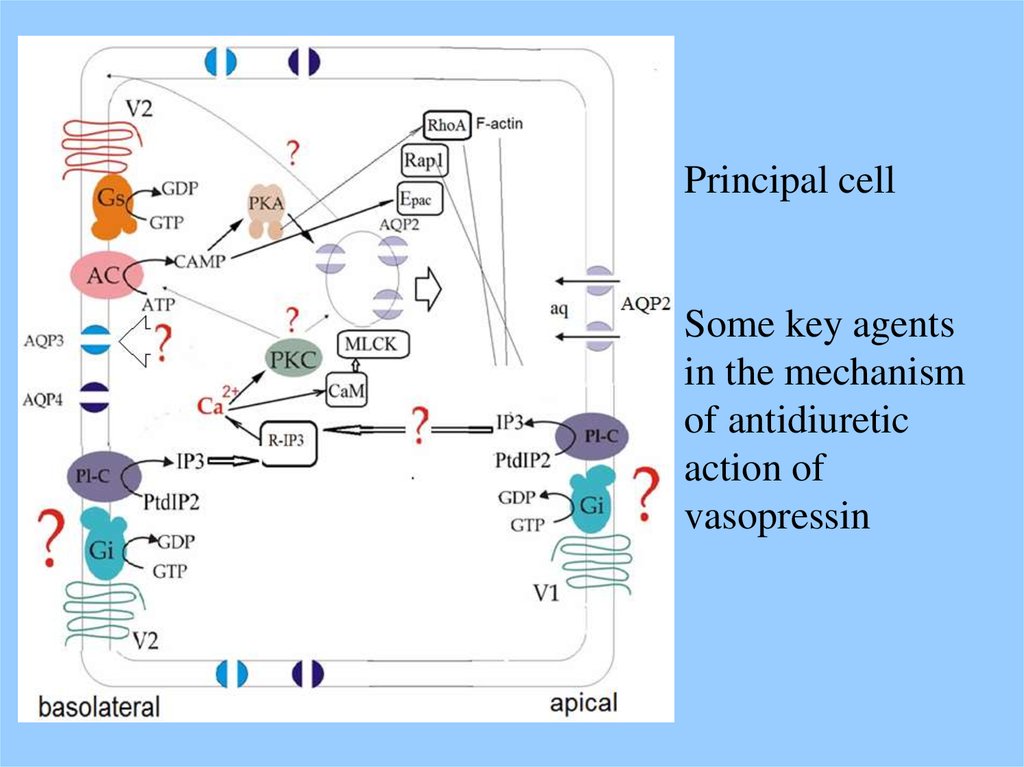
Principal cellSome key agents
in the mechanism
of antidiuretic
action of
vasopressin


































 biology
biology