Similar presentations:
Биокатализ. Ферментативный катализ
1.
Биокатализ2.
Биокатализ то же, что ферментативный катализ)— ускорение химических реакций в живых
клетках специальными белками — ферментами. В
основе биокатализа лежат те же самые
химические закономерности, что и в основе
небиологического катализа, используемого в
химическом производстве. Вместе с тем
биокатализ на основе ферментов отличается
ускорением реакций в десятки-сотни и даже
тысячи миллиардов раз в сравнении с
лабораторными и промышленными химическими
реакциями, специфичностью и регулируемостью,
т. е. изменением активности ферментов в
зависимости от потребностей организма
3.
Ферменты(энзимы)
–
биологические
катализаторы,
преимущественно
белковой
природы. Подавляющее большинство ферментов
имеют белковую природу. Термин фермент (от
лат. fermentum – закваска) был предложен в
начале 17 века голландским ученым Ван
Гельмонтом
для
обозначения
веществ,
способствующих
протеканию
спиртового
брожения. В 1878 году Кюне предложил термин
энзим (от греч. en – внутри, zyme – закваска).
Таким образом, оба эти названия обозначали
вещества, вызывающие процессы брожения.
4.
Поряду
признаков
ферменты
отличаются
от
неорганических катализаторов.
• Во-первых, подавляющее большинство ферментов
имеют белковую природу и, следовательно, являются
высокомолекулярными соединениями.
• Во-вторых, в отличие от неорганических катализаторов
ферменты действуют в «мягких» условиях: при
атмосферном давлении, нейтральных значениях рН, при
температурах
30–40°С.
Кроме
того,
скорость
ферментативного катализа во много сотен раз выше, чем
неорганического.
Одна
единственная
молекула
фермента может за 1 минуту катализировать до
миллиона химических реакций.
5.
Ферменты обладают высочайшей специфичностью поотношению к субстрату, то есть они осуществляют
катализ одной единственной строго определенной
реакции или группы однотипных реакций. В отличие
от неорганических катализаторов ферменты являются
катализаторами с регулируемой активностью. Они
могут взаимодействовать с различными факторами
внешней и внутриклеточной среды, и изменять под
действием этих факторов свои ферментативные
свойства. Таким образом, скорость протекания
ферментативных процессов в клетке может
ускоряться или замедляться под действием
различных
условий,
что
обеспечивает
приспособление организма к условиям среды на
молекулярном уровне.
6.
Строение ферментовПо строению ферменты делятся на простые и сложные.
Простые ферменты состоят только из белковой части, сложные
ферменты содержат небелковый компонент.
Холофермент – это сложный фермент.
Апофермент – белковая часть сложного фермента, а
небелковая часть сложного фермента – кофермент. Если
кофермент слабо связан с белковой частью и легко
диссоциируется, то он называется кофактором.
Кофактор – небелковая часть сложного фермента, способная
легко диссоциировать, несвязанная ковалентной связью с
белковой частью.
Простетическая группа – небелковая часть сложного фермента,
связанная с апоферментом ковалентной связью. Достаточно
часто в качестве коферментов в состав ферментов входят
витамины и их производные. Отдельно кофермент и
апофермент не обладают каталитической активностью.
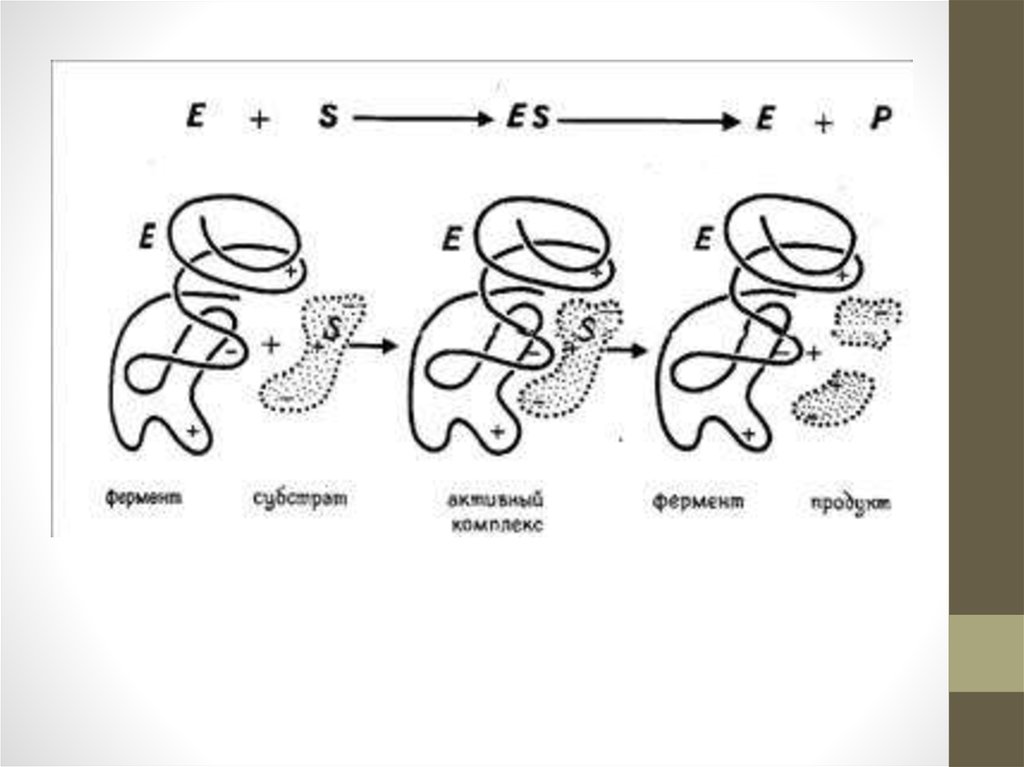
7.
8.
В молекуле фермента имеется активный центр – участокмолекулы фермента, способный связываться с молекулой
субстрата. Структура активного центра строго соответствует
структуре субстрата, говорят, что они подходят друг другу как
«ключ к замку». В активном центре могут располагаться
боковые радикалы аминокислот, находящиеся в самых
различных участках полипептидной цепочки апофермента.
9.
Помимо активного центра молекулы ферментовчасто содержат один или несколько регуляторных
центров. Это участки молекулы фермента,
способные взаимодействовать с различными
химическими
соединениями
(биологически
активными веществами и продуктами обмена).
Такое взаимодействие может ускорять или
замедлять протекание реакции, катализируемой
ферментом, что в целом приводит к тонкой
регуляции клеточного метаболизма и обеспечивает
адаптацию к меняющимся условиям окружающей
среды.
10.
Механизм действия ферментовНа первой стадии ферментативного катализа
происходит образование фермент-субстратного комплекса,
в котором фермент и субстрат могут быть связаны ионной,
ковалентной или иной связью. Образование этого
комплекса происходит почти мгновенно.
На второй стадии субстрат под воздействием фермента
видоизменяется и становится более доступным для
протекания соответствующей химической реакции. Это
наиболее длительная стадия всего каталитического
процесса, она определяет скорость протекания данной
реакции.
Далее происходит сама химическая реакция, в результате
которой образуется комплекс продукта реакции с
ферментом, этот комплекс нестабилен и очень быстро
распадается на продукт реакции и свободный фермент.
11.
12.
Свойства ферментовКаталитическая активность ферментов зависит от
температуры. Температура может влиять на активность
ферментов по-разному (рис. 2). При высоких температурах
может
происходить
денатурация
апофермента,
что,
естественно, приведет к потере им каталитической активности.
2. Активность ферментов зависит от кислотности среды, то есть
от рН. Большинство ферментов организма человека проявляют
максимальную активность при значениях рН, близких к
нейтральным (рис. 3). Лишь отдельные ферменты «работают» в
сильно кислой или сильно щелочной среде. Так, например,
активность пепсина – фермента, гидролизующего белки в
желудке, максимальна при рН 1,5–2,5, а ферменты тонкого
кишечника оптимально осуществляют свои функции в
щелочной среде
1.
13.
3. Специфичность фермента – это избирательностьфермента по отношению к субстрату. молекула фермента
представляет собой гибкую, эластичную структуру,
поэтому конформация активного центра фермента может
меняться при взаимодействии с субстратом. В момент
присоединения субстрат вынуждает фермент принять
некую определенную нужную форму.
14.
Классификация ферментовВ настоящее время известно более 2000 различных
ферментов. Они подразделяются на шесть классов,
каждый класс имеет определенный номер.
1. Оксидоредуктазы – это ферменты, которые
катализируют
окислительно-восстановительные
реакции.
2. Трансферазы катализируют реакции переноса
функциональных групп и молекулярных остатков с
одной молекулы на другую.
3. Гидролазы катализируют реакции гидролиза.
.
15.
4.Лиазы
ускоряют
реакции
негидролитического расщепления.
5.
Изомеразы
катализируют
процессы
изменения
геометрической
или
пространственной конфигурации молекулы.
6. Лигазы (синтетазы) катализируют реакции
образования сложных соединений из простых,
сопровождающиеся
гидролизом
богатой
энергией связи, как правило АТФ.
Каждый класс ферментов в свою очередь
подразделяется на подклассы, которые в свою
очередь подразделяются на подподклассы.














 biology
biology








