Similar presentations:
Ферменты. Стадии ферментативного катализа
1. Биохимия
Ферменты2. Ферменты
Посвоей
функции
ферменты
являются
биологическими
катализаторами.
Сущность
действия ферментов, так же как неорганических
катализаторов, заключается:
• в активации молекул реагирующих веществ,
• в разбиении реакции на несколько стадий,
энергетический барьер каждой из которых ниже
такового общей реакции.
Однако
энергетически
невозможные
реакции
ферменты катализировать не будут, они ускоряют
только те реакции, которые могут идти в данных
условиях.
3. Ферменты
Сходство ферментов и неорганическихкатализаторов заключается в следующем:
• Катализируют
только
энергетически
возможные реакции.
• Не изменяют направления реакции.
• Ускоряют наступление равновесия реакции,
но не сдвигают его.
• Не расходуются в процессе реакции.
4. Ферменты
Отличия ферментов от неорганических катализаторовпозволяют им «работать» внутри живых тел и
делают их изучение очень важным направлением в
химии:
• Скорость ферментативной реакции намного выше.
• Высокая специфичность.
• Мягкие условия работы (внутриклеточные).
• Возможность регулирования скорости реакции.
• Скорость
ферментативной
реакции
пропорциональна количеству фермента.
5. Стадии ферментативного катализа
Вферментативной
следующие этапы:
реакции
можно
выделить
1. Присоединение субстрата (S) к ферменту (E) с
образованием фермент-субстратного комплекса
(E-S).
2. Преобразование фермент-субстратного комплекса
в один или несколько переходных комплексов (EX) за одну или несколько стадий.
3. Превращение переходного комплекса в комплекс
фермент-продукт (E-P).
4. Отделение конечных продуктов от фермента.
6. Механизмы катализа
1. Кислотно-основной катализ – в активном центрефермента
находятся
группы
специфичных
аминокислотных остатков, которые являются
хорошими донорами или акцепторами протонов.
Такие группы представляют собой мощные
катализаторы многих органических реакций.
2. Ковалентный катализ – ферменты реагируют со
своими субстратами, образуя при помощи
ковалентных связей очень нестабильные ферментсубстратные комплексы, из которых в ходе
внутримолекулярных
перестроек
образуются
продукты реакции.
7. Типы ферментативных реакций
Взависимости от последовательности
взаимодействия между ферментом и
реактивами выделяют следующие типы
ферментативных реакций:
1. Случайная реакция
2. Последовательная реакция
3. Тип «пинг-понг»
8. Схема случайных реакций
В случайных реакциях последовательностьвзаимодействия между субстратом и
реагентами не имеет значения:
9. Схема последовательных реакций
В этом случае к ферменту последовательно присоединяютсясубстраты А и В, образуя "тройной комплекс", после чего
осуществляется катализ. Продукты реакции также
последовательно отщепляются от фермента.
10. Схема «пинг-понг»
Вэтом случае фермент сначала взаимодействует с
субстратом А, отбирая у него какие либо химические
группы и превращая в соответствующий продукт. Затем к
ферменту присоединяется субстрат В, получающий эти
химические группы.
11. Строение ферментов
Все ферменты являются белками, поэтому, они, как иостальные белки по составу делятся на простые и
сложные.
• Простые ферменты состоят только из аминокислот.
• Сложные ферменты имеют в своем составе белковую
часть, состоящую из аминокислот – апофермент, и
небелковую часть - кофактор. Кофактор, в свою очередь,
может
называться
коферментом
или
простетической группой.
Для осуществления катализа необходим полноценный
комплекс апобелка и кофактора, по отдельности катализ
они осуществить не могут. Как многие белки, ферменты
могут быть мономерами полимерами.
12. Строение ферментов
В составе фермента выделяют две области – активныйцентр и аллостерический центр.
Активный центр – комбинация аминокислотных
остатков
(обычно
12-16),
обеспечивающая
непосредственное связывание с молекулой
субстрата и осуществляющая катализ. В активном
центре выделяют два участка:
• якорный (контактный, связывающий) – отвечает за
связывание и ориентацию субстрата в активном
центре,
• каталитический – непосредственно отвечает за
осуществление реакции.
13. Схема активного центра
14. Строение ферментов
Аллостерический центр – центр регуляцииактивности
фермента,
который
пространственно отделен от активного центра
и имеется не у всех ферментов. Связывание с
аллостерическим
центром
какой-либо
молекулы (называемой активатором или
ингибитором,
а
также
эффектором,
модулятором,
регулятором)
вызывает
изменение конфигурации белка-фермента и,
как следствие, скорости ферментативной
реакции.
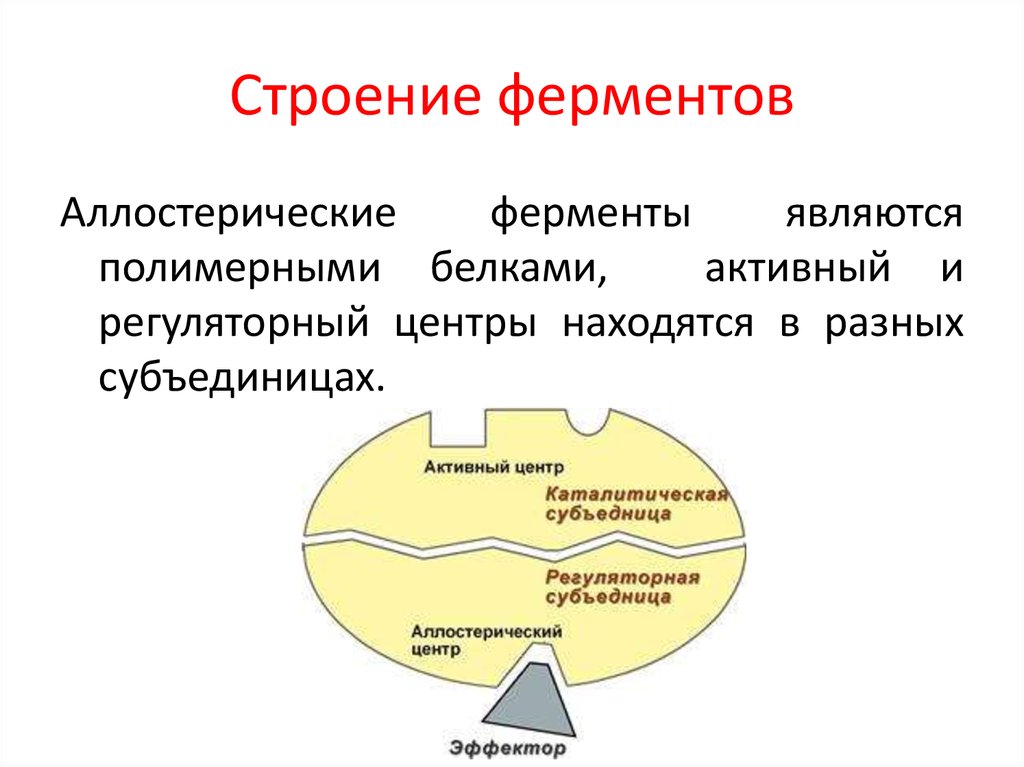
15. Строение ферментов
Аллостерическиеферменты
являются
полимерными белками,
активный и
регуляторный центры находятся в разных
субъединицах.
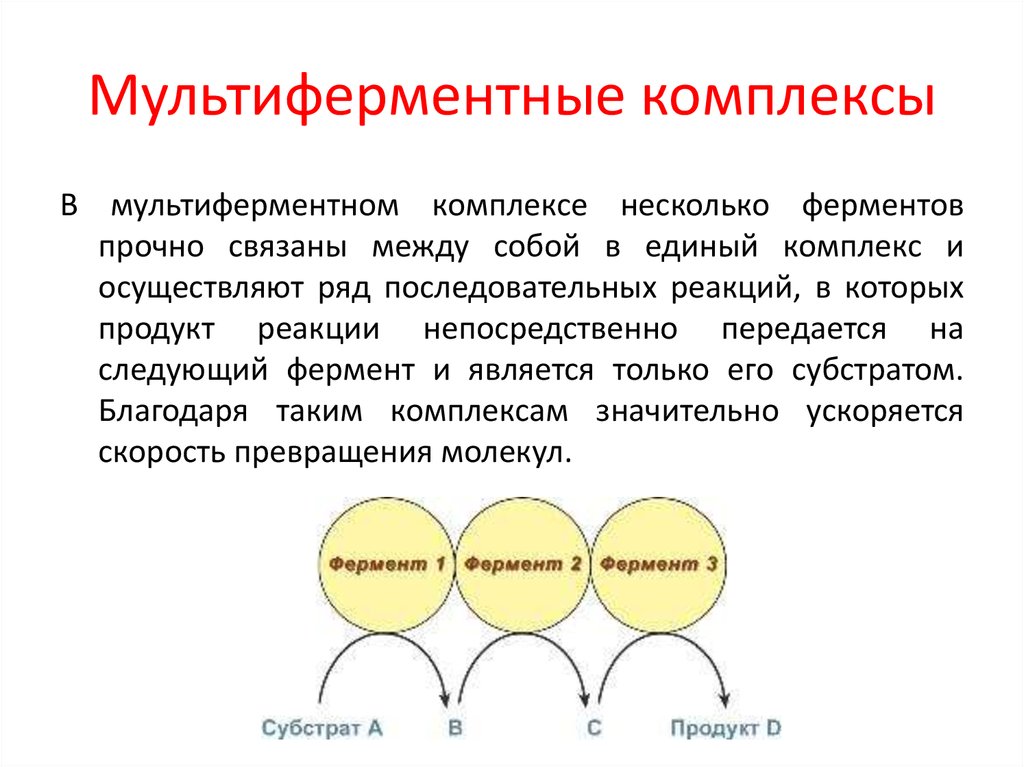
16. Мультиферментные комплексы
В мультиферментном комплексе несколько ферментовпрочно связаны между собой в единый комплекс и
осуществляют ряд последовательных реакций, в которых
продукт реакции непосредственно передается на
следующий фермент и является только его субстратом.
Благодаря таким комплексам значительно ускоряется
скорость превращения молекул.
17. Специфичность
Ферменты крайне избирательно запускают химические реакции, из всехвозможных вариантов направления фермент выбирает один нужный
и катализирует реакцию только в этом направлении – это и есть
специфичность действия катализатора.
Фермент может проявлять специфичность в отношении:
Одного из стереоизомеров. Почти все ферменты человеческого
организма реагируют только с L-аминокислотами. Это явление
называется стереоспецифичностью.
Одного вещества. Это абсолютная специфичность. Фермент «работает»
только с одним веществом.
Определенной группы веществ с общим строением. Это групповая
специфичность.
Определенной группы веществ с каким-либо общим свойством. Это
относительная групповая специфичность. Например, цитохром
Р450 окисляет только гидрофобные вещества, которых насчитывается
около 7000
18. Механизм специфичности ферментов
Вобщем
случае
специфичность
обусловлена
взаимодействием определенных функциональных групп
субстрата и фермента. На данный момент существуют две
теории, объясняющие специфичность ферментов. Одна из
них объясняет абсолютную специфичность, другая –
групповую.
«Ключ-замок», она - же теория Фишера. Согласно этой
теории конфигурация молекулы фермента соответствует
только одному веществу. Они подходят друг к другу как
ключ и замок. Другое вещество (другой ключ) не сможет
взаимодействовать с субстратом. Эта теория легко
объясняет абсолютную специфичность.
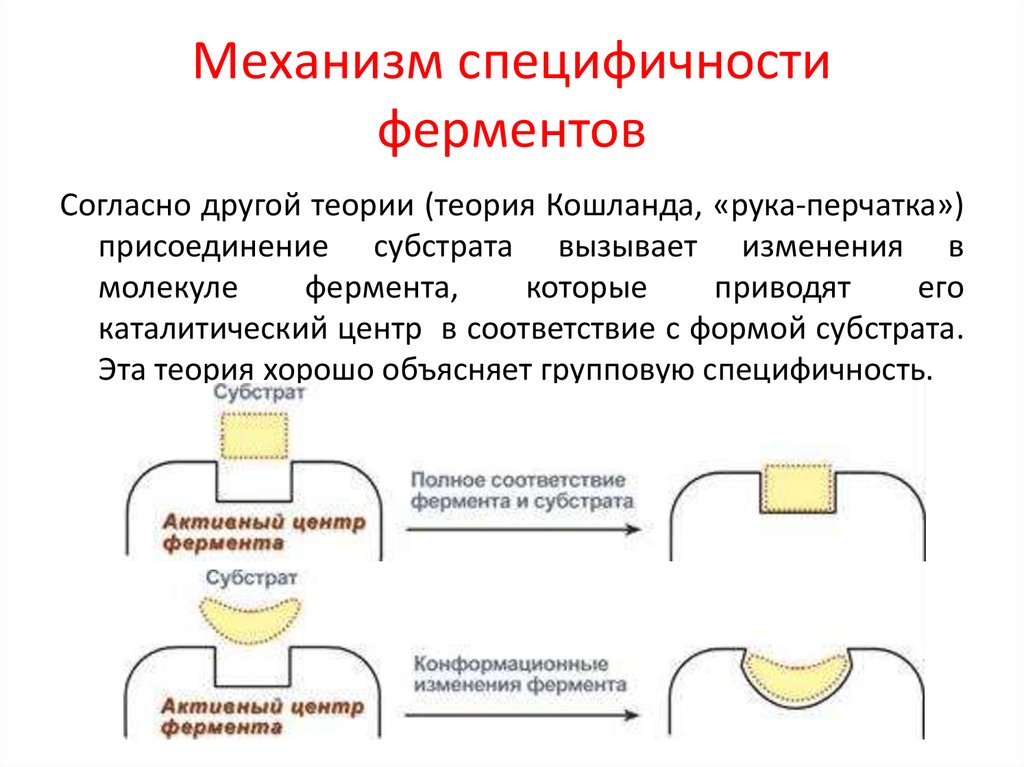
19. Механизм специфичности ферментов
Согласно другой теории (теория Кошланда, «рука-перчатка»)присоединение субстрата вызывает изменения в
молекуле
фермента,
которые
приводят
его
каталитический центр в соответствие с формой субстрата.
Эта теория хорошо объясняет групповую специфичность.
20. Регуляция активности фермента
Втечении времени активность фермента внутри клетки
непостоянна. Ферменты реагируют на изменение внешних и
внутренних условий клетки, что необходимо для её
нормального функционирования. Механизмов, которые
регулируют активность фермента всего 7:
1 Доступность субстрата или кофермента
2 Компартментализация
3 Изменение количества фермента
4 Ограниченный протеолиз ферментов
5 Аллостерическая регуляция
6 Белок-белковое взаимодействие
7 Ковалентная модификация
21. Кинетические способы регуляции
По закону действующих масс скорость пропорциональнапроизведению
концентраций.
Уменьшение
концентраций приводит к уменьшению скорости
реакции.
Субстрат, или кофермент может подаваться к ферменту
дозировано – это и есть ограничение их доступности.
Компартментализация – это явление, когда фермент,
субстрат и кофермент концентрируются в определенных
органеллах (компартментах) клетки.
При определенных условиях клетка может сокращать
количество синтезируемого фермента, что сокращает
его концентрацию.
22. Аллостерическая регуляция
Аллостерические ферменты построены из двух иболее субъединиц: одни субъединицы содержат
каталитический
центр,
другие
имеют
аллостерический центр и являются регуляторными.
Присоединение эффектора к аллостерической
(регуляторной)
субъединице
изменяет
конформацию белка и, соответственно, активность
каталитической субъединицы.
В качестве отрицательного регулятора может
выступать конечный метаболит биохимического
процесса или продукт данной реакции.
23. Белок-белковое взаимодействие
Термин белок-белковое взаимодействиеобозначает ситуацию, когда в качестве
регулятора выступают не метаболиты
биохимических процессов, а специфичные
белки. В целом ситуация схожа с
аллостерическим
механизмом:
после
влияния
каких-либо
факторов
на
специфичные белки изменяется активность
этих белков, и они, в свою очередь,
воздействуют на нужный фермент.
24. Ковалентная модификация
Ковалентная модификация заключается в обратимомприсоединении или отщеплении определенной группы,
благодаря чему изменяется активность фермента. Чаще
всего такой группой является фосфорная кислота, реже
метильные и ацетильные группы.
Фосфорилирование фермента происходит по остаткам
серина и тирозина. Присоединение фосфорной кислоты
к белку осуществляют ферменты протеинкиназы,
отщепление –протеинфосфатазы.
Ферменты могут быть активны как в фосфорилированном,
так и в дефосфорилированном состоянии.
25. Ингибирование
В медицине активно разрабатываются и используютсясоединения, изменяющие активность ферментов с целью
регуляции скорости метаболических реакций и
уменьшения синтеза определенных веществ в организме.
В медицине разделяют общий химический термин
«ингибитор»:
• на вещества, которые способны уменьшать активность
только одного фермента – это ингибиторы.
• на вещества, которые уменьшают активность вообще всех
ферментов – это инактиваторы.
26. Ингибирование
Можновыделить
два
основных
направления
ингибирования:
• по прочности связывания фермента с ингибитором
ингибирование бывает обратимым (фермент можно
восстановить)
и необратимым (сводится к
необратимому изменению, или даже разрушению
молекулы фермента).
• по отношению ингибитора к активному центру
фермента ингибирование делят на конкурентное (когда
ингибитор начинает конкурировать с субстратом за
местно
на
активном
центре
фермента)
и
неконкурентное
(ингибитор
присоединяется не в активном центре фермента, а в
другой его части).























 biology
biology








