Similar presentations:
Ферментный катализ
1. Ферментный катализ
2.
3.
Ферменты – это белки,способные быть
катализаторами
биохимических реакций
4. Биологические особенности ферментного катализа
• Нейтральный рН• Водная среда
• Температура 40оС
• Нормальное атмосферное
давление
• Высокая скорость реакций
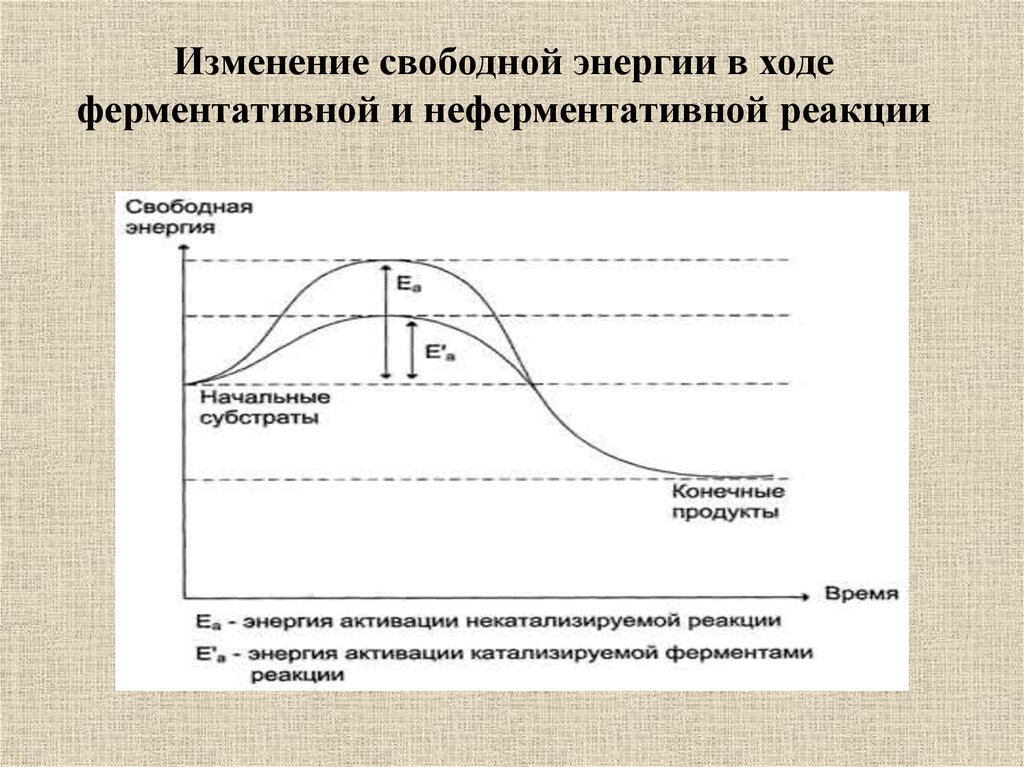
5. Изменение свободной энергии в ходе ферментативной и неферментативной реакции
6.
Энергия активации – это такоеколичество энергии в калориях,
которое необходимо для того,
чтобы все молекулы 1 моля
вещества при определенной
температуре достигли переходного
состояния, соответствующего
вершине энергетического барьера.
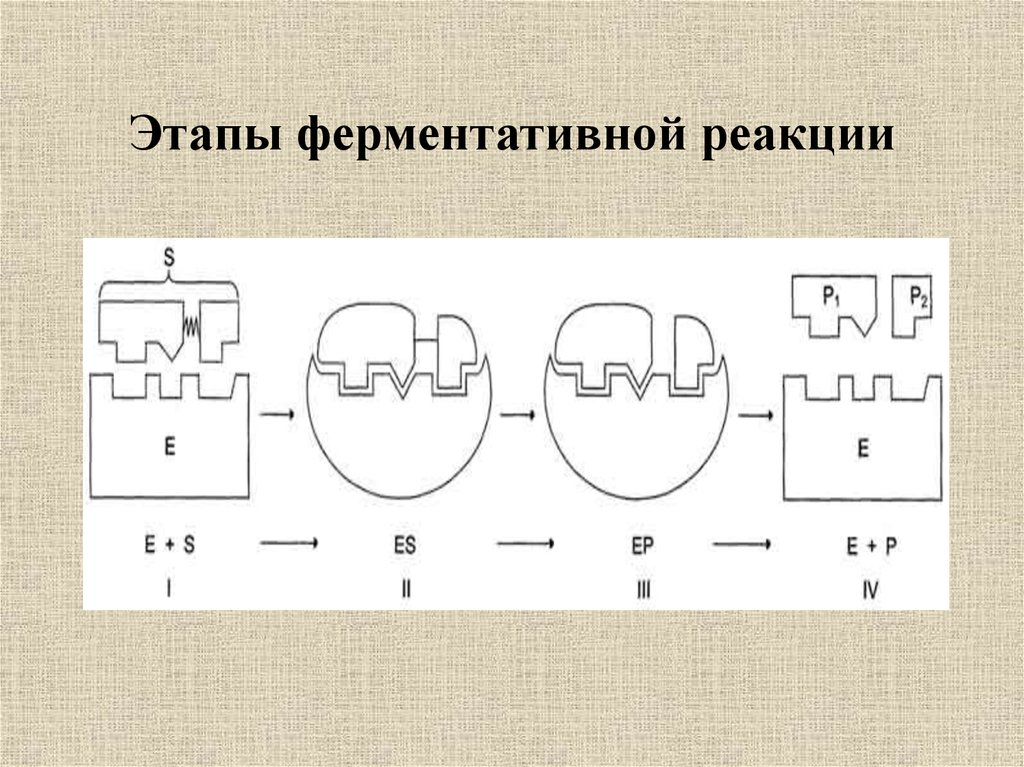
7. Этапы ферментативной реакции
8. Преимущества реакции с участием фермента
• Сближение и ориентация субстрата вактивном центре фермента
• Исключение воды из места проведения
реакции
• Стабилизация переходного состояния
• Перенос групп
9. Изменение свободной энергии в ходе ферментативной и неферментативной реакции
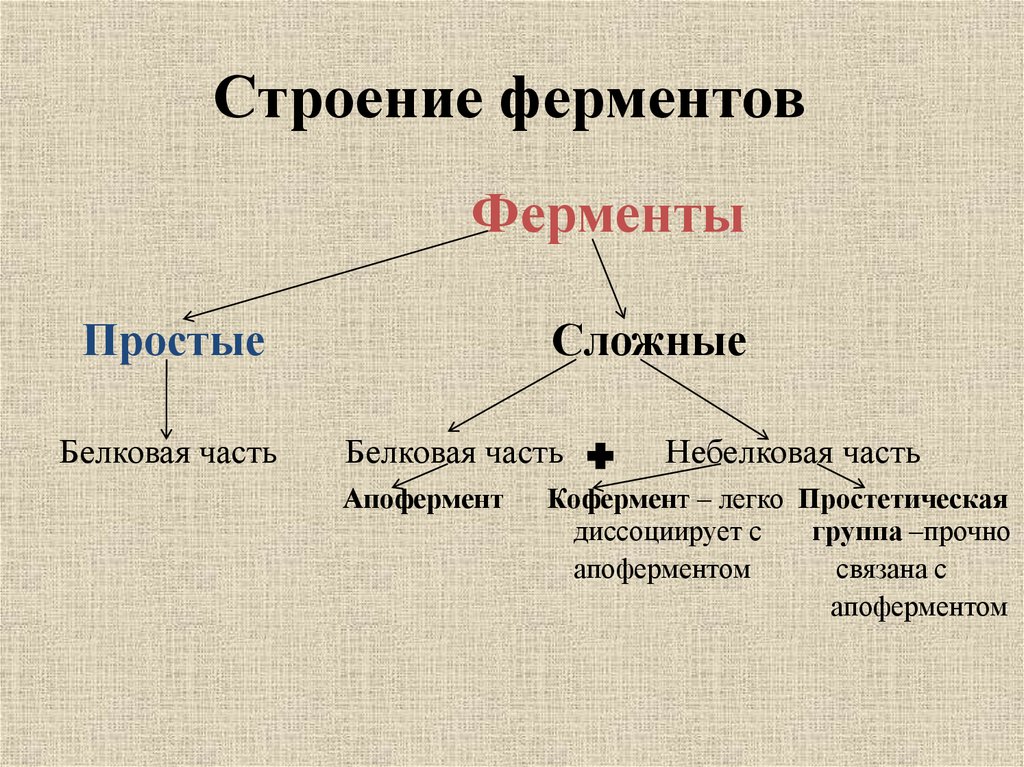
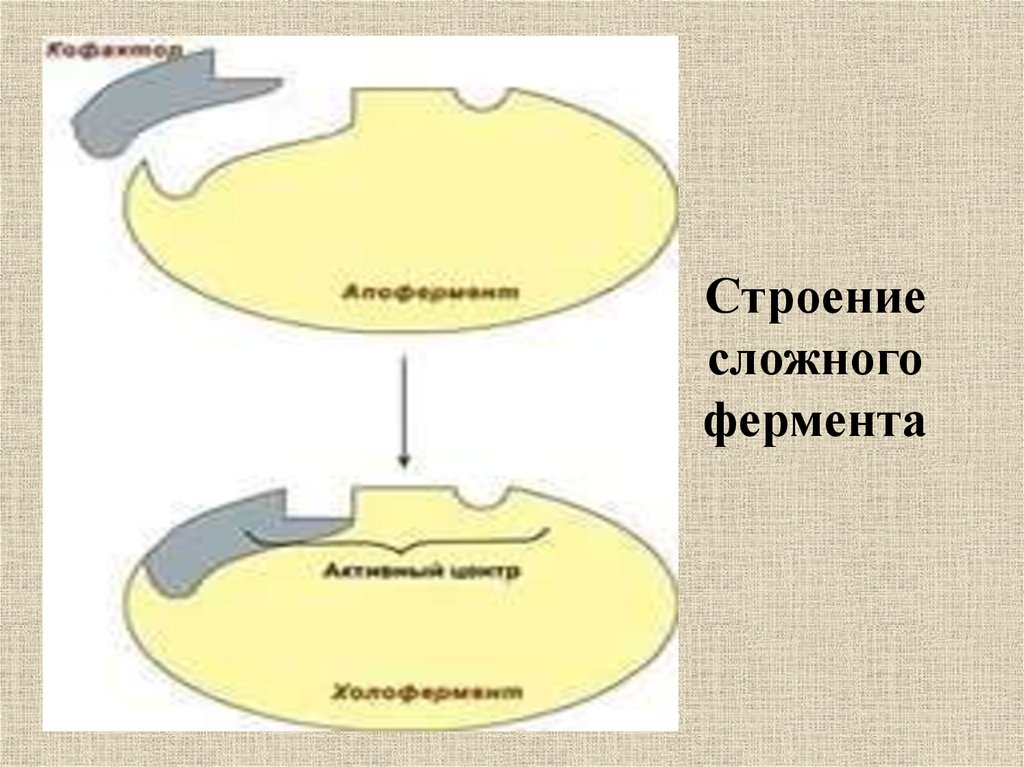
10. Строение ферментов
ФерментыПростые
Белковая часть
Сложные
Белковая часть
Апофермент
Небелковая часть
Кофермент – легко Простетическая
диссоциирует с
группа –прочно
апоферментом
связана с
апоферментом
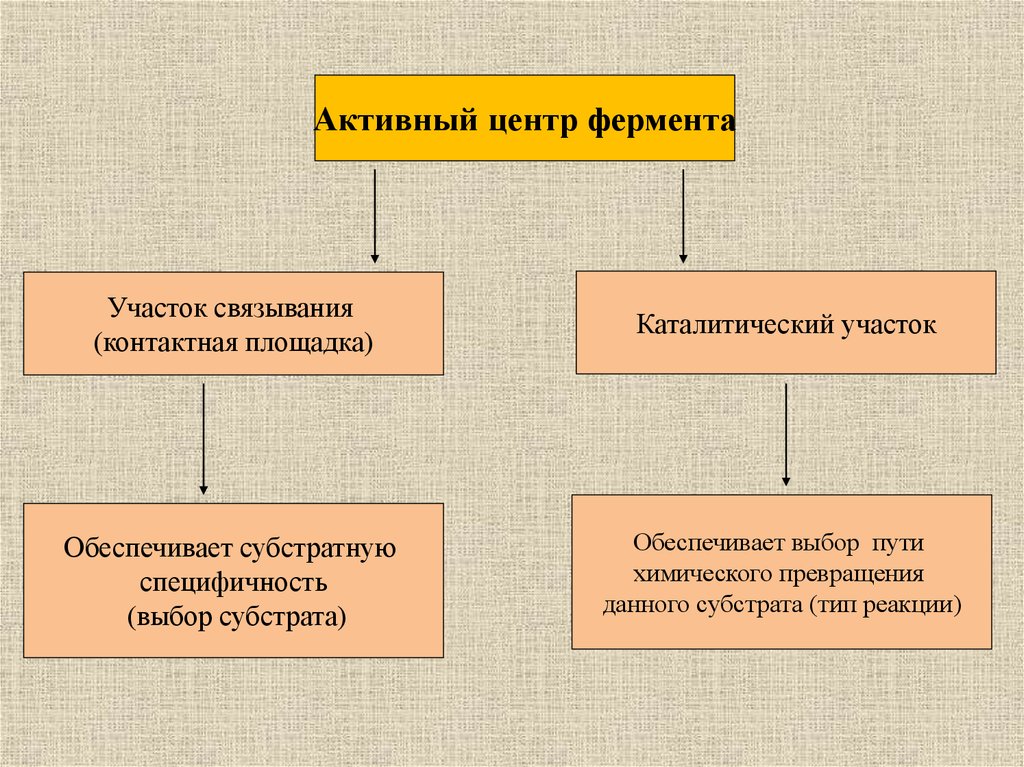
11.
Активный центр ферментаУчасток связывания
(контактная площадка)
Каталитический участок
Обеспечивает субстратную
специфичность
(выбор субстрата)
Обеспечивает выбор пути
химического превращения
данного субстрата (тип реакции)
12. Строение фермента
13. Строение сложного фермента
14.
Специфичность – этовысокая избирательность
действия ферментов,
основанная на
комплементарности
структуры субстрата и
активного центра фермента.
15. Теория Фишера (модель жесткой матрицы «ключ-замок»)
Теория Кошланда (модельиндуцированного взаимодействия
«рука-перчатка»)
16. Виды специфичности ферментов
• Абсолютная• Стереохимическая
• Относительная (групповая)
17.
Активность фермента – этоизменение субстрата под влиянием
фермента в единицу времени.
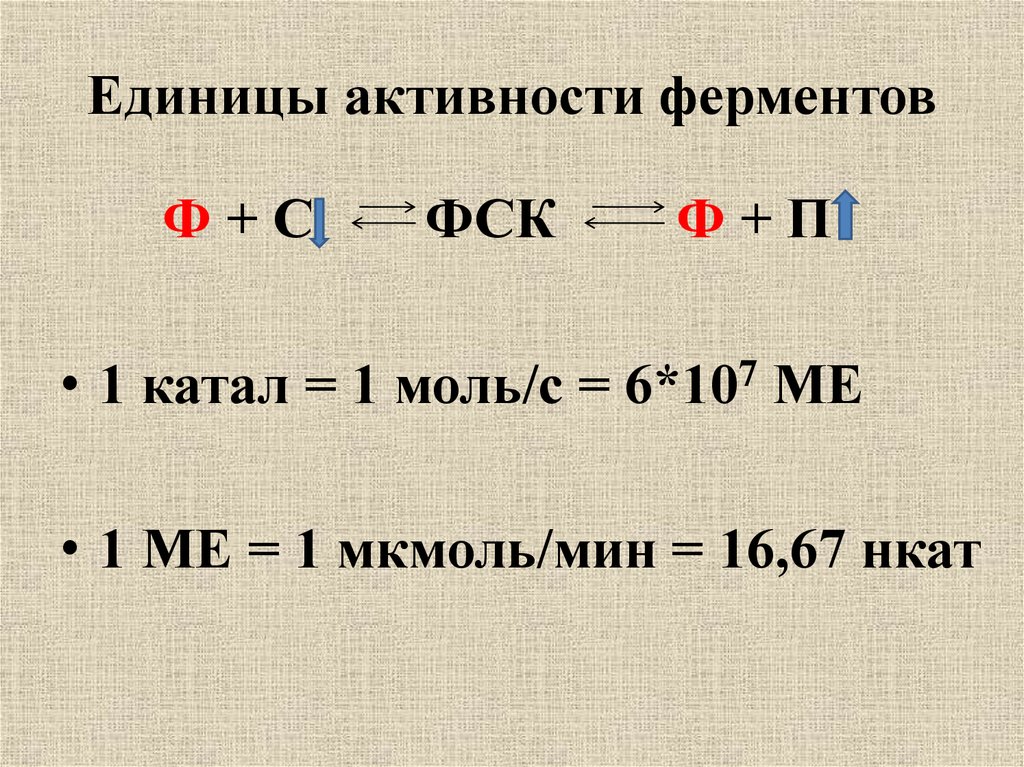
18. Единицы активности ферментов
Ф+СФСК
Ф+П
• 1 катал = 1 моль/с = 6*107 МЕ
• 1 МЕ = 1 мкмоль/мин = 16,67 нкат
19. Способы регулирования активности ферментов путем изменения:
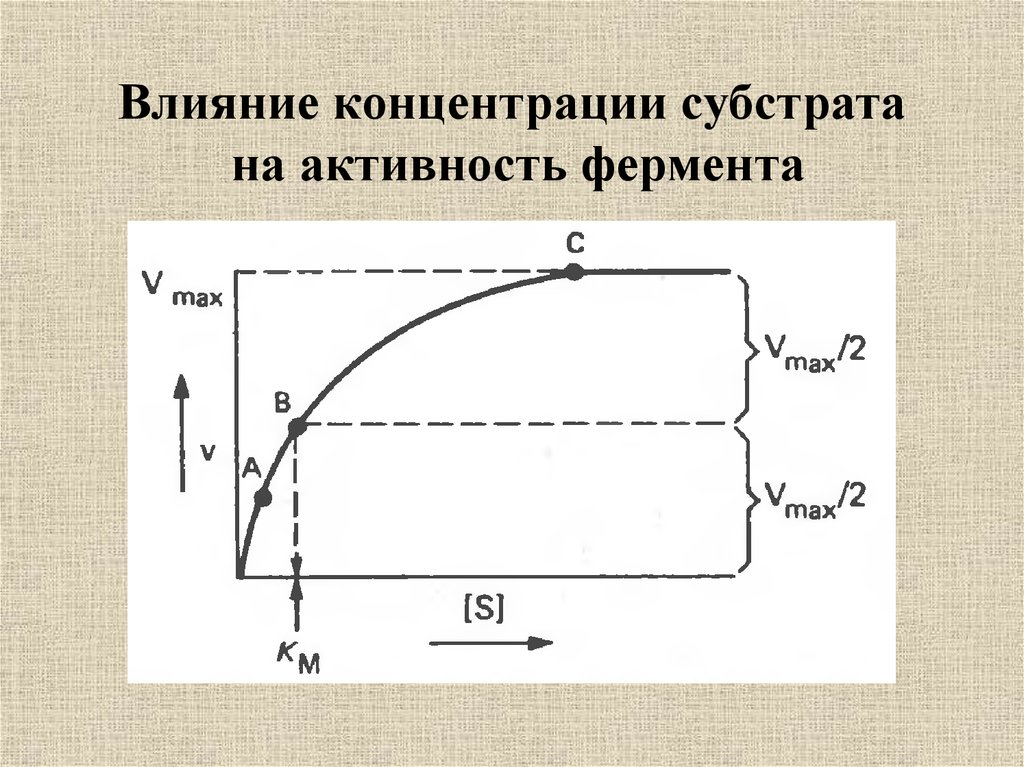
Концентрации субстрата
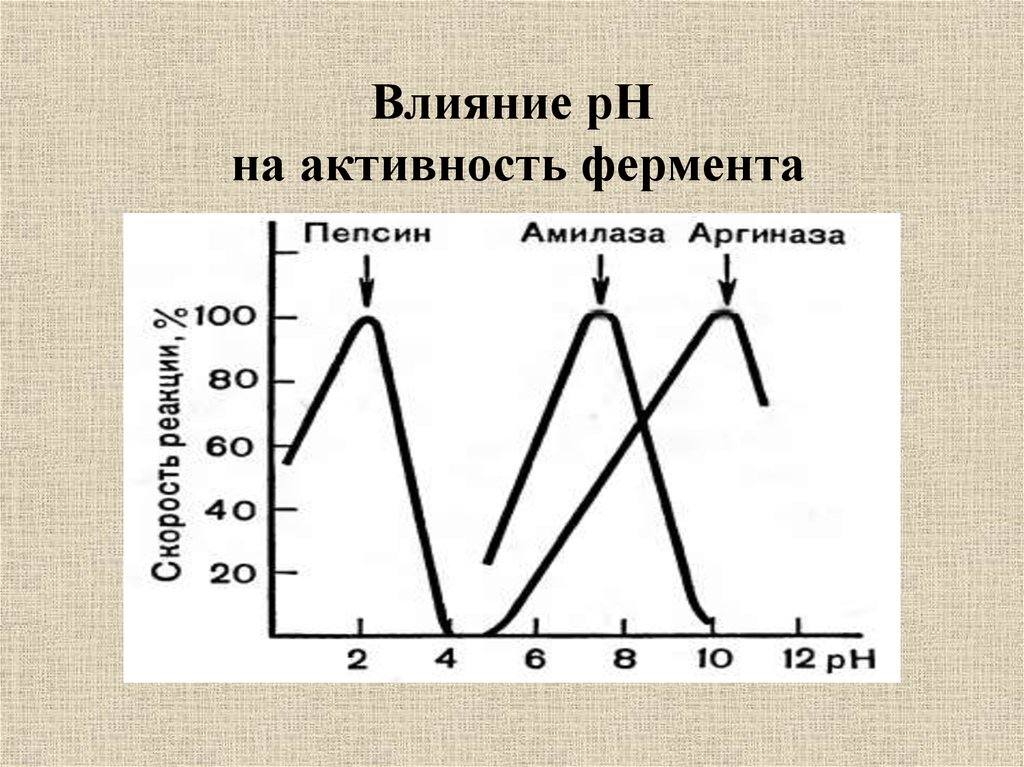
рН среды
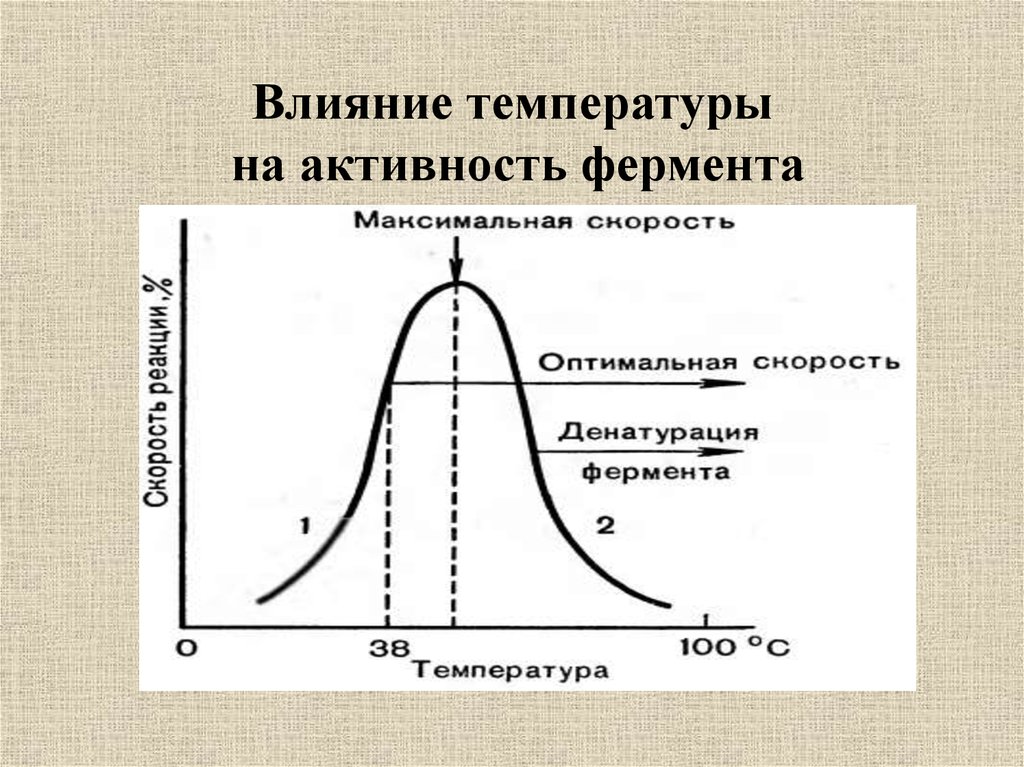
Температуры
Химического состава реакционной
среды
20. Влияние концентрации субстрата на активность фермента
21. Влияние рН на активность фермента
22. Влияние температуры на активность фермента
23. Влияние химического состава реакционной среды на активность ферментов
• Активация• Ингибирование
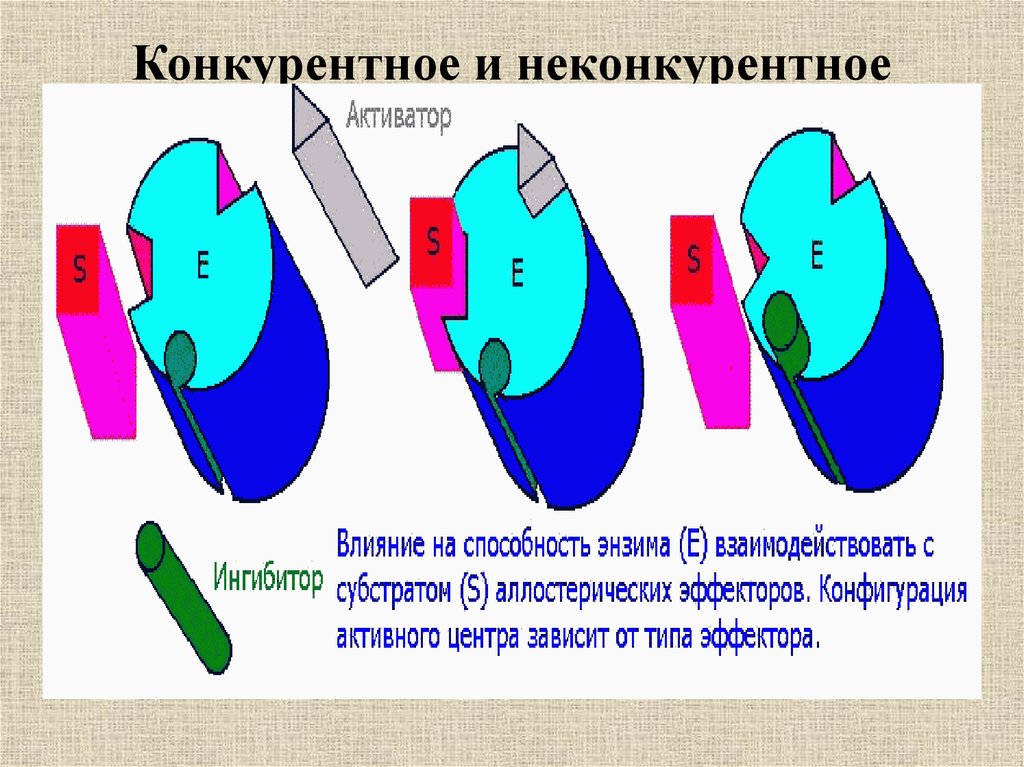
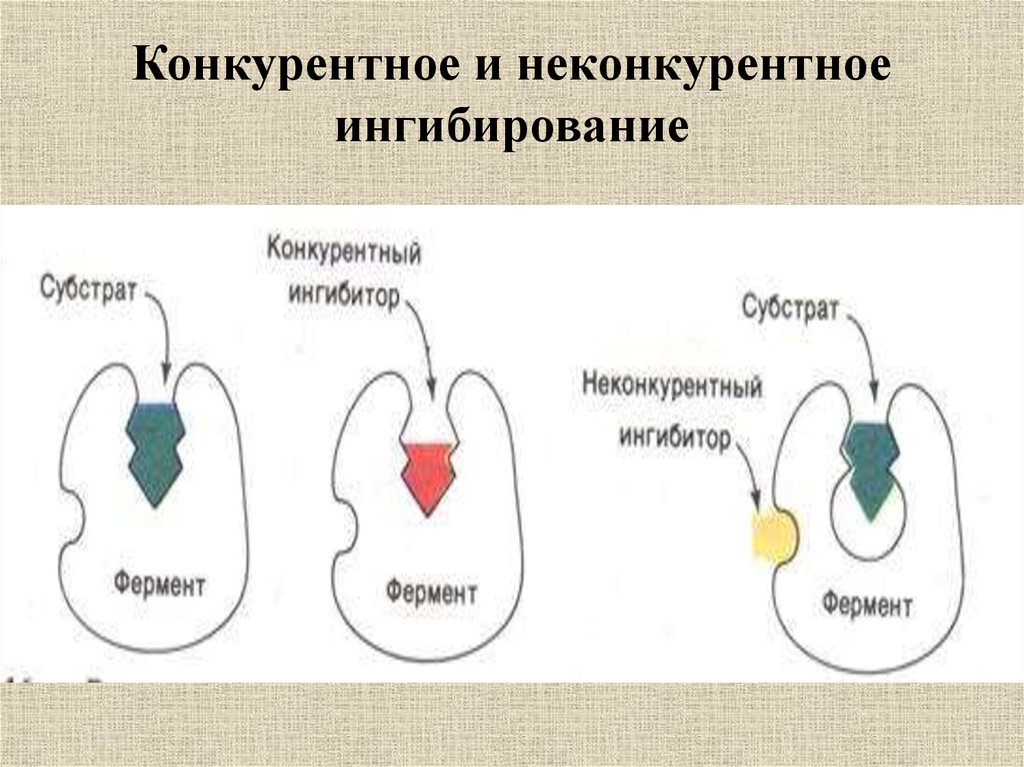
24. Конкурентное и неконкурентное ингибирование
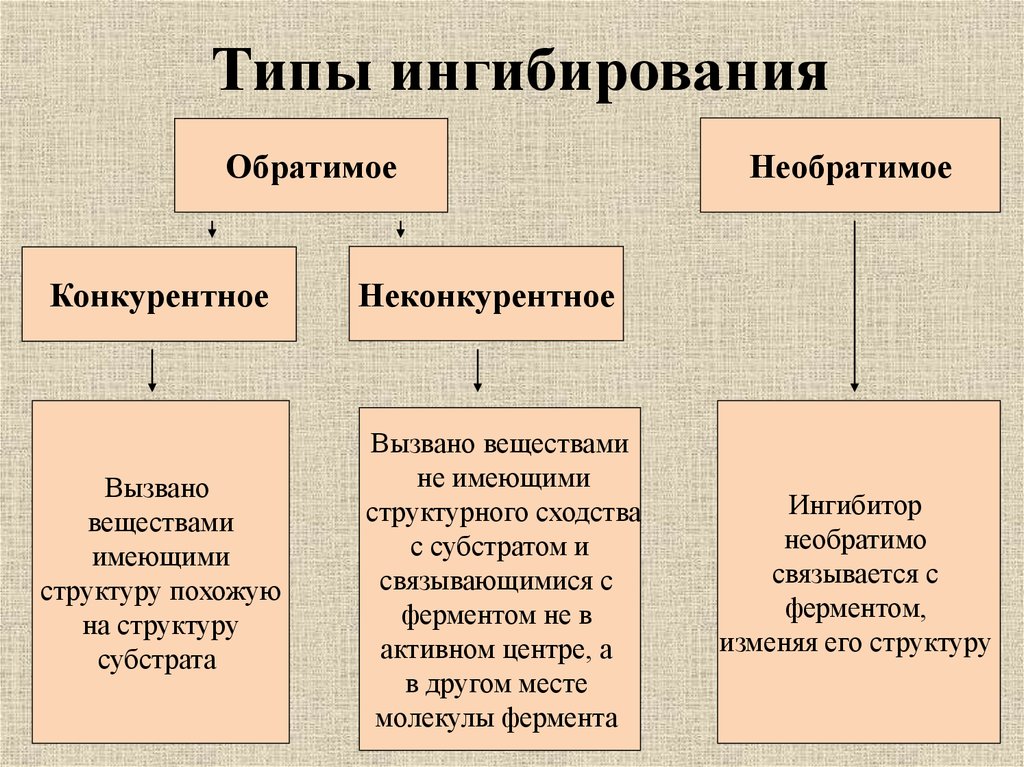
25. Типы ингибирования
ОбратимоеКонкурентное
Вызвано
веществами
имеющими
структуру похожую
на структуру
субстрата
Необратимое
Неконкурентное
Вызвано веществами
не имеющими
структурного сходства
с субстратом и
связывающимися с
ферментом не в
активном центре, а
в другом месте
молекулы фермента
Ингибитор
необратимо
связывается с
ферментом,
изменяя его структуру
26. Конкурентное и неконкурентное ингибирование
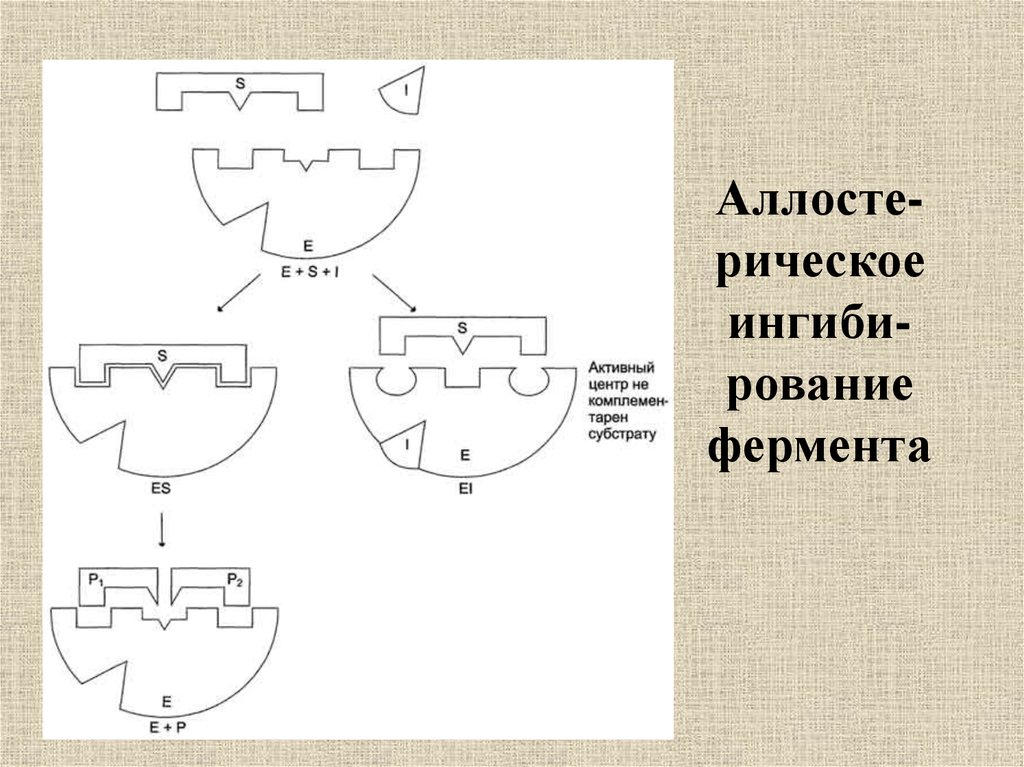
27. Аллосте-рическое ингиби-рование фермента
Аллостерическоеингибирование
фермента
28. Особенности аллостерических ферментов
Особенности аллостерических
ферментов
это олигомерные белки
имеют аллостерический центр
проявляют различную специфичность
к аллостерическим модуляторам
регуляция аллостерических ферментов
обратима
катализируют ключевые реакции
различных метаболических путей
29. Виды ковалентной модификации каталитической активности ферментов
• Частичный протеолиз• Ассоциация – диссоциация
• Фосфорилирование дефосфорилирование
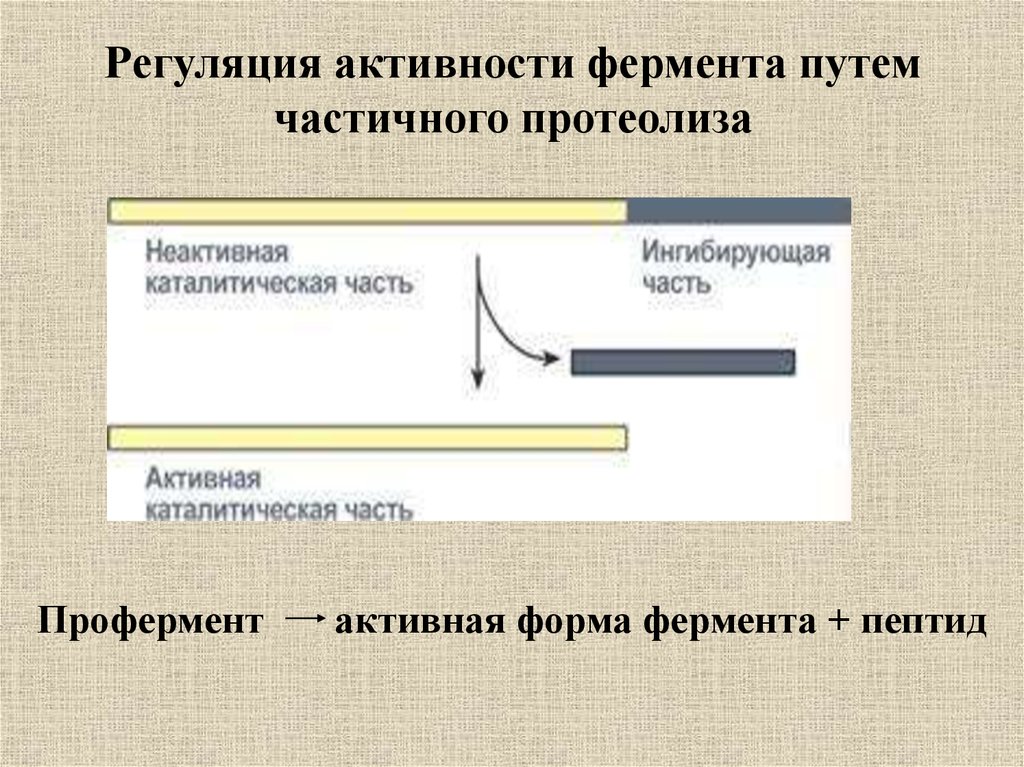
30. Регуляция активности фермента путем частичного протеолиза
Проферментактивная форма фермента + пептид
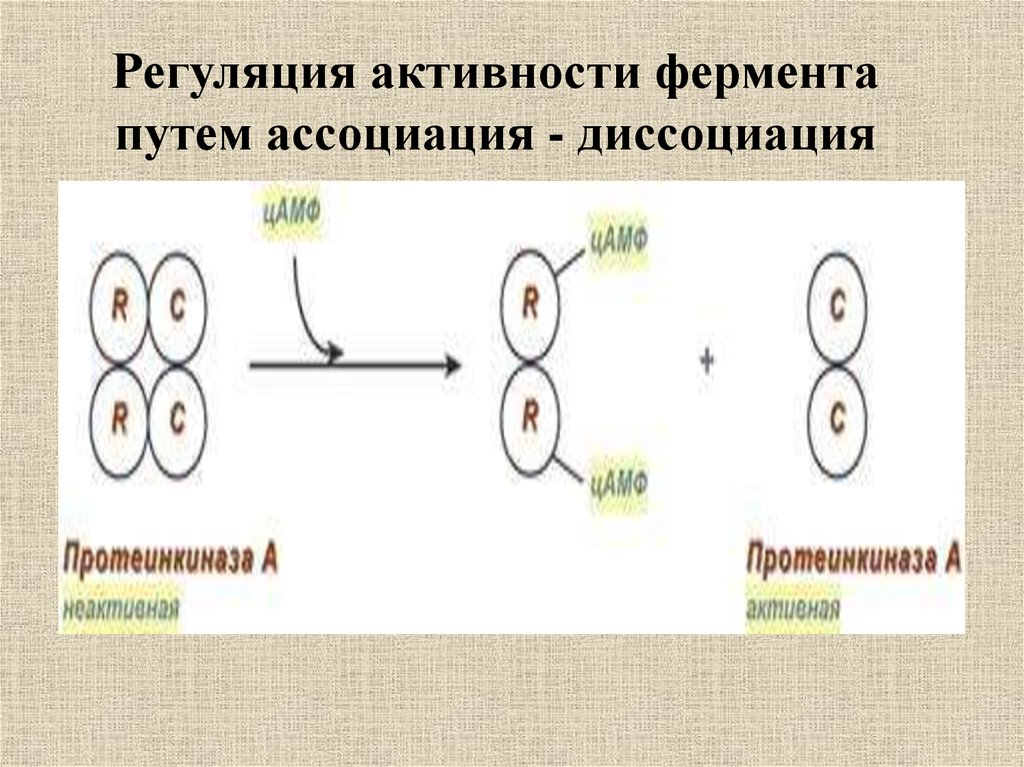
31. Регуляция активности фермента путем ассоциация - диссоциация
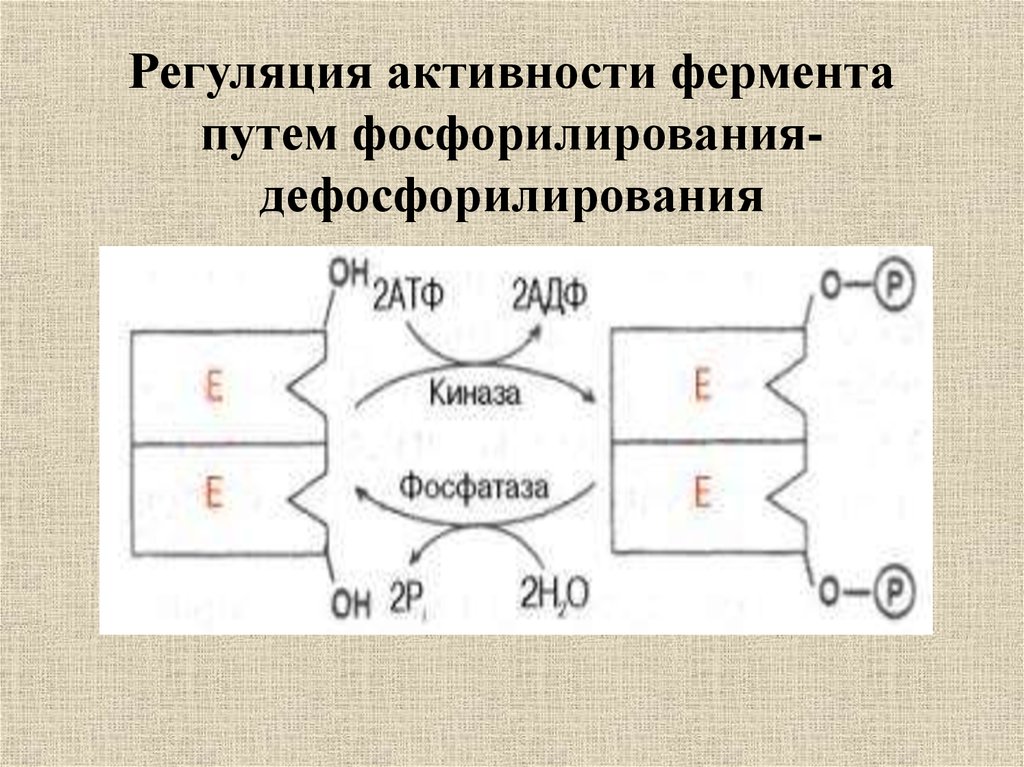
32. Регуляция активности фермента путем фосфорилирования- дефосфорилирования
Регуляция активности ферментапутем фосфорилированиядефосфорилирования
33.
Изоферменты – это ферменты,катализирующие одинаковые
реакции, но отличающиеся
физико-химическими и
биохимическими параметрами.
34. Изоферментные формы лактатдегидрогеназы (ЛДГ)
АААА
АААВ
ААВВ
АВВВ
ВВВВ
ЛДГ 1
ЛДГ 2
ЛДГ 3
ЛДГ 4
ЛДГ 5
сердце
мышцы
35. Факторы, определяющие распространение изоферментов
• Особенности метаболизма в различных органах итканях
• Особенности метаболизма в различных
органеллах клетки
• Особенности метаболизма взрослого организма и
эмбриона
• Различная чувствительность изоферментов к
аллостерическим модуляторам
36. Последовательный мультиферментный процесс
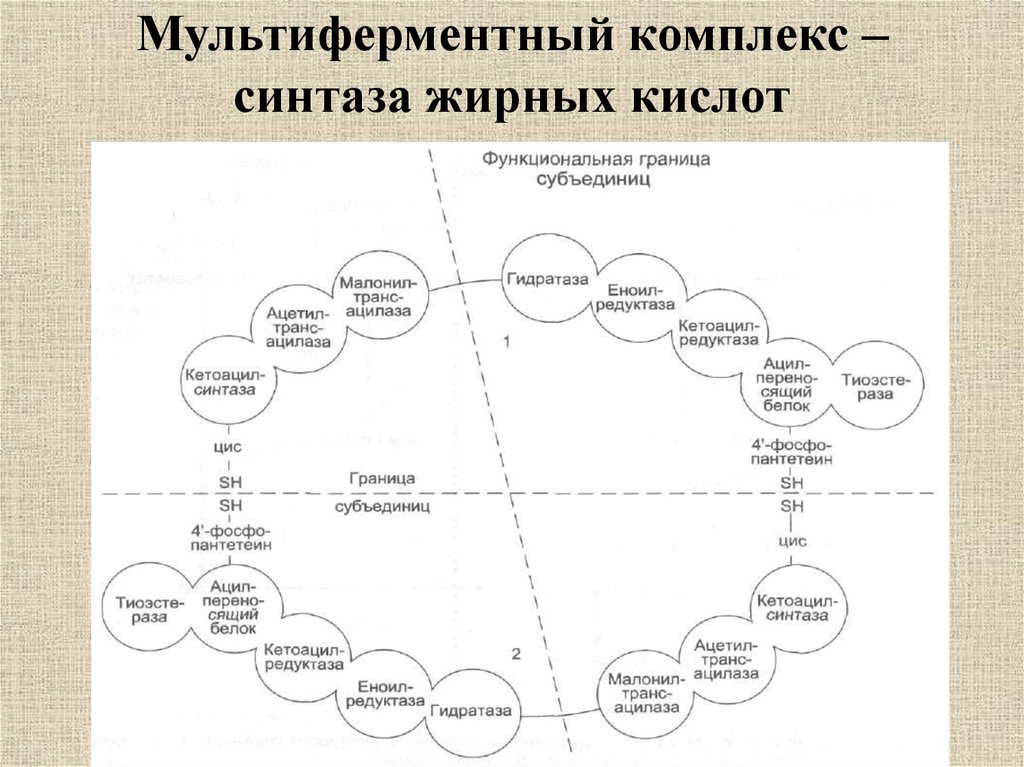
37. Мультиферментный комплекс – синтаза жирных кислот
38. Классификация ферментов
ОксидоредуктазыОкислительно – восстановительные
реакции всех типов
Трансферазы
Перенос отдельных атомов и групп атомов
Гидролазы
Гидролитическое расщепление
химических связей
Лиазы
Негидролитическое расщепление двойных
связей или их образование
Изомеразы
Взаимопревращения различных изомеров
Лигазы
Образование связей при взаимодействии
двух или более соединений (с помощью
энергии АТФ)





















 biology
biology








