Similar presentations:
Химия и искусство: техника офорт
1. Муниципальное автономное образовательное учреждение средняя школа №3
Внеклассное мероприятие:«Химия и искусство: техника офорт»
Химия. 9 класс.
Руководитель: Севостьянова Л.Н.
Учитель химии МАОУ СШ №3 р.п.Ильиногорск Володарского р-на
Нижегородской обл.
2.
Для корректной работы презентации в режиме показа слайдовнеобходимо установить маркер в положение
«Включить это содержимое»
3. Работы А.П.Остроумовой-Лебедевой
А.П. Остроумова -Лебедева,Вид на дворец. Дождь 1923,
офорт, Русский музей
А.П. ОстроумоваЛебедева (1871-1955)
А.П. Остроумова -Лебедева,
Пейзаж лунной ночью.1923,
офорт, Русский музей
А.П.Остроумова-Лебедева.
Крепость «Бип», офорт,
1824г, Русский музей
4.
Гипотеза: В школьном курсе химии очень большое вниманиеуделяется взаимодействию металлов с кислотами, знание этих
реакций пригодится нам в изготовлении нашей работы в технике
офорт
Цель: воспроизвести основные этапы создания офорта - нанести
изображение на поверхность металлической пластины методом
ее травления кислотой.
Задачи:
- подобрать кислоту, концентрацию кислоты для травления медной и
алюминиевой пластинки ;
- провести практическое исследование;
- получить гравюру в технике офорт
5.
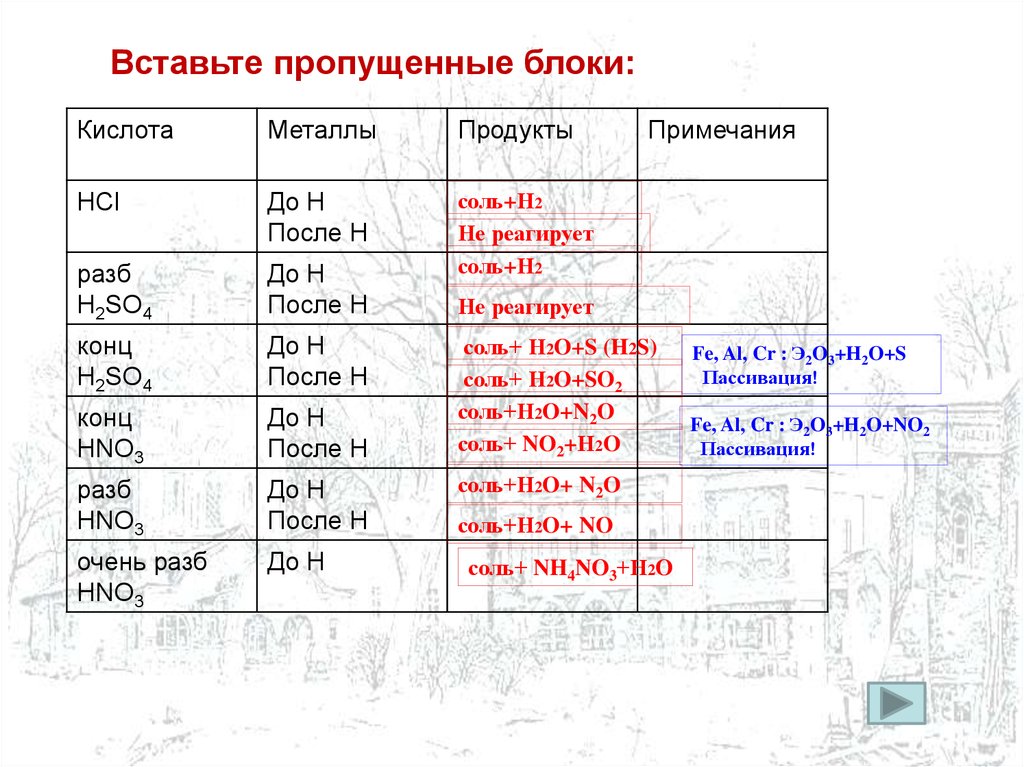
Вставьте пропущенные блоки:Кислота
Металлы
Продукты
HCl
До Н
После Н
разб
Н2SO4
До Н
После Н
соль+Н2
Не реагирует
соль+Н2
конц
H2SO4
До Н
После Н
конц
HNO3
До Н
После Н
разб
HNO3
До Н
После Н
очень разб
HNO3
До Н
Примечания
Не реагирует
соль+ Н2O+S (H2S)
соль+ Н2O+SO2
соль+Н2O+N2O
соль+ NO2+Н2O
соль+Н2O+ N2O
соль+Н2O+ NO
соль+ NH4NO3+Н2O
Fe, Al, Cr : Э2O3+H2O+S
Пассивация!
Fe, Al, Cr : Э2O3+H2O+NO2
Пассивация!
6.
Уравнения химических взаимодействий:Травление алюминиевой пластины соляной кислотой
2Аl + 6 HCl → 2 AlCl3 + 3 H2↑
Al0 – 3 é →Al3+ | окисление, восстановитель
2H+ +2é → H2 | восстановление, окислитель
Признаки реакции: бурно выделяется газ.
Травление медной пластины разбавленной азотной кислотой
3 Сu + 8HNO3(разб.) → 3Cu (NO3) 2 + 2NO↑+2 H2O
Cu0 - 2é → Cu 2+ | окисление, восстановитель
N5++3é→ N2+
| восстановление, окислитель
Признаки реакции: выделение газа бесцветного, стекающий с
пластинки раствор зеленого цвета, что говорит об образовании
соли меди.
7.
Сегодня я узнал….Я выполнил работу…
Я понял, что…
Теперь я могу…
Я научился…
У меня получилось…
Я смог…
Меня удивило…
Урок дал мне для жизни…
Мне захотелось…
Было интересно…





 chemistry
chemistry








