Similar presentations:
Биофизические основы патологии клетки. Свободные радикалы и болезни человека
1. Свободные радикалы и болезни человека
Биофизические основыпатологии клетки
Свободные радикалы и болезни человека
Ю.А. Владимиров, А.Н. Осипов
2018
2. Химические свойства NO
1. Реакция с кислородом:2NO + O2 2NO2
2. Реакция с супероксидным радикалом:
NO + O2 - ОNOО3. Реакция с тиолами:
NO + RSH RSNO
4. Реакция с металлопротеинами:
NO + Hb(Fe3+) Hb(Fe2+)NO
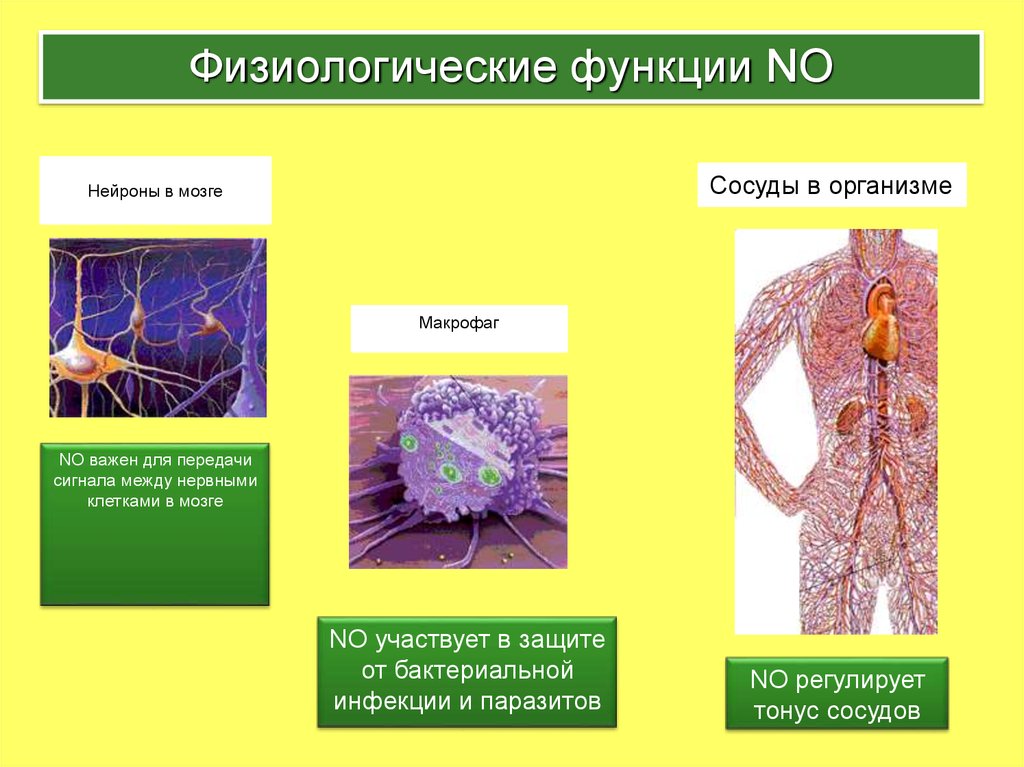
3. Физиологические функции NO
Сосуды в организмеНейроны в мозге
Макрофаг
NO важен для передачи
сигнала между нервными
клетками в мозге
NO участвует в защите
от бактериальной
инфекции и паразитов
NО регулирует
тонус сосудов
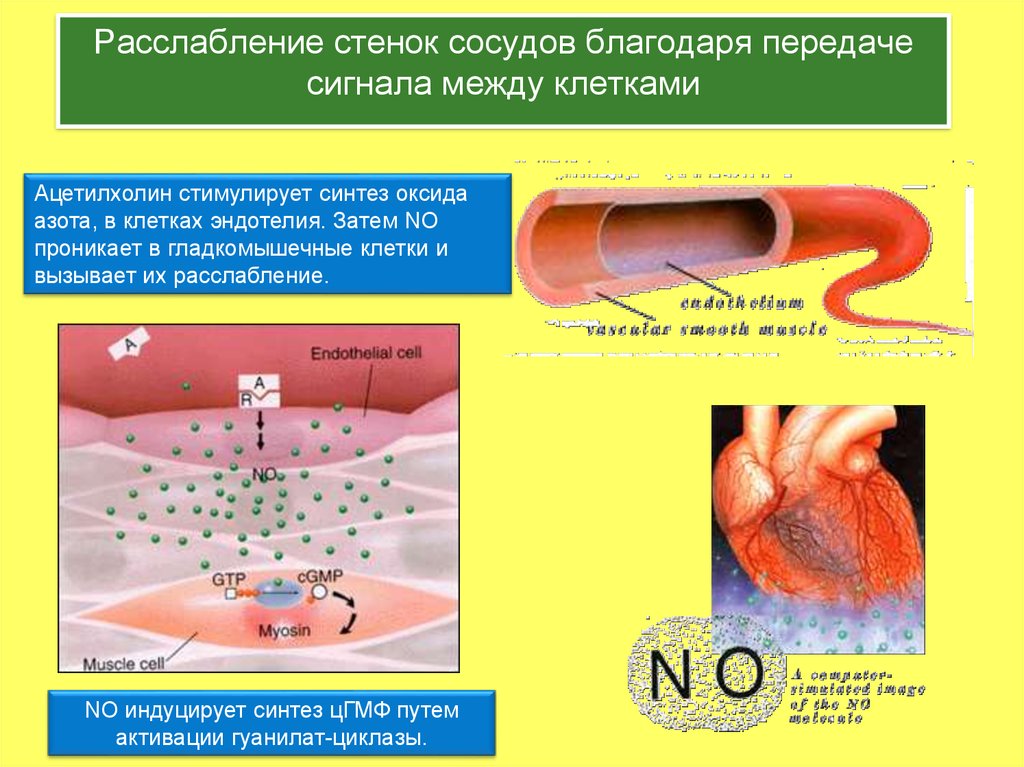
4. Расслабление стенок сосудов благодаря передаче сигнала между клетками
Ацетилхолин стимулирует синтез оксидаазота, в клетках эндотелия. Затем NO
проникает в гладкомышечные клетки и
вызывает их расслабление.
NO индуцирует синтез цГМФ путем
активации гуанилат-циклазы.
5. Оксид азота
Регуляция пероксидазнойактивности цитохрома с с
помощью Оксида Азота
6. Влияние АФК на развитие процессов в клетке
Количество Активных Форм КислородаДеполяризация
Истощение
резерва АТФ
Разрыв внешней мембраны
Необратимые
морфологические изменения
Ингибиторы
апоптоза
Аутофагия/
Митофагия
Выживание клетки
АФК
Цитохром с
Апоптоз
Гибель клетки
Некроз
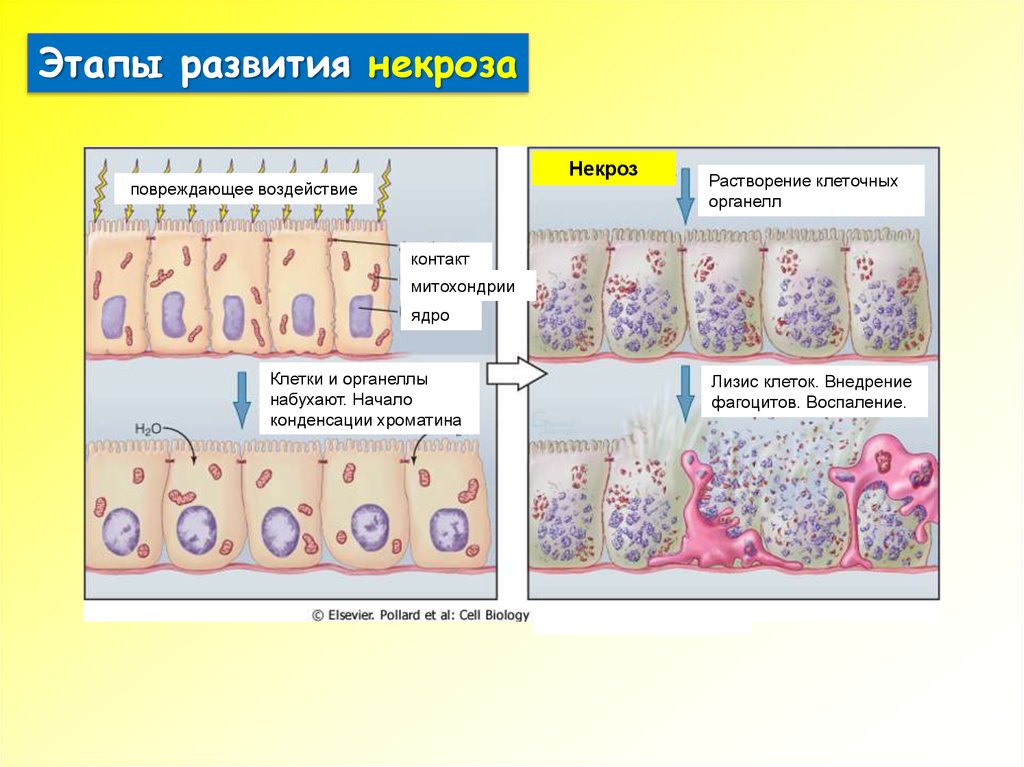
7.
Этапы развития некрозаНекроз
повреждающее воздействие
Растворение клеточных
органелл
контакт
ы
митохондрии
ядро
Клетки и органеллы
набухают. Начало
конденсации хроматина
Лизис клеток. Внедрение
фагоцитов. Воспаление.
8.
Этапы развития апоптозаКлетки фрагментируются.
Продолжается конденсация хроматина
Апоптоз
контакт
ы
митохондрии
ядро
Повреждение межклеточных контактов
Начало конденсации хроматина
Клетки превращаются в
апоптотические тельца
Клетки сжимаются
Хроматин конденсируется у периферии ядра
Апоптотические тельца подвергаются
фагоцитозу
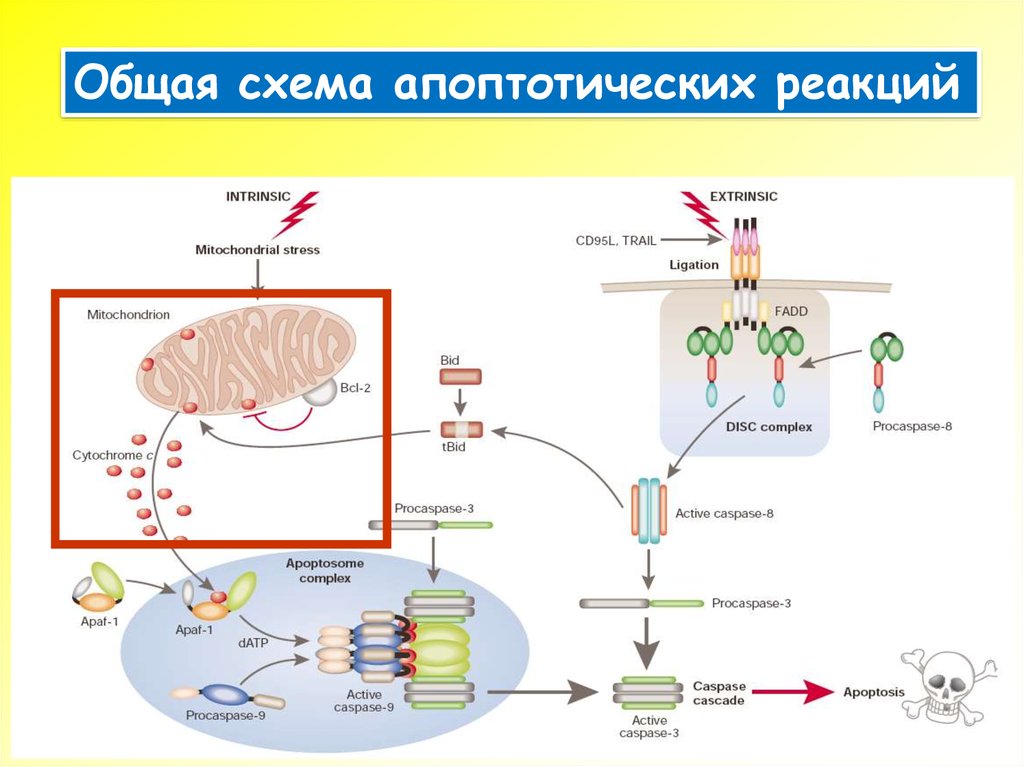
9.
Общая схема апоптотических реакций10. Кинетика процессов при апоптозе
Окислениекардиолипина
митохондриальных
мембран (пмоль/нмоль
общего кардиолипина)
Активность
каспаз 3/7 (ЕА/мг
белка)
Окисление
кардиолипина
Цитохром С
митохондриальных
(пмоль/мг белка)
мембран (пмоль/нмоль
общего кардиолипина)
Аннексин V (+)
Активность
клетки (% от
каспаз 3/7 (ЕА/мг
общего
белка) количества)
(V. Kagan et al., 2005)
11. Механизм фагоцитоза при апоптозе
РецепторыФагоцит
?
PS
Место
связывания
C1q
Рецепторы PS
Апоптотическая
клетка
лиганд C1q
RAC-1
C1q рецептор
DOCK 180
ELMO
CRKII
Перестройка цитоскелета
для формирования фагосомы
Фагоциты распознают на поверхности апоптотической клетки сигнал «съешь
меня», формируемый фосфатидилсерином (PS) на внешней мембране
клетки. Этот сигнал запускает процесс фагоцитоза апоптотической клетки
12.
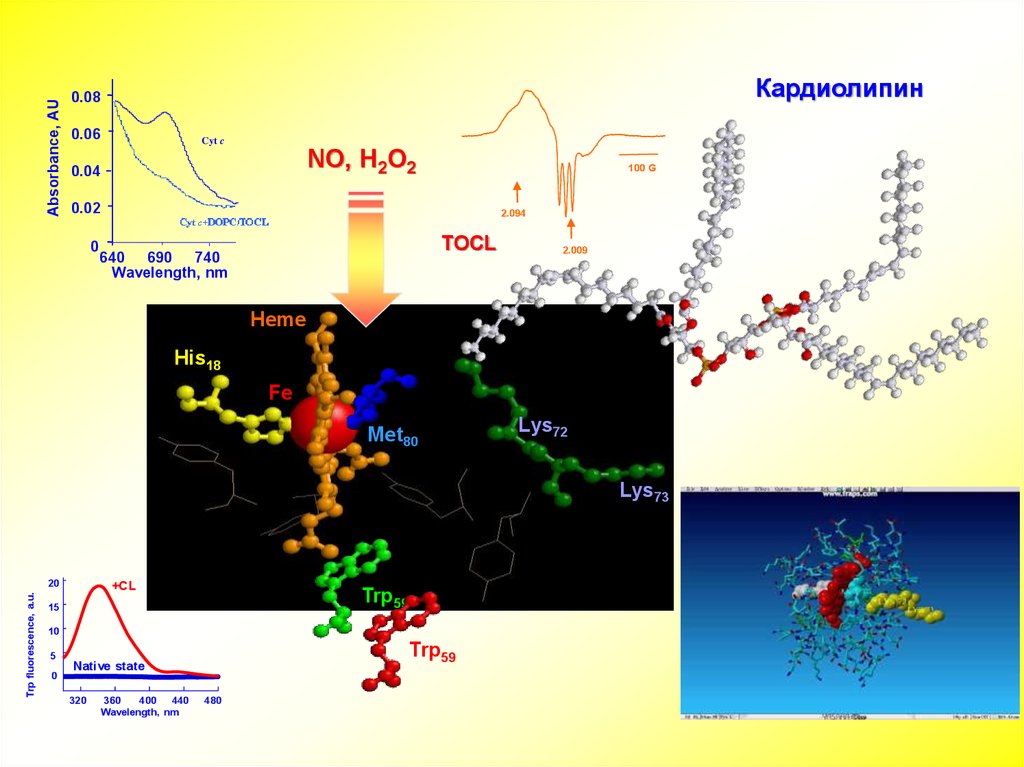
Absorbance, AUКардиолипин
0.08
0.06
Cyt c
NO, H2O2
0.04
100 G
0.02
0
2.094
TOCL
640 690 740
Wavelength, nm
2.009
Heme
His18
Fe
Met80
Lys72
Lys73
Trp fluorescence, a.u.
20
+CL
Trp59
15
10
Trp59
5
0
Native state
320
360
400
440
Wavelength, nm
480
13.
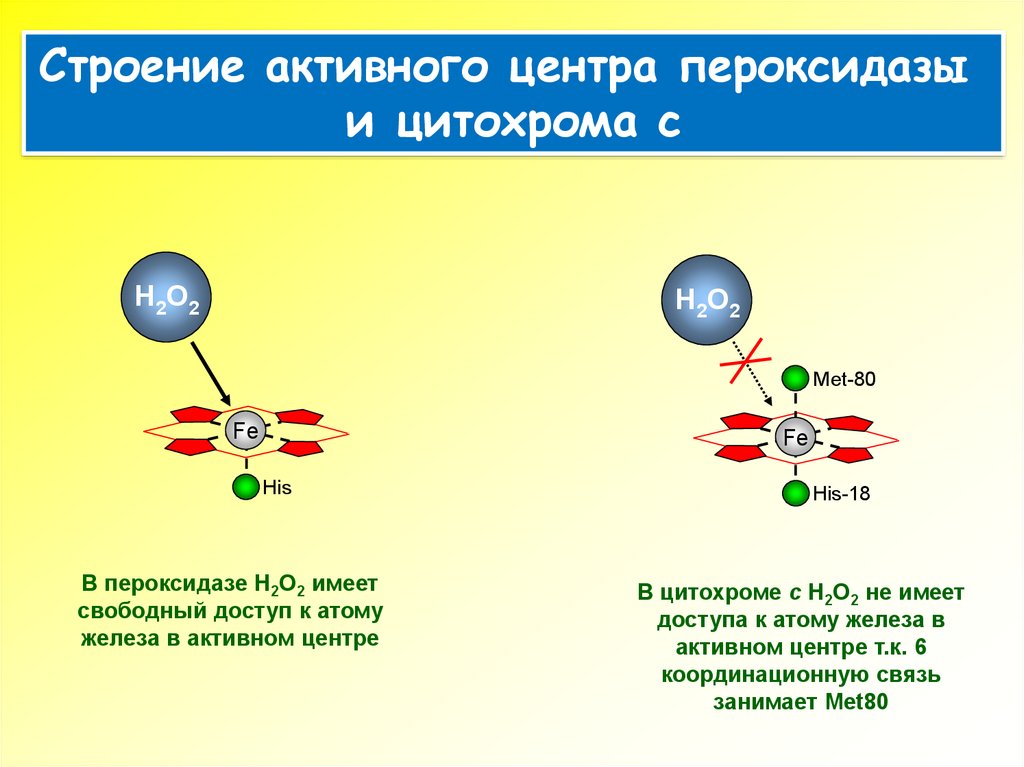
Строение активного центра пероксидазыи цитохрома с
H 2 O2
H2O2
Met-80
Fe
Fe
His
В пероксидазе H2O2 имеет
свободный доступ к атому
железа в активном центре
His-18
В цитохроме c H2O2 не имеет
доступа к атому железа в
активном центре т.к. 6
координационную связь
занимает Met80
14.
Изменения в активном центре вприсутствии кардиолипина
H 2 O2
H 2 O2
CL
Met-80
Met-80
Fe
Fe
His-18
His-18
Кардиолипин смещает Met80 в
активном центре и облегчает
доступ H2O2 к атому железа в
активном центре
15.
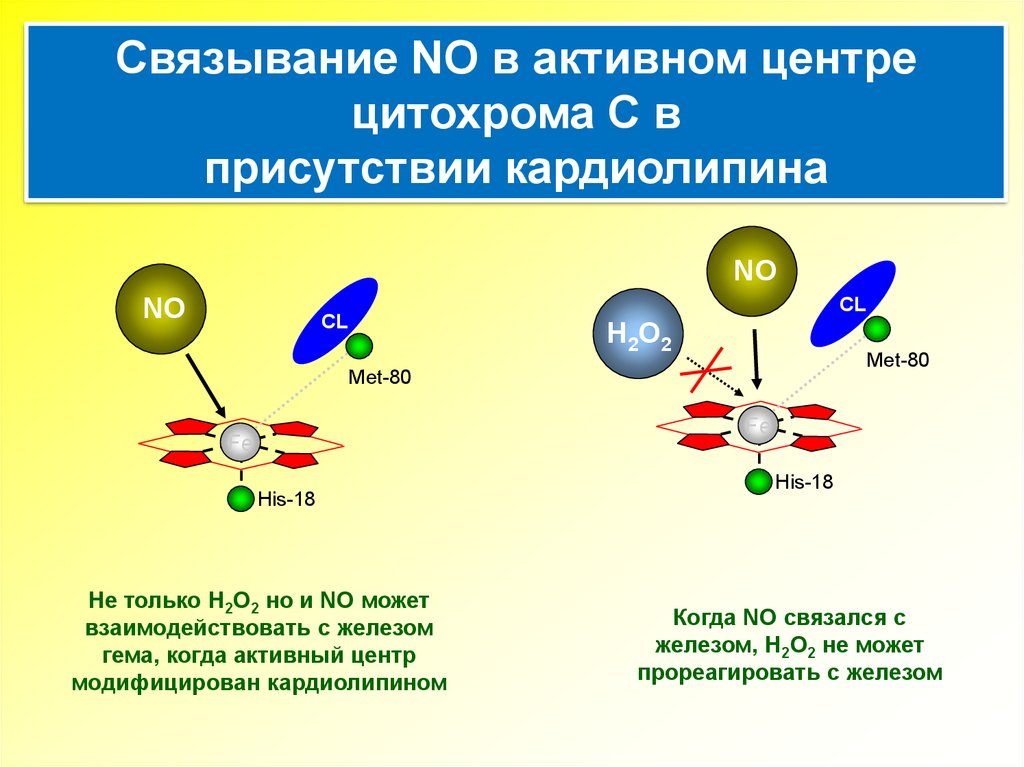
Связывание NO в активном центрецитохрома С в
присутствии кардиолипина
NO
NO
CL
CL
H 2 O2
Met-80
Met-80
Fe
Fe
His-18
Не только H2O2 но и NO может
взаимодействовать с железом
гема, когда активный центр
модифицирован кардиолипином
His-18
Когда NO связался с
железом, H2O2 не может
прореагировать с железом
16.
Лазерный фотолиз нитрозильногокомплекса в активном центре в
присутствии кардиолипина
NO
hn
NO
CL
CL
H 2O2
Met-80
Fe
Met-80
Fe
His-18
Нитрозильный комплекс
цитохрома с чувствителен к
действию видимого света и
может быть разрушен при
облучении видимым светом
His-18
Если NO удалено
облучением, то H2O2 легко
реагирует с гемом.
17.
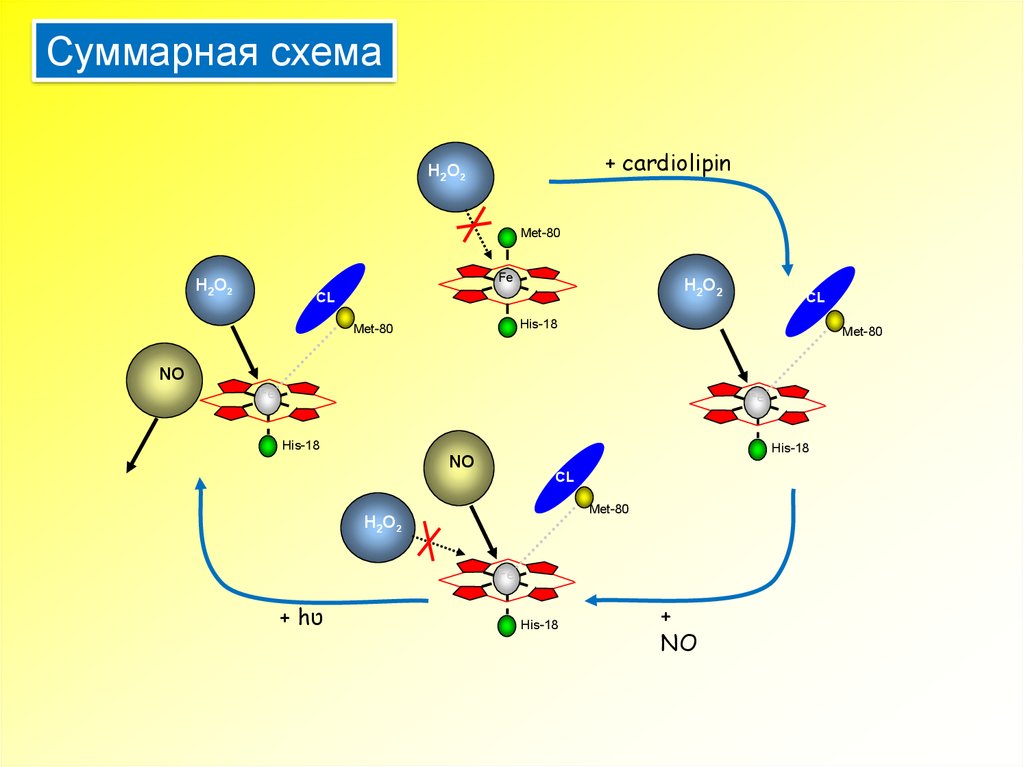
Суммарная схема+ cardiolipin
H2O2
Met-80
Fe
H2O2
H2O2
CL
CL
His-18
Met-80
Met-80
NO
Fe
Fe
His-18
His-18
NO
CL
Met-80
H2O2
Fe
+ hט
His-18
+
NO
18.
Оксид азотаРегуляция тонуса сосудов
с помощью Оксида Азота
19.
Перенос Оксида азота с Гемоглобина наГуанилат-циклазу под действием Лазерного
излучения
NO-гемоглобин
NO
гемоглобин
hn
Расслабление
сосудов
NO
GTP
Гуанилат-циклаза гладких мышц
cGMP
20.
Индукция cGMP при лазерном облучении NO-Hb-NOHb
+NOHb
120
100
cGMP [%]
80
60
40
20
0
Контроль
Облучение
NO-Hb
Облучение
NO-Hb
21.
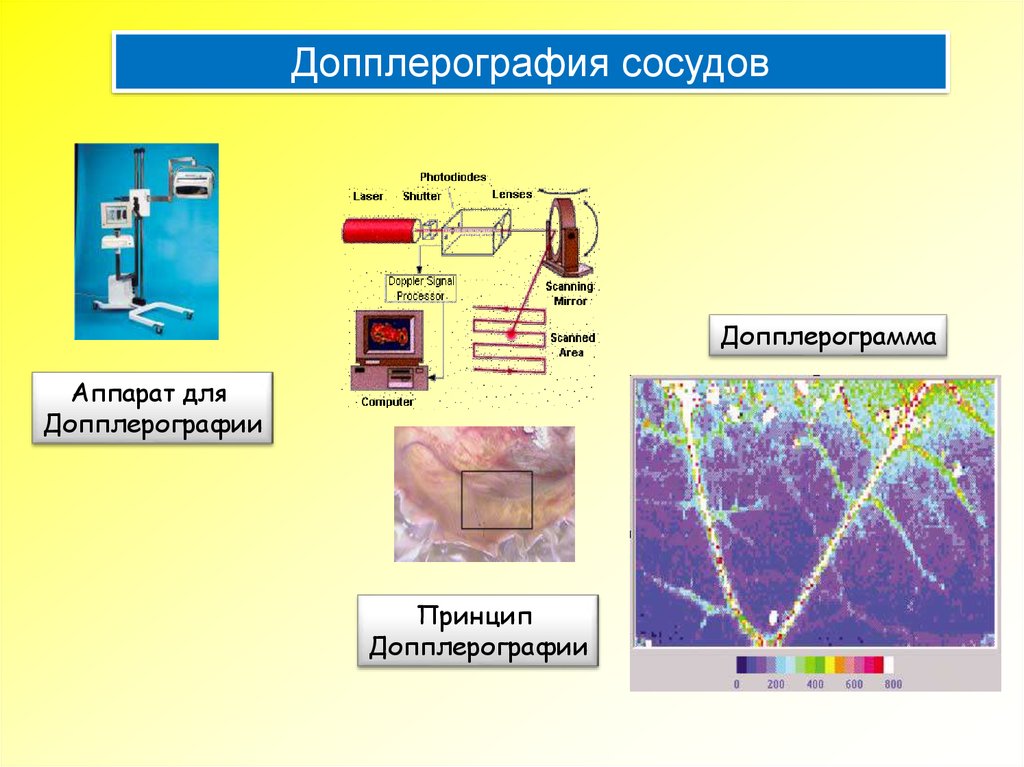
Допплерография сосудовДопплерограмма
Аппарат для
Допплерографии
Принцип
Допплерографии
22.
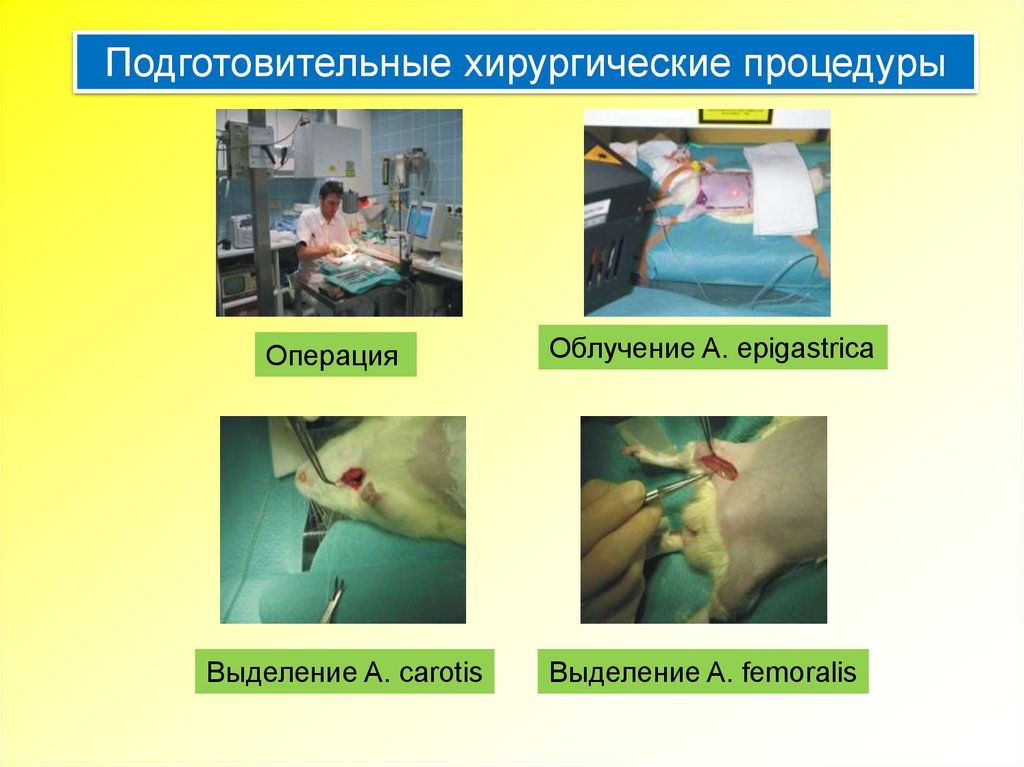
Подготовительные хирургические процедурыОперация
Выделение A. carotis
Облучение A. epigastrica
Выделение A. femoralis
23.
Результаты ДопплерографииКонтроль
Введение
NO-Hb
Облучение
После
облучения
24.
Изменение кровотока в A. epigastrica(по данным допплерографии)
HbNO + облучение
Hb+облучение
140%
130%
120%
110%
Перфузия
100%
90%
80%
70%
Контроль
Введение
Облучение
После обл.
25. Перекисное Окисление Липидов
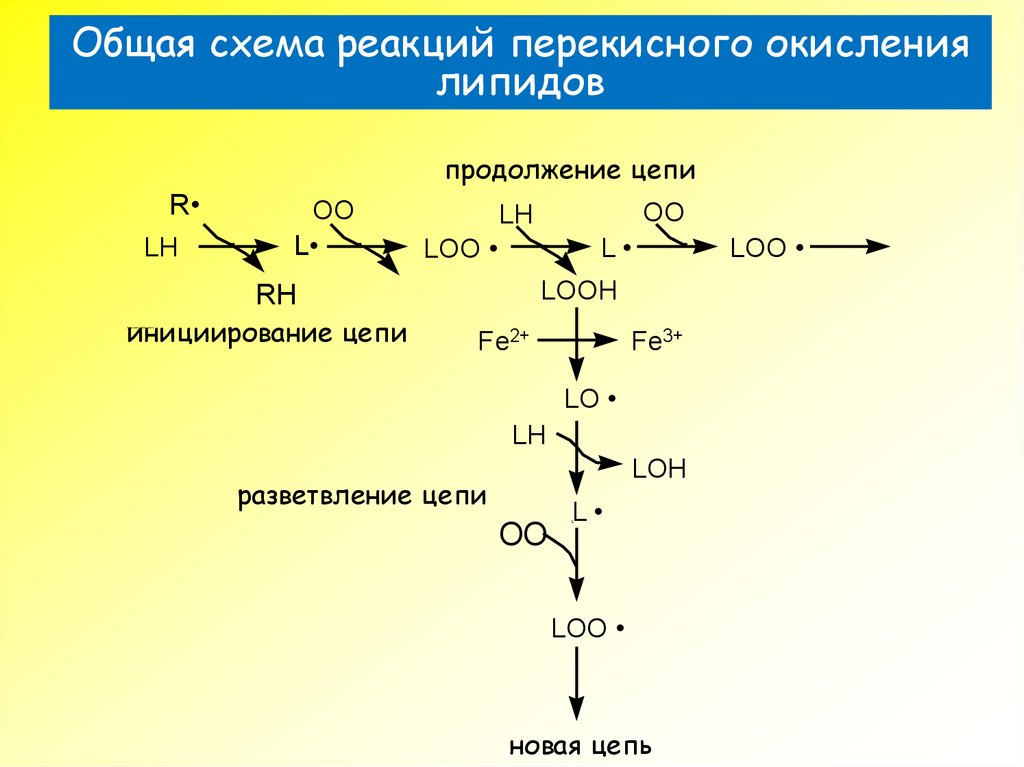
26. Общая схема реакций перекисного окисления липидов
продолжение цепиR
LH
OO
L
L
LOO
LOOH
RH
инициирование цепи
???€????‚‡??? €???
OO
LH
Fe2+
Fe3+
LO
LH
LOH
разветвление цепи
OO
L
L
LOO
новая цепь
LOO
27. Реакции перекисного окисления липидов: инициирование цепи
Rалкильный (С-центрированный)
радикал
L
LH
исходный (неокисленный)
липид
RН
инициирование цепи
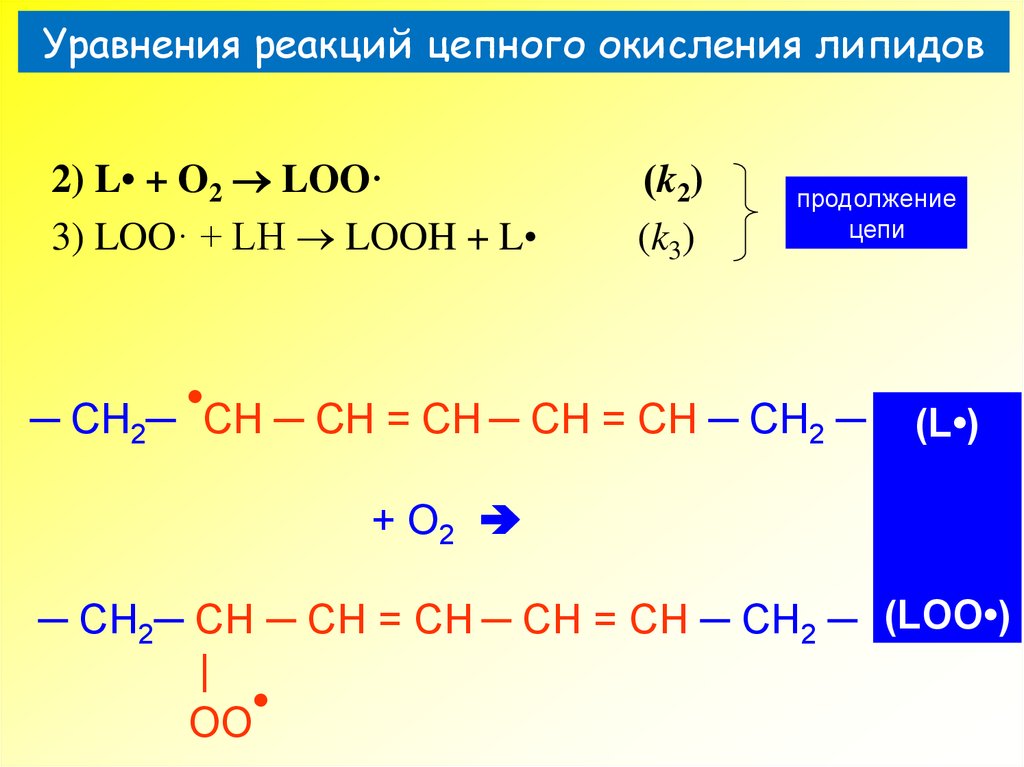
28. Уравнения реакций цепного окисления липидов
0) O2 + e- O2-… HO· (R•)1) LH + HO· L· + HOH
(k0)
(k1)
инициирование
цепи
─ CH2─ CH = CH ─ CH2─ CH = CH ─ CH2 ─
(LH)
+ R•
─ CH2─ CH ─ CH = CH ─ CH = CH ─ CH2 ─
+ RH
(L•)
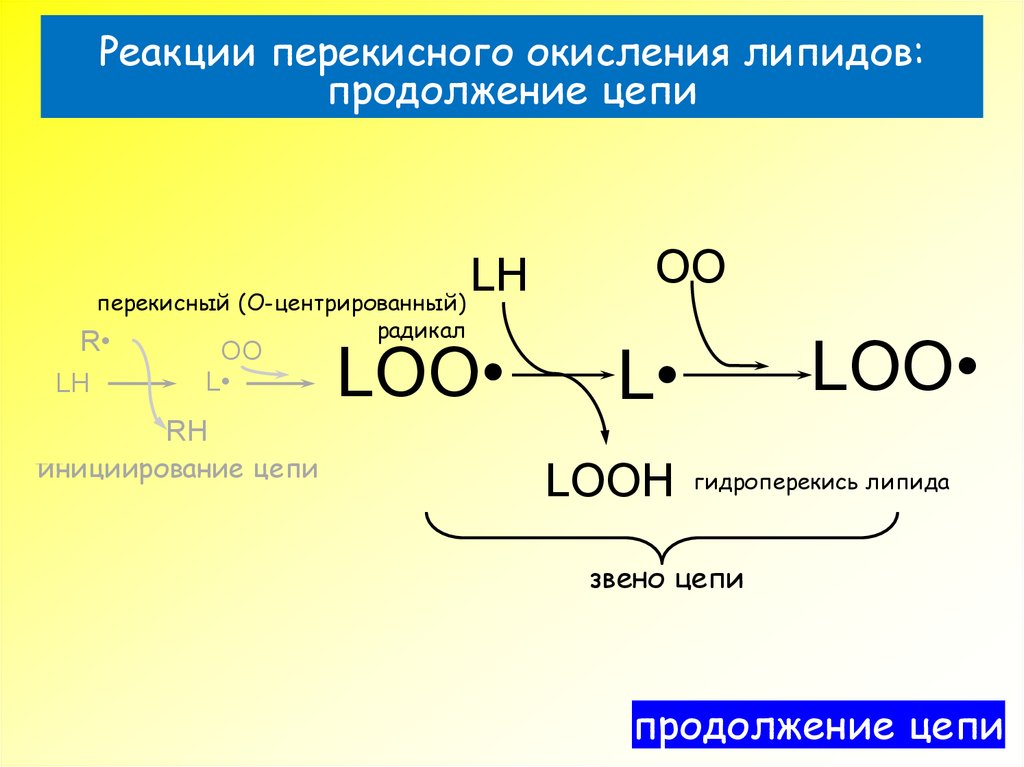
29. Реакции перекисного окисления липидов: продолжение цепи
LHперекисный (О-центрированный)
R
LH
OO
L
OO
радикал
LOO
LOO
L
RH
инициирование цепи
???€????‚‡??? €???
LOOH
гидроперекись липида
звено цепи
продолжение цепи
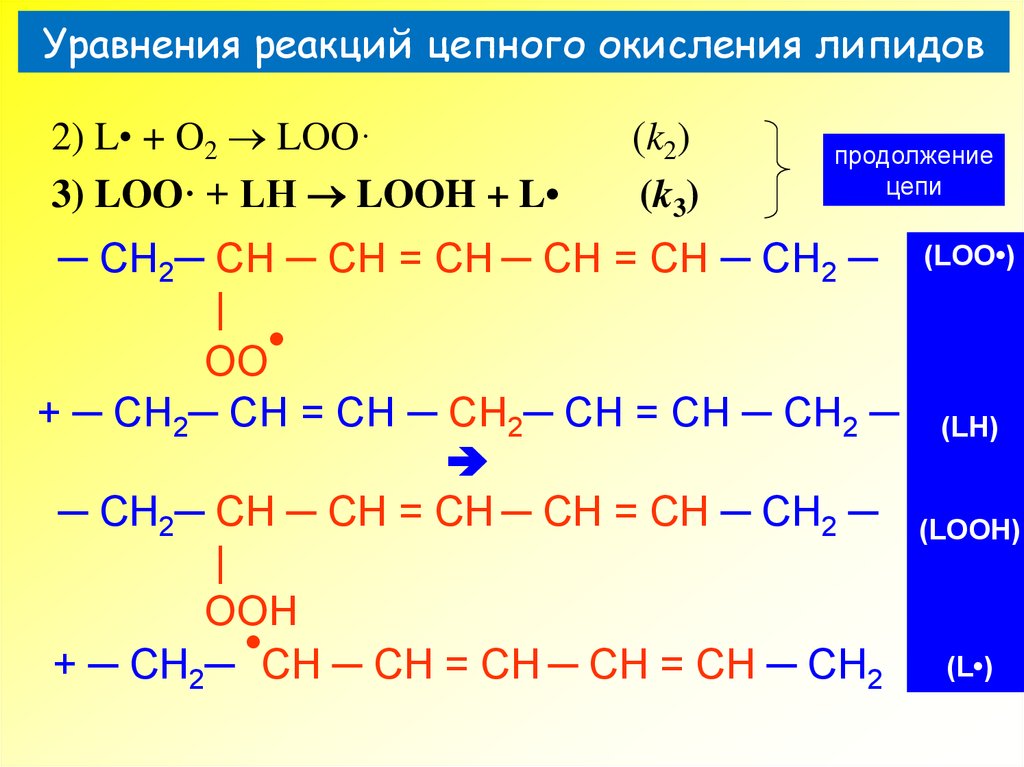
30. Уравнения реакций цепного окисления липидов
2) L• + O2 LOO·3) LOO· + LH LOOH + L
(k2)
(k3)
продолжение
цепи
─ CH2─ CH ─ CH = CH ─ CH = CH ─ CH2 ─
(L•)
+ O2
─ CH2─ CH ─ CH = CH ─ CH = CH ─ CH2 ─ (LOO•)
|
OO
31. Уравнения реакций цепного окисления липидов
2) L• + O2 LOO·3) LOO· + LH LOOH + L
(k2)
(k3)
продолжение
цепи
─ CH2─ CH ─ CH = CH ─ CH = CH ─ CH2 ─
|
OO
+ ─ CH2─ CH = CH ─ CH2─ CH = CH ─ CH2 ─
─ CH2─ CH ─ CH = CH ─ CH = CH ─ CH2 ─
|
OOH
+ ─ CH2─ CH ─ CH = CH ─ CH = CH ─ CH2
(LOO•)
(LH)
(LOOH)
(L•)
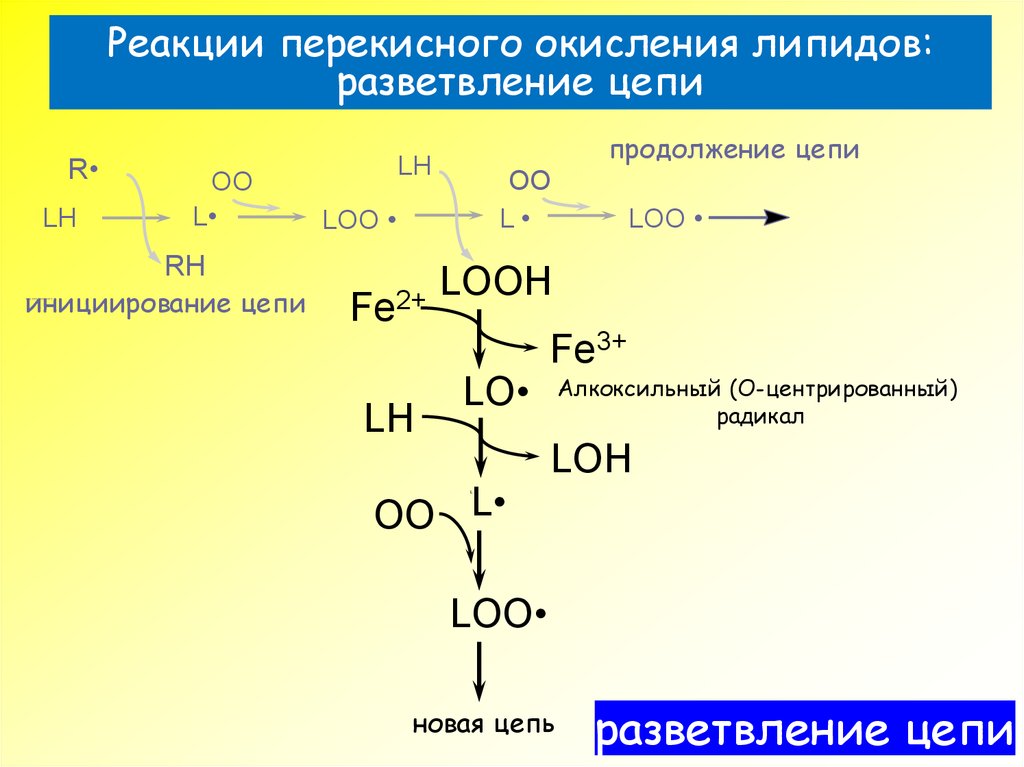
32. Реакции перекисного окисления липидов: разветвление цепи
RLH
OO
L
инициирование цепи
OO
L
LOO
RH
???€????‚‡??? €???
продолжение цепи
LH
Fe2+
LOO
LOOH
Fe3+
LH
Алкоксильный (О-центрированный)
радикал
LO
OO L
LOH
L
LOO
новая цепь
разветвление цепи
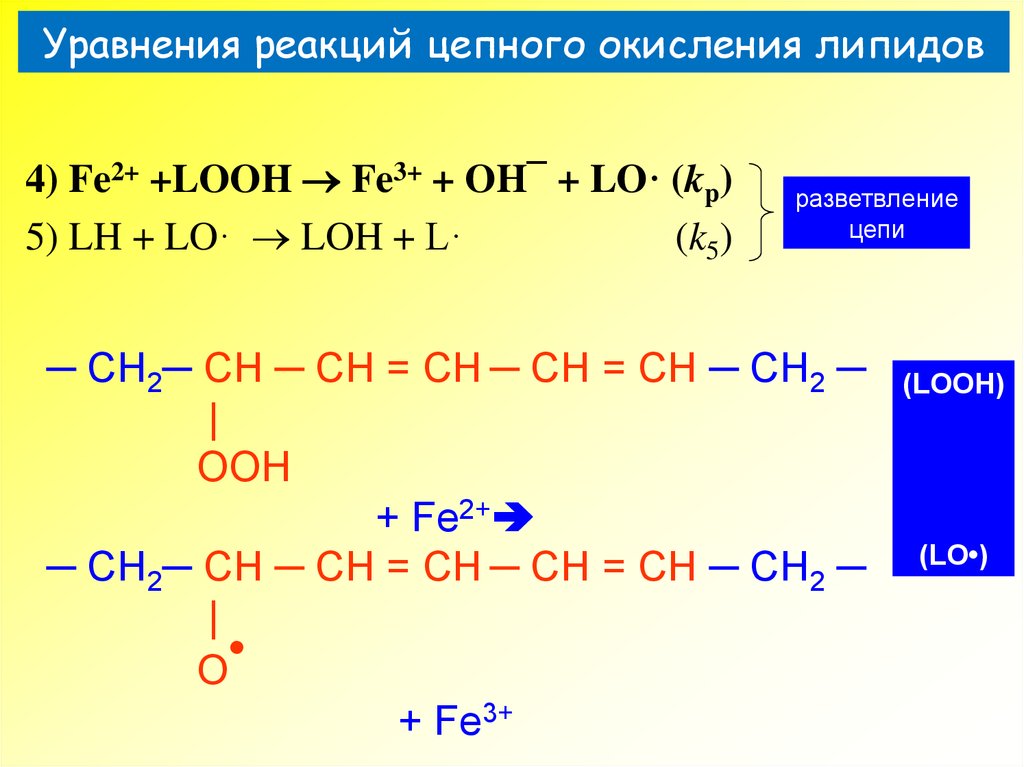
33. Уравнения реакций цепного окисления липидов
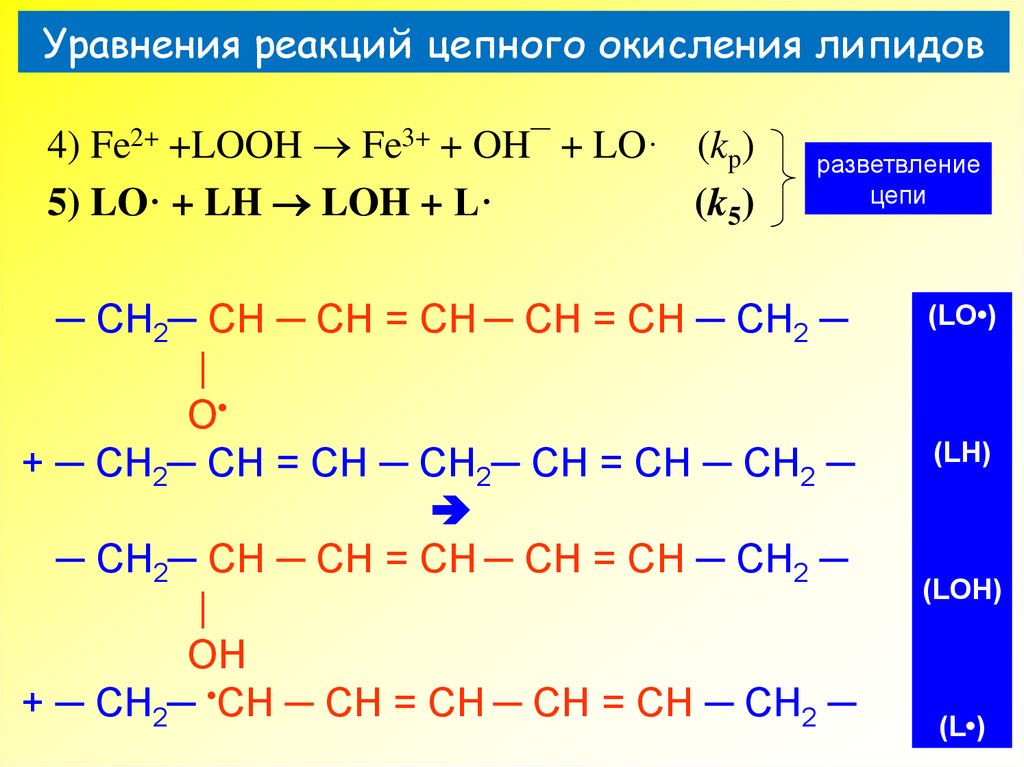
4) Fe2+ +LOOH Fe3+ + OH¯ + LO· (kp)5) LH + LO· LOH + L·
(k5)
разветвление
цепи
─ CH2─ CH ─ CH = CH ─ CH = CH ─ CH2 ─
|
OOH
+ Fe2+
─ CH2─ CH ─ CH = CH ─ CH = CH ─ CH2 ─
|
O
+ Fe3+
(LOOH)
(LO•)
34. Уравнения реакций цепного окисления липидов
4) Fe2+ +LOOH Fe3+ + OH¯ + LO· (kp)5) LO· + LH LOH + L·
(k5)
разветвление
цепи
─ CH2─ CH ─ CH = CH ─ CH = CH ─ CH2 ─
|
O
+ ─ CH2─ CH = CH ─ CH2─ CH = CH ─ CH2 ─
─ CH2─ CH ─ CH = CH ─ CH = CH ─ CH2 ─
|
OH
+ ─ CH2─ •CH ─ CH = CH ─ CH = CH ─ CH2 ─
(LO•)
(LH)
(LOH)
(L•)
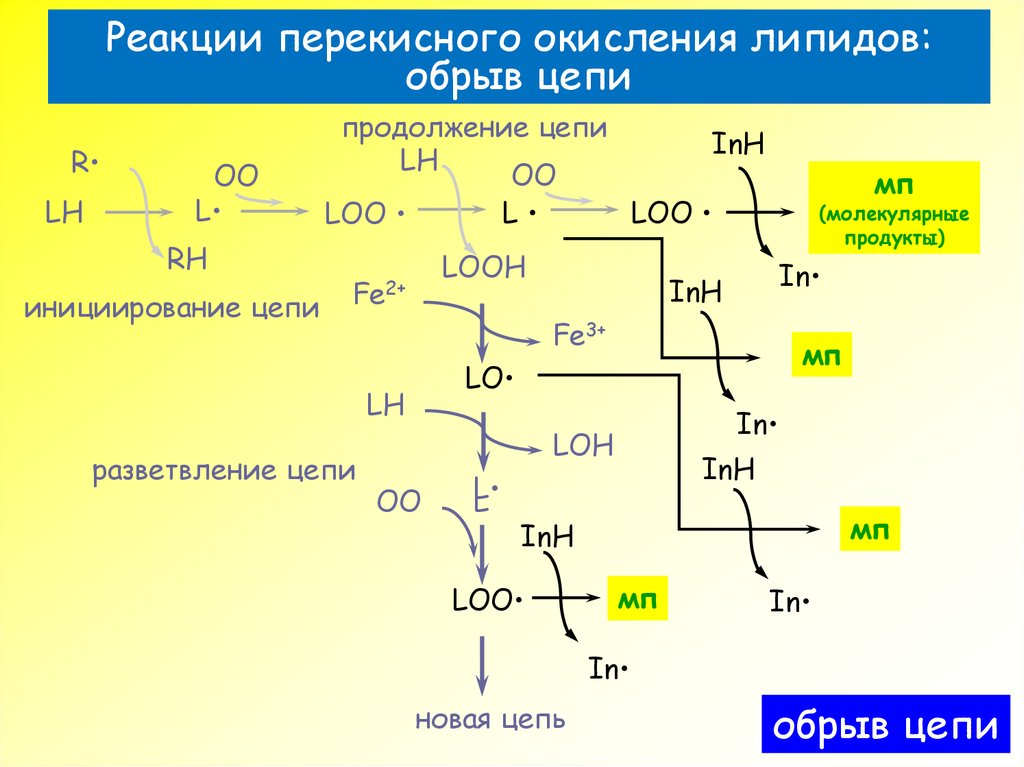
35. Реакции перекисного окисления липидов: обрыв цепи
RLH
OO
L
RH
инициирование цепи
продолжение цепи
InH
LH
OO
L
LOO
LOO
LOOH
Fe2+
(молекулярные
продукты)
In
InH
Fe3+
мп
LO
LH
разветвление цепи
мп
In
LOH
OO
L
L
InH
мп
InH
LOO
мп
In
In
новая цепь
обрыв цепи
36. Уравнения реакций цепного окисления липидов
6) LOO· + LOO· МП + hnLO· + LO· МП
L· + L· МП
7) L· + InH LH + In·
LO· + InH LOH + In·
LOO· + InH LOOH + In·
8) L· + In· МП
LO· + In· МП
LOO· + In· МП
9) L· + Fe2+ + H+ Fe3+ + LH
LO· + Fe2+ + H+ Fe3+ + LOH
LOO· + Fe2+ + H+ Fe3+ + LOOH
(k6)
(k7)
(k8)
(k9)
обрывцепи
37. Общая схема реакций перекисного окисления липидов
продолжение цепиR
LH
OO
L
L
LOO
LOOH
RH
инициирование цепи
???€????‚‡??? €???
OO
LH
Fe2+
Fe3+
LO
LH
LOH
разветвление цепи
OO
L
L
LOO
новая цепь
LOO



















 biology
biology








