Similar presentations:
Химические свойства солей
1. АНАЛИЗ ДОМАШНЕГО ЗАДАНИЯ
§ 42 № 4Дано:
m(NaOH)= 10 г
Найти:
m(H2SO4) - ?
Решение
10 г
Хг
2NaOH
+ H2SO4 → Na2SO4
М= 40 г/моль М= 98 г/моль
m= 80г
m= 98г
Х= 10г*98г/80г = 12,25г
+
2H2O
2.
КОТ В МЕШКЕ№1
№3
№5
№2
№4
№6
№7
3.
ХИМИЧЕСКИЕСВОЙСТВА
Что общего между
всеми этими
СОЛЕЙ. картинками???
ПОЛУЧЕНИЕ И
ПРИМЕНЕНИЕ
4.
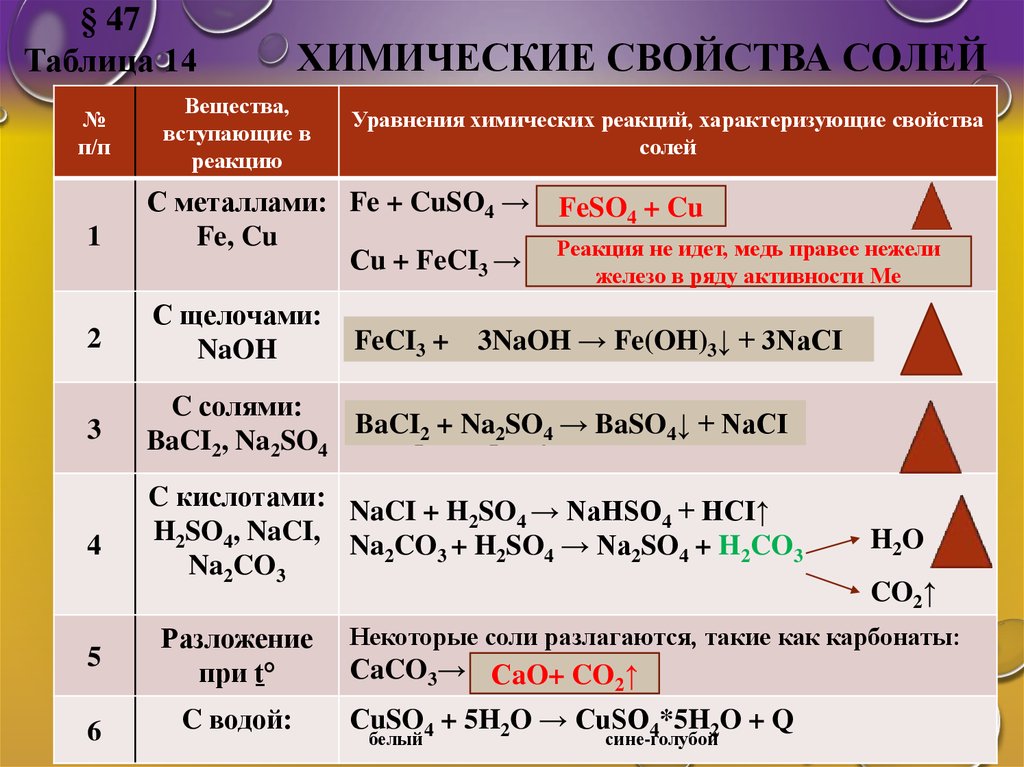
§ 47Таблица 14
№
п/п
1
ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
Вещества,
вступающие в
реакцию
Уравнения химических реакций, характеризующие свойства
солей
С металлами: Fe + CuSO4 → ???
FeSO4 + Cu
Fe, Cu
Реакция не идет, медь правее нежели
Сu + FeCI3 → ???
железо в ряду активности Ме
2
С щелочами:
FeCI
FeCI33 ++ NaOH
3NaOH→→???
Fe(OH)3↓ + 3NaCI
NaOH
3
C солями:
BaCI + Na SO → BaSO ↓ + NaCI
BaCI2, Na2SO4 BaCI22 + Na22SO44→ ??? 4
4
5
6
C кислотами: NaCI + H SO → NaHSO + HCI↑
4
4
H2SO4, NaCI, Na CO + 2H SO
2
3
2
4 → Na2SO4 + H2CO3
Na2CO3
Разложение
при ṯ°
C водой:
H2 O
CO2↑
Некоторые соли разлагаются, такие как карбонаты:
СaCO3→ ???
СaO+ CO2↑
СuSO4 + 5H2O → CuSO4*5H2O + Q
белый
сине-голубой
5.
ЭТО НУЖНО ЗАПОМНИТЬ!!!Соли взаимодействуют с металлами если, металл
вступающий в химическую реакцию в ряду активности
металлов находится левее, чем тот металл, который
находится в составе соли!!!
Соли взаимодействуют с щелочами если, в результате
реакции образуется нерастворимое вещество (осадок)
Соли взаимодействуют с кислотами если, соль
образована более слабой кислотой чем та кислота,
которая с ней вступает в реакцию. Соль образована
летучей кислотой.
Соли взаимодействуют друг с другом если, в результате
реакции образуется нерастворимое вещество (соль)
6.
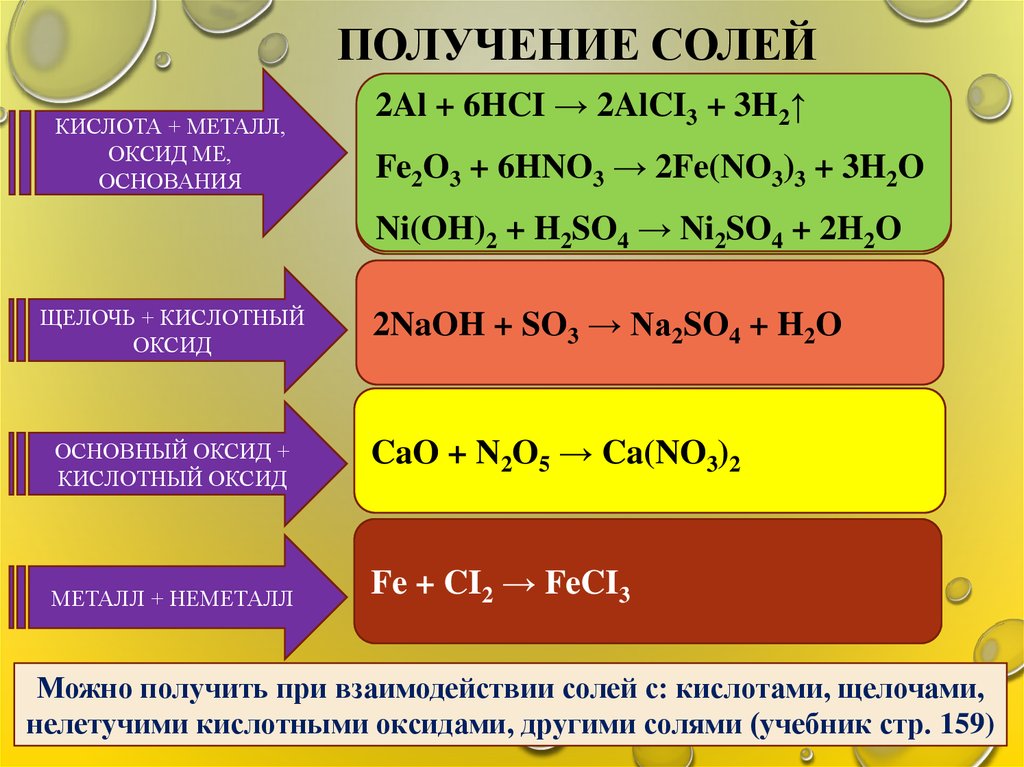
ПОЛУЧЕНИЕ СОЛЕЙКИСЛОТА + МЕТАЛЛ,
ОКСИД МЕ,
ОСНОВАНИЯ
2Al
6HCI
Al ++HCI
→→
…2AlCI3 + 3H2↑
Fe2O3 + 6HNO
HNO3 3→→…2Fe(NO3)3 + 3H2O
Ni(OH)2 + H2SO4 → Ni
…2SO4 + 2H2O
ЩЕЛОЧЬ + КИСЛОТНЫЙ
ОКСИД
ОСНОВНЫЙ ОКСИД +
КИСЛОТНЫЙ ОКСИД
МЕТАЛЛ + НЕМЕТАЛЛ
NaOH ++SO
2NaOH
SO3 3→→…Na2SO4 + H2O
CaO + N2O5 → …
Ca(NO3)2
Fe + CI2 → FeCI
… 3
Можно получить при взаимодействии солей с: кислотами, щелочами,
нелетучими кислотными оксидами, другими солями (учебник стр. 159)
7.
ПРИМЕНЕНИЕ СОЛЕЙ8.
ЗАКРЕПЛЕНИЕУчебник § 47 № 1
ДОМАШНЕЕ ЗАДАНИЕ
§ 46 № 2,5
§ 47 № 2, 3(а, в)
9.
НАПИШИТЕ УРАВНЕНИЕРЕАКЦИИ ВЗАИМОДЕЙСТВИЯ
АЛЮМИНИЯ С СЕРНОЙ
КИСЛОТОЙ
10.
ВЫБЕРИТЕ ИЗ ПЕРЕЧНЯ ТОЛЬКОСОЛИ И ДАЙТЕ ИМ НАЗВАНИЯ:
CaSO4, CuO, CuCI2, AlCI3, H2SO4,
LiOH, MgO, FePO4.
11.
ПЕРЕЧИСЛИТЕ, С КАКИМИВЕЩЕСТВАМИ ВЗАИМОДЕЙСТВУЮТ
КИСЛОТЫ? ПРИ КАКИХ УСЛОВИЯХ
ПРОИСХОДЯТ ЭТИ РЕАКЦИИ?
12.
ЧТО ТАКОЕ ИНДИКАТОРЫ? ДЛЯЧЕГО ОНИ НУЖНЫ ХИМИКАМ?
КАК СЕБЯ ВЕДУТ ИНДИКАТОРЫ С
КИСЛОТАМИ И ЩЕЛОЧАМИ?
13.
ЧТО ТАКИЕ ОСНОВАНИЯ(ГИДРОКСИДЫ)? КАКИЕ ОСНОВАНИЯ
(ГИДРОКСИДЫ) БЫВАЮТ?
14.
НАПИШИТЕ УРАВНЕНИЕХИМИЧЕСКОЙ РЕАКЦИИ
ВЗАИМОДЕЙСТВИЕ ГИДРОКСИДА
КАЛИЯ С УГЛЕКИСЛЫМ ГАЗОМ
15.
КАКИЕ СПОСОБЫ ПОЛУЧЕНИЯОСНОВАНИЙ (ГИДРОКСИДОВ)
ВЫ МОЖЕТЕ ПРЕДЛОЖИТЬ?












 chemistry
chemistry








