Similar presentations:
Химические свойства солей
1. Химические свойства солей
2.
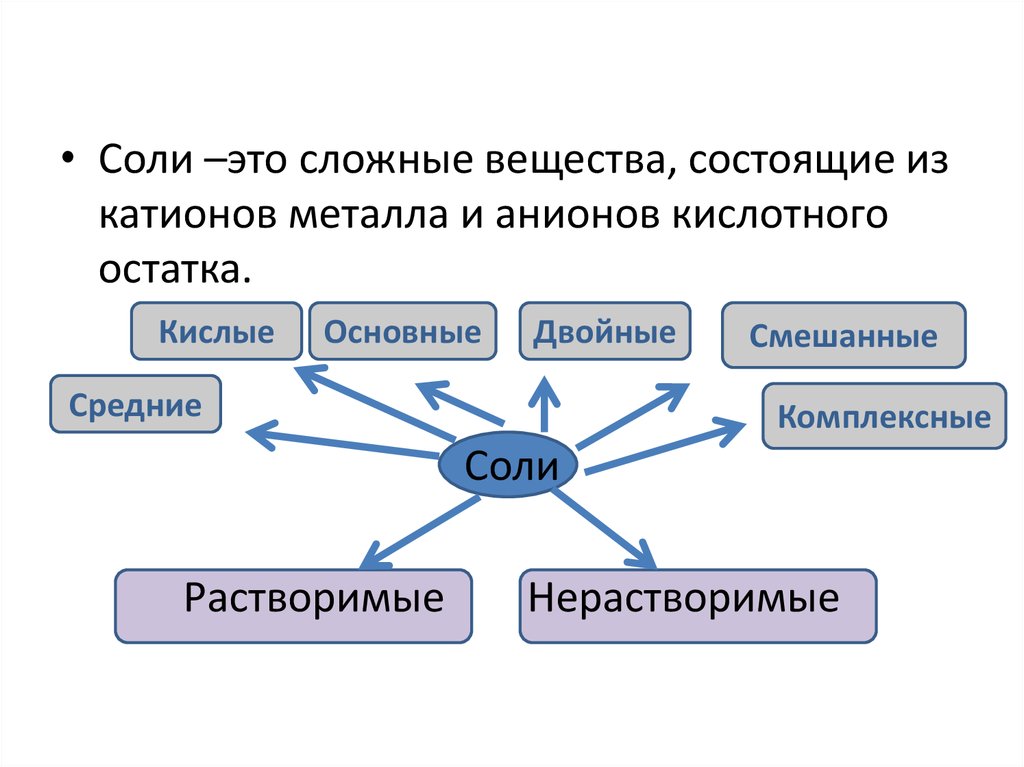
• Соли –это сложные вещества, состоящие изкатионов металла и анионов кислотного
остатка.
Кислые
Основные
Двойные
Средние
Смешанные
Комплексные
Соли
Растворимые
Нерастворимые
3.
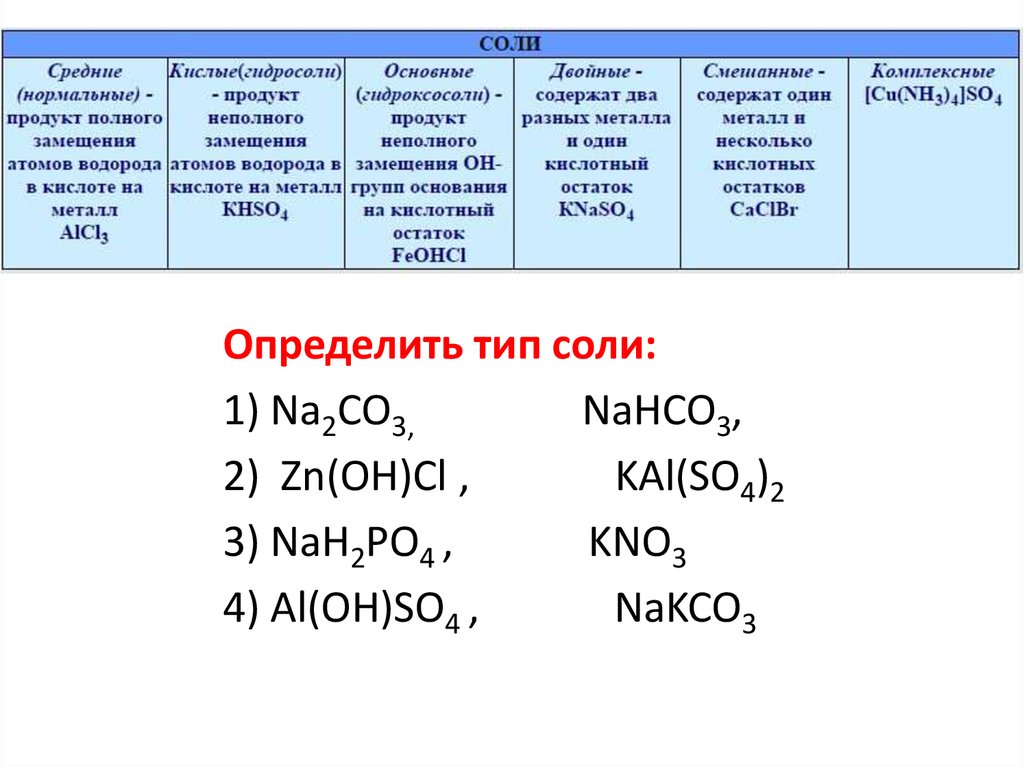
Определить тип соли:1) Na2CO3,
NaHCO3,
2) Zn(OH)Cl ,
KAl(SO4)2
3) NaH2PO4 ,
KNO3
4) Аl(OH)SO4 ,
NaKCO3
4. Ме – основный оксид– основание – соль неМе – кислотный оксид– кислота - соль
• Соль + Ме =• Соль + кислота =
• Соль + щелочь =
• Соль + соль =
5.
Химические свойства солей:1. Взаимодействие растворов солей с металлами.
соль + металл = соль1 + металл1
Условия протекания реакции:
-исходная и образовавшаяся соли являются растворимыми;
-металл, в ряду электрохимического напряжения металлов находится левее, чем
металл, входящий в состав соли.
Fe + CuCl2 =FeCl2 + Cu
CaJ2 + Na =
AlBr3 + Zn =
AgCl + Cu =
MgS + Ca =
FeCl2 + Zn =
6.
2. Взаимодействие солей с кислотами:соль + кислота = соль1 + кислота1
Условия протекания реакции: образование в результате реакции
осадка газа или воды.
CaF2 + H2SO4 = CaSO4 + 2HF
CaJ2 + HCl =
AlBr3 + H3PO4 =
AgCl + H2SO4 =
MgS + HBr =
FeCl2 + HI =
7.
• 3. Взаимодействие с щелочами:• соль + щёлочь = соль1 + основание
Условия протекания реакции:
-исходная соль должна быть растворимой;
-образование в результате реакции осадка или газа.
CuCl2 + 2KOH = Cu(OH)2 + 2KCl
AlBr3 + NaOH =
AgCl + Ba(OH)2 =
FeCl2 + LiOH =
CaJ2 + HCl =
MgS + HBr =
8.
4. Взаимодействие с солями:соль1 + соль2 = соль3 + соль4
-
Условия протекания реакции:
исходные соли должны быть растворимыми;
образование в результате реакции нерастворимой соли (осадок).
CuCl2 + K2CO3= Ca2CO3 + 2KCl
AlBr3 + Na3PO4 =
AgCl + BaF2 =
FeCl2 + CaF2 =
CaJ2 + Na2CO3 =
MgS + KF =
9.
• 5. Гидролиз солей!!!!!некоторые соли подвергаются обменному
взаимодействию с водой при растворении с
образованием кислоты и основания.
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S.
10.
6. Реакции разложения:при
нагревании
некоторые
соли
подвергаются
разложению:
нитраты,
карбонаты, сульфаты, перманганат калия,
хлорат калия, соли аммония.
K2CO3 = K2O + CO2








 chemistry
chemistry








