Similar presentations:
Жидкостная хроматография
1. Жидкостная хроматография
Ионообменная, ионная хроматографияВ основе методов лежит процесс замещения ионов,
связанных с неподвижной фазой, ионами элюента,
поступающими в колонку.
Процессы динамического ионного обмена основаны на
общих принципах элюативной хроматографии.
Вещества,
способные
к
обмену
ионообменниками или ионитами
ионами,
называют
В зависимости от знака заряда обмениваемых ионов
различают катиониты и аниониты
Определение
отдельных
элементов
соответствующих
фракциях
элюата
химическими методами.
проводят
в
классическими
1
2.
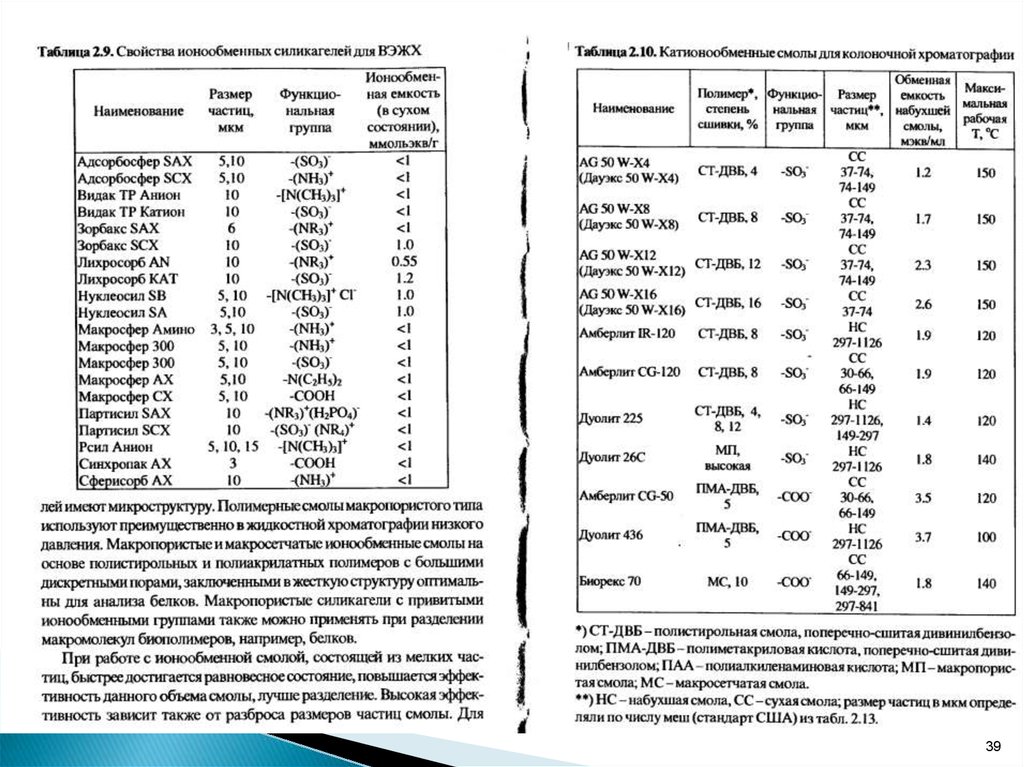
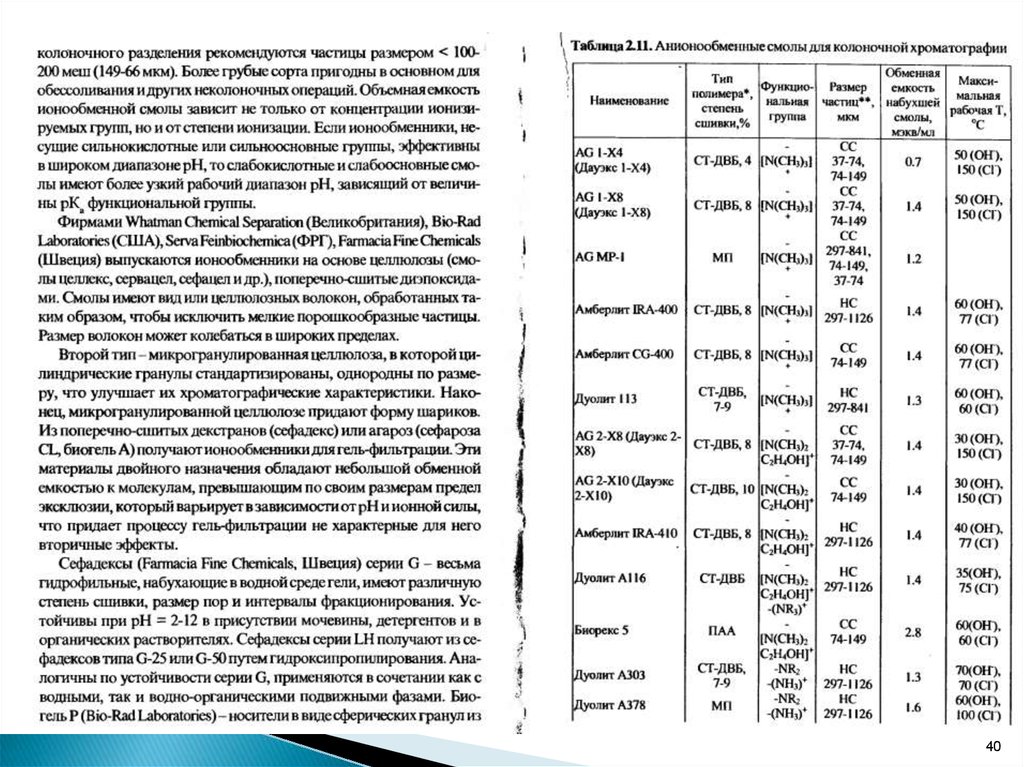
В качестве ионитов обычно используют синтетическиеполимерные вещества на основе сополимера стирола
и дивинилбензола СТ-ДВБ,
называемые ионообменными смолами.
Ионообменные смолы состоят из матрицы R и
активных групп, содержащих подвижные ионы:
R-SO3-H, R-OH, R-PO3H2, R-COO – катиониты;
R-NH2, R-NH, R-N(CH3)3, R-NH3OH – аниониты.
В
катионои
анионообменниках
следующие реакции
R-H + Na+ = R-Na + H+
R-OH + Cl- = R-Cl + OH-
протекают
2
3.
Твердость и механическая прочность сополимеразависит от степени сшивки, т.е. от процентного
содержания дивинилбензола.
Смолы с высокой степенью сшивки (8-30% ДВ),
способны
не
изменять
объем
в
различных
растворителях, выдерживать большие давления без
сжатия (усадки), пригодны для хроматографирования
малых ионов.
Смолы с низкой степенью сшивки 2-4% применяют
для хроматографирования макромолекул.
3
4.
Ионообменники, содержащие сильнокислотныеили сильноосновные группы, реагирующие с
любыми
ионами
раствора,
называются
универсальными.
Ионная
хроматография
– высокоэффективный
вариант ионообменной хроматографии.
Ионообменные материалы, необходимые для
работы в условиях ВЭЖХ должны обладать
достаточной
механической
прочностью,
набухаемостью и скоростью диффузии в поры
частиц сорбента.
4
5.
В ионной хроматографии взамен классическихионообменных смол разработаны специальные
наполнители колонок:
1. сферические частицы d=30-40 мкм
непористого
стекла
или
высокопрочного
полимера, покрытые тонким слоем пористого
ионообменника;
2. частицы пористого силикагеля, покрытые
слоем жидкого ионообменника.
5
6.
Каждыйионит
характеризуется
обменной
емкостью и степенью набухания.
Обменная емкость - количество эквивалентов
ионов, обмениваемых 1 г ионита.
Степень набухания – объем упакованного в
колонну обменника (в мл), приходящийся на 1 г
его в сухом виде, мл/г.
Емкость различных смол колеблется от 0,5 до 10
ммоль·экв/г.
Для обозначения сильных ионообменников
применяют символ S, а для слабых - W .
6
7.
Для оценки селективности ионообменниковприменяют экспериментально установленные
ряды сродства:
для катионообменников:
Li+ < Na+ < K+< Rb+ <Cs+< Mg2+ < Ca2+<Sr2+< Ba2+
для анионообменников:
F- < OH- <Cl- < Br- < NO3- < SCN- < ClO4-
7
8.
Элюирующая сила подвижной фазы в ионнойхроматографии зависит от
рН, ионной силы,
природы применяемого буферного раствора,
присутствия органического растворителя или ПАВ.
При выборе значения рН учитывают природу
ионогенных групп разделяемых ионов, природу
матрицы.
Поддерживают значение рН:
рН 2 – 12 для сильнокислотных
сильноосновных ионообменников;
рН
5 -12
для слабокислых;
рН
2–6
для слабоосновных.
или
8
9.
При разделении слабых кислотрН = рКа + 1,5;
При разделении слабых оснований
рН = рКв-1,5.
Ионная сила влияет на емкость ионита,
с увеличением I - сорбция ионов уменьшается и
возрастает элюирующая сила растворителя.
9
10.
Для ускорения и улучшения разделения ионовприменяют
градиентное
элюирование
–
последовательно применяют буферные растворы с
увеличивающейся ионной силой.
В качестве элюентов наиболее часто используют
воду,
ацетатный,
боратный,
фосфатный,
гидрокарбонатный буферные растворы,
а также растворы органических и неорганических
кислот с определенным значением рН.
10
11.
Ионообменное равновесие описываютконстантой обмена.
Для равновесия
RKt + M+ = RM + Kt+
K = (aRMaKt)/(aRKtaM).
При замене активностей концентрациями
получают концентрационную константу,
называемую коэффициентом селективности.
Если концентрация одного из ионов в растворе и
в фазе ионита велика по сравнению с другими,
например, [Kt]>>[M] и [RKt] >> [RM],используют
коэффициент распределения D=[RM]/[M].
11
12.
Существуют два варианта ионной хроматографии.Двухколоночная ионная хроматография
В ионной хромтатографии в качестве универсального
метода
детектирования
используется
кондуктометрический.
Сам элюент представляет раствор электролита
высокой концентрации и обладает собственной
электропроводностью,
детектирование
путем
простого измерения электропроводности элюата
невозможно.
Проблемы детектирования решены
за счет
использования подавляющей колонки и специального
выбора подвижной фазы. Подавляющая колонка
располагается за разделяющей.
12
13.
Принцип действия подавляющей колонки напримере определения анионов. Подавляющая
колонка заполняется катионообменником в Н+ форме. Подвижная фаза может представлять
раствор
NaHCO3/Na2CO3.
Компоненты
подвижной фазы, выходящие из разделяющей
колонки,
реагируют
с
катионообменником
подавляющей колонки:
Na++ HCO + H = Na + H2CO3
3
2Na++
CO2 + 2H =2 Na + H2CO3
3
Черта означает
ионообменника.
нахождение
иона
в
фазе
13
14.
Таким образом, собственные ионы подвижнойфазы в результате ионного обмена превращаются в
малодиссоциированную и обладающую очень малой
электропроводностью
угольную
Определяемые ионы, например, Cl- или
претерпевают
химических
на
подавляющей
превращений
и
колонке
сохраняют
кислоту.
NO3
не
никаких
свою
электропроводность.
Подавители
электропроводности
элюента
выполняют также в виде мембран и полых волокон.
14
15.
Этотвариант
имеет
более
высокую
чувствительность определения (больше, чем на
порядок).
Но обладает рядом недостатков:
увеличение
экстраколоночных
эффектов,
требование дополнительного
аппаратурного
оформления,
необходимость
периодической
регенерации и наличия больших мертвых
объемов.
Применение: контроль качества воды, анализ
качества
пара
при
контроле
воды
электростанций; в ядерной энергетике контроль
радиоактивных выбросов.
15
16.
Одноколоночная ионная хроматографияЕсли собственная электропроводность подвижной
фазы достаточно мала, то можно обойтись и без
подавляющей колонки.
Элюентами с малой электропроводностью служат
растворы слабых органических кислот, например,
фталевой, бензойной, или салициловой.
Для обеспечения постоянства электропроводности
и ионной силы элюента следует очень точно
поддерживать значение рН раствора.
Необходимость
отсутствует,
если
детектирование.
в
подавляющей
колонке
используют
фотометрическое
16
17.
Ион-парная хроматография – жидкостнаяхроматография, в которой подвижная фаза
содержит сорбируемое ионогенное вещество
(ион-парный реагент) и разделение смеси
веществ происходит за счет различия в
способности веществ к образованию ионных пар
и (или) в коэффициентах распределения ионных
пар между подвижной и неподвижной фазами.
Суть
метода:
в
динамическом
модифицировании обращено-фазового сорбента
группами,
обладающими
ионообменными
свойствами.
Для этих целей в типичные ПФ
для ОФХ
добавляют
гидрофобные
органические
соединения с ионогенными группами.
17
18.
Дляразделения
оснований
используют
алкилсульфаты натрия (алкил от С4 до С12) в
количестве 0,001-0,01 моль/л, создавая буфером
рН 2-5.
Для разделения кислот применяют соли
тетраалкиламмония (фосфат тетрабутиламмония,
бромид
цетилтриметиламмония
и
др.)
в
концентрациях 0,001-0,01 моль/л и рН 3-7.
В
ионпарном
режиме
селективность
разделения неионогенных компонентов будет
лимитироваться обращено-фазовым механизмом
удерживания, а удерживание оснований и кислот
заметно возрастет, улучшится форма пиков
18
19.
Эксклюзионная хроматографияРазделение происходит за счет распределения
молекул между растворителем, находящимся
внутри
пор
сорбента,
и
растворителем,
протекающим
между
его
частицами,
т.е.
различное удерживание
веществ обусловлено
различиями в размерах молекул, их форме и
способности проникать в поры неподвижной
фазы.
Гель-проникающая
хроматография
эксклюзионная
хроматография,
неподвижной фазой служит гель.
в
(ГПХ)
которой
19
20.
Рольтвердого
наполнителя
состоит
формировании пор определенного размера,
а неподвижной фазой является
заполняющий эти поры.
в
растворитель,
Особенность метода – возможность разделения
молекул по их размеру в растворе в диапазоне
молекулярных масс 102 - 108, что делает его
незаменимым для исследования синтетических
высокомолекулярных веществ и биополимеров.
20
21.
Объем эксклюзионной колонки:Vc=VM+Vi+Vd,
где VM - мертвый объем (объем растворителя
между частицами сорбента, т.е. объем подвижной
фазы);
Vi - объем пор, занятый растворителем (объем
неподвижной фазы);
Vd - объем матрицы сорбента без учета пор.
Полный объем растворителя в колонке Vt
представляет собой сумму объемов подвижной и
неподвижной фаз:
Vt= VM+Vi.
21
22.
Связьмежду
удерживаемым объемом
и молекулярной массой
(или размером молекул)
образца
описывается
калибровочной кривой.
Каждый
конкретный
сорбент характеризуется
своей
калибровочной
кривой,
по
которой
оценивают
область
разделяемых
на
нем
молекулярных масс.
22
23.
Точка А соответствует пределу эксклюзии,или мертвому объему колонки VM .
Точка В отражает предел проникания. Все
молекулы, масса которых меньше, чем в точке В,
будут выходить одним пиком с удерживаемым
объемом Vt .
Между А и В располагается диапазон
селективного разделения.
С1 - отрезок, отсекаемый на оси ординат
продолжением отрезка CD;
С2 - тангенс угла наклона этого отрезка к оси
ординат.
С2 называют разделительной емкостью
колонки: число мл растворителя на один порядок
изменения молекулярной массы.
23
24.
Чем больше С2, тем селективнее разделение вданном диапазоне масс.
В нелинейных областях (участки АС и ВД) с
уменьшением С2 эффективность
фракционирования снижается.
Изменением параметров взаимодействия в
системе полимер-сорбент-растворитель можно
переходить от адсорбционного механизма к
эксклюзионному и наоборот.
В общем случае
стремятся подавить
адсорбционные и другие побочные эффекты, так
как они существенно искажают результаты,
особенно при исследовании молекулярномассового распределения (ММР) полимеров.
24
25.
ОтличиеТребования:
ЭХ
–
априори
известная
продолжительностиь
анализа,
возможность
предсказания порядка элюирования компонентов
по размеру их молекул, примерно одинаковая
ширина пиков и уверенность в выходе всех
компонентов пробы за короткий промежуток
времени, соответствующий Vt.
стабильность потока подвижной
фазы, температуры.
Ошибка определения средних молекулярных
масс при изменении температуры
на 100С
составляет
±10%.
Термостатирование
обязательно .
25
26.
Детектор: дифференциальный рефрактометр.Растворитель должен удовлетворять требованиям:
1). Полностью растворять образец при температуре
разделения;
2). Смачивать поверхность сорбента и не ухудшать
эффективность колонки;
3). Предотвращать адсорбцию разделяемых веществ
с поверхностью сорбента;
4). Обеспечивать максимальную высокую
чувствительность детектирования;
5). Иметь низкую вязкость и токсичность.
26
27.
Наилучшим растворителем по комплексу свойств дляЭХ синтетических полимеров является
тетрагидрофуран.
Анализируемое вещество
Растворитель
высокополярные и нерастворимые
в ТГФ полимеры (полиамиды,
полиакрилонитрил,
полиэтилентерефталат,
полиуретаны и др.)
полимеры низкой полярности
(каучуки, полисоксаны)
Метилформамид,
м-крезол.
полиолефины
о-дихлорбензол,
1,2,3-трихлорбензол
Толуол, хлороформ
27
28.
Сорбенты:Первоначально
на
основе
данных
о
химическом
составе
или
растворимости
анализируемых веществ устанавливают, какой
вариант
процесса
следует
применить
–
хроматографию в водных системах или в
органических растворителях, что в значительной
степени определяет тип сорбента.
Затем по калибровочной кривой выбирают
сорбент нужной пористости с учетом имеющихся
сведений о молекулярной массе образца.
Для
разделения
белков,
ферментов,
полисахаридов, полиэлектролитов используют
декстрановые
полиакриамидные,
гели, гели агарозы
гели
(сефадексы),
оксиакрилметакрилатные
28
29.
Стиролдивинилбензольные гели совместимы сµ-стирогель (от1000Á и выше) пригоден для
элюентами умеренной полярности.
работы с тетрагидрофураном, ароматическими и
хлорированными углеводородами, гексаном,
циклогексаном, диоксаном, трифтолэтанолом,
гексафторпропанолом, диметилформамидом.
Эффективно – использование отдельных наборов
колонок для каждого растворителя.
29
30.
Если смесь содержит вещества, отличающиесяпо молекулярной массе не более чем на 2-2,5
порядка, то удается их разделить на колонках с
одним диаметром пор.
Иначе используют наборы из нескольких
колонок с сорбентами различной пористости.
Калибровочную кривую получают сложением
кривых для отдельных сорбентов.
30
31.
Принципиальнаячерта
ЭХ
высокомолекулярных синтетических полимеров
заключается в невозможности разделения смеси
на индивидуальные соединения.
Эти
вещества
представляют
смесь
полимергомологов с разными молекулярными
массами Мi.
Молекулярную массу таких смесей оценивают
средней величиной, которая зависит от способа
усреднения.
31
32.
Мn получают методами криоскопии, осмометриии, эбуллиоскопии;И wсреднемассовую
М
- с помощью светорассеивания
молекулярную массу:
и ультрацентрофугирования.
Ni – число молекул с массой Мi;
Различают среднечисленную молекулярную массу:
M
N
i i
Mn 1
( f /M ) N
i
i i
и среднемассовую молекулярную массу:
2
M
i Ni
M w f M
i i M N
i i
32
33.
Мn получают методами криоскопии,осмометриии, эбуллиоскопии;
Мw - с помощью светорассеивания и
ультрацентрофугирования.
Ni – число молекул с массой Мi;
Mi N i
- общая масса полимера;
f M N / M N
i
i i
i i
- характеризует
Mw / Mn
полидисперсность полимера.
33
34.
ПрименениеЭХ:
исследование
ММР
полимеров
и
анализа
макромолекул
биологического
происхождения
(белки,
нуклеиновые кислоты и т.д.).
Микропрепаративное
эксклюзионное
разделение часто используют в качестве первого
этапа при разделении сложных смесей путем
комбинации различных видов ВЭЖХ.
34










































 physics
physics chemistry
chemistry








