Similar presentations:
Электродные потенциалы
1. Электродные потенциалы
2. УМК «ХИМИЯ»
Тема лекции:Электродные
потенциалы
Лектор – Иванов М.Г.
3. Цель лекции: изложение основных понятий электродных потенциалов на границе металл- раствор электролита в рамках современной
химической теорииКомпетенции, формируемые у студента:
Умения:
прогнозировать на основе современных
представлений о строении атомов и химической
связи, возможность протекания ОВ реакций в
расплавах и растворах электролитов.
4.
СОДЕРЖАНИЕОсновные понятия
Носители заряда
Связь электродного потенциала и энергии Гиббса
Водородный электрод
Уравнение Нернста
Потенциалы газовых электродов
Диаграммы Латимера
Диаграммы Пурбе
Гальванический элемент
Элемент Даниэля
Гальванический элемент с инертными электродами
Литература
5.
Основные понятиясодержание
По типу носителей заряда проводники электрического
тока делят на две группы: в проводниках первого рода
ток переносят электроны (металлы, полупроводники),
в проводниках второго рода – ионы (растворы и
расплавы электролитов).
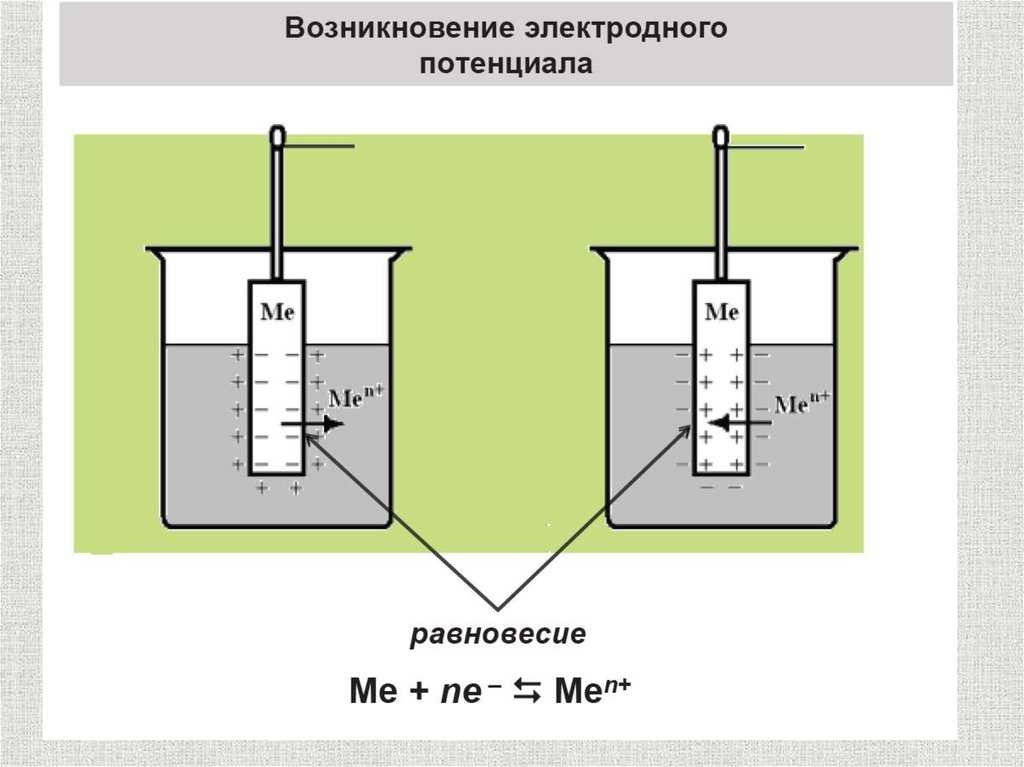
Электродом называется проводник первого рода,
контактирующий с проводником второго рода:
6.
7.
8.
9.
10.
Основные понятиясодержание
Электродный потенциал служит мерой изменения
свободной энергии Гиббса ( G) в системе и указывает
на направление окислительно- восстановительного
процесса:
Gо = – ЕоnF
G <0, когда E > 0
Gо
= – RT•lnK
Самопроизвольный процесс
RT
E
ln K
nF
O
11.
12.
13.
14.
Основные понятиясодержание
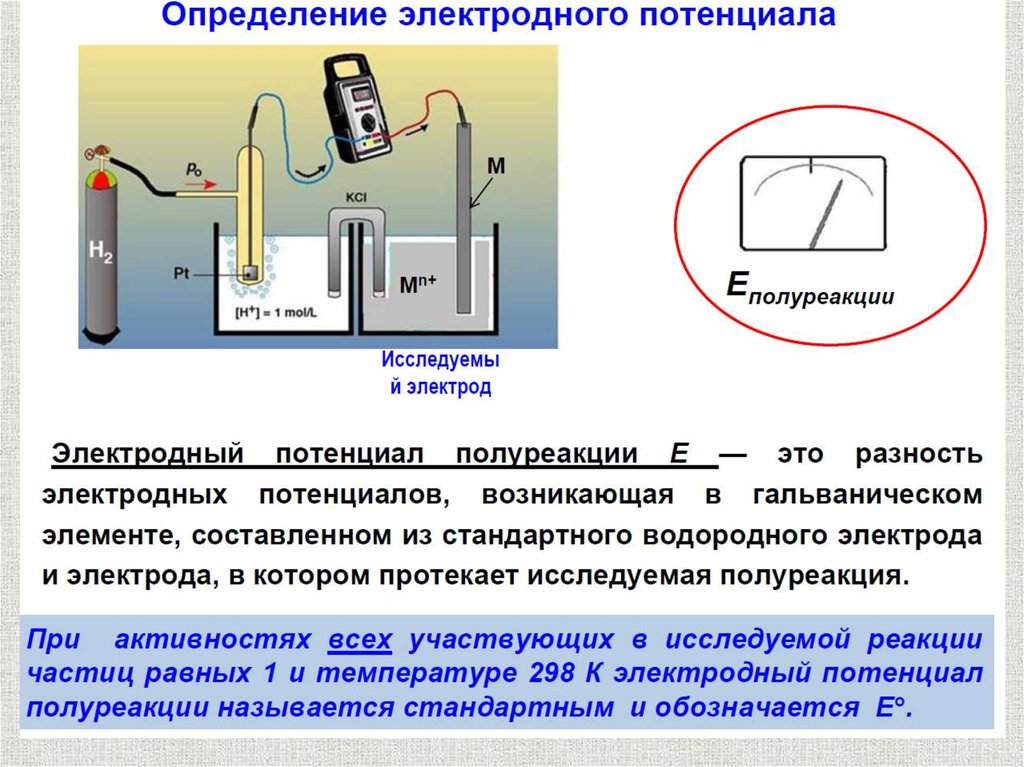
За величину электродного потенциала данного
электрода в водородной шкале принимают ЭДС
гальванического элемента:
Me/[Me(H2O)m]n+ (H2, H2SO4)/Pt
Стандартные значения потенциалов электродов (E0), при условиях:
температура 298,15 К,
давление газа (для газовых электродов) 1,013•105 Па,
концентрация потенциалопределяющих ионов - 1 моль/л.
15.
16.
Уравнение Нернстасодержание
R = 8,314 Дж/(моль К) – универсальная газовая постоянная;
F = 96500 Кл/моль - постоянная Фарадея (заряд одного моля
электронов);
T – абсолютная температура, К;
n – число электронов;
символы в квадратных скобках означает молярную концентрацию
вещества.
17.
Уравнение Нернстасодержание
для ионно-металлического электрода:
для водородного электрода:
18.
Уравнение Нернстасодержание
При температуре 298,15 К уравнение Нернста
для, полуреакции
MnO4 + 8H+ + 5e = Mn2+ + 4H2O
примет вид
4
=
E MnO /Mn 2
o
][H+]8
0,059
lg
[MnO
E MnO /Mn 2 +
4
4
5
[Mn2+]
19.
Уравнение Нернстасодержание
Для реакций
2H 2e H 2
O2 + 4e +
4H+
= 2H2O;
E 2H /H E o2H /H 0,059pH
2
0
EO 2 /2H 2O
2
1,23 0,059pH.
20.
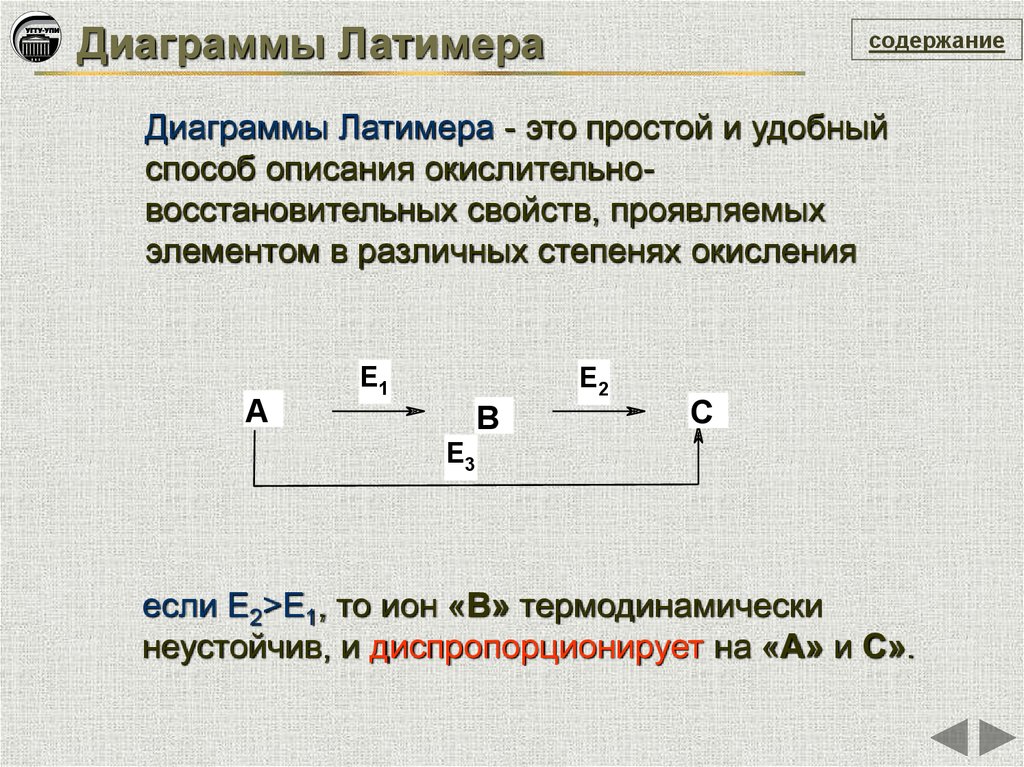
Диаграммы Латимерасодержание
Диаграммы Латимера - это простой и удобный
способ описания окислительновосстановительных свойств, проявляемых
элементом в различных степенях окисления
E1
E2
A
B
C
E3
если Е2>Е1, то ион «В» термодинамически
неустойчив, и диспропорционирует на «А» и С».
21.
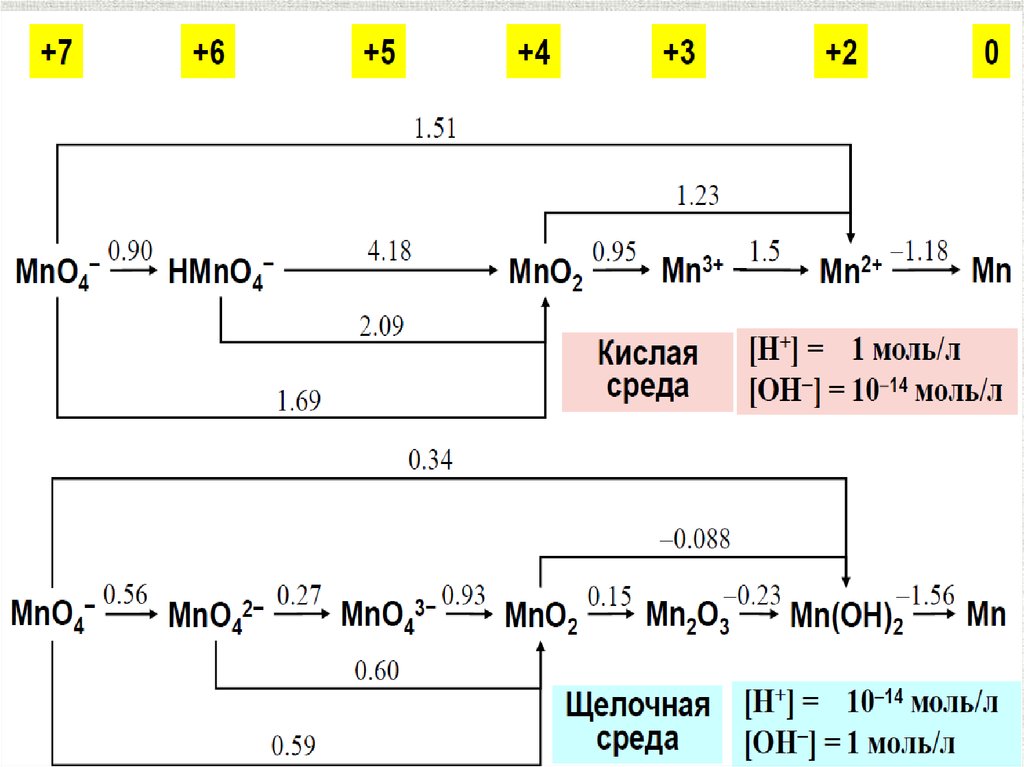
Диаграммы ЛатимераpH = 14
pH = 0
содержание
22.
23.
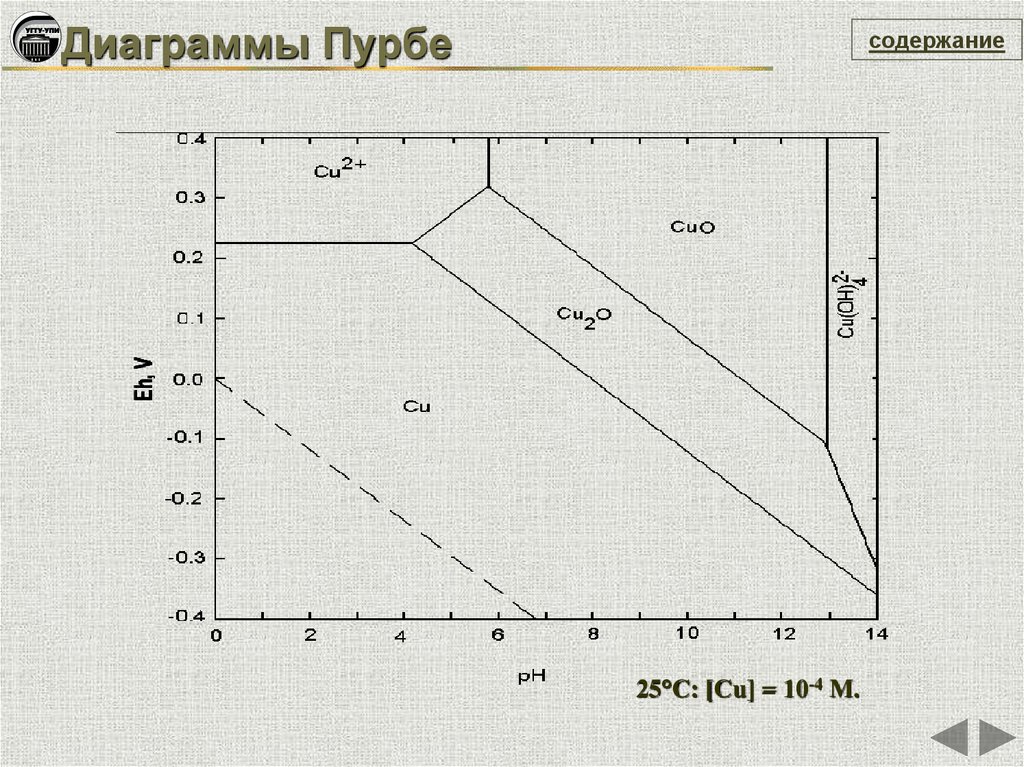
Диаграммы Пурбесодержание
25°C: [Cu] = 10-4 M.
24.
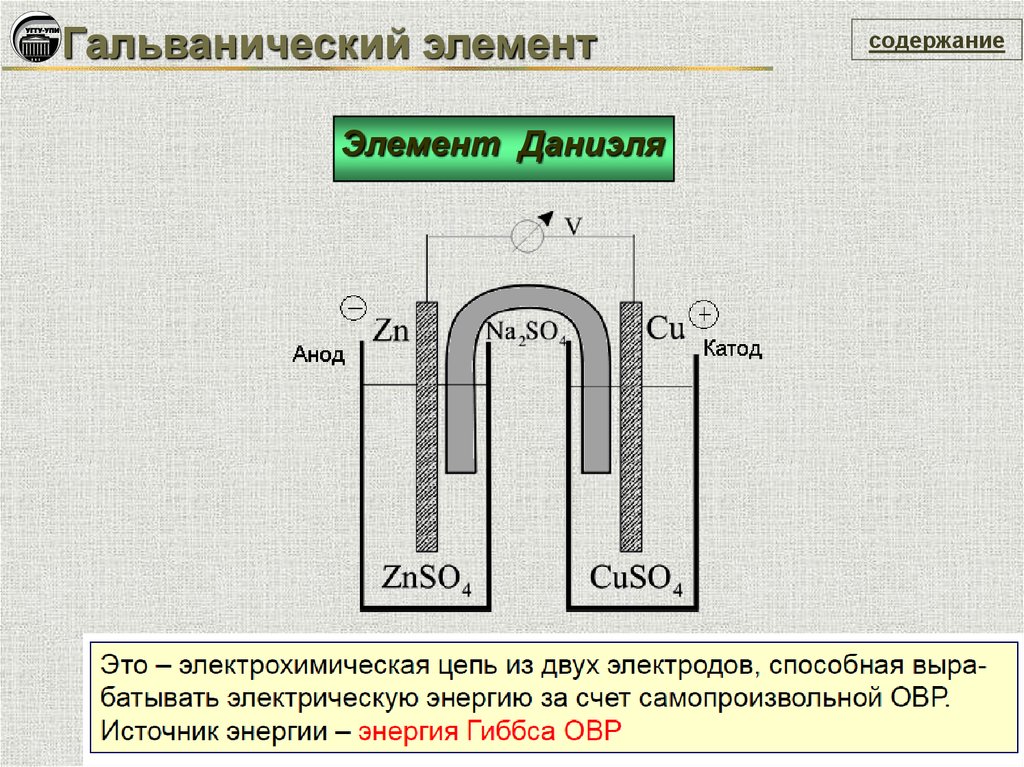
Гальванический элементЭлемент Даниэля
содержание
25.
Гальванический элементЭлемент Даниэля
Zn / ZnSO4 CuSO4 / Cu
Cu2+ + 2e = Cuo (катод, восстановление)
Zno – 2e = Zn2+ (анод, окисление)
Zn0 + Сu2+ = Zn2+ + Cu0
ЭДС = ЕоОх - EоRed = 0,34 – (– 0,76) = 1,1B
содержание
26.
Гальванический элемент синертным электродом
содержание
Zn / ZnSO4 KMnO4, H2SO4, MnSO4, /С
2 MnO4 + 5e +8H+ = Mn2+ + 4H2O (катодный процесс )
5 Zno - 2e = Zn2+
(анодный процесс)
2 MnO4 + 5Zn + 16H+ = 2Mn2+ + 5Zn2+ +8H2O
ЭДС = ЕоОх - EоRed = 1,51 – (– 0,76) = 2,27B
27.
28.
29.
30.
31.
32.
33.
34.
35.
36.
37.
38.
Список литературысодержание
1. Ахметов Н.С. Общая и неорганическая химия. М.: Высшая школа.
2002.
2. О.М. Полторак, Л.М. Ковба. «Физико-химические основы
неорганической химии». М.: МГУ, 1994.
3. В.И. Горшков, И.А. Кузнецов. «Физическая химия». М.: МГУ,
1993.
4. А. Джонсон. Термодинамические аспекты в курсе
неорганической химии. М.: Мир. 1985.
5. Анорганикум. Под ред. Л. Кольдица. М. Мир. 1984. Т.1. 6.
Хьюи Дж. Неорганическая химия. Строение вещества и
реакционная способность. М., Химия, 1987.
7. Фичини Ж., Ламброзо-Бадер Н., Депезе Ж.-К. Основы
физической химии. М. Мир. 1972. стр.276-283.
8. Дж. Кемпбел. Современная общая химия. М.:Мир. 1975г. Т.2.
стр.90. гл.20., Т3.
9. Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии. М.:
Мир,1982. Т. 2.
10. Б.Б.Дамаскин, О.А.Петрий. Электрохимия. М: Высшая школа,
1987.
11. CRC Hand book of Chemistry and Physics. 82 издание. 2001-2002.





























 chemistry
chemistry








