Similar presentations:
Стандартные электродные потенциалы. Введение в электродные потенциалы
1.
Стандартные электродныепотенциалы
Введение в электродные потенциалы
2.
Что такое электродные потенциалы?Стандартные электродные потенциалы — это значения, характеризующие способность
химического элемента или иона вступать в окислительно-восстановительные реакции. Это
величина, измеряемая относительно стандартного водородного электрода, который принято
считать нулевым. Стандартные потенциалы важны для предсказания направления реакций и
расчета электродвижущей силы в электрохимических процессах.
Чем больше положительное значение стандартного электродного потенциала, тем больше вещество
склонно восстанавливаться (принимать электроны). Если значение отрицательное, вещество скорее
будет выступать в роли восстановителя (отдавать электроны).
3.
Стандартные условияСтандартные электродные потенциалы (E∘) — это электродные потенциалы, измеренные
относительно стандартного водородного электрода (СВЭ), который условно принимается за
ноль вольт при стандартных условиях: температуре 25°С (298°К), давлении 1 атм и активности
(концентрации) ионов 1 моль/л
Основные моменты:
1. Сравнение с водородом: Стандартный водородный
электрод (E° = 0B) используется как эталон. Все
остальные электродные потенциалы измеряются
относительно этого эталона.
2. Окисление и восстановление:
1. Если значение стандартного потенциала
положительное, это означает, что вещество легко
восстанавливается (принимает электроны).
2. Если потенциал отрицательный, то вещество
склонно к окислению (отдает электроны).
3. Гальванические элементы: Стандартные
электродные потенциалы используются для расчета
напряжения между электродами в электрохимической
ячейке (гальваническом элементе). Электродвижущая
сила (ЭДС) ячейки вычисляется как разность
потенциалов между катодом и анодом.
4.
Таблица стандартных электродных потенциалов5.
Окислительно-восстановительные реакцииОкислительно-восстановительные реакции (редокс-реакции) — это химические реакции,
в которых происходит изменение степеней окисления атомов реагентов в результате передачи
электронов. В этих реакциях один компонент отдаёт электроны (окисляется), а другой
принимает их (восстанавливается).
Основные понятия окислительновосстановительных реакций:
1.Окисление: процесс отдачи электронов веществом, в
результате чего его степень окисления увеличивается.
• Пример: Zn → Zn2+ +2e− (цинк окисляется, отдавая
два электрона).
2.Восстановление: процесс принятия электронов
веществом, что приводит к уменьшению его степени
окисления.
• Пример: Cu2+ +2e−→ Cu (медь восстанавливается,
принимая два электрона).
3.Окислитель: вещество, которое принимает электроны
и восстанавливается в ходе реакции (при этом оно
вызывает окисление другого вещества).
• Пример: Cu2+ — окислитель.
4.Восстановитель: вещество, которое отдаёт электроны
и окисляется в ходе реакции.
• Пример: Zn — восстановитель.
Пример окислительно-восстановительной
реакции:
Рассмотрим классическую реакцию между цинком и
сульфатом меди:
Zn+CuSO4 → ZnSO4+Cu
Эта реакция представляет собой обмен электронами
между цинком и ионами меди:
• Цинк окисляется: Zn → Zn2+ +2e−
• Медь восстанавливается: Cu2+ +2e− → Cu
Электрохимические процессы:
В электрохимических системах, таких как
гальванические элементы, редокс-реакции
происходят на электродах:
• Анод — это электрод, на котором происходит
окисление.
• Катод — это электрод, на котором происходит
восстановление.
6.
Применение электродных потенциалов1. Расчет электродвижущей силы (ЭДС) в
электрохимических элементах
Электродные потенциалы используются для расчета
напряжения, генерируемого в гальванических (или
электрохимических) ячейках. Разность между
стандартными электродными потенциалами двух
электродов дает электродвижущую силу:
ЭДС = E∘катод − E∘анод
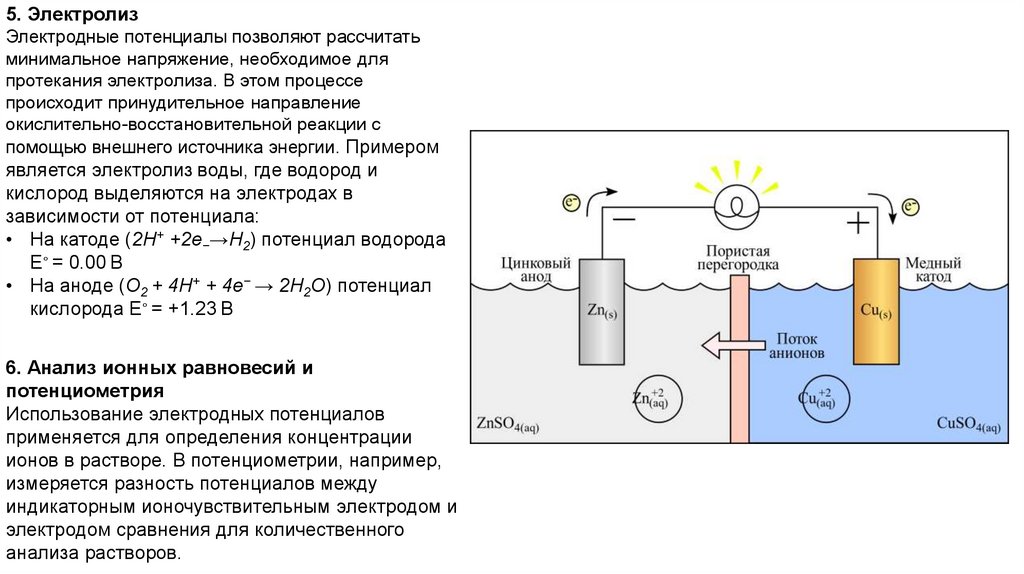
Пример: В элементе Даниэля (цинк-медный
элемент):
• Полуреакция на аноде (цинк):
Zn → Zn2+ + 2e− (E∘ = −0.76В)
• Полуреакция на катоде (медь):
Cu2+ + 2e− → Cu (E∘ = +0.34В)
ЭДС = +0.34 В − (−0.76 В) = +1.10 В
Эта величина определяет выходное
напряжение батареи или ячейки.
2. Предсказание самопроизвольности реакций
Зная стандартные электродные потенциалы, можно предсказать,
будет ли окислительно-восстановительная реакция происходить
спонтанно. Для этого сравнивают потенциалы окислителя и
восстановителя:
• Если E∘окислитель>E∘восстановитель, то реакция будет протекать
самопроизвольно.
3. Коррозия и защита металлов
Электродные потенциалы важны для анализа процессов коррозии.
Металлы с более отрицательными электродными потенциалами
(например, цинк, железо) подвержены коррозии, поскольку они легче
окисляются. В защите металлов используется метод катодной
защиты — например, железо покрывают цинком (гальванизация),
потому что цинк имеет более отрицательный электродный потенциал
и окисляется вместо железа.
4. Металлургия и добыча металлов
Электродные потенциалы помогают в выборе подходящих методов
извлечения металлов из руд. Например, с помощью электролиза
можно выделять металлы с высокой электроотрицательностью,
такие как алюминий (E∘ = −1.66 В), из их соединений.
7.
5. ЭлектролизЭлектродные потенциалы позволяют рассчитать
минимальное напряжение, необходимое для
протекания электролиза. В этом процессе
происходит принудительное направление
окислительно-восстановительной реакции с
помощью внешнего источника энергии. Примером
является электролиз воды, где водород и
кислород выделяются на электродах в
зависимости от потенциала:
• На катоде (2H+ +2e−→H2) потенциал водорода
E∘ = 0.00 В
• На аноде (O2 + 4H+ + 4e− → 2H2O) потенциал
кислорода E∘ = +1.23 В
6. Анализ ионных равновесий и
потенциометрия
Использование электродных потенциалов
применяется для определения концентрации
ионов в растворе. В потенциометрии, например,
измеряется разность потенциалов между
индикаторным ионочувствительным электродом и
электродом сравнения для количественного
анализа растворов.






 chemistry
chemistry








