Similar presentations:
Электродные потенциалы. Гальванические элементы
1.
ТЕМА №8: ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ.ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Рассматриваемые вопросы:
1. Электродные потенциалы и механизм их возникновения.
2. Стандартный водородный электрод. Стандартные электродные
потенциалы.
3. Электрохимический ряд напряжений металлов.
4. Уравнение Нернста.
5. Гальванические элементы.
1
2.
1. Электродные потенциалы и механизм их возникновенияЭлектрохимия – раздел химии, изучающий взаимосвязь химических
и электрических процессов.
Для всех металлов характерно свойство в той или иной степени
растворяться в воде или в растворах их солей.
Образование двойного электрического слоя на
границе раздела фаз металл – раствор.
Двойной электрический
слой (ДЭС),
характеризуется
некоторой
разностью
электростатических потенциалов.
2
3.
Например, для железной пластинки устанавливается следующееравновесие:
Fe 2e Fe
пластинка
Fe 2e Fe
2
2
раствор
2
Fe 2e Fe
окисление
0
восстановление
3
4.
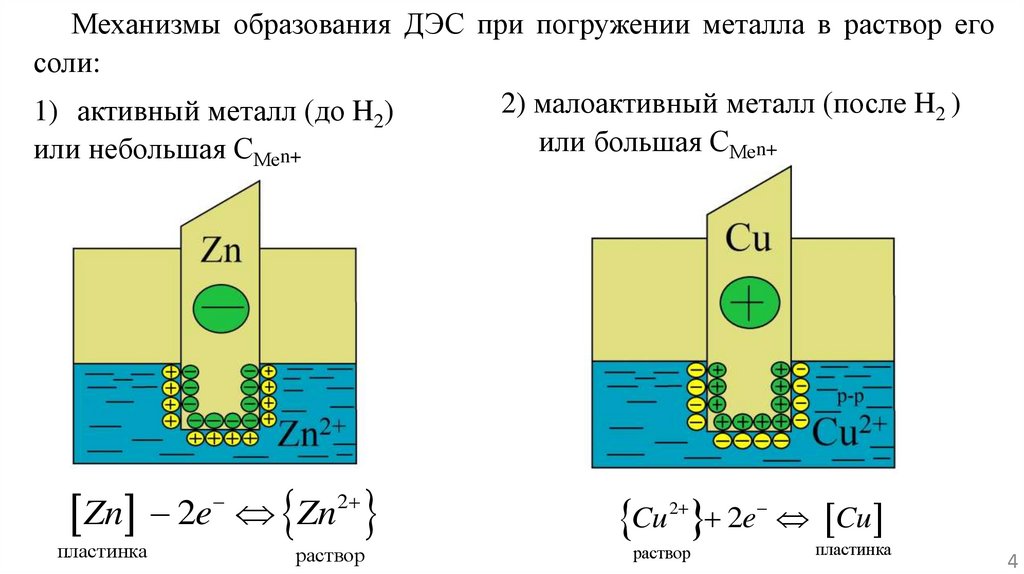
Механизмы образования ДЭС при погружении металла в раствор егосоли:
2) малоактивный металл (после H2 )
1) активный металл (до H2)
или большая СМеn+
или небольшая СМеn+
2
Zn
2
e
Zn
пластинка
раствор
2
Cu
2
e
Cu
раствор
пластинка
4
5.
Электродный потенциал (φ) – разность (скачок) потенциалов,возникающая между металлом и жидкой фазой.
Электродный потенциал зависит от:
1) природы металла;
2) концентрации ионов металла в растворе;
3) температуры;
4) рН среды.
5
6.
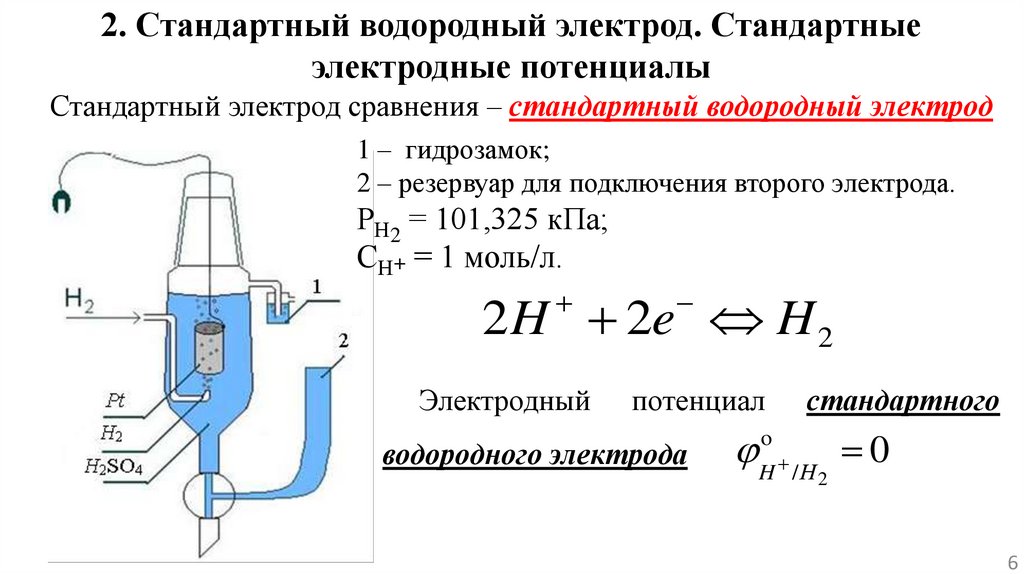
2. Стандартный водородный электрод. Стандартныеэлектродные потенциалы
Стандартный электрод сравнения – стандартный водородный электрод
1 – гидрозамок;
2 – резервуар для подключения второго электрода.
РН2 = 101,325 кПа;
СН+ = 1 моль/л.
2 H 2e H 2
Электродный
потенциал
водородного электрода
стандартного
H / Н 0
o
2
6
7.
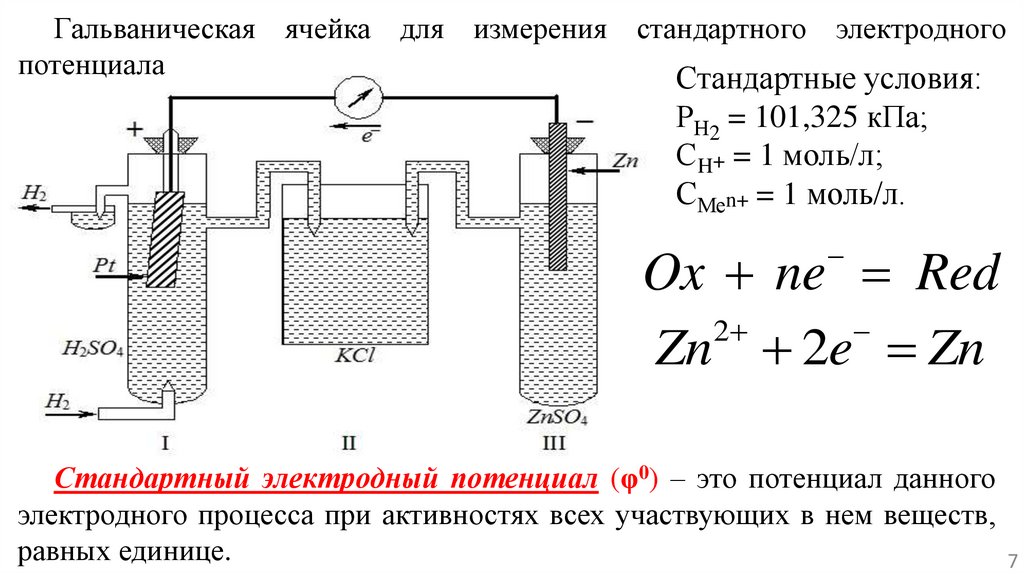
Гальваническая ячейка для измерения стандартного электродногопотенциала
Стандартные условия:
РН2 = 101,325 кПа;
СH+ = 1 моль/л;
СМеn+ = 1 моль/л.
Ox ne Red
2
Zn 2e Zn
Стандартный электродный потенциал (φ0) – это потенциал данного
электродного процесса при активностях всех участвующих в нем веществ,
равных единице.
7
8.
3. Электрохимический ряд напряжений металлов8
9.
Следствия из ряда напряжений металлов:1) чем меньше электродный потенциал металла (φ0Меn+/Me), тем
легче металл окисляется и труднее восстанавливается из
растворов своих солей;
2) металлы, стоящие в ряду напряжений левее водорода,
способны вытеснять его из разбавленных растворов кислот;
3) металлы с более низким электродным потенциалом
способны вытеснять (восстанавливать) из растворов солей
металлы с более высоким электродным потенциалом.
9
10.
4. Уравнение НернстаЗависимость величины электродного потенциала от концентрации ионов
металла в растворе и от температуры описывается уравнением Нернста:
Ox / Red
0
Ox / Red
2,3 R T
aox
lg
n F
aRed
φOx/Red, φ0Ox/Red – электродный и стандартный электродный потенциалы
системы, В;
R – универсальная газовая постоянная, R =8,314 Дж / (моль·К);
Т – абсолютная температура, К (Т = 298,15 К);
F – постоянная Фарадея, F = 96485 Кл / моль;
n – количество электронов, участвующих в электродной реакции;
аOx, аRed – активности окисленной и восстановленной форм соединения.
10
11.
Для разбавленных растворов электролитов активности можно заменитьконцентрациями, тогда уравнение Нернста будет иметь вид:
0,059
n
lg Me
n
0
где φ – потенциал металла при данной концентрации ионов, В;
φ0 – стандартный электродный потенциал металла, В;
n – заряд иона металла;
[Men+] – молярная концентрация гидратированных ионов металла в
3
растворе, моль/дм
11
12.
Задача. Определить потенциал свинцового электрода, если концентрацияионов свинца в растворе составила 0,1 моль/дм3.
Решение. Реакция протекающая на электроде: Pb2+ + 2e– = Pb.
Так как, концентрация ионов металла в растворе не равна 1 моль/дм3, то
для определения электродного потенциала используется уравнение
Нернста.
0,059
Pb2 / Pb Pb2 / Pb
lg CPb2
n
0
0,059
Pb2 / Pb – 0,13
lg0,1 – 0,16 В
2
12
13.
5. Гальванические элементы. Электродвижущая силагальванического элемента
Гальванический элемент – устройство, в котором химическая
энергия окислительно-восстановительной реакции непосредственно
преобразуется в энергию электрического тока.
Гальванический элемент (ГЭ) состоит из двух полуэлементов
(окислительно–восстановительных систем), соединенных между собой
металлическим проводником и солевым мостиком.
В ГЭ на одном полуэлементе с меньшим значением электродного
потенциала (анод) протекает процесс окисления (процесс отдачи
электронов), на другом, с большим значением электродного
потенциала (катод) – восстановления (процесс присоединения
электронов).
13
14.
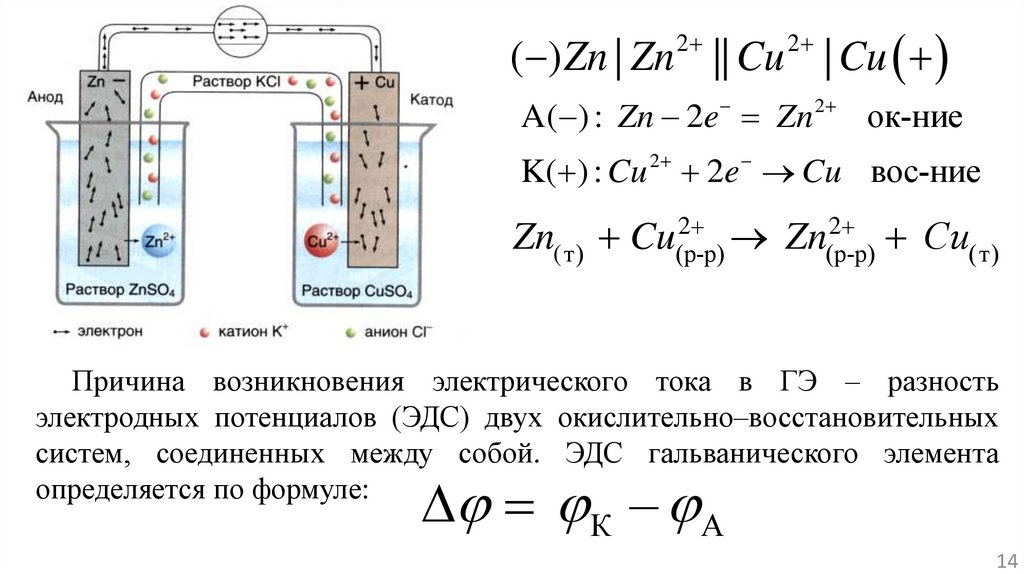
( ) Zn | Zn || Cu | Cu2
2
A( ) : Zn 2e Zn
2
ок-ние
K( ) : Cu 2 2e Cu вос-ние
2
2
Zn(т) Cu(р-р)
Zn(р-р)
Сu(т)
Причина возникновения электрического тока в ГЭ – разность
электродных потенциалов (ЭДС) двух окислительно–восстановительных
систем, соединенных между собой. ЭДС гальванического элемента
определяется по формуле:
К – А
14
15.
6. Связь ЭДС с изменением стандартной энергии ГиббсаТермодинамическое
условие
самопроизвольного
протекания
химического процесса G < 0. Взаимосвязь между G и ЭДС ГЭ
выражается формулой:
G –n F
где n – число электронов, принимающих участие в окислительновосстановительном процессе (наименьшее общее кратное – НОК);
Δφ0 – ЭДС ГЭ, В;
F – постоянная Фарадея, равная 96 500 Кл/моль
15
16.
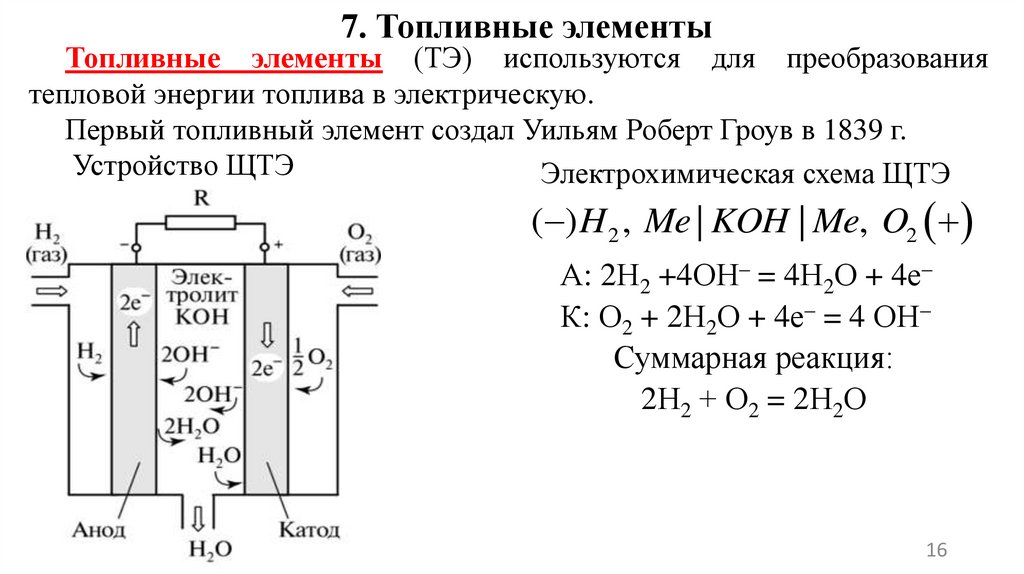
7. Топливные элементыТопливные элементы (ТЭ) используются для преобразования
тепловой энергии топлива в электрическую.
Первый топливный элемент создал Уильям Роберт Гроув в 1839 г.
Устройство ЩТЭ
Электрохимическая схема ЩТЭ
( ) H 2 , Me | KOH | Me, O2
А: 2Н2 +4ОН– = 4Н2О + 4е–
К: О2 + 2Н2О + 4е– = 4 ОН–
Суммарная реакция:
2Н2 + О2 = 2Н2О
16
17.
Топливныеэлементы
в
результате
химической
реакции
преобразовывают водород и кислород в электричество. В результате этого
процесса образуется вода и выделяется большое количество теплоты.
Водородно-кислородный щелочной топливный элемент (ЩТЭ).
Принцип работы: к аноду подводится топливо – водород
(восстановитель), к катоду – окислитель (чистый кислород или кислород
воздуха). Между электродами находится раствор электролита (КОН).
Носителем заряда в ЩТЭ является ион ОН–, движущийся от катода к
аноду, где он вступает в реакцию с Н2, производя Н2O и e–. Вода,
полученная на аноде, движется обратно к катоду, снова генерируя там ОН–
ионы. В результате в ТЭ производится электричество и побочный продукт
– теплоту.
Достоинства ЩТЭ: 1) дешевизна в производстве; 2) работают при
относительно низкой температуре; 3) являются самыми эффективными
(КПД может достигать 70%).
17
18.
Практическое использование химических источников тока18
19.
Принцип действия и устройство свинцового аккумулятора.Свинцовый аккумулятор состоит из емкости, заполненной H2SO4, в
которую погружены 2 электрода:
I) состоит из губчатого Pb;
II) из диоксида свинца PbO2.
Pb + PbO2 + 2H2SO4
процесс зарядки аккумулятора
процесс разрядки аккумулятора
PbSO4 + H2O
Процесс разрядки аккумулятора – процесс возникновения во внешней
цепи электрического тока за счет ОВР. При разрядке через аккумулятор
пропускается электрический ток от внешнего источника тока.
19













 chemistry
chemistry








