Similar presentations:
Белки - 2. Тканевой обмен аминокислот
1.
Белки-2Тканевой обмен
аминокислот
лекция 18
2. Содержание лекции
1.Основные реакции обмена аминокислот-реакции по радикалу
-реакции на карбоксильную группу
-реакции на аминогруппу
2.Аммиак, пути его
образования,токсичность
3.Пути детоксикации аммиака
4.Пути вступления аминокислот в ЦТК
3.
4.
5.
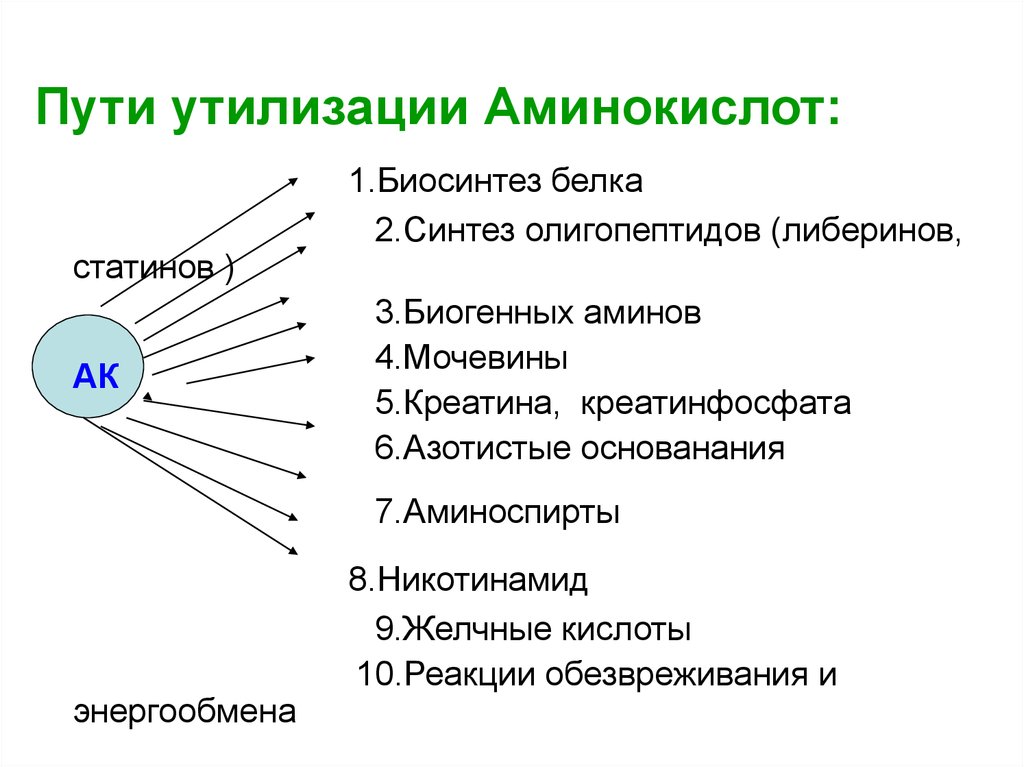
Пути утилизации Аминокислот:статинов )
АК
1.Биосинтез белка
2.Синтез олигопептидов (либеринов,
3.Биогенных аминов
4.Мочевины
5.Креатина, креатинфосфата
6.Азотистые основанания
7.Аминоспирты
энергообмена
8.Никотинамид
9.Желчные кислоты
10.Реакции обезвреживания и
6.
Кроме индивидуальных путей обмена,известен ряд превращений, общий
почти для всех аминокислот. Это
реакции:
1.по радикалу (R)- реакции
гидроксилирования ( про----> o-про)
разрыва
радикала( образование Vit PP и ТРП);
2.Реакции на --СООН группудекарбоксилирование( образование
биогенных аминов, ГИС гистамин)
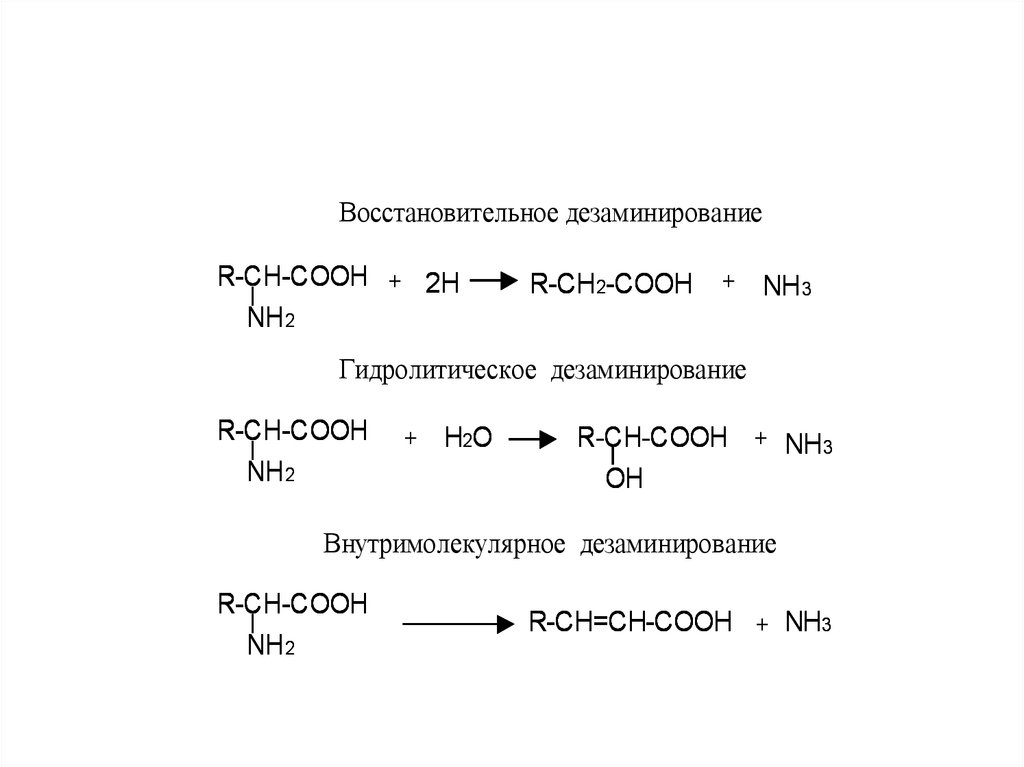
3. Реакции на группу NH2дезаминирование 4х типов:
7.
Окислительное дезаминированиеR-CH-COOH
NH 2
Флавин
R-CH-COOH
NH
Флавин-Н2
H2O
NH 3
H 2O2
Каталаза
O2
R
C=O
COOH
H 2O + 1 /2O2
8.
Восстановительное дезаминированиеR-CH-COOH + 2H
NH 2
R-CH 2-COOH
+
NH 3
Гидролитическое дезаминирование
R-CH-COOH
NH 2
+
H2O
R-CH-COOH + NH 3
OH
Внутримолекулярное дезаминирование
R-CH-COOH
NH 2
R-CH=CH-COOH + NH3
9. Трансаминирование аминокислот
окислительное дезаминированиепрямое10.
Первая стадия яв-сяферментативной с образованием
промежуточного продуктаиминокислоты, которая спонтанно,
без участия фермента, распадается
на аммиак и α- кетокислоту.
Этот тип реакций наиболее
распространен в тканях
11.
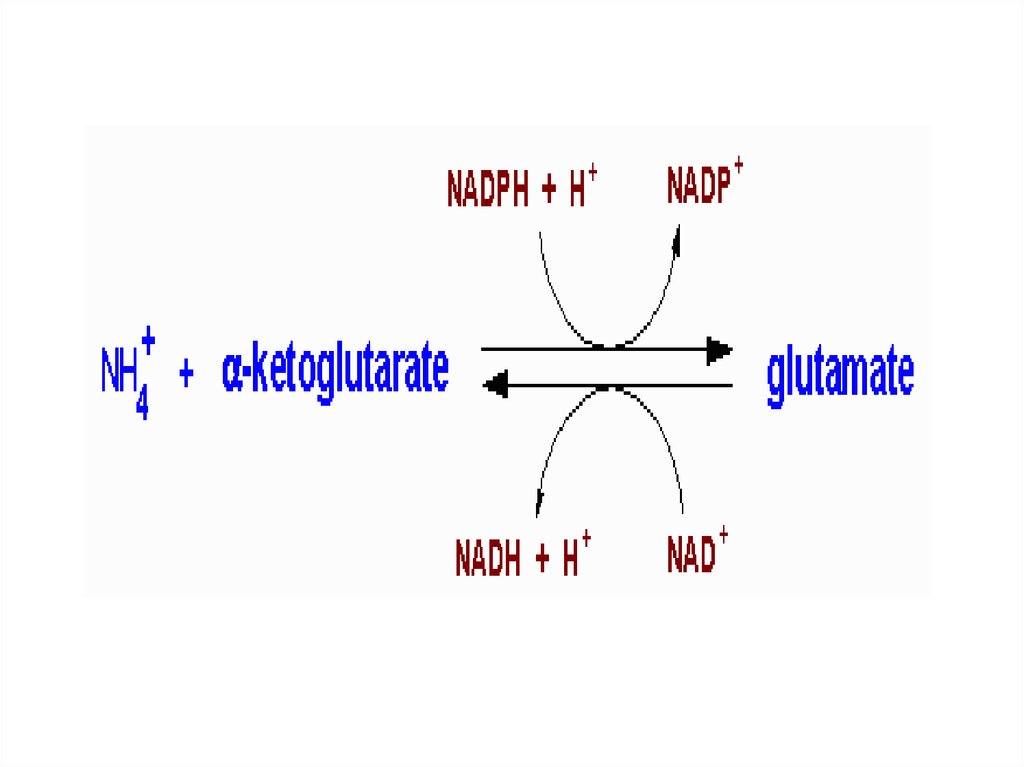
ГЛУ+NAD+--- иминоглут кислота +НОН-
--- α- кетоглутарат+NADH+H+ + NH3
Первая стадия катализируется ГДГ
(анаэробный фермент). Вторая стадия
проходит спонтанно. Реакцияобратима!
12.
ГДГ- состоит из 6 субъединиц ипроявляет свою активность только в
мультимерной форме. При
диссоциации ГДГ на субъединицы, в
присутствии NADH2, ГТФ,
стероидных гормонов), она теряет
свою Глутаматдегидрогеназную
функцию, но приобретает
способность дезаминировать другие
аминокислоты (аланин). ГДГрегуляторный, аллостерический
фермент.
13.
Все остальные аминокислоты могутокисляться и дезаминироваться
только непрямым путем ( т.е. через
дополнительную стадию
трансаминирования).
Коферментом трансаминаз является
фосфорилированная форма Vit В6пиридоксальфосфат, который в
процессе реакции обратимо
превращается в
пиридоксальаминфосфат
14.
15.
Это главный путь удаления азотау аминокислот. Выделены
трансаминазы, катализирующие
переаминирование большинства
аминокислот. После поступления
пищевых аминокислот из
воротной вены, например,
значительная часть их в печени
подвергается
переаминированию.
16.
Исключением являютсяаминокислоты с разветвленным
углеводородным радикалом, для
которых в печени нет
соответствующих трансаминаз, о
чем говорит более высокая
концентрация таких аминокислот
в крови, оттекающей от печени
по сравнению с концентрацией в
крови воротной вены.
17.
Непрямое окислительноедезаминирование.
Почти все природные а/к сначала
реагируют с α-КГК в реакции
трансаминирования с образованием
ГЛУ и соответствующей кетокислоты,
а образовавшаяся ГЛУ затем
подвергается прямому
окислительному дезаминированию
под действием ГДГ.
Т.е. все а/к подвергаются
дезаминированию непрямым путем,
18.
Любая а/кα- КГК
NADH2 +NН3
Любая кето
кислота
ГЛУ
NADH+ + HOH
ГДГ
трансаминазы
19.
Поскольку обе эти реакции – итрансаминирование, и прямое
дезаминирование- обратимы, то
создаются условия для синтеза
новой заменимой а/к, если в
организме есть соответствующие
кетокислоты. Организм человека не
наделен способностью
синтезировать углеводные скелеты(
т.е. α-кетокислоты) незаменимых а/к.
Этой способностью обладают
растения.
20.
Т.о. можно сказать, что путь синтезазаменимых а/к в организме- это
непрямое окислительное
дезаминирование, которое
запущеное в обратном направлении.
Этот путь называется
трансаминированием.
21.
22.
23.
Существует еще один механизмнепрямого дезаминирования α- а/к,
при которм ГЛУ, АСП, и АМФ
выполняют роль системы переноса
NН2- группы:
24.
О2--- малатЩУК
АК
ГЛУ
α- кетоглу
фумарат
АСП
Н2О
АМФ
ИМФ
NH3
25.
ГДГ выполняет следующие функции:1.Осуществляет связь обмена а/к с ЦТК
через α-кетоГЛУ
2.Обеспечивает связывание аммиака
3.Обеспечивает синтез всех
заменимых аминокислот
4.Обеспечивает перекачку протонов с
NADH на NADFH ( пластическая
функция при синтезе а/к)
26.
NH4+аминокислота
пируват
глутамат
кетокислота
АЛА
КГ
трансаминаза
АЛТ
АСТ
оксалоацетат
АСП
мочевина
27.
Трансаминирование-это главныйпуть удаления азота у аминокислот.
Выделены трансаминазы,
катализирующие переаминирование
большинства аминокислот. После
поступления пищевых аминокислот
из воротной вены, например,
значительная часть их в печени
подвергается переаминированию.
28.
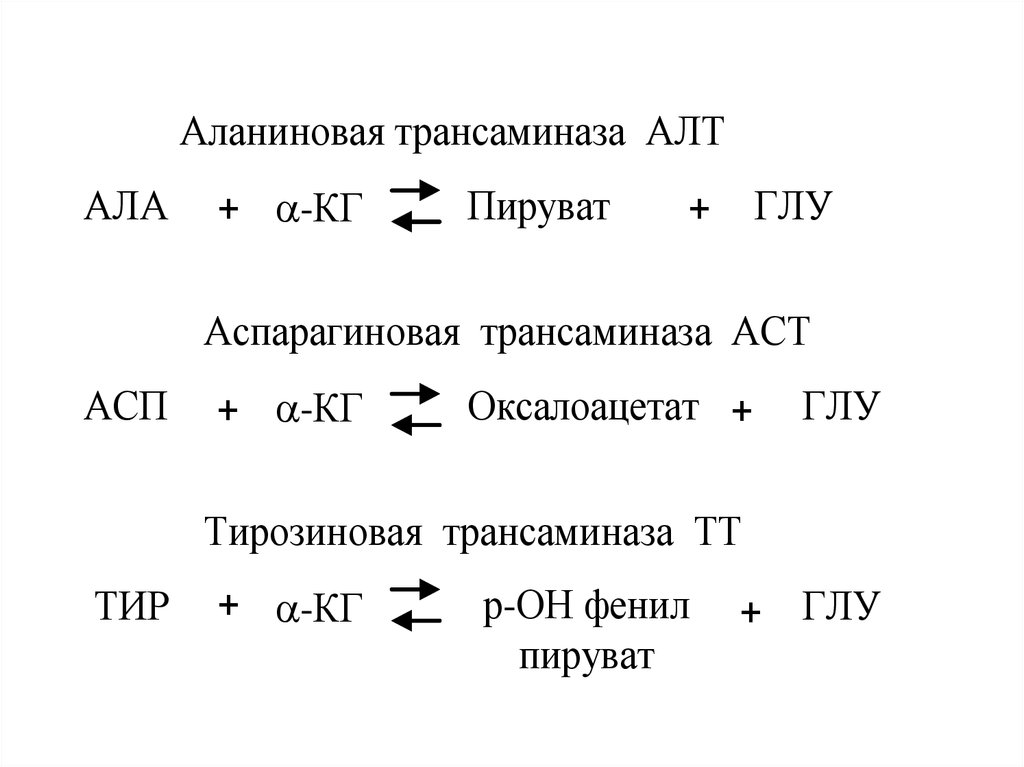
Аланиновая трансаминаза АЛТАЛА
+ -КГ
Пируват
+
ГЛУ
Аспарагиновая трансаминаза АСТ
АСП
+ -КГ
Оксалоацетат +
ГЛУ
Тирозиновая трансаминаза ТТ
ТИР
+ -КГ
р-ОН фенил + + ГЛУ
пируват
29.
Исключением являютсяаминокислоты с разветвленным
углеводородным радикалом, для
которых в печени нет
соответствующих трансаминаз, о чем
говорит более высокая концентрация
таких аминокислот в крови,
оттекающей от печени по сравнению
с концентрацией в крови воротной
вены.
30. Клиническое значение определения активности трансаминаз
Для клинических целей наибольшеезначение имеют 2 трансаминазыАсАТ и АлАТ
АсАТ
АСП + α-КГК
ЩУК+ ГЛУ
АлАТ
АЛА + α-КГК
ПВК + ГЛУ
31.
В сыворотке крови здоровых людейактивность этих трансаминаз в
среднем составляет-15-20 Е., по
сравнению с десятками и сотнями
тысяч единиц во внутренних органах
и тканях. Поэтому органические
поражения при остых и хронических
заболеваниях сопровождаются
деструкцией клеток, и выходу АсАТ и
АлАТ из очага поражения в кровь.
32.
Наибольшая активность АлАТприходится на печень, а АсАТ на
миокард. Поэтому определение
активности АсАТ в сыворотке крови
используется для ранней
диагностики болезней Боткина, а
также для ее безжелтушных форм.
Высокая активность фермента
поддерживается 10-15 дней, затем
постепенно снижается.
33.
Определение активностиАсАТиспользуется для ранней
диагностики ИМ. Причем увеличение
активности наблюдается через 24-36
час. И снижается на 3-7 сутки, при
благоприятном исходе.
Для дифференциальной диагностики
гепатита и ИМ используется
коэффициент де Ритиса:
К= АсАТ/ АсАТ = 1.5-2 ( в норме)
Если К>2 – ИМ.
Если К < 0.6 ---болезнь Боткина
34. Токсичность аммиака и пути его обезвреживания
1.Аммиак в тканях протонирован( NH4+), т.е он связывает Н+, и тем
самым изменяект КЩБ( кислотнощелочной баланс).
2.Аммиак вступает в реакции
«насильственного» аминирования αкетокислот, извлекает из ЦТК
важнейшие субстраты и вызывает
тем самым низкоэнергетический
сдвиг, т.е. состояние близкое к
гипоксическому
35.
3.Аммиак изменяет соотношение ионовнатрия и калия т.к. близок к ним по
физико- химическим свойствам:
следовательно нарушается водноэлектролитный баланс.
4.Аммиак обладает
нейротоксичностью- изменяет
мембранный потенциал нейронов,
способен ингибировать биосинтез
белка( аминирует белки)
36. Пути обезвреживания аммиака
В плазме крови содержится 25-40мМ/л аммиака. При накоплении
последнего возникает тремор,
нечленораздельная речь, иногда
смерть.
Аммиак- этиологический фактор
почечной недостаточности
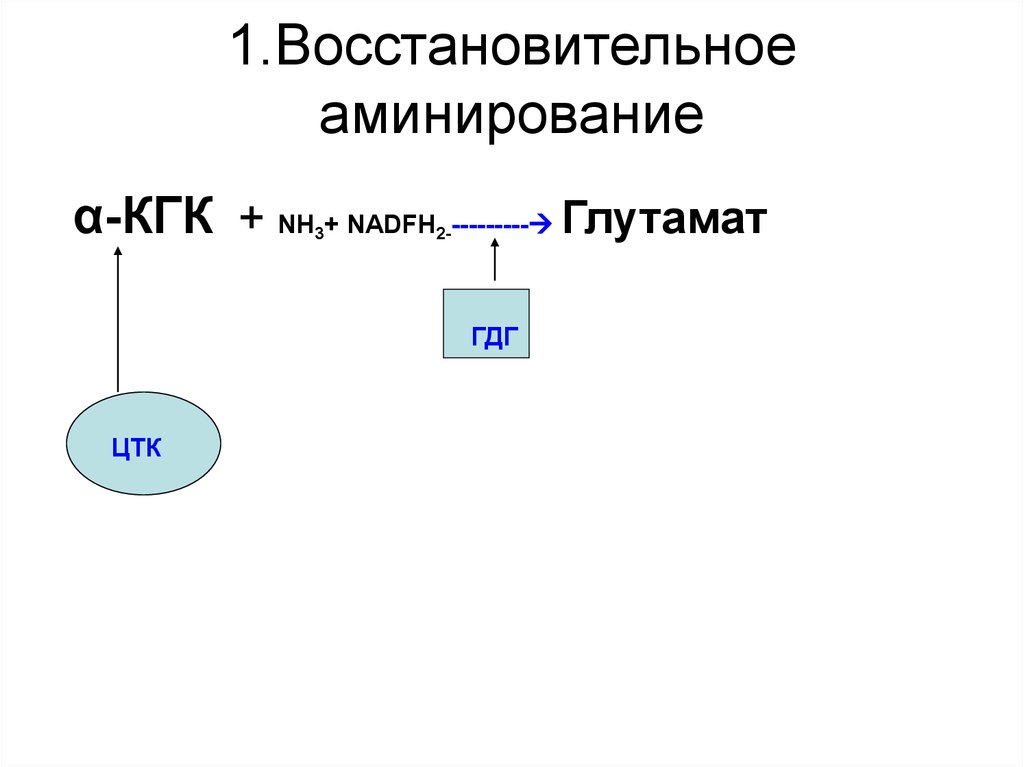
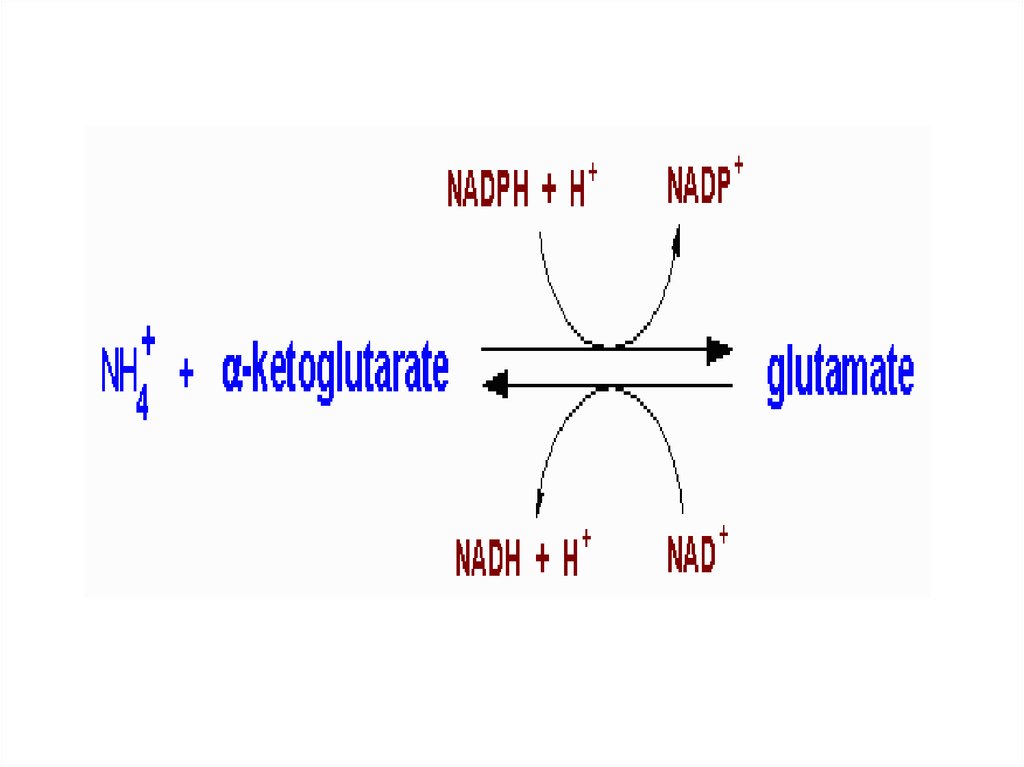
37. 1.Восстановительное аминирование
α-КГК + NH + NADFH --------- Глутамат3
2-
ГДГ
ЦТК
38.
39. 2.Образование амидов дикарбоновых кислот
Т.к. ГЛН и АСН выделяются с мочой,то они являются транспортной
формой аммиака.
ГЛН -- АЛА-- по воротной вене в
печень, где аминогруппа идет на
синтез мочевины, а углеродные
скелеты на ГНГ. Это глюкозоаланиновый цикл между печенью и
мышцами ( цикл Кори)
40.
41.
3. Основная масса ГЛН и АСНзахватывается почками, где под
действием глутаминазы от них
отщепляется аммиак.. Далее он
реагирует с Н+ и дает ион аммония,
который экскретируется с мочой.
При ацидозе экскреция катиона
аммония с мочой увеличивается,т.к.
ацидоз активирует глутаминазу и она
активно отщепляет аммиак от ГЛН,
который в свою очередь активно
захватывает протоны и тем самым
ликвидирует ацидоз.
42.
Кроме того при ацидозе происходитпотеря Na+ и K+ с мочой. Это
приводит к снижению осмотического
давления и обезвоживанию тканей.
Но этот процесс не развивается
благодаря образованию NH4+ ,
который обладает близкими физикохим. cвойствами с Na+ и K+,замещая
их он предотвращает нарушение
водно- электролитного баланса. Это
аммониогенез
43.
4. Амидирование свободныхкарбоксильных групп белков
(амидированные формы белков
устойчивы к протеазам)
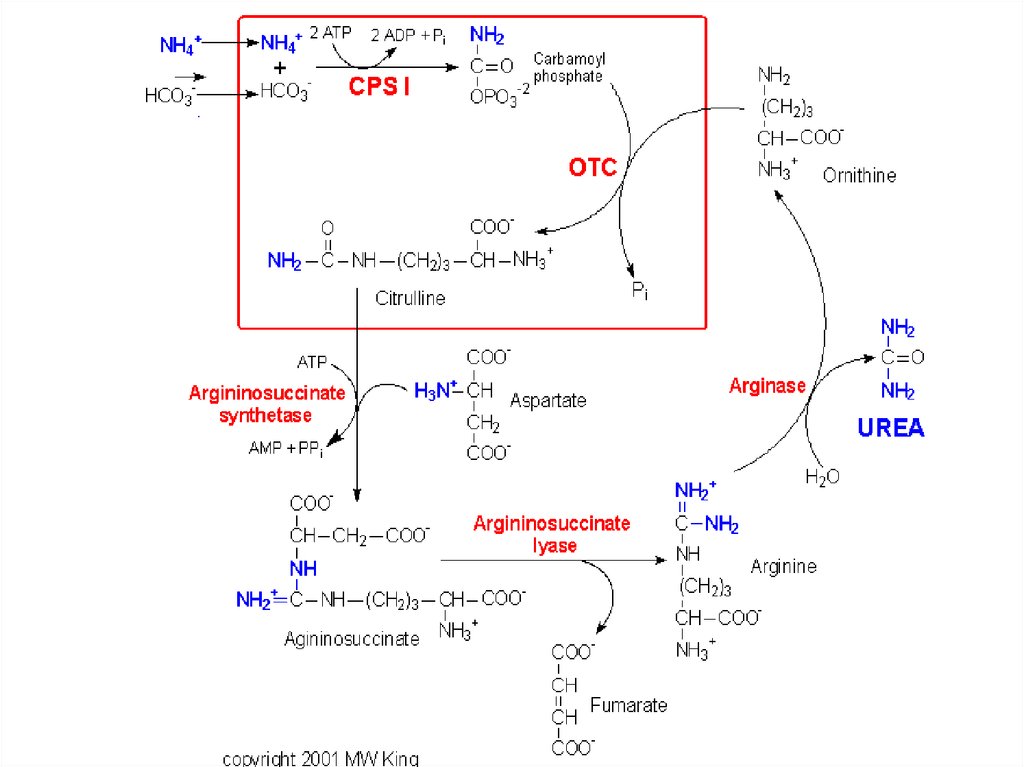
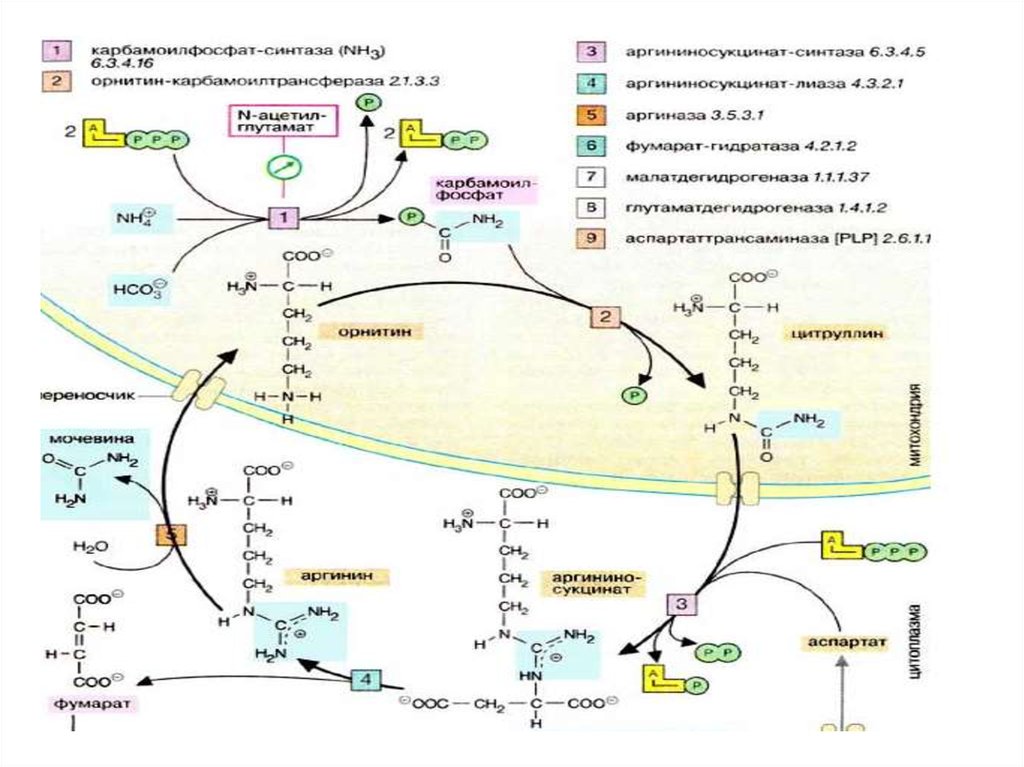
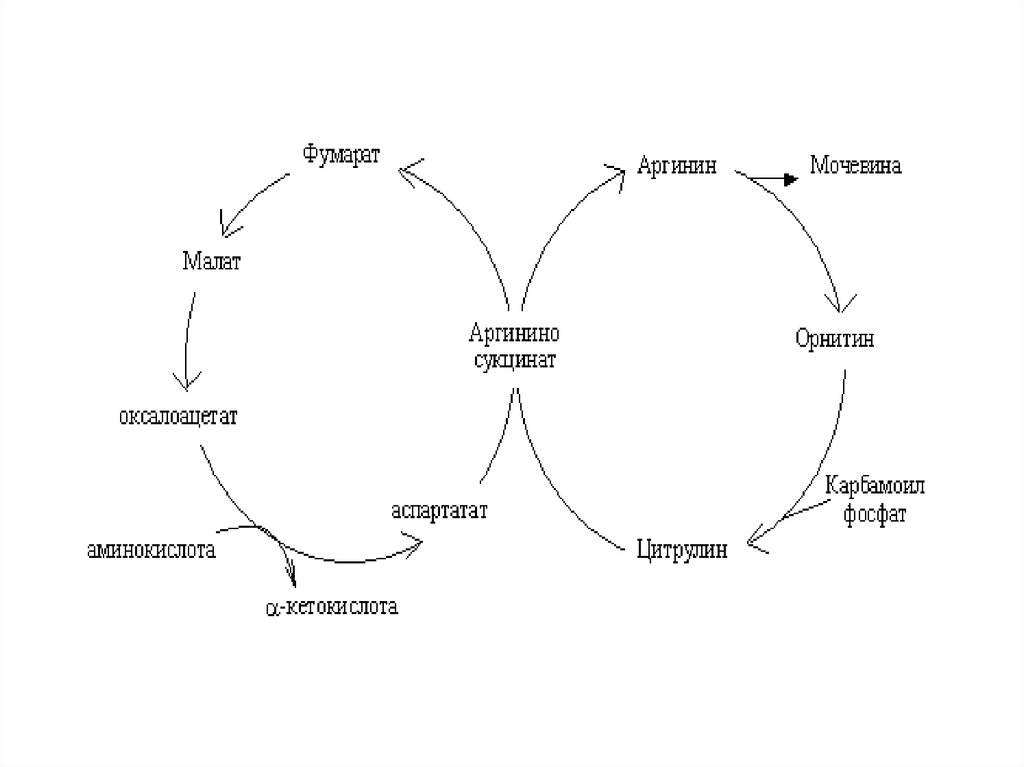
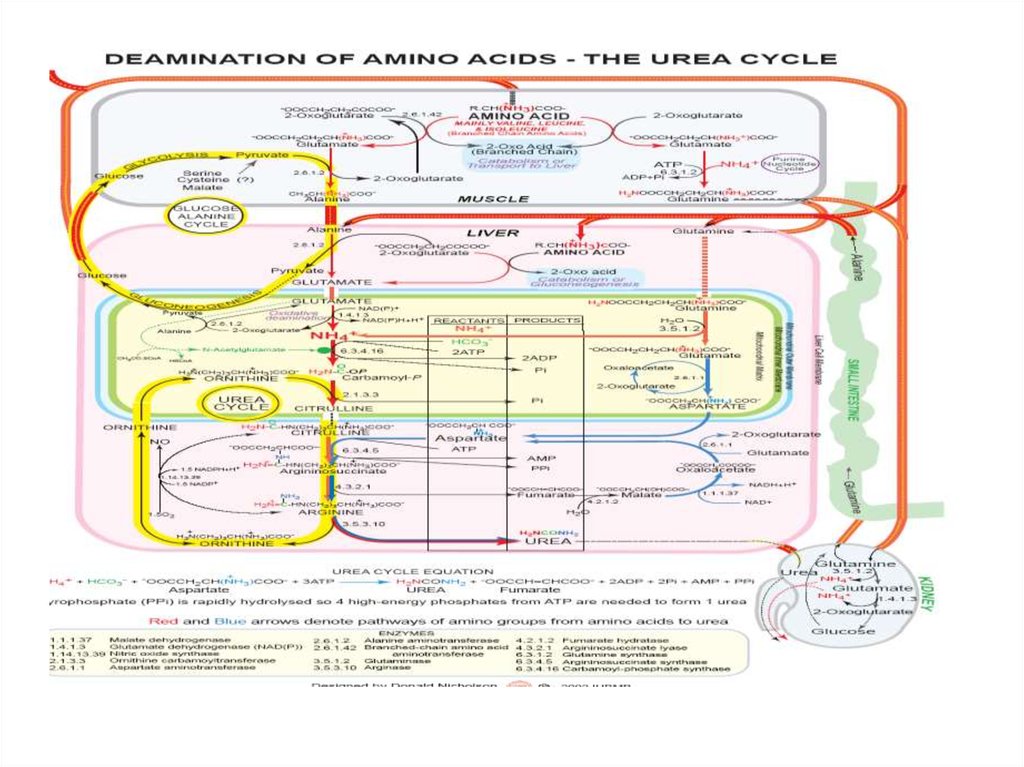
44. Биосинтез мочевины
• Это основной механизмобезвреживания аммиака. 90%
азота организма выводится в
виде мочевины (М)., причем ее
количество зависит от
количества, потребляемого
белка.. В норме суточное
выделение- 25-30г.
45.
• Орнитиновый цикл синтезамочевины (ОЦСМ) протекает в
гепатоцитах,т.к. них наиболее
высокая активность ферментов
азотного обмена.
• Первая р-ция катализируется
КФС-1. Существует еще и КФС-2,
которая катализирует такую же рцию в синтезе пиримидинов.
46.
Это еще один путьдетоксикации аммиака- синтез
пиримидиновых оснований.
Первая и вторая р-ции ЦСМ
протекают в МХ. –образуется
цитруллин, затем он выходит в
цитоплазму и дальше реакции
идут в цитоплазме.
47.
48.
49.
Мочевина- природныйантиоксидант,
радиопротектор,который
взаимодействует с Fe+2, и
останавливает перекисные
процессы. Мочевина изменяет
структуру воды, как акцептор а/к
защищает мембраны клеток,
блокирует протеолиз и тем
самым удлиняет жизнь белков.
50.
Энергетическая стоимостьЦСМ
ЦСМ « стоит» 3 молекулы АТФ:
2 АТФ на стадии синтеза
карбомоилфосфата и 1 атом на
стадии синтеза аргининсукцината.
Но фактически в процессе
используются 4 макроэргических
связи АТФ.
51.
2- когда синтез-ся карбомоилфосфат( АТФ—АДФ- 1 макроэр. связь)
АТФ—АДФ- 1 макроэр. связь
И 2 при синтезе аргининосукцината
(АТФ—АДФ—АМФ) – это еще 2
макроэрга.
52.
53.
54. Биологическая роль ЦСМ
1. Механизм детоксикации аммиака2. Механизм регуляции КЩС( т.к.
поставляет СО2.
3. ЦСМ поставляет орнитин
4. Имея митохондриальную
локализацию, ЦСМ регулирует
потоки а/к по различным
направлениям --- ГНГ, биосинтез
белка, липогенез.
55.
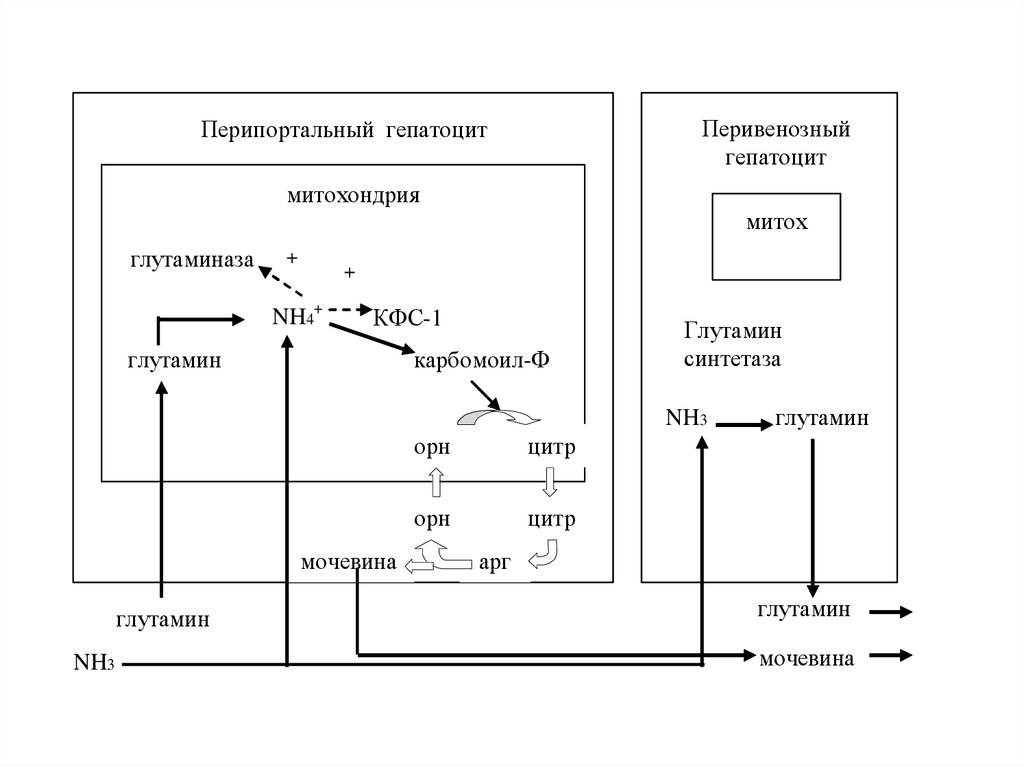
Перивенозныйгепатоцит
Перипортальный гепатоцит
митохондрия
митох
глутаминаза
+
+
NH4+
КФС-1
глутамин
карбомоил-Ф
Глутамин
синтетаза
NH3
мочевина
глутамин
NH3
орн
цитр
орн
цитр
глутамин
арг
глутамин
мочевина
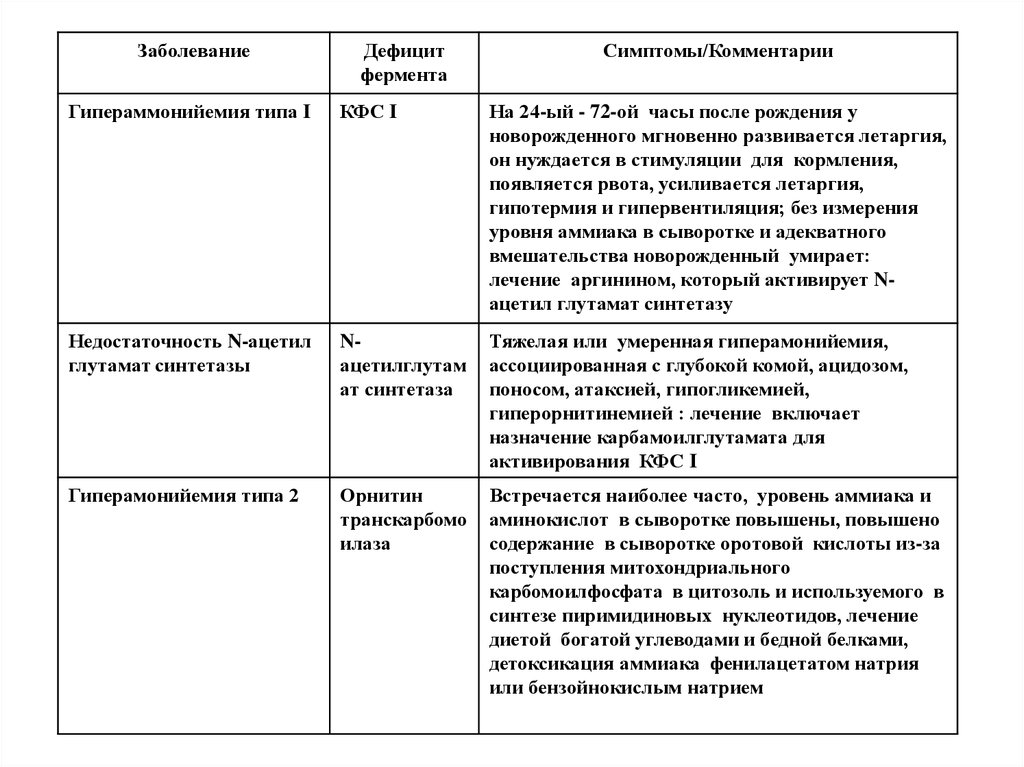
56. Врожденные дефекты ЦСМ
Врожденные дефекты ферментов с 1 по 5.Чем ближе ферментный блок к аммиаку,
тем тяжелее клиническая картина.
При недостаточности 1 и 2 ферментовярко выраженная гипераммнионемия с
летальным исходом.
При недостаточности 3- ферментаповышено содержание цитруллинацитрулинемия.
При недостаточности 4- фаргининоянтарная ацидурия.
57.
ЗаболеваниеДефицит
фермента
Симптомы/Комментарии
Гипераммонийемия типа I
КФС I
На 24-ый - 72-ой часы после рождения у
новорожденного мгновенно развивается летаргия,
он нуждается в стимуляции для кормления,
появляется рвота, усиливается летаргия,
гипотермия и гипервентиляция; без измерения
уровня аммиака в сыворотке и адекватного
вмешательства новорожденный умирает:
лечение аргинином, который активирует Nацетил глутамат синтетазу
Недостаточность N-ацетил
глутамат синтетазы
Nацетилглутам
ат синтетаза
Тяжелая или умеренная гиперамонийемия,
ассоциированная с глубокой комой, ацидозом,
поносом, атаксией, гипогликемией,
гиперорнитинемией : лечение включает
назначение карбамоилглутамата для
активирования КФС I
Гиперамонийемия типа 2
Орнитин
транскарбомо
илаза
Встречается наиболее часто, уровень аммиака и
аминокислот в сыворотке повышены, повышено
содержание в сыворотке оротовой кислоты из-за
поступления митохондриального
карбомоилфосфата в цитозоль и используемого в
синтезе пиримидиновых нуклеотидов, лечение
диетой богатой углеводами и бедной белками,
детоксикация аммиака фенилацетатом натрия
или бензойнокислым натрием
58.
Гиперамонийемия типа 2
Орнитин
транскарбомо
илаза
Встречается наиболее часто, уровень аммиака и
аминокислот в сыворотке повышены, повышено
содержание в сыворотке оротовой кислоты из-за
поступления митохондриального
карбомоилфосфата в цитозоль и используемого
в синтезе пиримидиновых нуклеотидов, лечение
диетой богатой углеводами и бедной белками,
детоксикация аммиака фенилацетатом натрия
или бензойнокислым натрием
Классическая
цитруллинемия
Аргининосук
цинат
синтетаза
Эпизодическая гиперамонийемия, рвота,
летаргия, атаксия, возможна кома: лечение
назначением аргинина, для увеличения
экскреции цитруллина, и бензойнокислого
натрия для детоксикации аммиака
Аргининосукци
нат ацилурия
Аргининосук
цинат лиаза
(аргининосук
циназа)
Эпизодические симптомы подобны классической
цитруллинемии , повышение в плазме и
спинномозговой жидкости аргининосукцината:
лечение аргинином и бензойнокислым натрием
Гипераргинине
мия
Аргиназа
Редкое заболевание, прогрессивная
спастическая квадриплегия и олигофрения,
аммиак и аргинин повышены в спинномозговой
жидкости и сыворотке, аргинин, лизин и
орнитин повышены в моче: лечение включает
диету с незаменимыми аминокислотами (кроме
аргинина), низко белковая диета
59.
60. Регуляция ЦСМ
Краткосрочная: на уровень 1-гоферменты, который направляет азот
ГЛУ( а значит и всех а/к) в
карбомоилфосфат
Долгосрочная: определяется
уровнем липолиза, Ацетил-SКоА.
Последний при недостатке
углеводов, яв-ся наиболее
предпочтительным субстратом, чем
липиды.
61.
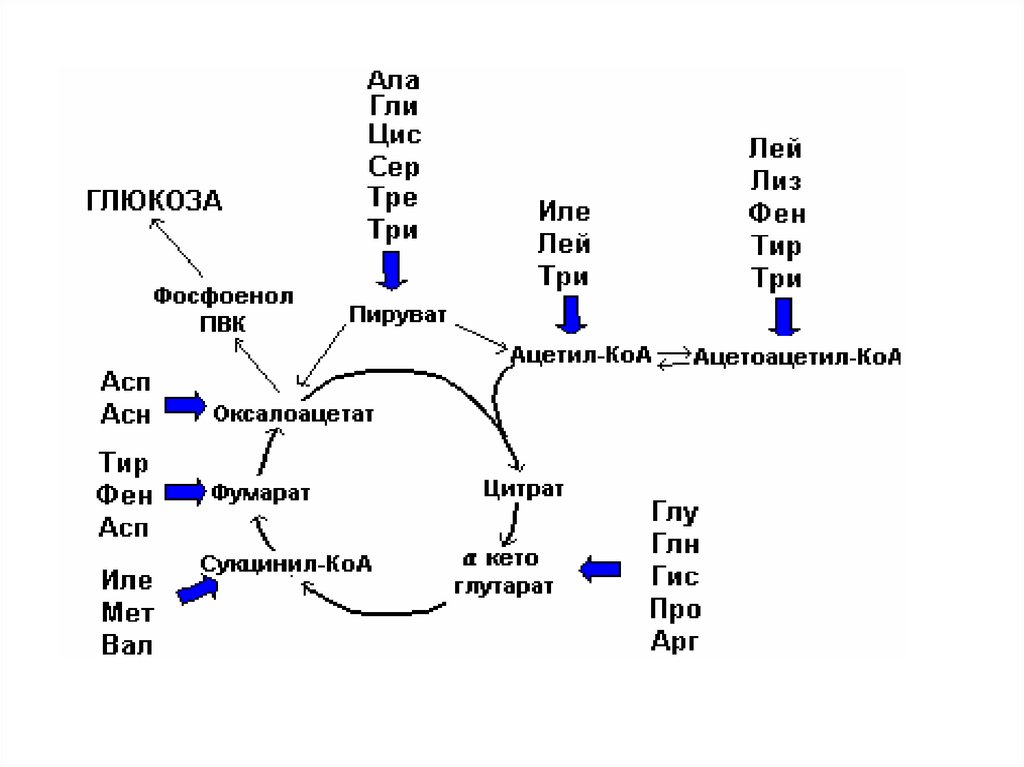
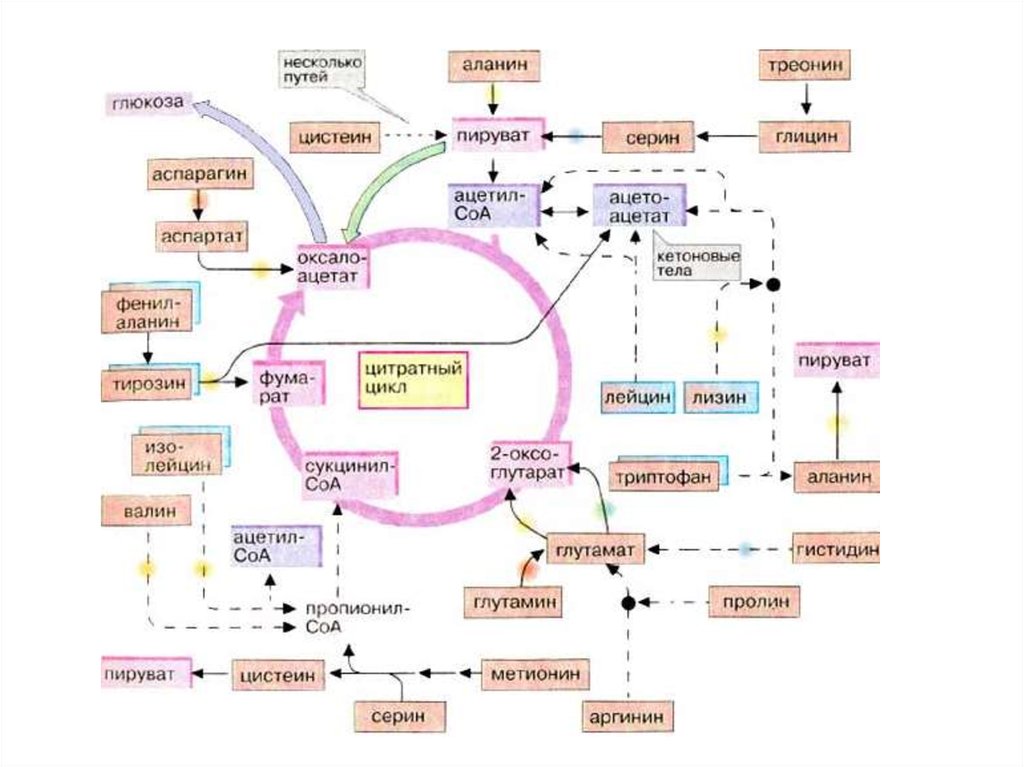
62. Пути вступления аминокислот в ЦТК
• В процессе детоксикации амиака ,образующиес углеродные скелеты
могут использоваться в различных
потребностях клеток.
• Роль а/к в энергетическом обмене
при нормальных условиях невелика,
т.к. основными энергетическими
субстратами яв-ся все же липиды и
углеводы.
63.
Но в экстремальныхситуациях (диабет, голод,
алкогольная интоксикация)
роль аминокислот резко
возрастает. На первых этапах
главным субстратом яв-ся
мобилизованные при распаде
гликогена углеводы (первые
24 часа).
64.
Дальше, после истощениязапасов гликогена,
происходит переключение
метаболизма на
утилизацию липидов (1015 дней), с
одновременным
включением ГНГ.
65.
После истощениязапасов липидов
наступает терминальная
стадия- утилизация а/к- увеличение аммиака в
крови---- увеличению
интоксикации---- кома---- смерть.
66.
67.
68.
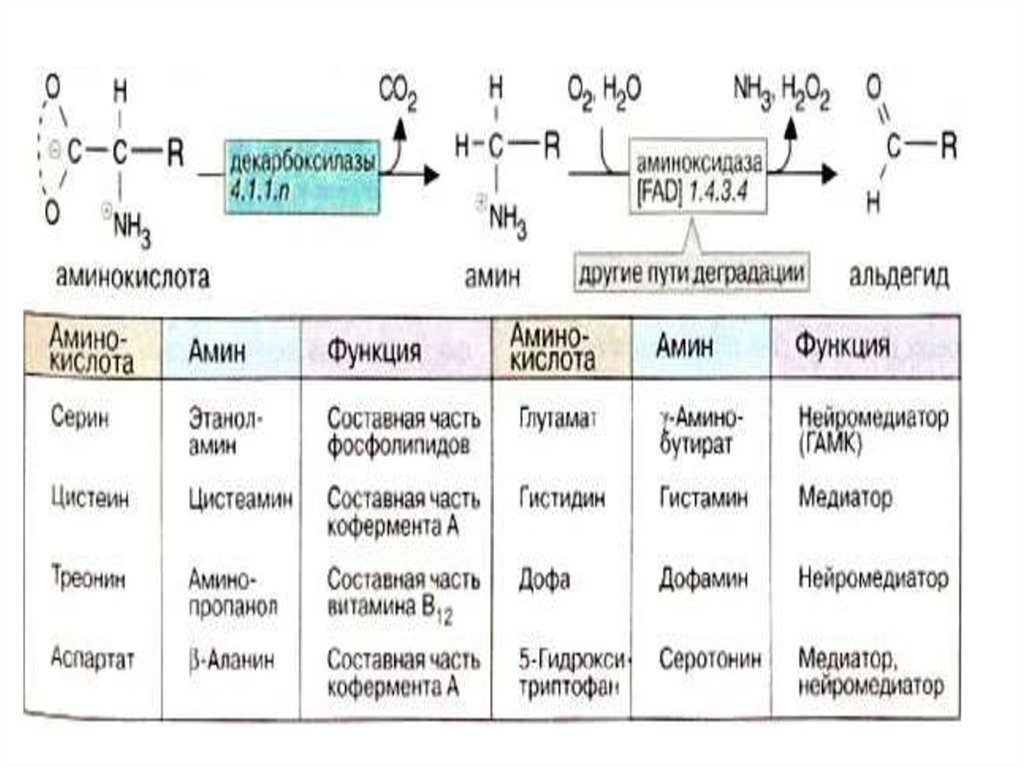
Реакции декарбоксилированияаминокислот лежат в основе
образования биогенных аминов.
Продукты декарбоксилирования
ароматических аминокислот и
глутаминовой кислоты выполняют
роль нейромедиаторов,и многие
лекарственные препараты,
используемые для лечения
неврологических
69.
и психических заболеванийоказывают влияние на
метаболизм указанных
соединений. Активная форма
витамина В6 является
коферментом декарбоксилаз,
катализирующих эти реакции.
Реакции декарбоксилирования
необратимы
70.
71.
72.
73.
Норадреналин - основнойнейромедиатор симпатических
постганглионарных окончаний. И
норадреналин и его
метилированное производное,
адреналин накапливаются в
синаптических отделах
нейронов, которые их
секретируют.
74.
Обмен катехоламиновпроисходит при участии
катехоламин-Oметилтрансферазы, (КOMT) и
тираминазы, (MAO). Оба эти
фермента широко
распространены в организме,
хотя КОМТ не обнаружен в
нервных окончаниях
75.
Нарушения метаболизмадофамина служат причиной
болезни Паркинсона.
Из триптофана через
промежуточный 5гидрокситриптофан
образуется серотонин,
соединение с широким
спектром действием
76.
Из триптофана черезпромежуточный 5гидрокситриптофан
образуется серотонин,
соединение с широким
спектром действием
77. Синтез серотонина, мелатонина
78.
Серотонин присутствует всамых высоких
концентрациях в тромбоцитах
и в желудочно-кишечном
тракте. Меньшие количества
найдены в ядрах мозга
(лимбическая система, новая
кора) и сетчатке.
79.
После высвобождения изсеротонинергических нейронов,
большая часть высвобождаемого
серотонина возвращается
активно секретируемыми клетками.
Некоторые антидепрессанты
ингибируют этот механизм,
способствуя более длительному
пребыванию серотонина в
синаптической щели.
80.
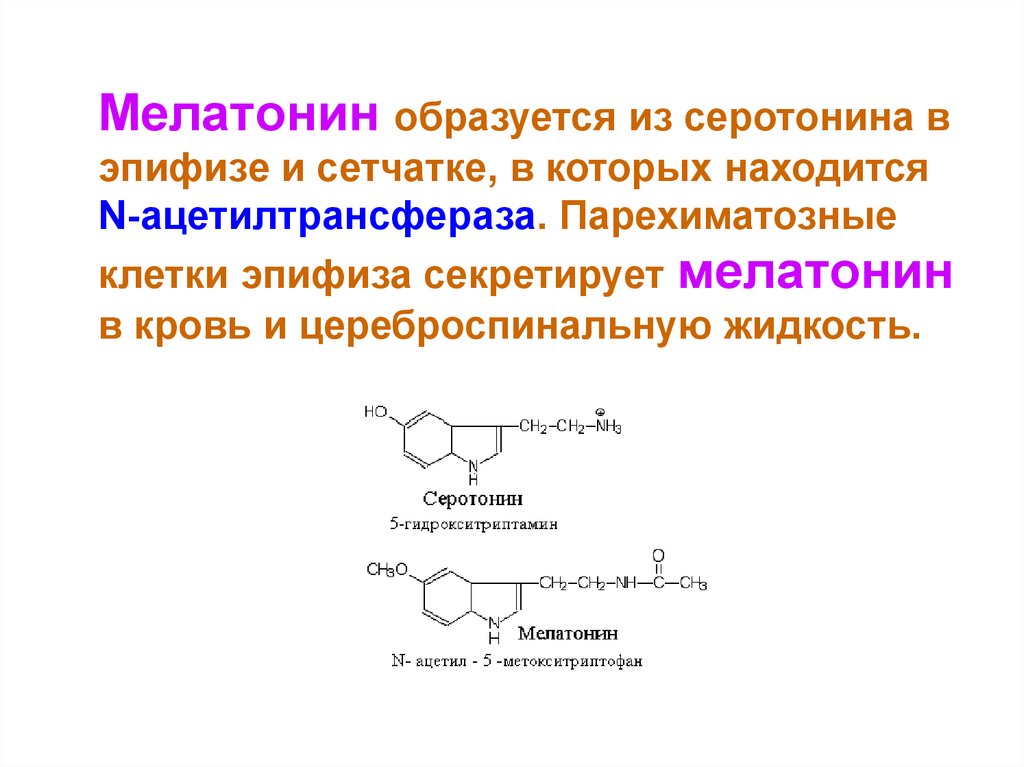
Мелатонин образуется из серотонина вэпифизе и сетчатке, в которых находится
N-ацетилтрансфераза. Парехиматозные
клетки эпифиза секретирует мелатонин
в кровь и цереброспинальную жидкость.
81.
Синтез и секрециямелатонина увеличиваются в
течение темнового периода
дня и поддерживаются в
низком уровне в течение
светлых часов.
82.
Эти суточные колебания синтезамелатонина регулируются с
участием норадреналина,
секретируемого постганглионарными
симпатическими нервами,
иннервирующими эпифиз.
Мелатонин в свою очередь
ингибирует синтез и секрецию
других медиаторов (дофамин и
ГАМК).
83.
84.
Гистамин образуется путемдекарбоксилирования
гистидина.
Гистамин играет важную
роль в о многих
патологических процессах.
Он образуется из гистидина
путем декарбоксилирования.
85.
Эту реакцию катализируетдекарбоксилаза ароматических Lаминокислот. Этот фермент не
обладает выраженной
субстратной
специфичностью и
катализирует также
декарбоксилирование ДОФА, 5гидрокситриптофана, фенилаланина,
тирозина и триптофана.
86.
Декарбоксилаза in vitro и in vivoингибируется аметиламинокислотами,
применяемыми в клинике в
качестве гипотензивных средств.
В большинстве клеток имеется
также специфическая
декарбоксилаза гистидина.
87.
На первом этапе амин окисляется спередачей водородов на ФАД и
образованием аммиака и
соответствующего альдегида, а на
втором этапе восстановленный
кофермент окисляется
молекулярным кислородом с
образованием пероксида водорода.
88.
Окислительное дезаминированиеR-CH-COOH
NH 2
Флавин
R-CH-COOH
NH
Флавин-Н2
H2O
NH 3
H 2O2
Каталаза
O2
R
C=O
COOH
H 2O + 1 /2O2
89.
Ингибиторы МАО находятприменение при лечении
гипертонической болезни,
депрессивных состояний и
т.д.
90.
Подобно другим биогеннымаминам, гистамин разрушается
путем окислительного
дезаминирования при помощи
моноаминоксидазфлавинзависимых ферментов,
локализованных
преимущественно в
митохондриях (МАО). Реакция
необратима и протекает в два
этапа.
91.
В головном мозге концентрацияаминокислот почти в 8
раз
выше, чем в плазме крови, и
существенно выше, чем в
печени. В особенности высоким
является уровень глутамата
(примерно 5-10 мМ) и
аспартата (2-3 мМ).
92.
В тканях мозга интенсивнопротекают метаболические
превращения аминокислот,
такие, как окислительное
дезаминирование,
трансаминирование,
модификация боковой цепи и др.
93.
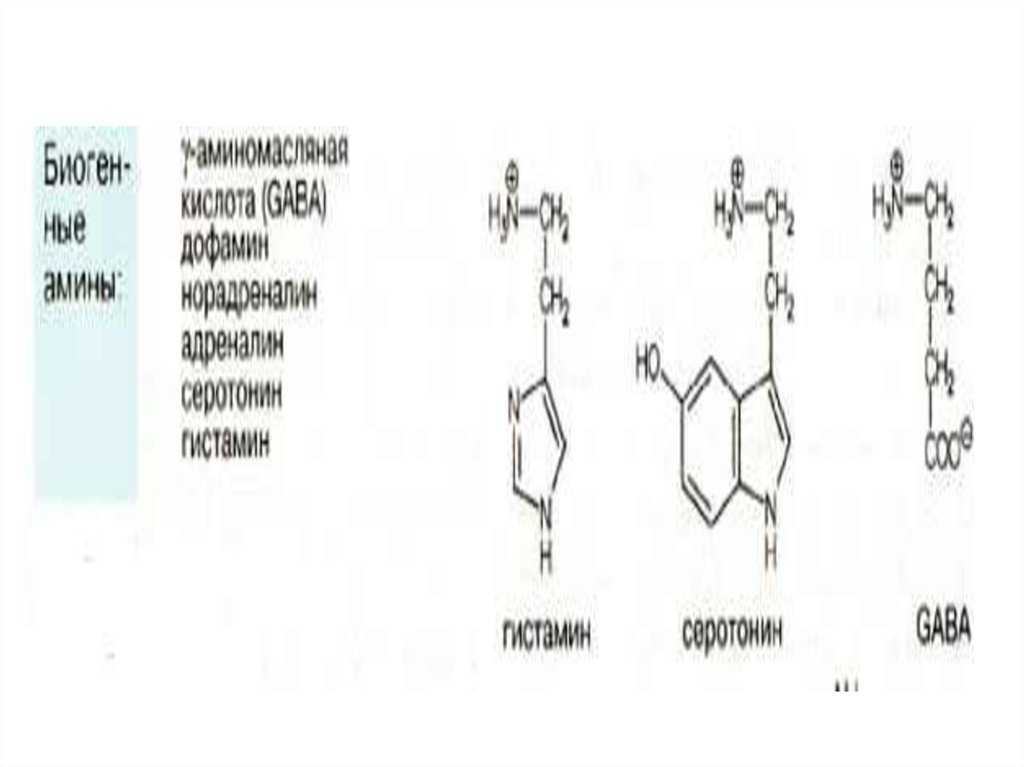
g аминомасляная кислотаобразуется путем
декарбоксилирования Lглутамата. Эта реакция
катализируется
пиридоксальфосфат-зависимым
ферментом L-глутамат-
декарбоксилазой.
94.
Она локализована главнымобразом в нейронах
центральной нервной
системы, преимущественно в
сером веществе головного
мозга.
95.
В особенности важной длянормального функционирования
головного мозга является
реакция декарбоксилирования, в
результате которой образуется γаминомасляная кислота (γаминобутират) (ГАМК, GABA)
(предшественник — глутамат) и
биогенные амины.
96.
Биосинтез и деградациюглутамата можно
рассматривать, как
побочный путь цитратного
цикла (ГАМК-шунт), который
в отличие от основного цикла
не приводит к синтезу
гуанозин-5'-трифосфата.
97.
98.
ГАМК-шунт характерен дляклеток центральной нервной
системы, но не играет
существенной роли в других
тканях.
99.
Декарбоксилирование L-глутамата - это основной путь
биосинтеза g-аминомасляной
кислоты. Возможно также ее
образованием из путресцина
(продукт дезаминирования
орнитина)
100.
Катаболизм g-аминобутиратаначинается с потери аминогруппы и
образования янтарного
полуальдегида. Последний может
быть восстановлен в gгидроксибутират при участии Lлактатдегидрогеназы, либо
окислиться с образованием
янтарной кислоты и затем в цикле
лимонной кислоты до СО2 и Н2О.
101.
ГАМК оказывает тормозящийэффект на деятельность ЦНС.
Ее препараты используют при
лечении заболеваний ,
сопровождающихся
возбуждением коры головного
мозга
102.
Глутамат, ГАМК, выполняютв нейронах функцию
медиаторов. Они хранятся в
синапсах и выделяются при
поступлении нервного импульса.
Переносчики индуцируют или
ингибируют потенциал действия,
контролируя тем самым
возбуждение соседних
нейронов.
103.
Эти аминокислотыобразуются в реакции
трансаминирования из
промежуточных метаболитов
цитратного цикла, 2оксоглутарата и
оксалоацетата
104.
Многие моноамины и катехоламиныинактивируются аминоксидазой
(моноаминоксидазой, "МАО")
путем дезаминирования с
одновременным окислением в
альдегиды. Следовательно,
ингибиторы МАО играют важную
роль при фармакологическом
воздействии на метаболизм
нейромедиаторов.
























































































 biology
biology








