Similar presentations:
Перекисное окисление липидов. Характеристика, продукты, биологическая и патофизиологическая роль
1. Перекисное окисление липидов
Характеристика, продукты, биологическаяи патофизиологическая роль
2.
Перекисное окисление липидов – свободнорадикальный цепнойпроцесс,
протекающий
в
биомембранах
и
липопротеинах,
сопровождается окислительной деградацией полиненасыщенных
жирных кислот (ПНЖК) с образованием свободнорадикальных и
молекулярных продуктов.
Свободнорадикальные реакции ПОЛ постоянно протекают во всех
организмах– от микроорганизмов до животных и человека.
Роль ПОЛ:
- обновление мембранных липидов
- поддержание структурного гомеостаза
- биосинтез биологически активных соединений (простагландинов,
тромбоксанов, лейкотриенов)
- функционирование мембранных ферментов
- экспрессия генов
- деление клеток
- регуляция апоптоза
- Чрезмерная активация ПОЛ приводит к развитию патологических
процессов (окислительный стресс).
3.
В 1956 г. Н.Н.Семёнов совместно с С.Хиншелвудом получили Нобелевскуюпремию по химии «За исследования механизма химических реакций, в
особенности за создание теории цепных реакций».
Сирил Норман Хиншелвуд
Академик Н.Н.Семёнов
4.
Тарусов Б.Н.Автор гипотезы о ведущей
роли свободнорадикальных
реакций ПОЛ в развитии
патологических процессов в
клетке
Владимиров Ю.А.
Бурлакова Е.Б.
5.
Эмануэль Н.М.Тарусов Б.Н.
Выдвинули идею о роли ПОЛ в происхождении и патогенезе
различных болезней. Это легло в основу концепции о СРО как
универсальном механизме в повреждении мембранных структур
клетки, а также окислительной модификации биомолекул при
различных патологических состояниях, действии экстремальных
факторов, а также при старении.
6.
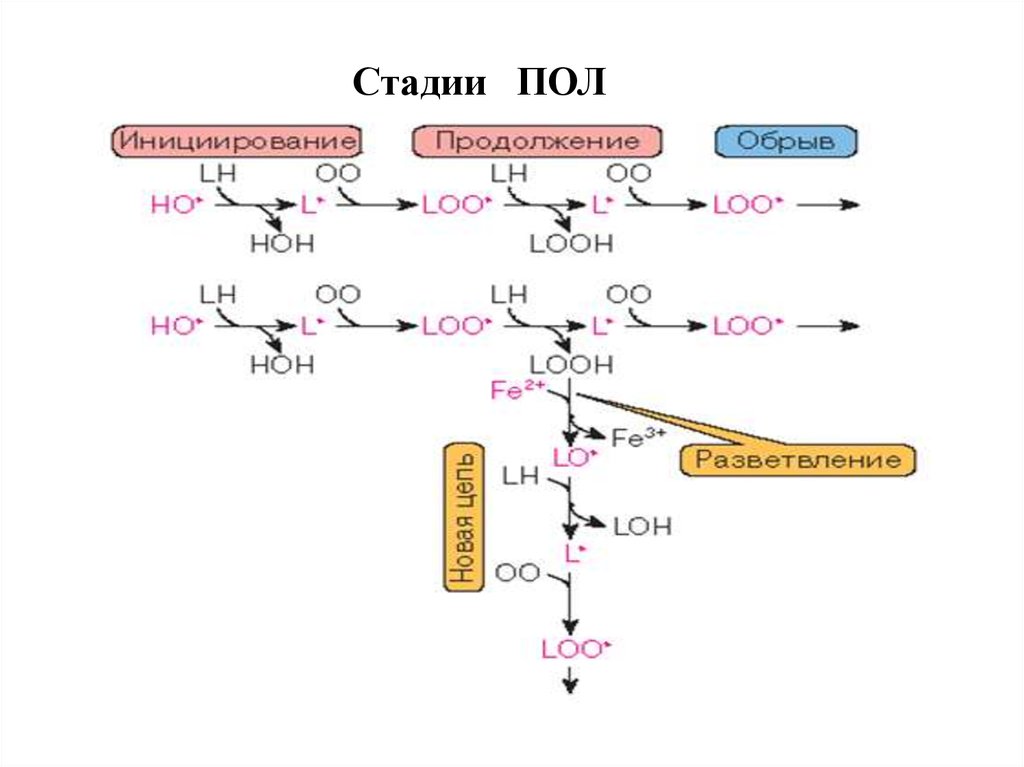
Общее уравнение свободнорадикальногоПОЛ имеет следующий вид:
(L• + LO•) + LH + O2 → (L• + LO•) +
LOOH + H2O
L•, LO• - липидные радикалы
LH полиненасыщенная
кислота (ПНЖК)
LOOH – гидроперекись липида
жирная
7. Важнейшие особенности ПОЛ:
1. О2 - зависимый процесс. О2 необходим для образованияАКМ, для инициации процесса, реакций продолжения и
разветвления цепи;
2. скорость процесса зависит не только от концентрации
исходных и конечных веществ, но и от содержания
промежуточных соединений – липидных радикалов;
3. большая зависимость ПОЛ от температуры среды
(Q10 > 5);
4.
скорость
ПОЛ
сильно
зависит
от
степени
ненасыщенности липидов;
5. ПОЛ инициируется путем отрыва атома водорода от атома
углерода в α-положении, т.е. соседнего с двойной связью;
6. по типу утилизации кислорода ПОЛ относится к
диоксигеназному пути окисления.
8.
Схема участия молекулярного кислорода вокислительных превращениях субстратов (S) в клетке
S восст
О2
S окисл
оксидазный путь О2
Н 2О
SH
монооксигеназный путь SOH Н 2О
SH
диоксигеназный путь SOOH
9.
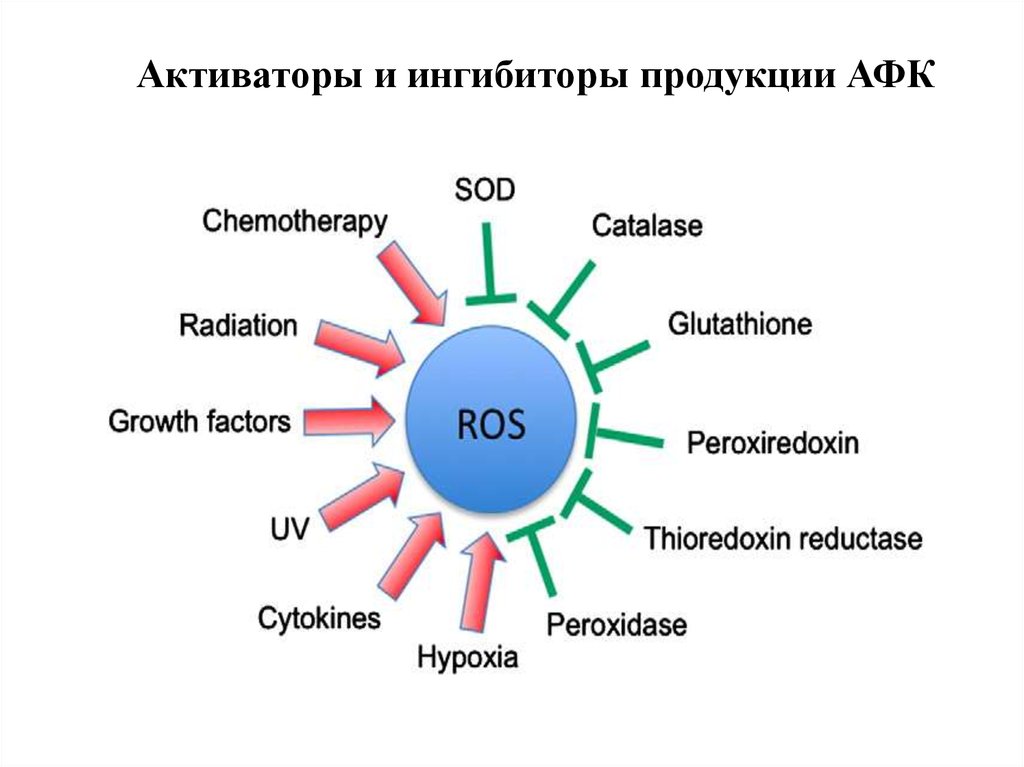
Активаторы и ингибиторы продукции АФК10.
11.
Основными "фабриками" по производству свободных радикалов в нашеморганизме служат маленькие продолговатые тельца внутри живой
клетки — митохондрии, самые главные её энергетические станции.
12.
В физиологических условиях более95% молекулярного кислорода
вовлекается в процесс окислительного
фосфорилирования в митохондриях.
Однако молекула кислорода способна
к неполному восстановлению, что
приводит к возникновению
чрезвычайно реакционно-способных
кислородных радикалов.
13.
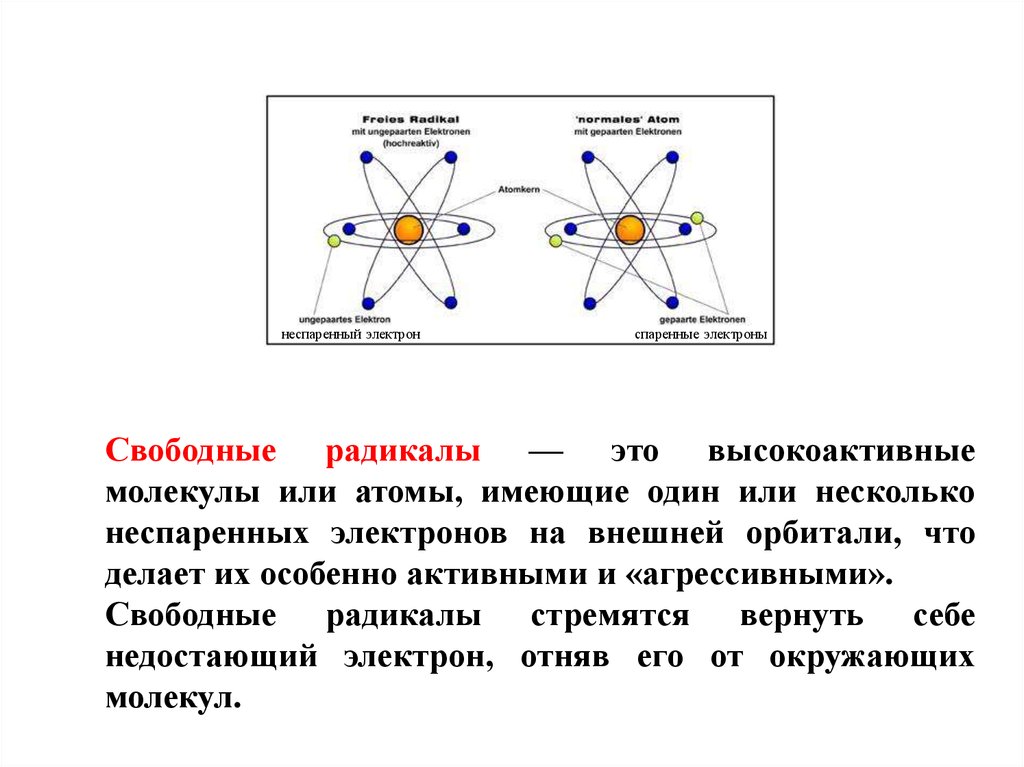
неспаренный электронспаренные электроны
Свободные радикалы — это высокоактивные
молекулы или атомы, имеющие один или несколько
неспаренных электронов на внешней орбитали, что
делает их особенно активными и «агрессивными».
Свободные радикалы стремятся вернуть себе
недостающий электрон, отняв его от окружающих
молекул.
14.
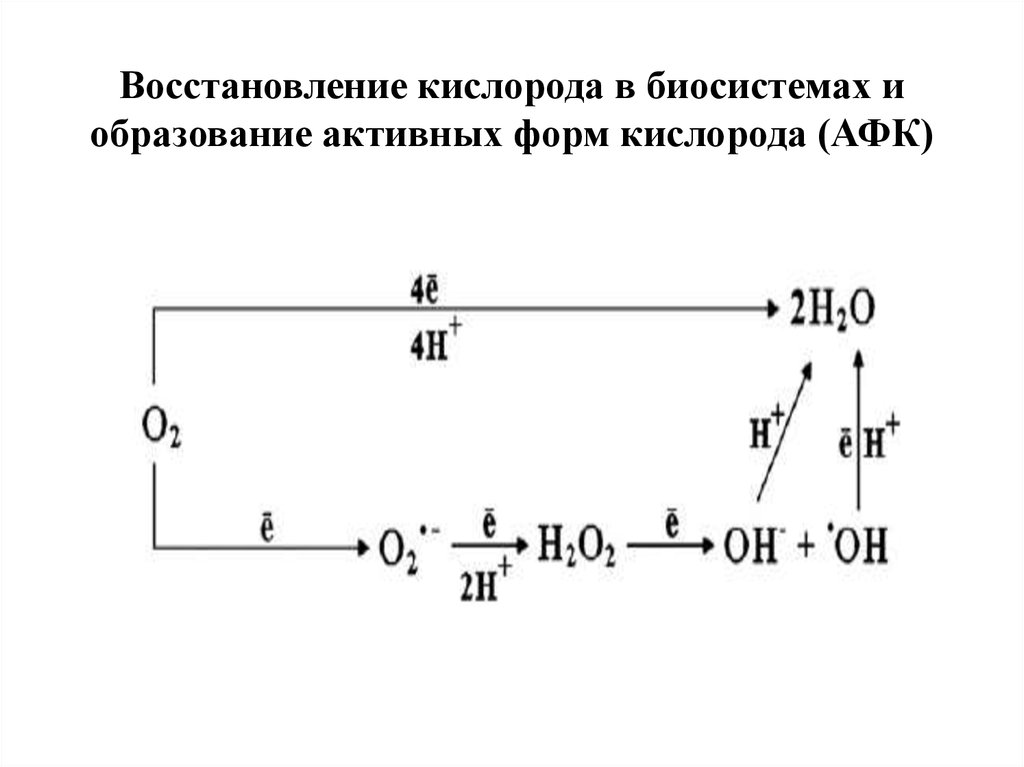
Восстановление кислорода в биосистемах иобразование активных форм кислорода (АФК)
15.
Активированные кислородные метаболиты (АКМ)- высокореакционные, преимущественно
радикальные кислородные соединения,
образующиеся в живых организмах в результате
неполного восстановления молекулярного
кислорода или изменения спина одного из его
электронов, находящихся на внешних орбиталях.
Обнаружено от 300 до 800 различных органических
радикалов: радикалы липидов, белков,
низкомолекулярных пептидов, нуклеиновых
кислот, фенолов, неорганических молекул
16.
Меньщикова Е.Б. и др., 200617.
Владимиров Ю.А., 200018.
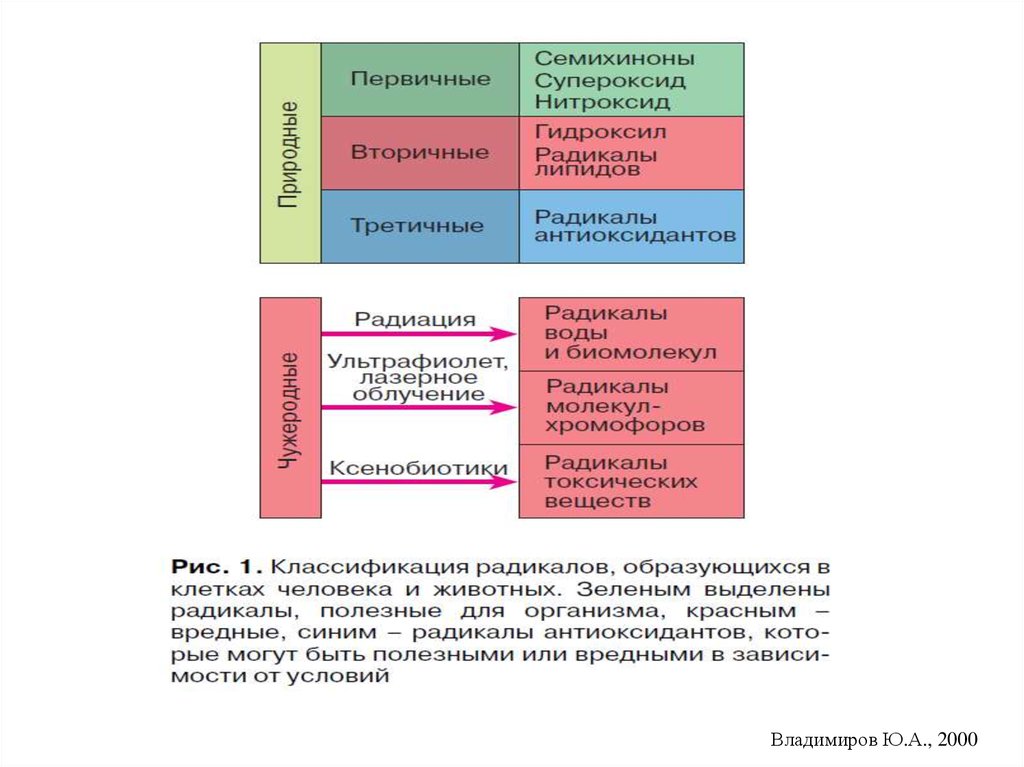
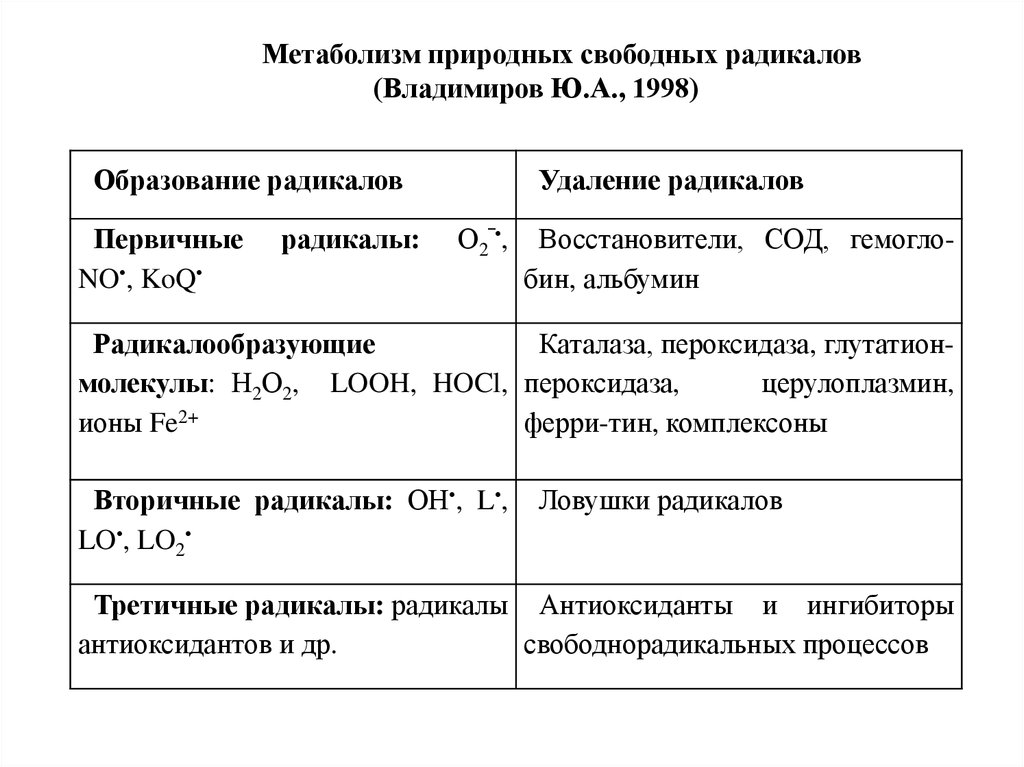
Метаболизм природных свободных радикалов(Владимиров Ю.А., 1998)
Образование радикалов
Первичные
NO•, KoQ
радикалы:
Удаление радикалов
О2‾•,
Восстановители, СОД, гемоглобин, альбумин
Радикалообразующие
Каталаза, пероксидаза, глутатионмолекулы: Н2О2, LOOH, HOCl, пероксидаза,
церулоплазмин,
ионы Fe2+
ферри-тин, комплексоны
Вторичные радикалы: ОН•, L•,
LO•, LO2
Ловушки радикалов
Третичные радикалы: радикалы Антиоксиданты и ингибиторы
антиоксидантов и др.
свободнорадикальных процессов
19.
Свободные радикалы разделяют натретичные (Владимиров Ю.А.).
первичные,
вторичные и
Первичные свободные радикалы постоянно образуются в процессе
жизнедеятельности организма в качестве средств защиты против
бактерий, вирусов, чужеродных и опухолевых клеток. Так, фагоциты
выделяют и используют свободные радикалы в качестве оружия
против микроорганизмов и раковых клеток.
Вторичные радикалы, в отличие от первичных, не выполняют
физиологически полезных функций.
Напротив, они оказывают разрушительное действие на клеточные
структуры, стремясь отнять электроны у «полноценных» молекул,
вследствие чего «пострадавшая» молекула сама становится
свободным радикалом (третичным), но чаще всего слабым, не
способным к разрушающему действию.
20.
Классификация АКМ1. Активные формы кислорода (АФК) – продукты одно, двух- и трехэлектронного восстановления молекулярного кислорода (О2•‾, НО2•, Н2О2, ОН•) или
изменения спина одного из электронов внешней орбитали (1О2).
2. Гипогалогениты - активные формы галогенов (АФГ) - (HOCl, HOBr, HOI,
HOSCN) – продукты ферментативной реакции перекиси водорода и галогенов,
которая катализируется миелопероксидазой, эозинпероксидазой,
лактопероксидазой. Маркеры воспаления.
3. Оксид азота NO• и его метаболиты - активные формы азота (АФА) - (NO2•,
NO+, NO‾,ONOO‾, S-нитрозотиолы). Физиологические функции NO•: регуляция
тонуса сосудов (эндотелиальный фактор расслабления), медиатор нового типа,
бактерицидное и противораковое действие.
4. Липидные радикалы (L•, LO•, LO2•) - образуются при протекании ПОЛ, при
высоких концентрациях - цитотоксическое действие, при стационарных
концентрациях - регуляторы биологических процессов.
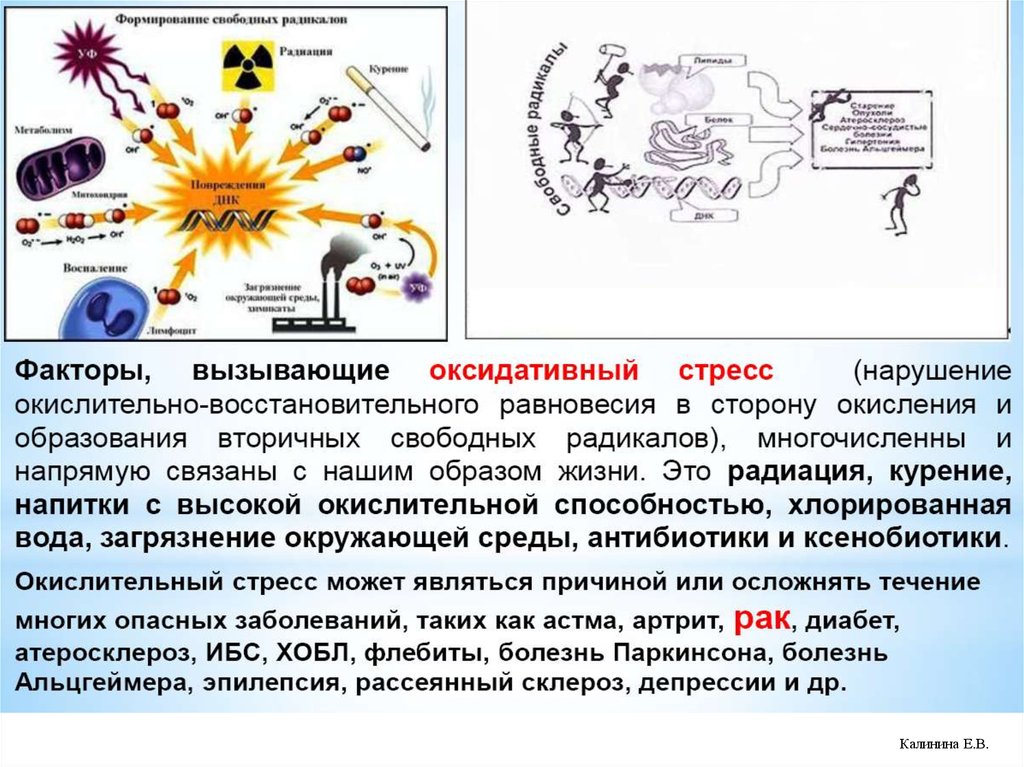
21.
Окислительный стресс (ОС) - состояние сдвигадинамического равновесия в системе
прооксиданты↔антиоксиданты (ПОЛ↔АО) в сторону
усиления свободнроадикального окисления (СРО) на фоне
нарушения работы антиоксидантной системы.
В механизмах ОС выделяют:
- собственно ОС (АФК↑);
- нитрозильный стресс (АФА↑);
- галогенирующий стресс (АФГ↑)
- карбонильный стресс (АКС – альдегиды, кетоны ↑)
22.
Различные уровни АФК индуцируют различныеклеточные процессы:
низкие уровни АФК являются сигнальными молекулами,
митогенами или промоторами дифференциации и
пролиферации, высокие уровни АФК блокируют рост,
гиперпродукция АФК вызывает ОС, активирует апоптоз
23. АФК → ПОЛ↑ → окислительный стресс → гибель клетки
24.
25.
26.
Источники супероксидного анион-радикала (О2●▬)в клетке
1. Аутоокисление органических соединений (например,
гемоглобина).
2. Ксантиноксидаза, которая катализирует окисление
ксантина (гипоксантина) в мочевую кислоту.
3. ЭТЦ митохондрий (5-6% АФК).
4.ЭТЦ микросом (75% АФК)
5. НАДФН-оксидаза
Пути удаления О2●▬ в клетке
1. Супероксиддисмутазы
2.Низкомолекулярные антиоксиданты - α-токоферол,
аскорбат, мочевая кислота и др.
27.
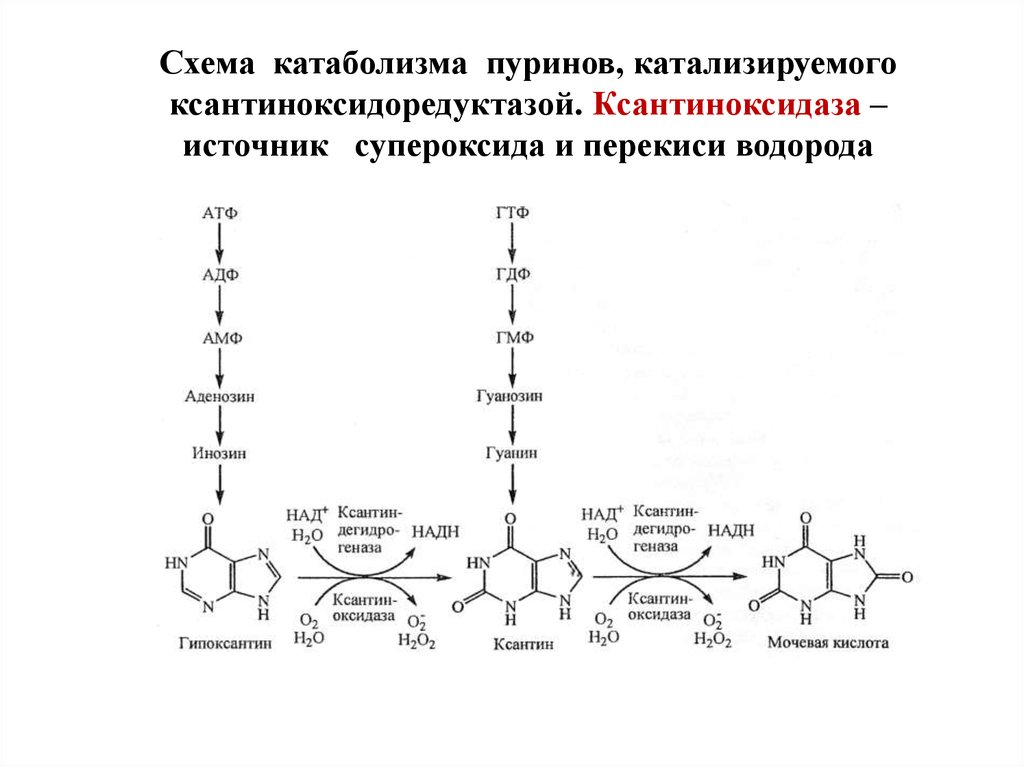
Ксантиноксидоредуктаза – источниксупероксида и перекиси водорода в клетке
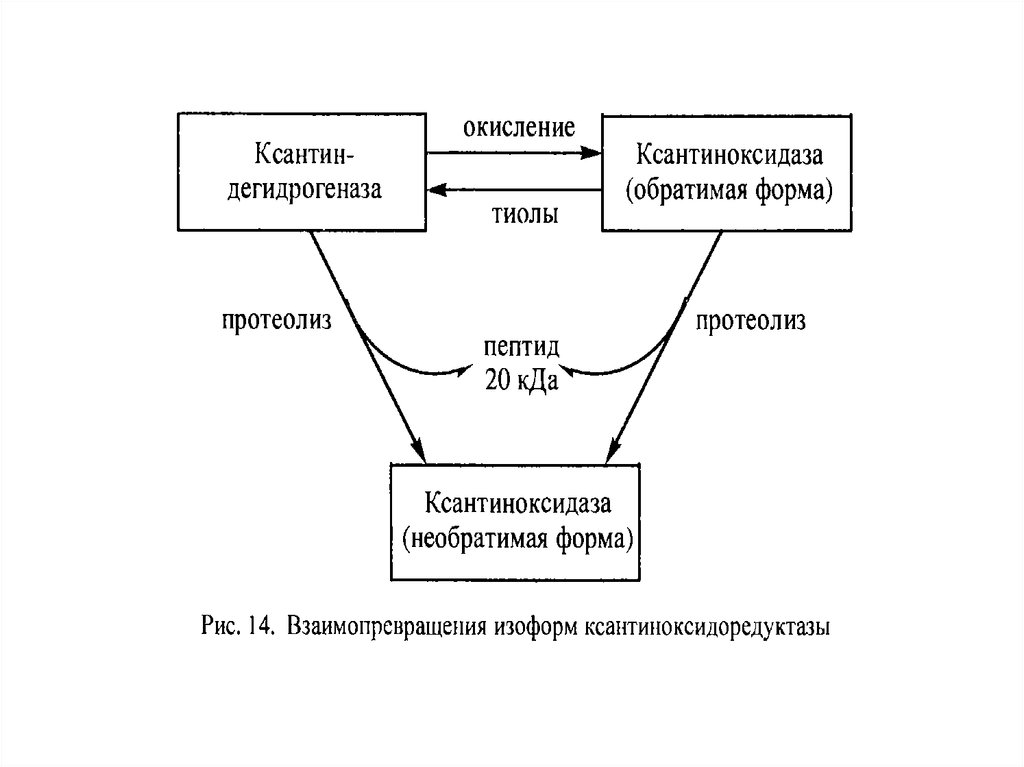
Ксантиноксидоредуктаза представлена двумя
изоформами: ксантиндегидрогеназой (КД) и
ксантиноксидазой (КО).
КД КО – это группа из двух близких по структуре Mo6+
и Fe2+-содержащих ферментов, локализованы в
большинстве органов, обладают широкой субстратной
специфичностью. Они окисляют пурины (через
гипоксантин и ксантин до мочевой кислоты), пиримидины,
адреналин, дегидрируют НАДН, НАДФН.
28.
Схема катаболизма пуринов, катализируемогоксантиноксидоредуктазой. Ксантиноксидаза –
источник супероксида и перекиси водорода
29.
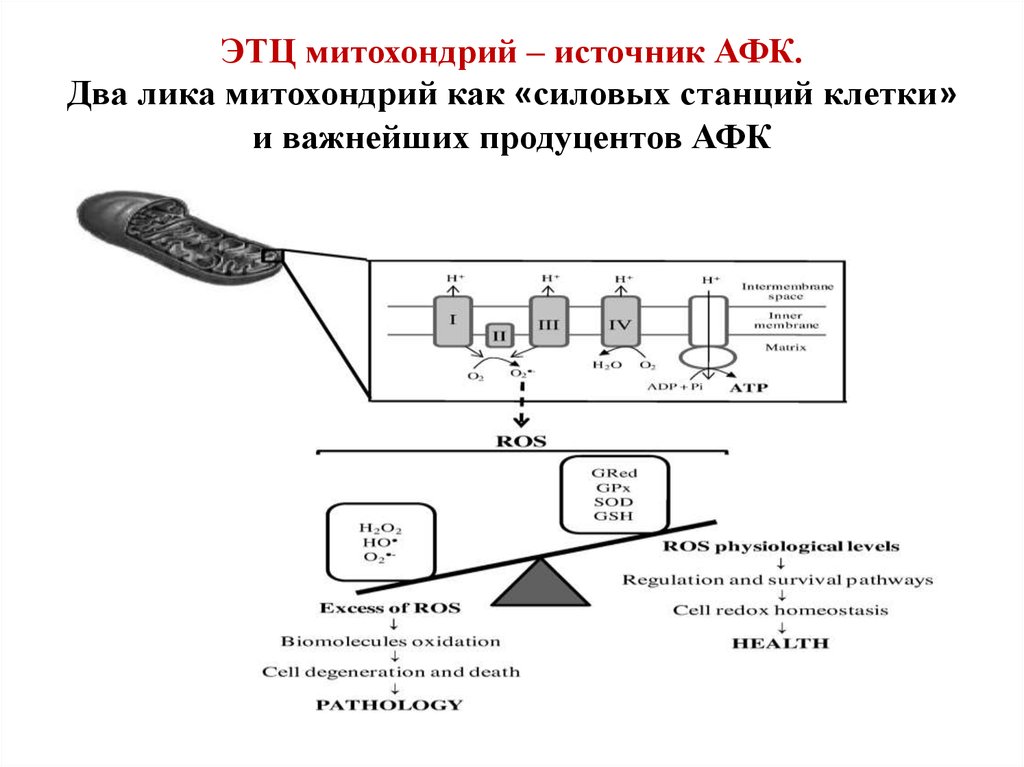
30. ЭТЦ митохондрий – источник АФК. Два лика митохондрий как «силовых станций клетки» и важнейших продуцентов АФК
31. Продукция супероксида и перекиси водорода в митохондриях
32. Роль митохондрий в индукции апоптоза. Открытие апоптоз-индуцирующегл фактора (AIF ) Гвидо Крэмером (1994)
33. Образование митоптического тельца и митоптоз
.34.
Конформационные болезни (КБ) – это заболевания,связанные с нарушнием механизмов нативной укладки
клеточных белков (фолдинг) в процессе их созревания и
выполнения ими физиологических функций.
При всех этих заболеваниях наблюдается
митохондриальная дисфункция, приводящая к
повышенной продукции АФК, которые способствуют
нарушению нормального фолдинга белков и накоплению
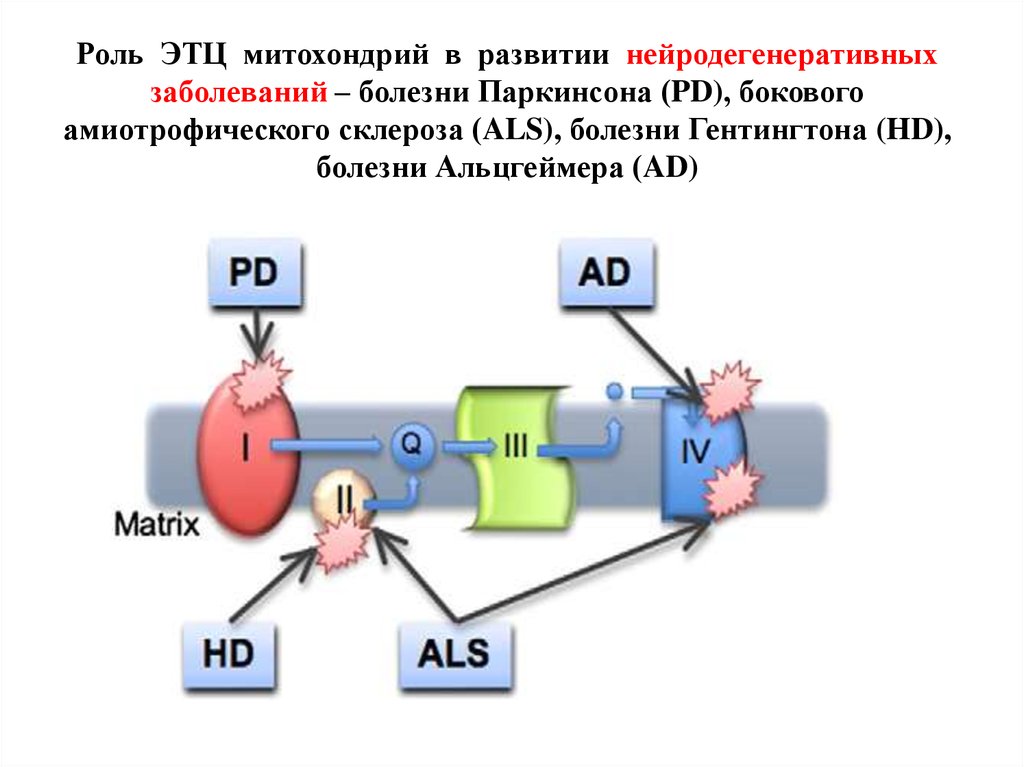
молекул с аномальной конформацией.
35. Роль ЭТЦ митохондрий в развитии нейродегенеративных заболеваний – болезни Паркинсона (PD), бокового амиотрофического склероза
(ALS), болезни Гентингтона (HD),болезни Альцгеймера (AD)
36. Болезнь Паркинсона – впервые описана Джеймсом Паркинсоном в 1817 году в «Эссе о дрожжательном параличе». Основу клинической
Болезнь Паркинсона – впервые описана Джеймсом Паркинсономв 1817 году в «Эссе о дрожжательном параличе». Основу
клинической картины БП составляет классическая триада:
акинезия (гипокинезия), мышечная ригидность и тремор покоя.
37.
38.
Нарушение метаболизма при болезни Паркинсона(Крыжановский и др., 2000):
1. митохондриальная дисфункция - нарушение I
ферментативного комплекса ЭТЦ (I ФК ЭТЦ);
2. энергетический дефицит нейрона;
3. усиление ПОЛ с образованием токсичных
продуктов;
4. Са-перегрузка нейронов, гибель клетки;
5. мутации в гене α-синуклеина → изменение
структуры белка α-синуклеина → его накопление
в нейроне → агрегация белка с образованием
телец Леви. В настоящее время α-синуклеин ключевой молекулярный маркер БП.
39.
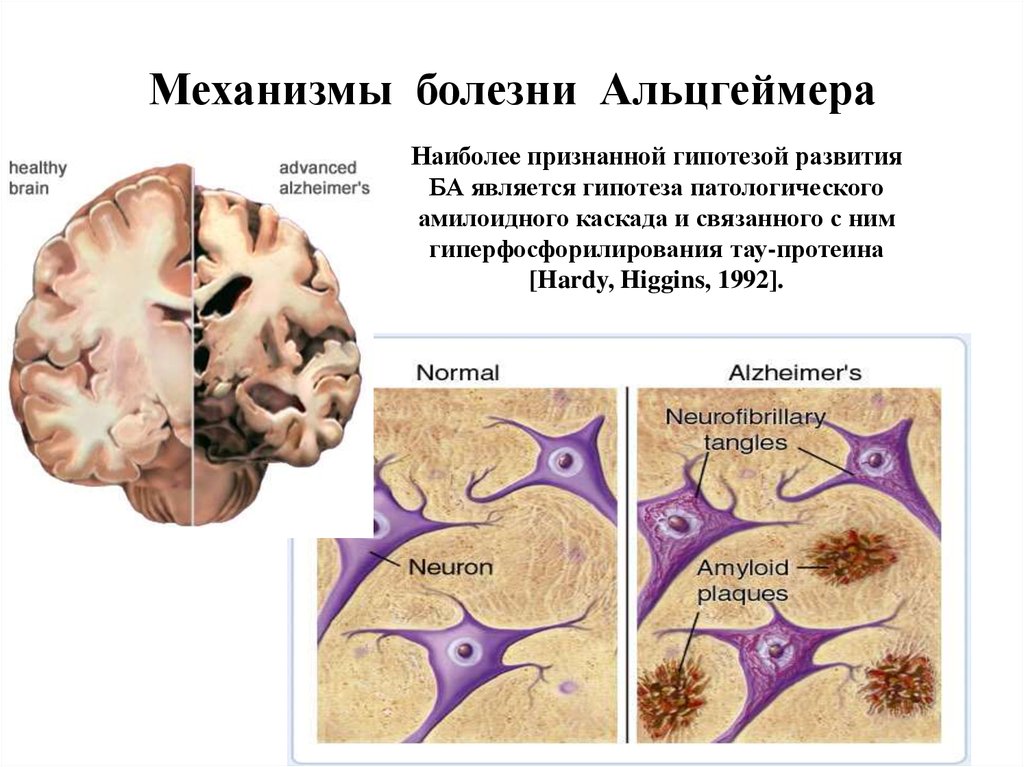
40. Механизмы болезни Альцгеймера
Наиболее признанной гипотезой развитияБА является гипотеза патологического
амилоидного каскада и связанного с ним
гиперфосфорилирования тау-протеина
[Hardy, Higgins, 1992].
41.
БолезньАльцгеймера
(сенильная
деменция)
—
нейродегенеративное заболевание, впервые описанное в 1906
году немецким психиатром Алоисом Альцгеймером. Как
правило, обнаруживается у людей старше 65 лет.
Общемировая заболеваемость на 2006 г. оценивалась в
26,6 млн. человек, а к 2050 году число больных может вырасти
вчетверо.
Патоморфологические и биохимические механизмы БА
связаны с:
- митохондриальной дисфункцией (нарушение IV ФК
ЭТЦ);
- накоплением β-амилоидного пептида и образованием
внеклеточных амилоидных
бляшек;
- гиперфосфорилованием тау-белка, ассоциированного с
микротрубочками,
и образованием
внутриклеточных
нейрофибриллярных клубочков. Гибель нейронов.
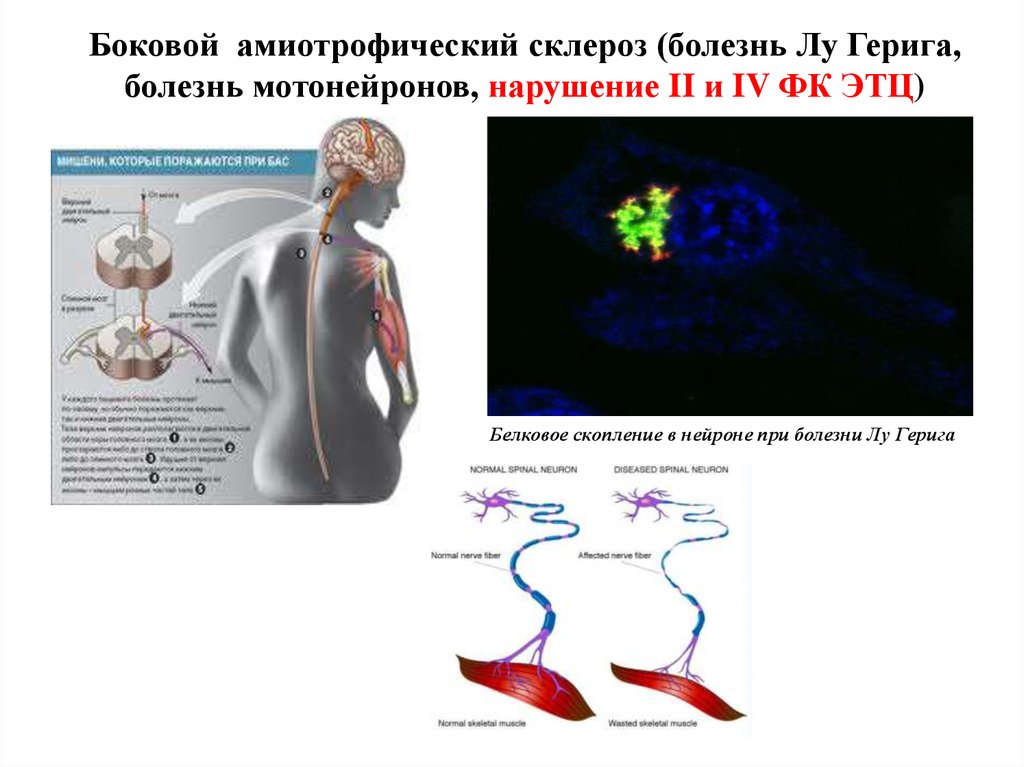
42. Боковой амиотрофический склероз (болезнь Лу Герига, болезнь мотонейронов, нарушение II и IV ФК ЭТЦ)
Белковое скопление в нейроне при болезни Лу Герига43.
Генри Луи Гериг, прозванный за выносливость«Железный конь» — выдающийся бейсболист. В
возрасте 36 лет он заболел боковым
амиотрофическим склерозом, который широко
известен в США и Канаде как «болезнь Лу
Герига».
Эксперт по черным дырам, Хокинг –
один из самых выдающихся
астрофизиков. Его достижения еще
более значимы потому, что ученый
страдает дегенеративным
генетическим заболеванием, которое
диагностировали, когда Стивену был
21 год; тогда будущему ученому врачи
обещали всего несколько лет. Но
Хокинг не только прожил более
полувека, но и сделал множество
фундаментальных открытий в
области теоретической астрофизики.
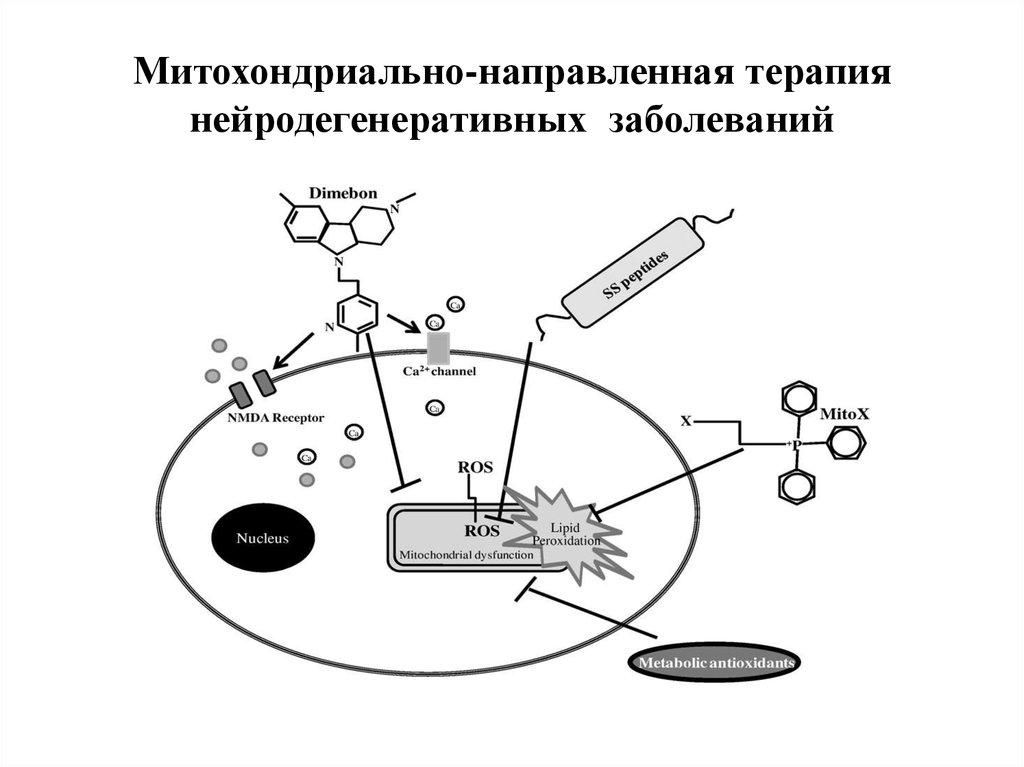
44. Митохондриально-направленная терапия нейродегенеративных заболеваний
45.
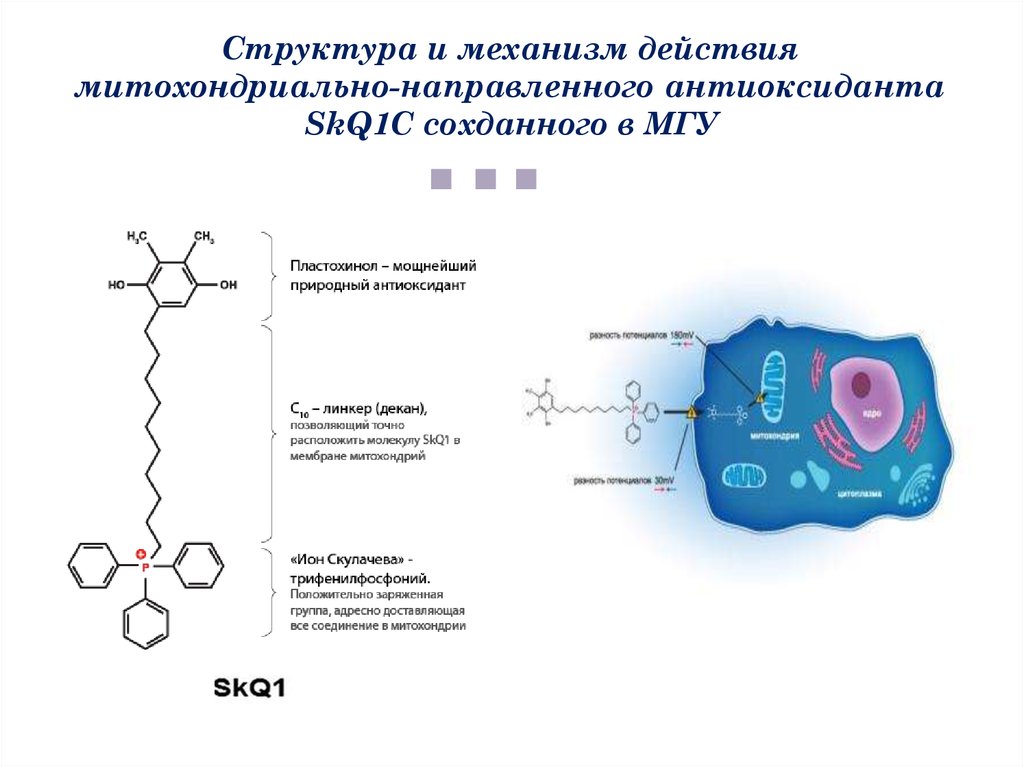
Структура и механизм действиямитохондриально-направленного антиоксиданта
SkQ1С сохданного в МГУ
46.
ЭТЦ микросом – источник АФКОбразование О2‾• и Н2О2 в системе микросомального
окисления (75% АФК)
Главной функцией монооксигеназ является детоксикация
ксенобиотиков путем гидроксилирования:
ХН + О2 + АН2 → ХОН + Н2О + А
47.
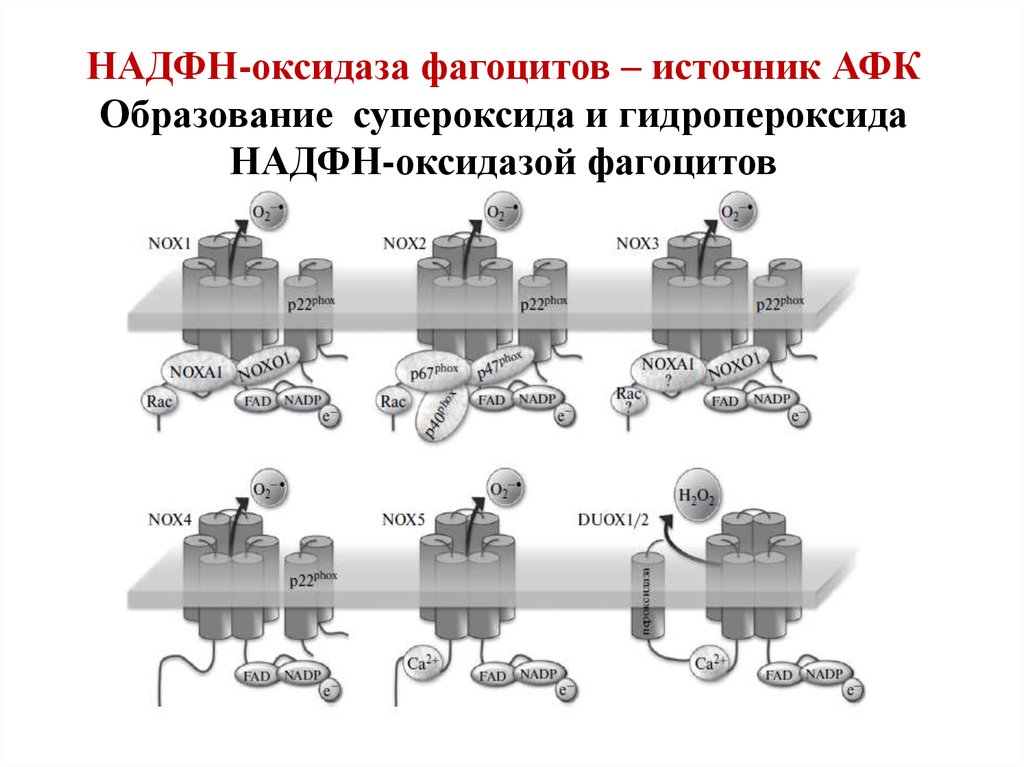
НАДФН-оксидаза фагоцитов – источник АФКОбразование супероксида и гидропероксида
НАДФН-оксидазой фагоцитов
48.
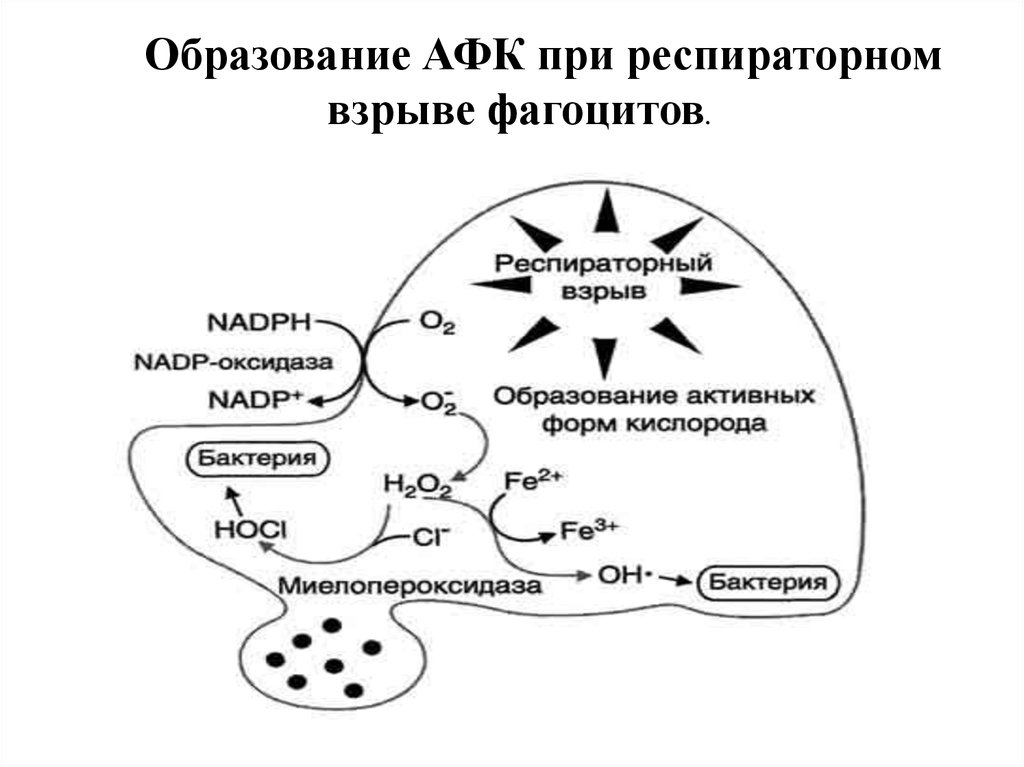
Образование АФК при респираторномвзрыве фагоцитов.
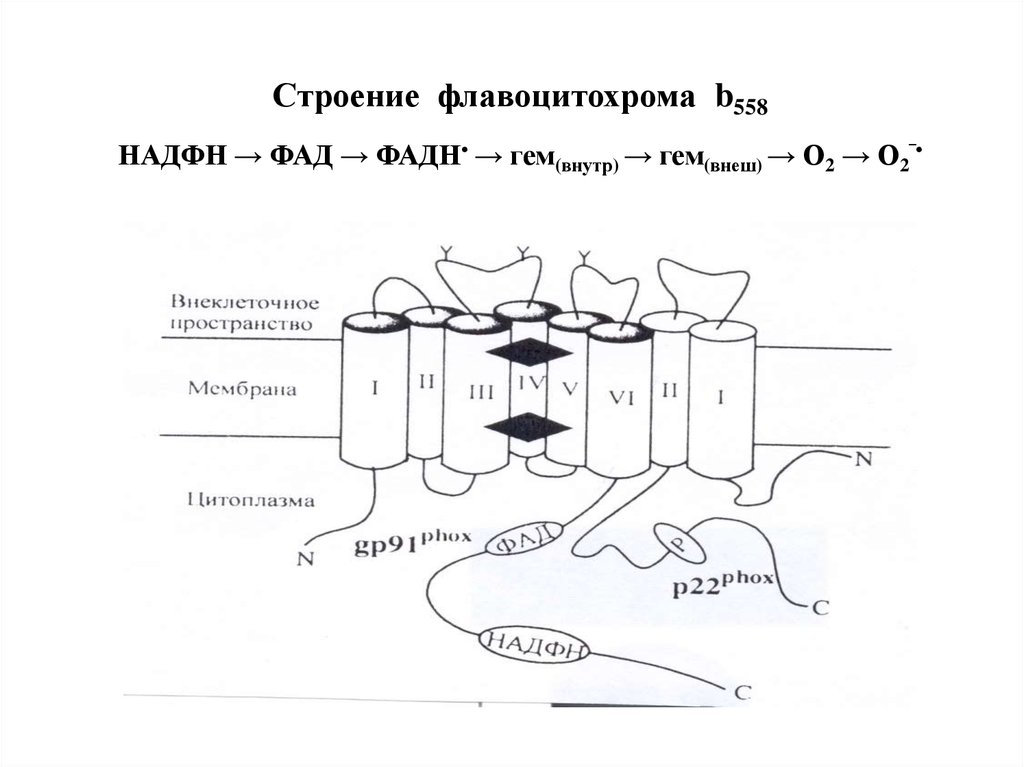
49. Структура НАДФН-оксидазы.
1) Состоит из 6 гетерогенных субъединиц: 2 мембраносвязанных (gp 91, p 22) и 4 цитозольных (p47, p40, р67,Rac), которые под влиянием стимуляторов объединяются в
ферментативный комплекс, генерирующий О2‾•.
2) Важнейший компонент НАДФН-оксидазы – цитохром b558
состоит из гликопротеина - -субъединицы (gp91) и αсубъединицы (р22). -субъединица (gp91) содержит 6
трансмембранных α-спиралей на N-конце и участки
гликозилирования. С-конец имеет сайты связывания ФАД и
НАДФН, в состав цит b558 входит 2 гема
50.
Строение флавоцитохрома b558НАДФН → ФАД → ФАДН• → гем(внутр) → гем(внеш) → О2 → О2‾
51. Роль НАДФН-оксидазы в патогенезе заболеваний.
• Хронический гранулематоз («детский фатальныйхронический гранулематоз»; 1:200-250 тыс.) –
генетические дефекты субъединиц НАДФН-оксидазы,
невозможность развития дыхательного взрыва лейкоцитов.
• Лимфогранулематоз (болезнь Ходжкина, злокачественная гранулема) – злокачественное заболевание
лимфоидной ткани, характерным признаком которого
является наличие гигантских клеток БерезовскогоШтернберга и ингибирование НАДФН-оксидазы.
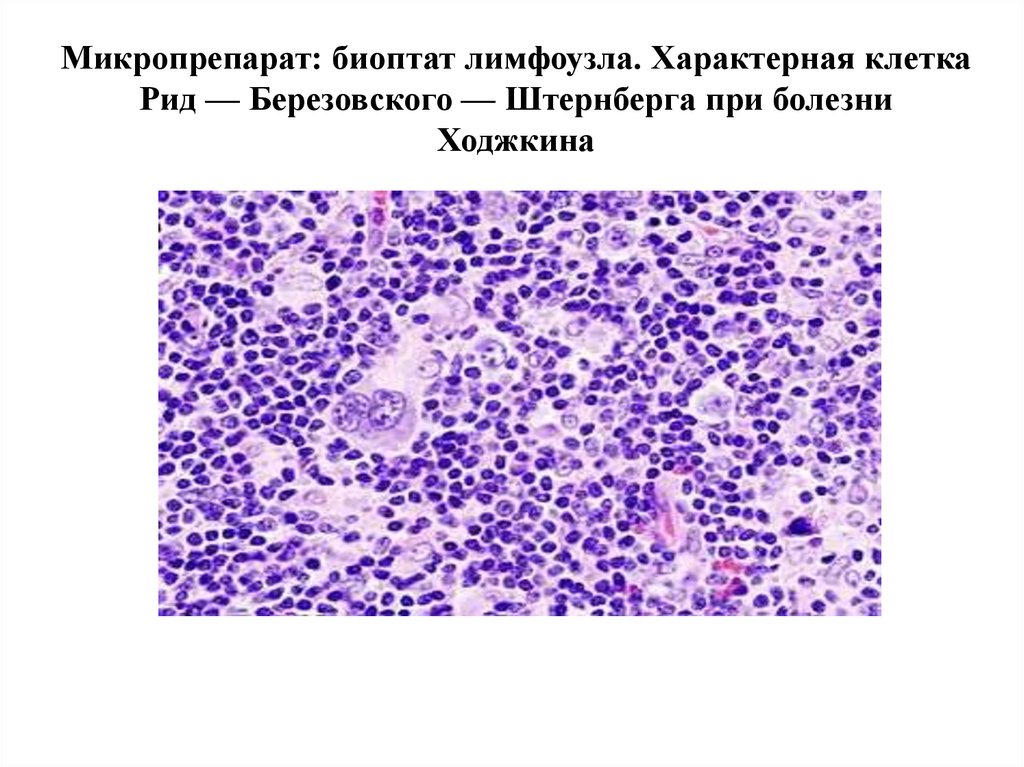
52.
Микропрепарат: биоптат лимфоузла. Характерная клеткаРид — Березовского — Штернберга при болезни
Ходжкина
53.
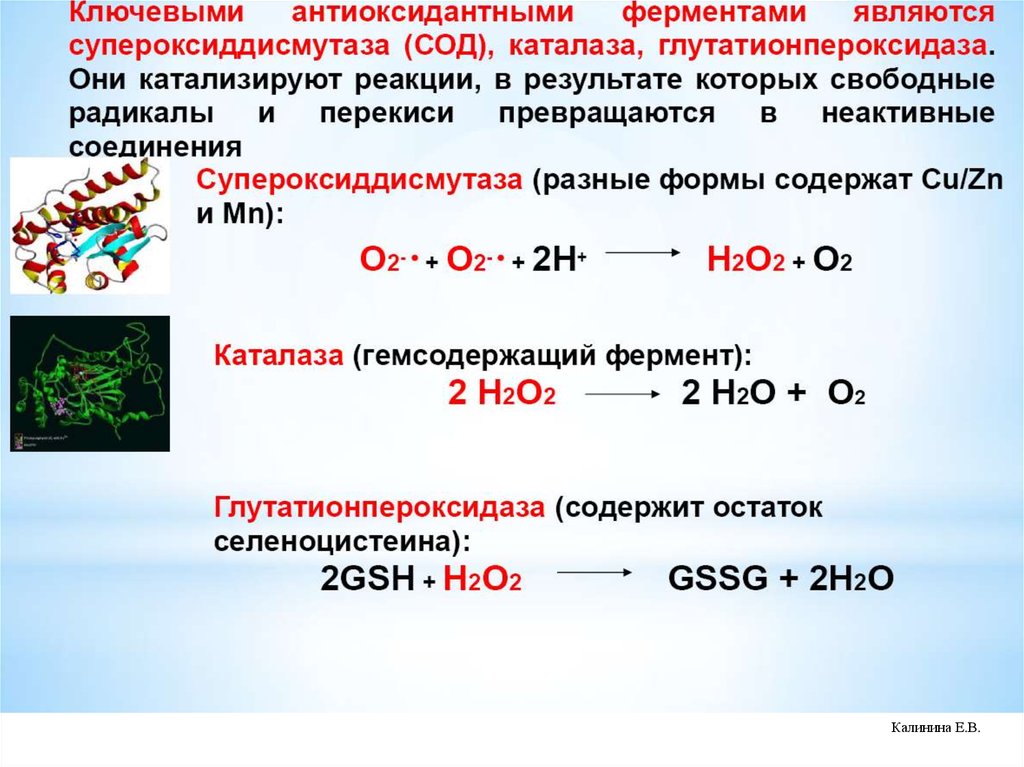
СупероксиддисмутазыСупероксиддисмутазы (СОД) – суперсемейство ферментов, относящихся
к классу оксидоредуктаз и катализирующих реакцию дисмутации
супероксидного анион-радикала с образованием перекиси водорода и
кислорода:
О2‾• + О2‾• → Н2О2 + 3О2
СОД присутствуют у всех аэробных организмов.
СОД (эритрокупреин) была открыта Мак-Кордом и Фридовичем в 1969 г.
СОД классифицируют по строению активного центра и структурной
организации молекулы.
Выделяют 3 семейства СОД:
- Cu,Zn-СОД (эукариоты, хлоропласты растений, бактерии)
- Fe-СОД, Mn-СОД (прокариоты, митохондрии эукариот, хлоропласты)
- Ni-СОД (Streptomyces, цианобактерии)
54.
Структура различных изоферментов СОД55. Источники перекиси водорода в клетке:
1.2.
3.
4.
5.
НАДФН-оксидаза
Электрон-транспортная цепь митохондрий
Электрон-транспортная цепь микросом
Ксантиноксидоредуктаза (КОР)
Супероксиддисмутаза
Пути удаления перекиси водорода:
1. Каталаза
2. Глутатионпероксидаза
3. Пероксиредоксины
56. Элиминация перекиси водорода в клетке осуществляется ферментативным путем:
1.Каталаза – гемсодержащий внутриклеточный фермент (тетрамер):2Н2О2 → 2Н2О + О2
2. Глутатионпероксидаза – конститутивное семейство ферментов,
которые способны восстанавливать органические и неорганические
гидропероксиды до гидроксисоединений или других восстановленных
эквивалентов. Имеются селеновые и неселеновые ГПО. Селеновые
ГПО содержат в активном центре селеноцистеин, который
вовлекается в каталитический цикл.
2GSH + H2O2 → GSSG + 2 H2O
3. Пероксиредоксины – цитозольные белки, обладающие перксидазной
активностью, которые имеют фиксированные цистеиновые остатки на
концах молекул, восстанавливают Н2О2
57. Индукция ПОЛ
1.Самый эффективный индуктор ПОЛ – гидроксильный радикалОН•, который образуется в реакциях Фентона, Осипова, в
реакции оксида азота и супероксида.
Н2О2 + Fe2+ → OH• + OH▬ + Fe3+
HOCl + Fe2+ → OH• + Cl▬ + Fe3+
NO• + O2•▬ → ONOO▬ → ONOOH → OH• + NO2
2. Fe2+ активирует ПОЛ через реакцию разветвления цепи, а
также реакции Фентона и Осипова.
LOOH + Fe2+ → LO• + OH▬ + Fe3+
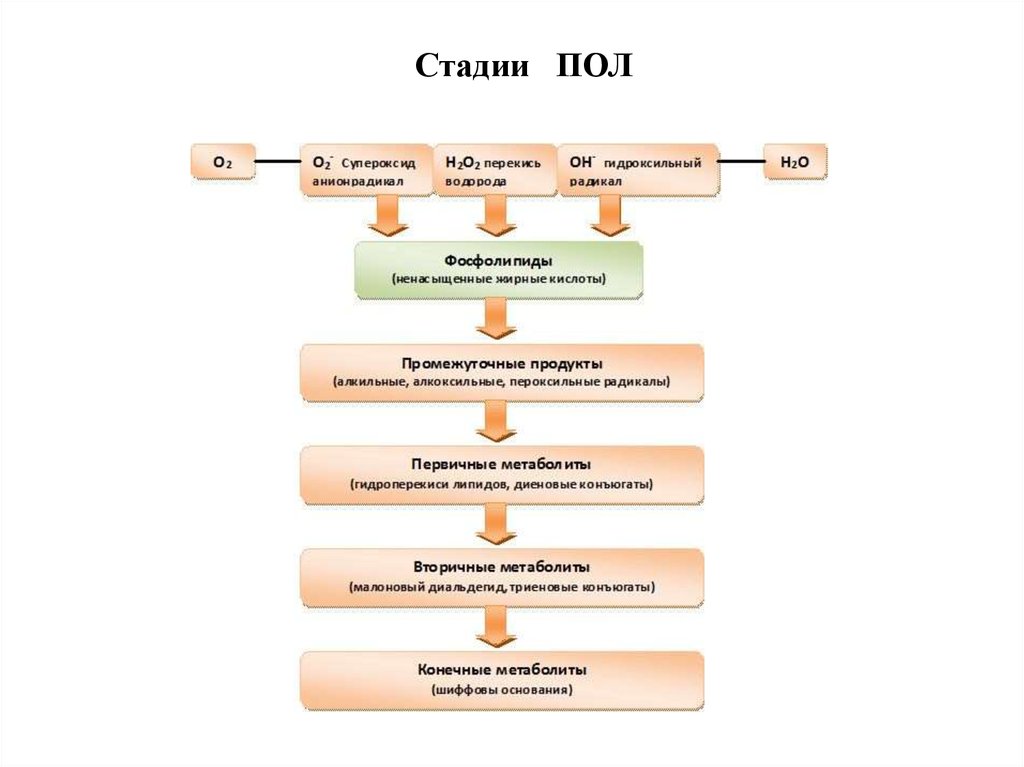
58.
Стадии ПОЛ59.
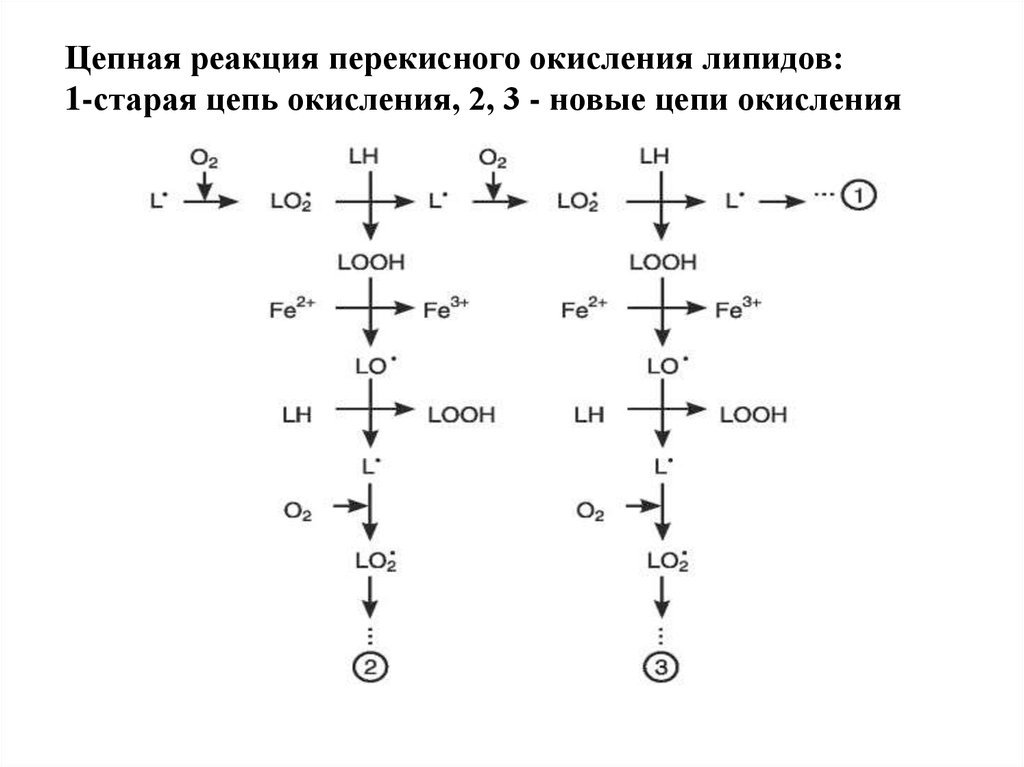
Цепная реакция перекисного окисления липидов:1-старая цепь окисления, 2, 3 - новые цепи окисления
60.
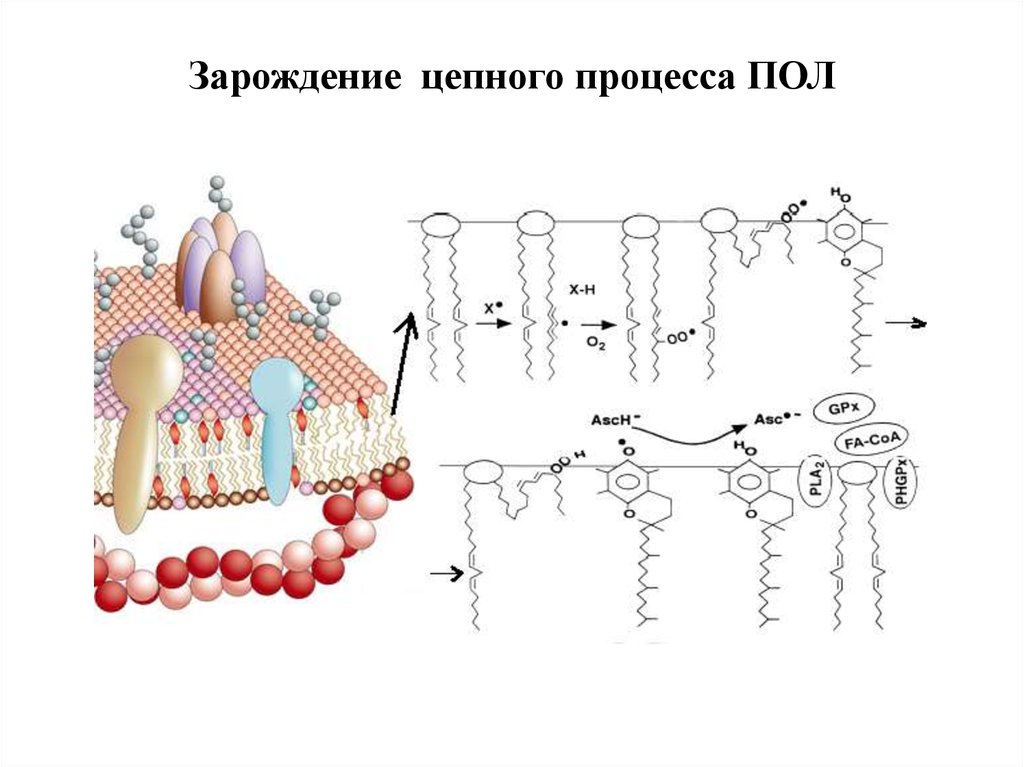
Стадии ПОЛ61. Зарождение цепного процесса ПОЛ
62.
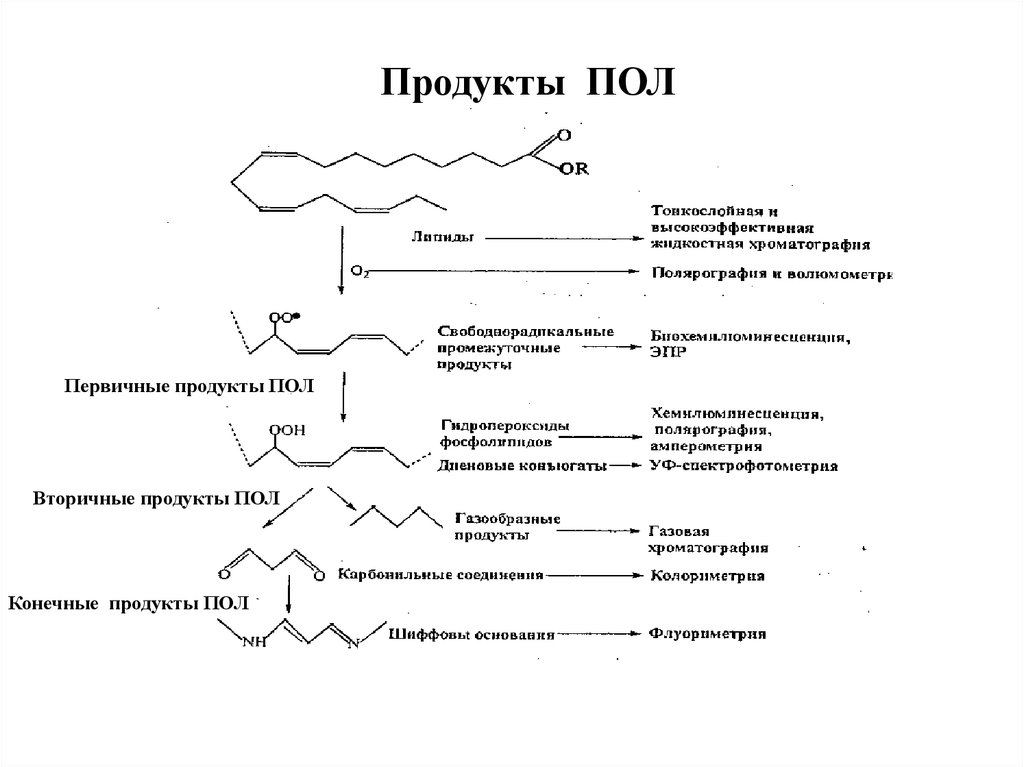
Продукты ПОЛПервичные продукты ПОЛ
Вторичные продукты ПОЛ
Конечные продукты ПОЛ
63.
64. Первичные продукты ПОЛ
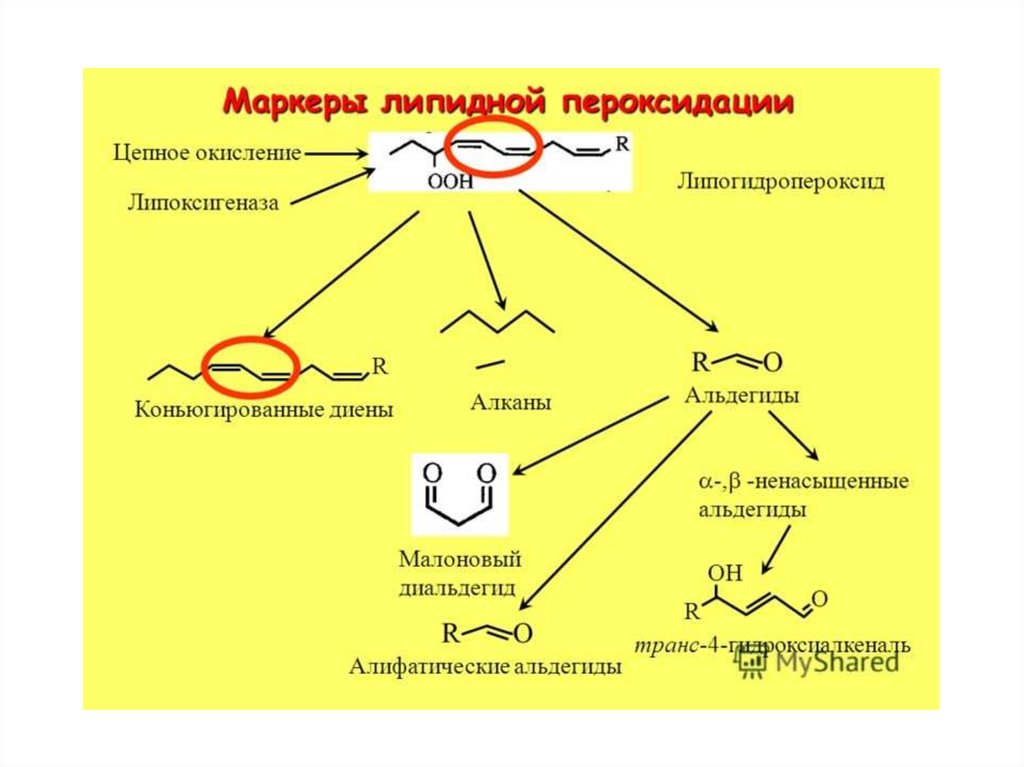
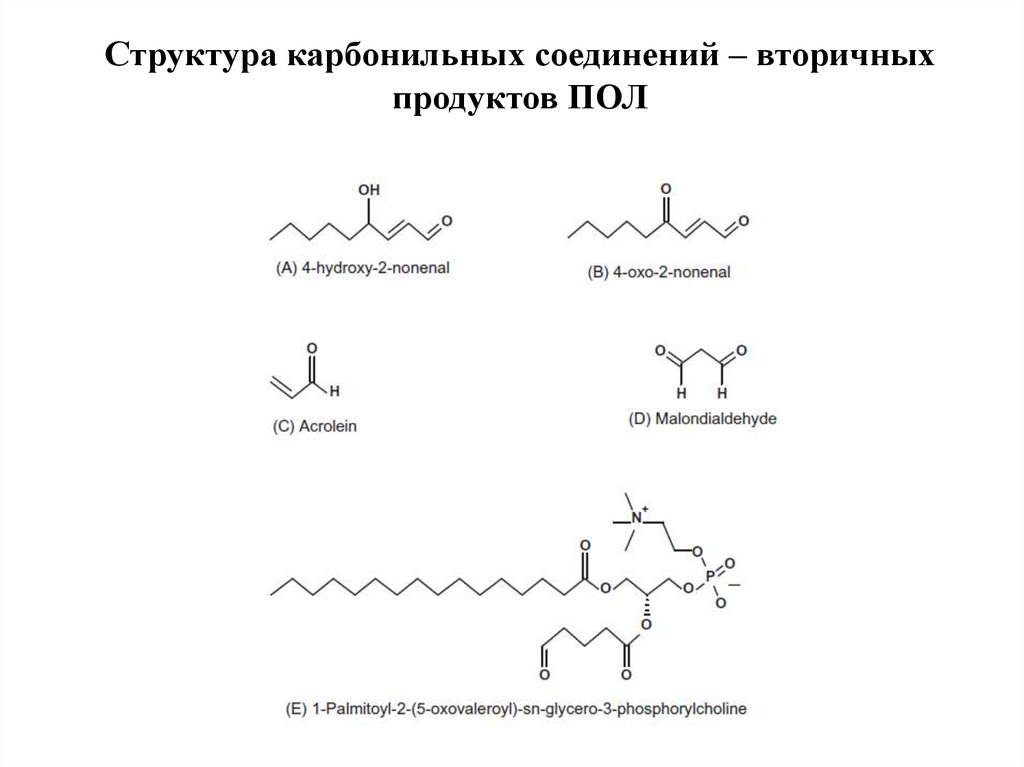
65. Структура карбонильных соединений – вторичных продуктов ПОЛ
66.
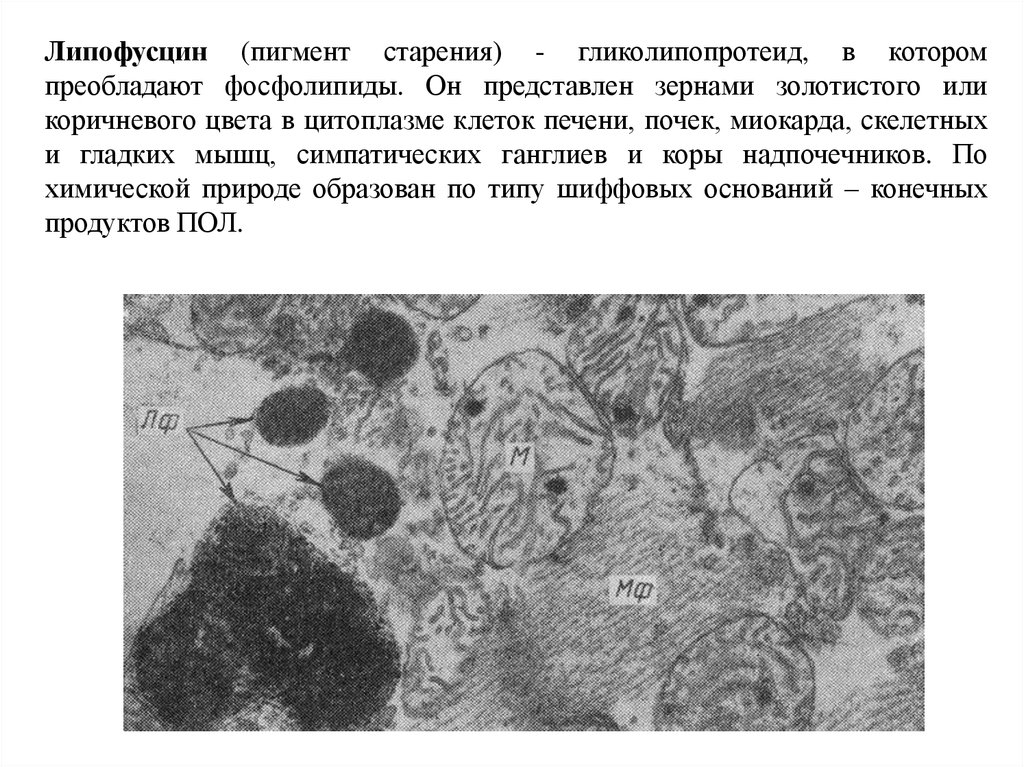
Липофусцин (пигмент старения) - гликолипопротеид, в которомпреобладают фосфолипиды. Он представлен зернами золотистого или
коричневого цвета в цитоплазме клеток печени, почек, миокарда, скелетных
и гладких мышц, симпатических ганглиев и коры надпочечников. По
химической природе образован по типу шиффовых оснований – конечных
продуктов ПОЛ.
67.
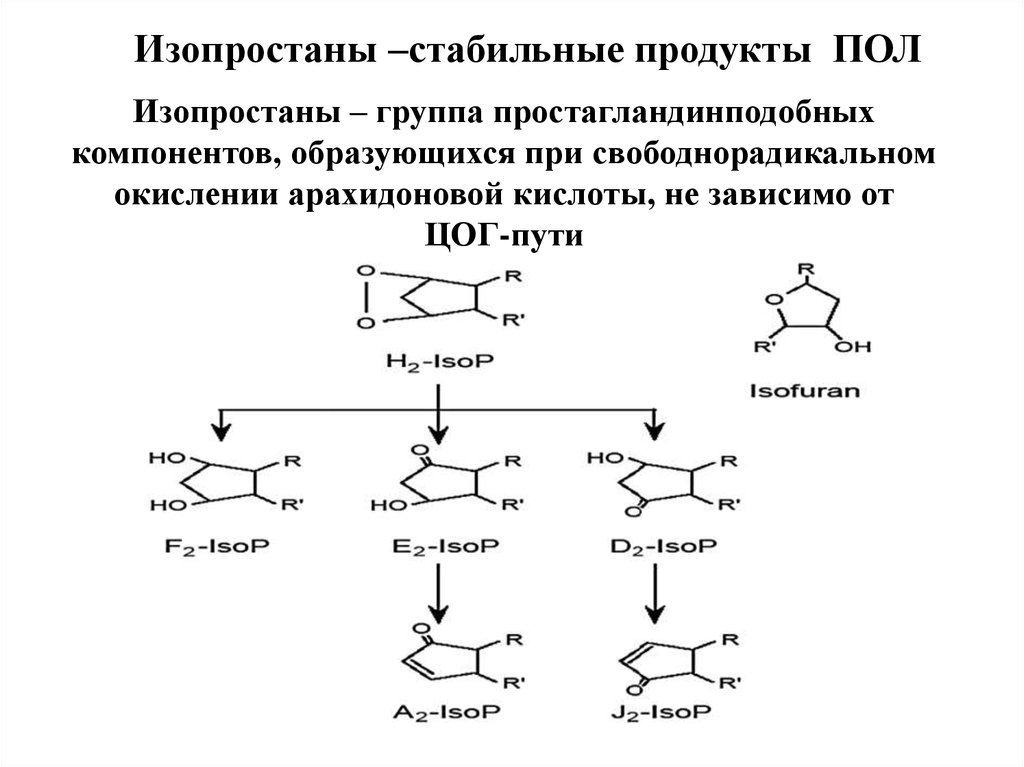
Изопростаны –стабильные продукты ПОЛИзопростаны – группа простагландинподобных
компонентов, образующихся при свободнорадикальном
окислении арахидоновой кислоты, не зависимо от
ЦОГ-пути
68.
Влияние ПОЛ на липидный бислой мембран69.
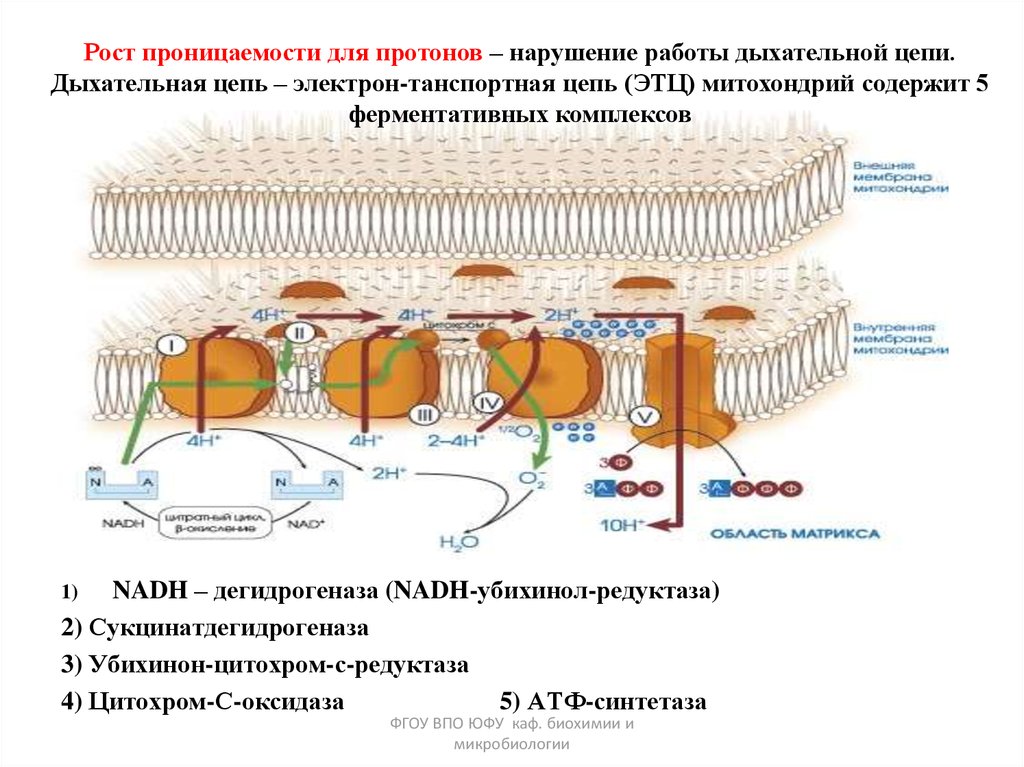
Рост проницаемости для протонов – нарушение работы дыхательной цепи.Дыхательная цепь – электрон-танспортная цепь (ЭТЦ) митохондрий содержит 5
ферментативных комплексов
NADH – дегидрогеназа (NADH-убихинол-редуктаза)
2) Сукцинатдегидрогеназа
3) Убихинон-цитохром-с-редуктаза
4) Цитохром-С-оксидаза
5) АТФ-синтетаза
1)
ФГОУ ВПО ЮФУ каф. биохимии и
микробиологии
70.
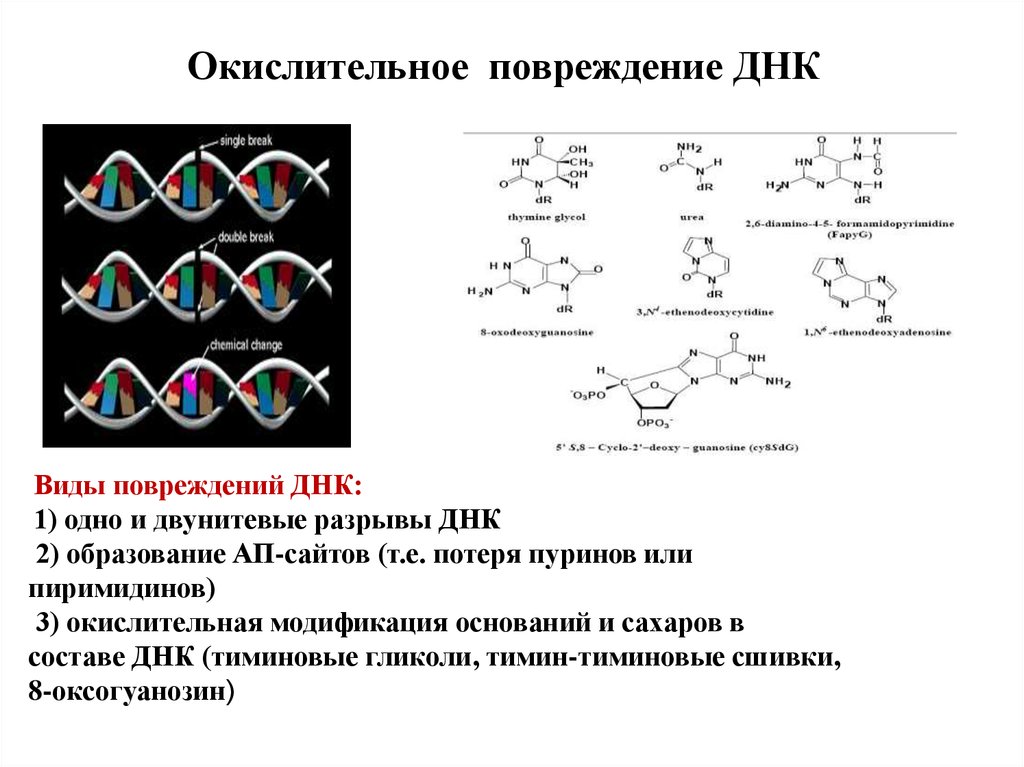
Окислительное повреждение ДНКВиды повреждений ДНК:
1) одно и двунитевые разрывы ДНК
2) образование АП-сайтов (т.е. потеря пуринов или
пиримидинов)
3) окислительная модификация оснований и сахаров в
составе ДНК (тиминовые гликоли, тимин-тиминовые сшивки,
8-оксогуанозин)
71.
72.
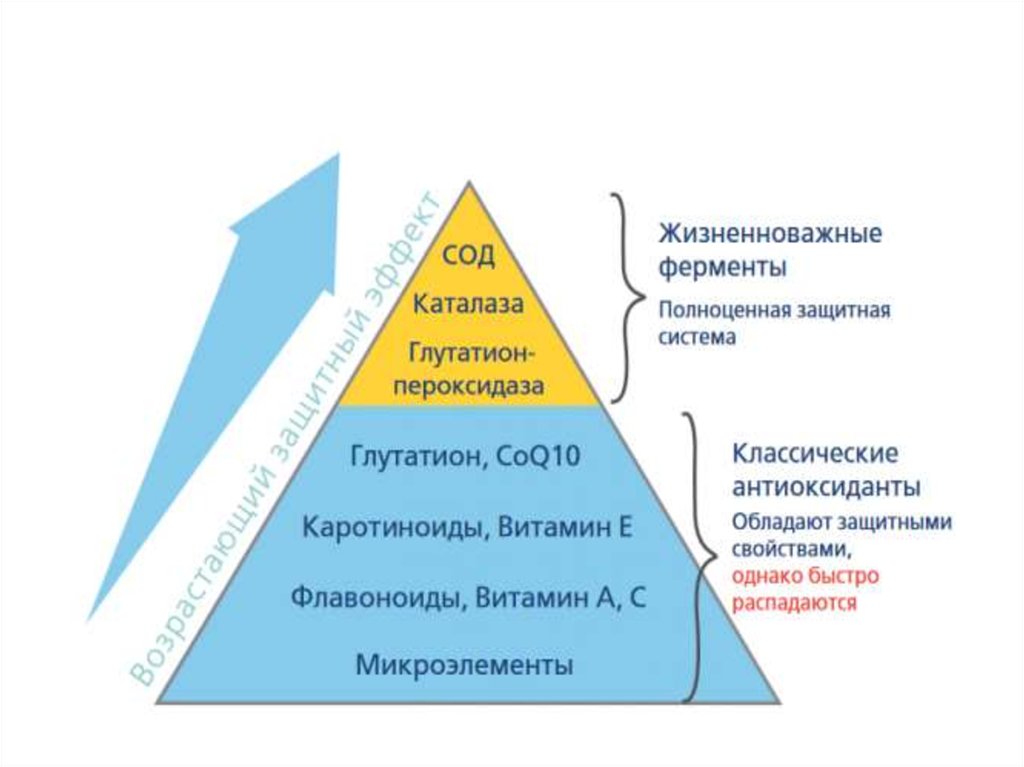
Живые клетки имеют систему защиты отповышенной продукции свободных радикалов
антиоксидантную
систему,
механизм
действия которой направлен на блокирование
действия
свободных
радикалов.
Антиоксидантная
система
образована
антиоксидантными
ферментами
и
низкомолекулярными антиоксидантами.
Антиоксиданты «ловят» радикалы, отдавая
им
свои
электроны,
таким
образом,
обезвреживая их. При этом структура
антиоксидантов остается стабильной.
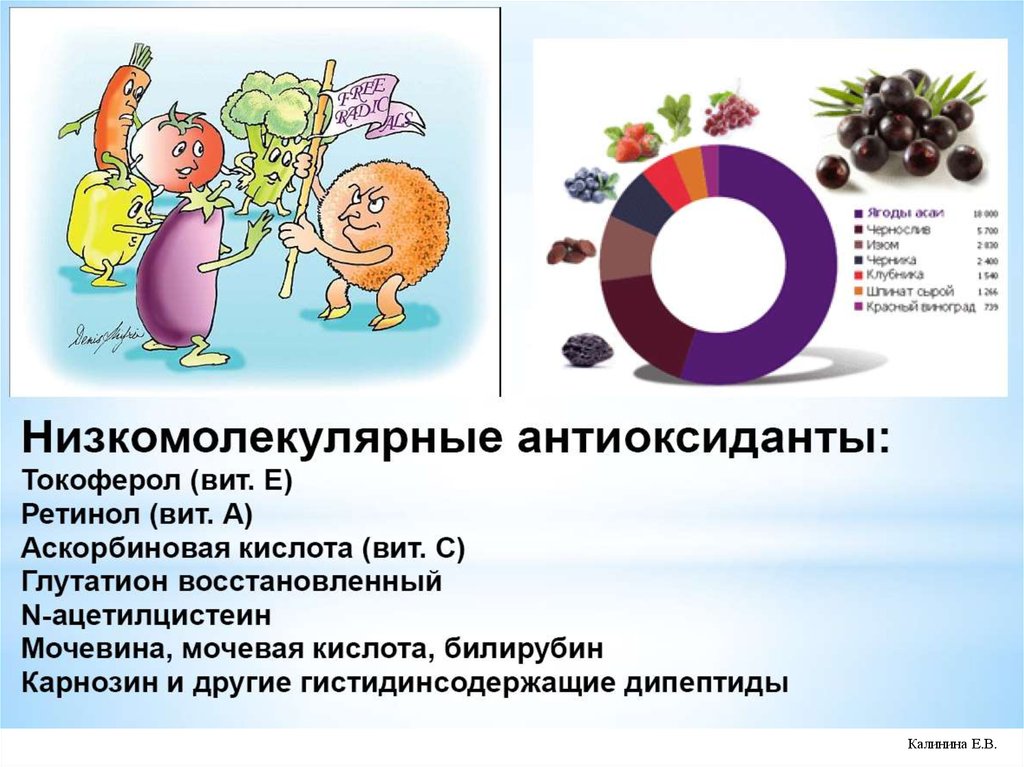
73.
74.
Калинина Е.В.75.
Калинина Е.В.76.
Калинина Е.В.77.
Калинина Е.В.78.
Калинина Е.В.79.
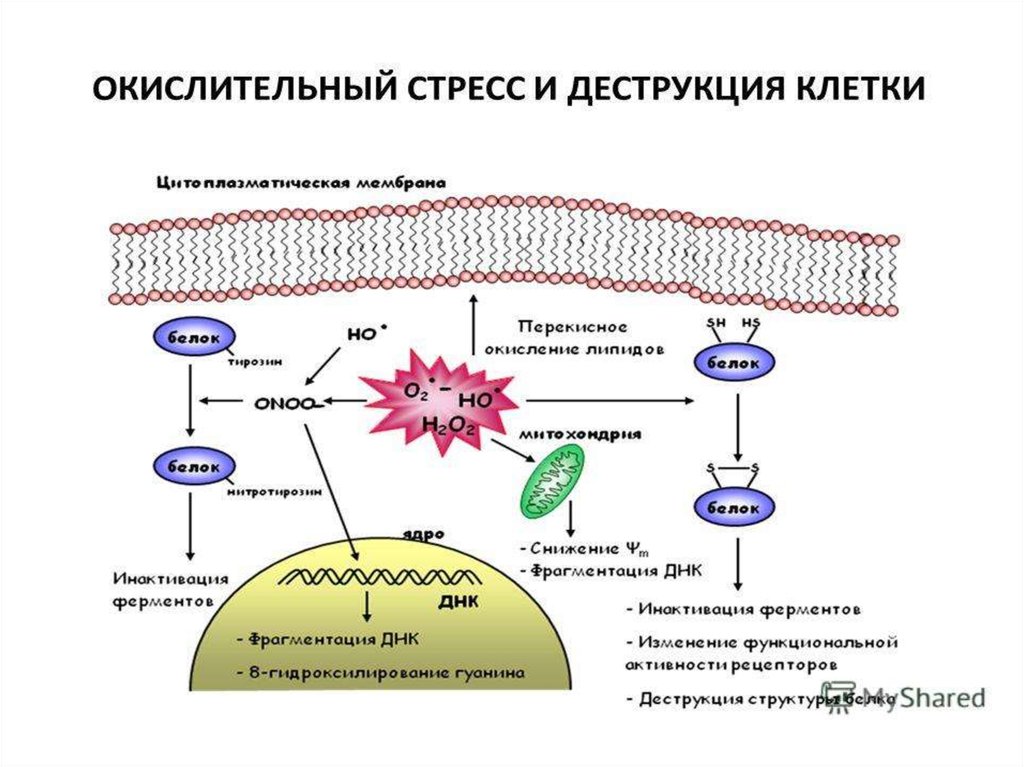
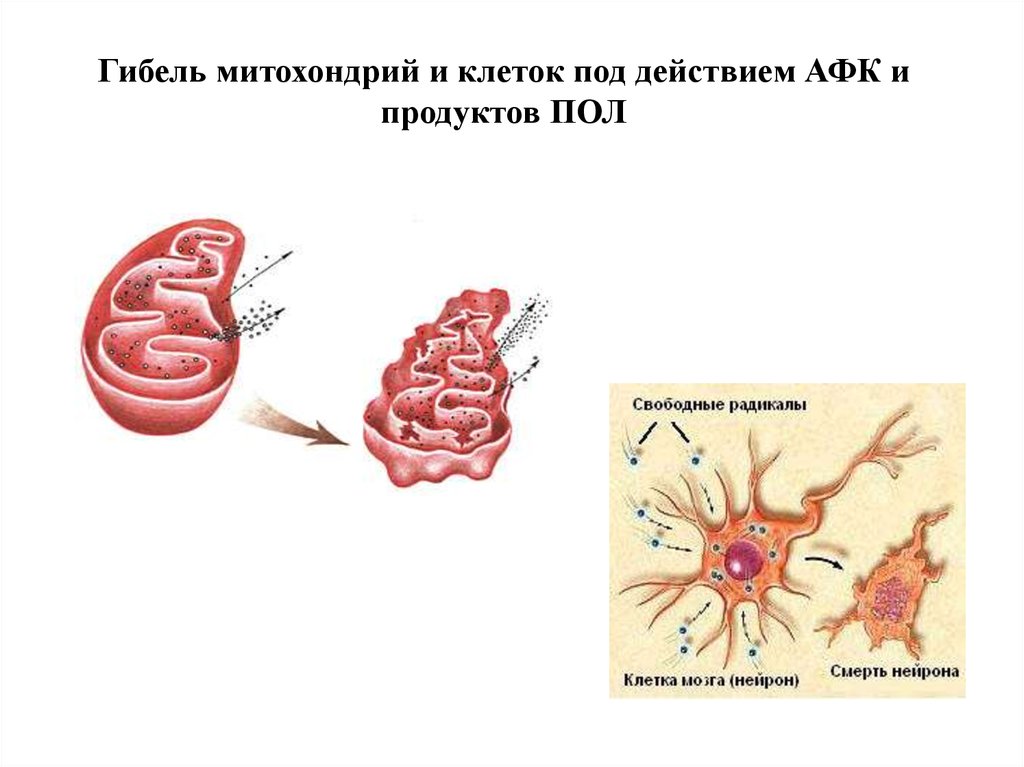
Гибель митохондрий и клеток под действием АФК ипродуктов ПОЛ












































 chemistry
chemistry








