Similar presentations:
Свободное окисление и микросомальное окисление
1. ТЕМА
СВОБОДНОЕ ОКИСЛЕНИЕМИКРОСОМАЛЬНОЕ
ОКИСЛЕНИЕ
2. Вопросы лекции
Свободное окисление
Оксидазные и оксигеназные реакции
Микросомальное окисление
Активные формы кислорода
Перекисное окисление липидов
Прооксиданты, антиоксиданты,
их клиническое значение
3. Пути использования кислорода в клетке
СРО активные формы О2ЦТД
СВОБОДНОЕ ОКИСЛЕНИЕ
оксидазы оксигеназы
НАДФН + Н +
МАО
(ФАД)
диоксигеназы
монооксигеназы
Цитохром Р450 (редуктаза)
МСО
(гепатоциты)
ПОЛ
R+O2=RO2
Цитохром Р450
(гидроксилирование ААК)
4.
Свободное окисление - это кислородзависимые процессы, которые несвязаны с образованием АТФ.
В реакциях свободного окисления
участвуют оксидазы и оксигеназы,
которые используют кислород как
субстрат:
ОКСИДАЗЫ –забирают водород от
субстрата и передают его на кислород
ОКСИГЕНАЗЫ (моно- и диоксигеназы)
внедряют кислород в молекулу субстрата
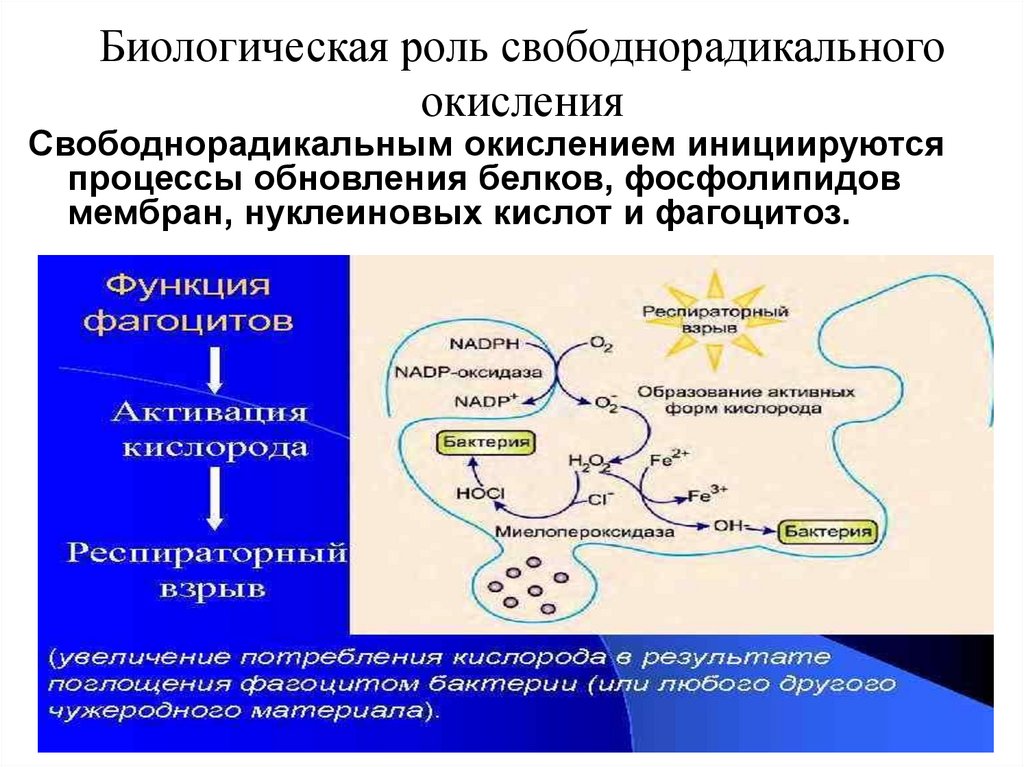
5. Биологическая роль свободнорадикального окисления
Свободнорадикальным окислением инициируютсяпроцессы обновления белков, фосфолипидов
мембран, нуклеиновых кислот и фагоцитоз.
6. ОКСИДАЗЫ
Примером оксидазы может служитьНАДФН-оксидаза плазматической
мембраны фагоцитирующих
лейкоцитов:
НАДФН + Н+ + О2 → НАДФ+ + Н2О2 ,
субстратом является НАДФН, а
продуктом - пероксид водорода, который
используется лейкоцитом для
уничтожения поглощенных бактерий.
7.
Флавинсодержащие моноаминооксидазы (МАО) –окислительное дезаминирование биогенных
аминов (Ко-фермент – ФАД).
Реакция протекает в 2 стадии:
1. Дегидрирование амина с восстановлением
простетической группы фермента (Е-ФАД) и
образование имина
2. Имин реагирует с водой и превращается в
альдегид, а восстановленный фермент
окисляется кислородом с образованием Н2О2
R-CH2-NH2 + O2 + H2O → R-CHO + NH3 + H2O2
защита организма от избытка нейромедиаторных
моноаминов
8. Инактивация биогенных аминов
Чаще всего осуществляется окислениемферментами моноаминооксидазы (МАО),
коферментом которых является ФАД.
Таким пу
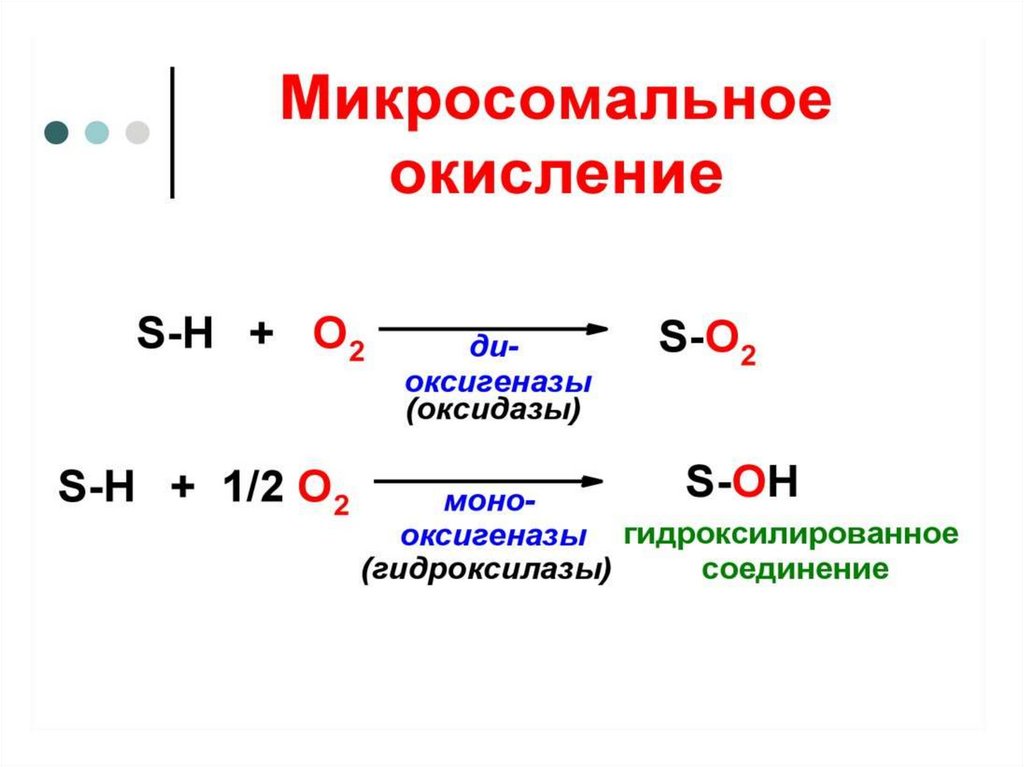
9. ОКСИГЕНАЗЫ
К ним относятся система цитохрома Р-450 иМонооксигеназы - гидролизуют
ароматические аминокислоты (Три, Фен, Тир),
дофамин, остатки пролина и лизина при
созревании коллагена.
Диоксигеназы - включение двух атомов
кислорода в молекулу субстрата R + O2 → RO2
Обычно окисление молекул, содержащих
бензольное кольцо (окисление
гомогентизиновой кислоты (распад тирозина),
разделение молекулы β-каротина на две
молекулы ретиналя
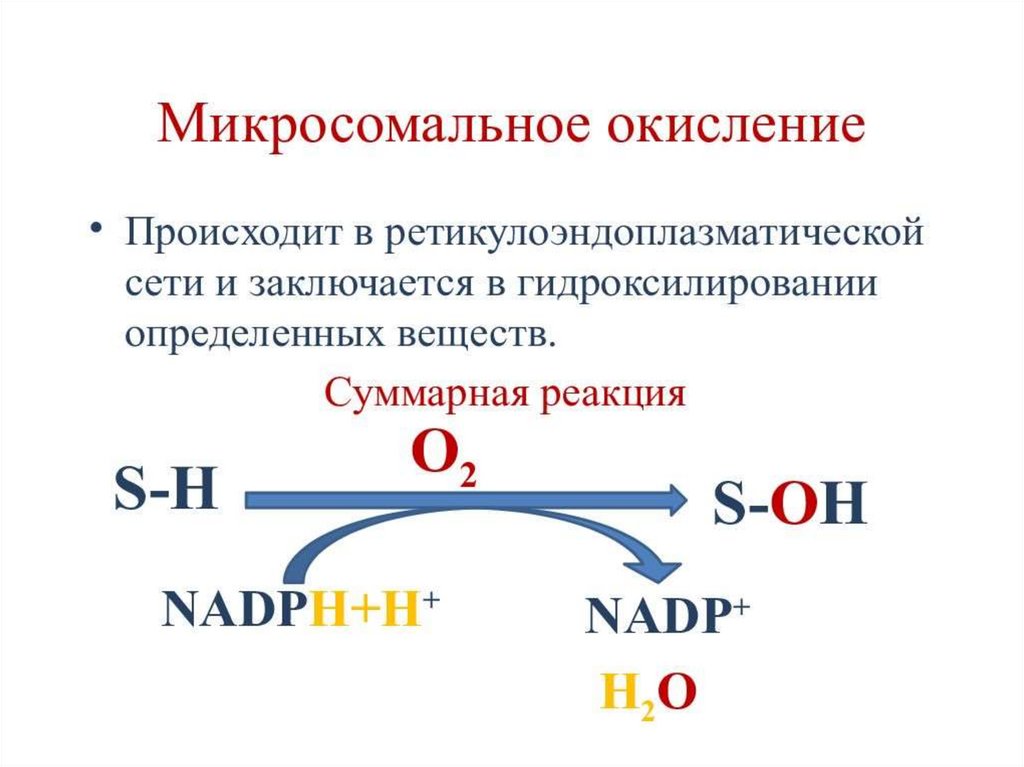
10. Микросомальное окисление (МСО)
Это сложный биохимический процесс, вкотором участвуют мультиферментные
комплексы печени и в некоторой степени
ферменты других органов – легких, почек,
кожи и ЖКТ, которые также обеспечивают
поддержание, регулирование и осуществление
этого процесса.
К группе микросомальных ферментов относят
специфические оксидазы, различные
гидролазы и ферменты конъюгации.
11.
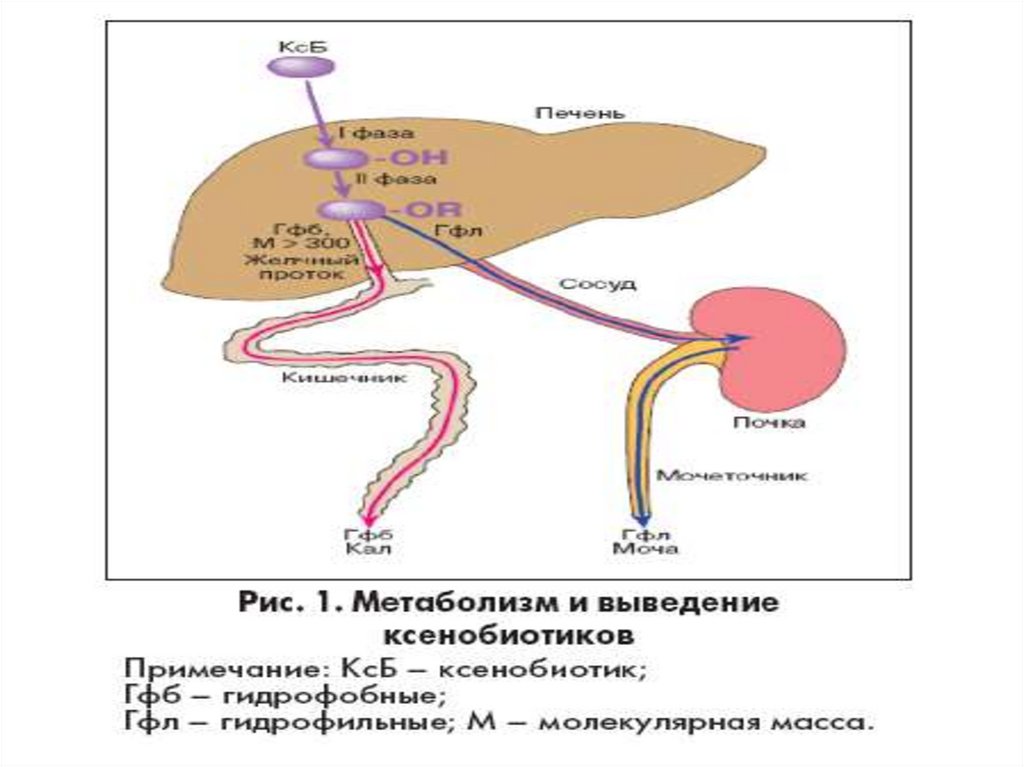
Процесс микросомального окислениянеобходим для окисления ксенобиотиков, к
числу которых относятся лекарственные
средства, пестициды, канцерогены и др.
Окисление осуществляется в мембранах ЭПР
гепатоцитов клеток печени, где активна цепь
свободного окисления, включающая НАДФНцитохром Р450-редуктазу и цитохром Р450.
Процесс идет в несколько стадий химической
модификации вещества, в результате чего
ксенобиотик становится более гидрофильным.
При этом возрастает его растворимость в воде,
что облегчает их выведение из организма.
12.
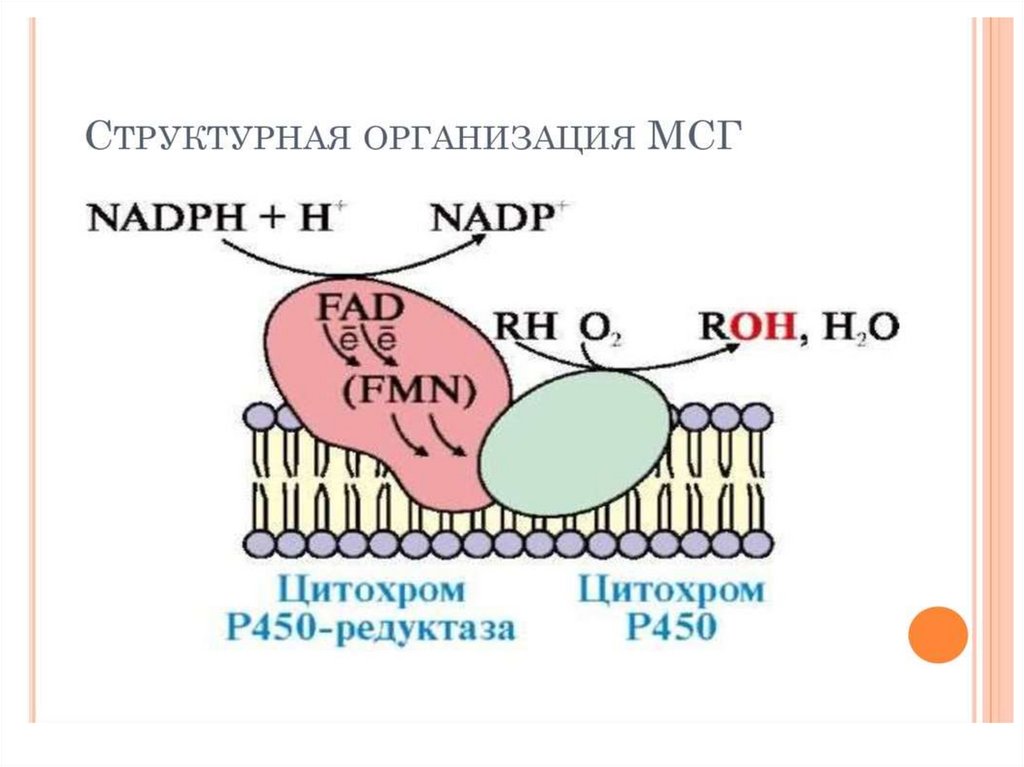
13. Стадии микросомального окисления
Гидрофобный субстрат (R-H) связывается с молекулойкислорода в активном центре цитохрома P450 , повышая
таким образом активность фермента.
2. NADP окисляется NADP-цитохром P450 редуктазой ,
акцептором 2 электронов будет один из атомов
кислорода, который переходит в форму супероксида O2-.
Второй атом кислорода включается в R-H, образуя
гидроксильную группу R-OH.
Суммарное уравнение реакции гидроксилирования:
1.
RH + O2 + NADФH + H+ → ROH + H2O + NADФ
Индуцировать цитохром Р450 способны барбитурат,
фенобарбитал
14.
15.
16.
17.
18.
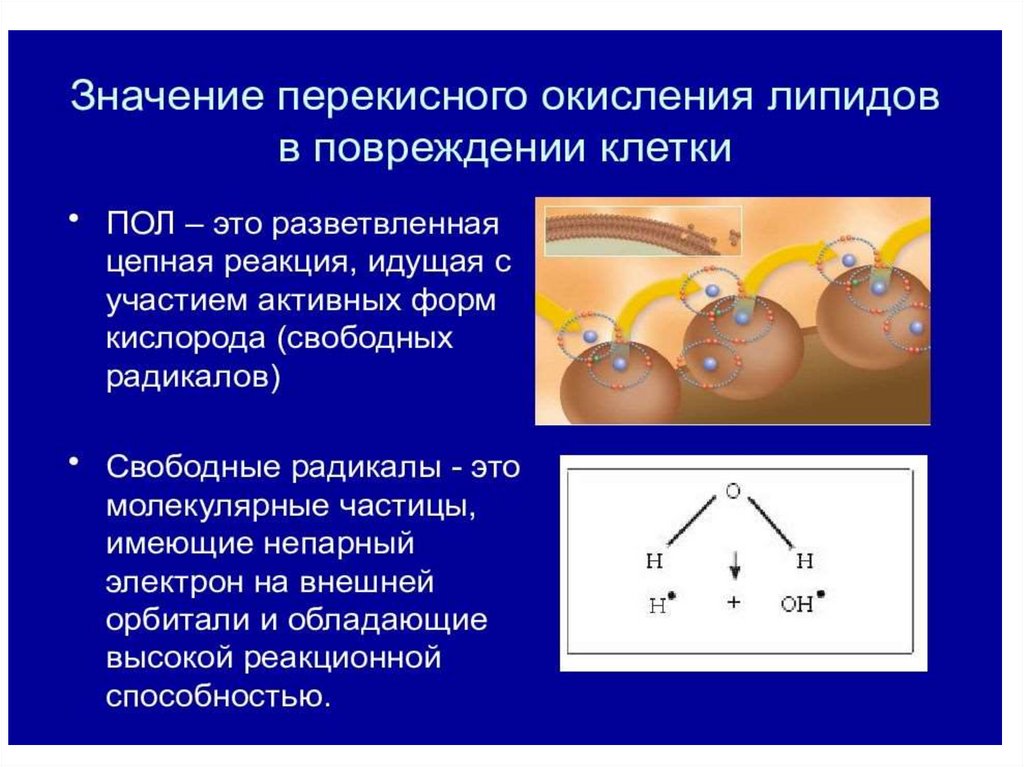
19. СВОБОДНЫЕ РАДИКАЛЫ
Свободные радикалы отличаются от обычныхмолекул тем, что у них на внешней
электронной оболочке имеется неспаренный
(одиночный) электрон. Это делает радикалы
химически активными, поскольку радикал
стремится вернуть себе недостающий
электрон, отняв его от окружающих молекул
и тем самым их повреждая.
Например, радикал гидроксила обозначают
.
как HO , радикал перекиси водорода как
HOO., радикал супероксида как O2.-.
20.
Из первичного радикала – супероксида, а такжев результате других реакций в организме могут
образоваться весьма активные молекулярные
соединения: перекись водорода, гипохлорит и
гидроперекиси липидов.
Под действием ионов металлов переменной
валентности, в первую очередь – ионов Fe2+ , из
этих веществ образуются вторичные свободные
радикалы, такие как радикал гидроксила и
радикалы липидов, которые оказывают
разрушительное действие на клеточные
структуры
21.
22.
Образование активных форм кислорода:кислород участвует в образовании перекисей и
активных радикалов, которые необходимы в
пероксисомах для внутриклеточного
пищеварения, разрушения макрофагами
бактерий, вирусов, регуляции метаболизма и т.д.
Перекиси и активные формы кислорода
(кислородные радикалы) оказывают также
повреждающее воздействие на структуры
клеток и тканей, активируя ПОЛ. Разрушение
перекисей и инактивация свободных радикалов
осуществляется с помощью ферментативной и
неферментативной антиокидантной системы
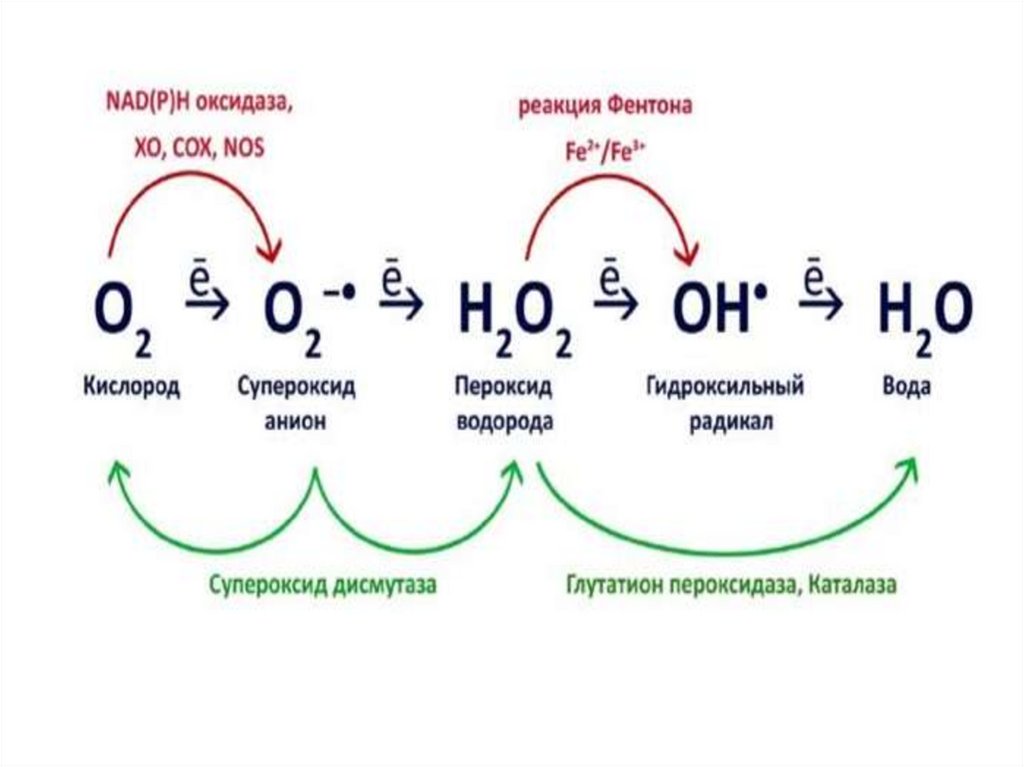
23.
.-О2 → О2 → О2
2-
→ Н2О2
→OH-
.
+ ОН-
супер- пер- пергидрококсид оксид оксид сильный
радикал анион
радикал
Синглетный кислород:
ОCl- + Н2О2 →Cl- + 1О2
24.
25. Источники электронов
Главный источник свободных радикалов –дыхательная цепь. Утечка электронов
происходит из комплексов I и II в
реакциях с убихиноном. Неполное
использование кислорода приводит к
образованию свободных супероксидных
радикалов.
Ионы меди Сu2+ и Fe2+ катализируют
образование опасных гидроксильных
радикалов .-ОН из пероксида водорода.
26.
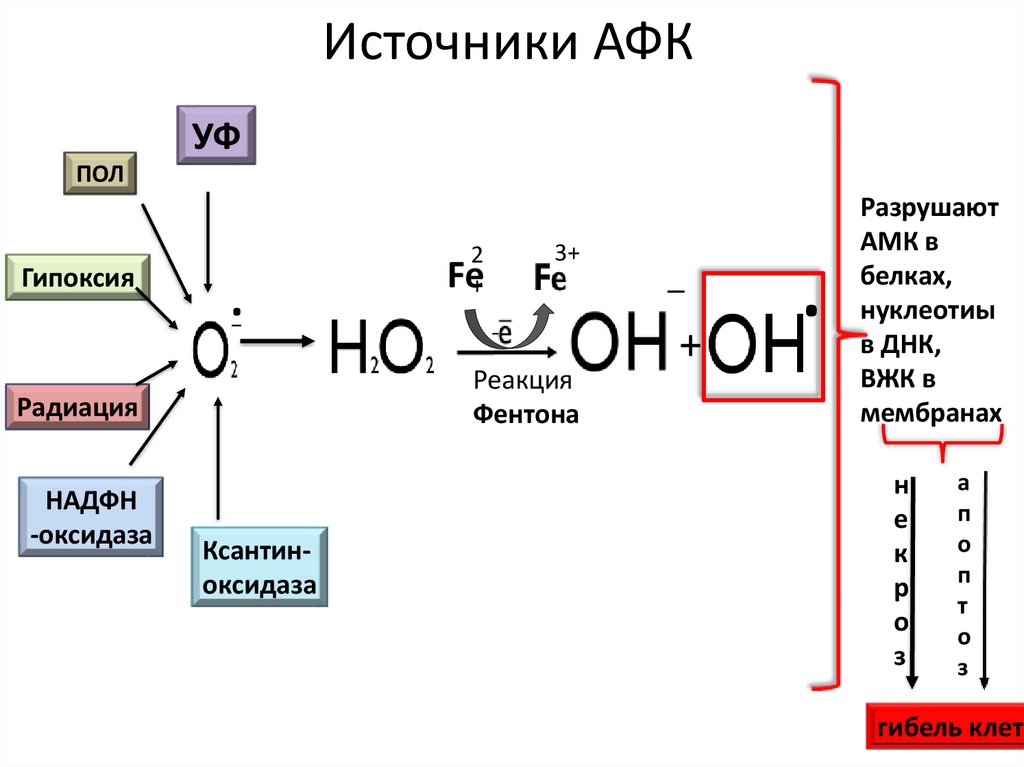
27. Источники АФК
УФПОЛ
Гипоксия
.
-
Реакция
Фентона
Радиация
НАДФН
-оксидаза
3+
2
Fe+
Ксантиноксидаза
_
+
.
Разрушают
АМК в
белках,
нуклеотиы
в ДНК,
ВЖК в
мембранах
н
е
к
р
о
з
а
п
о
п
т
о
з
гибель клетк
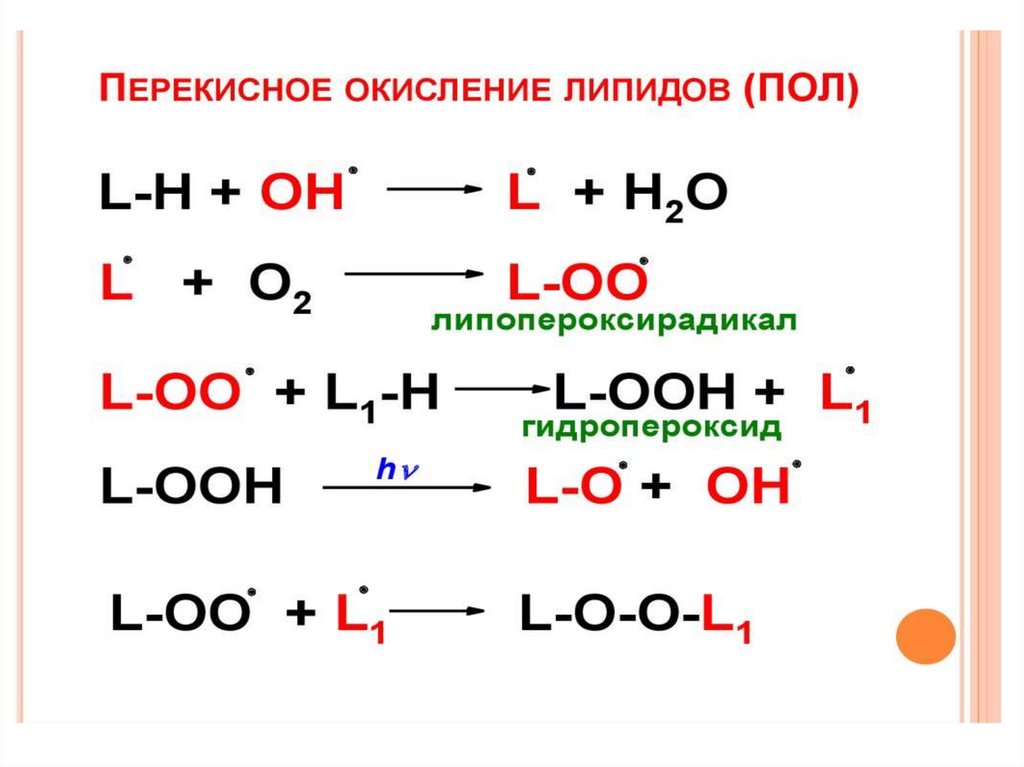
28. ПЕРЕКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ (ПОЛ)
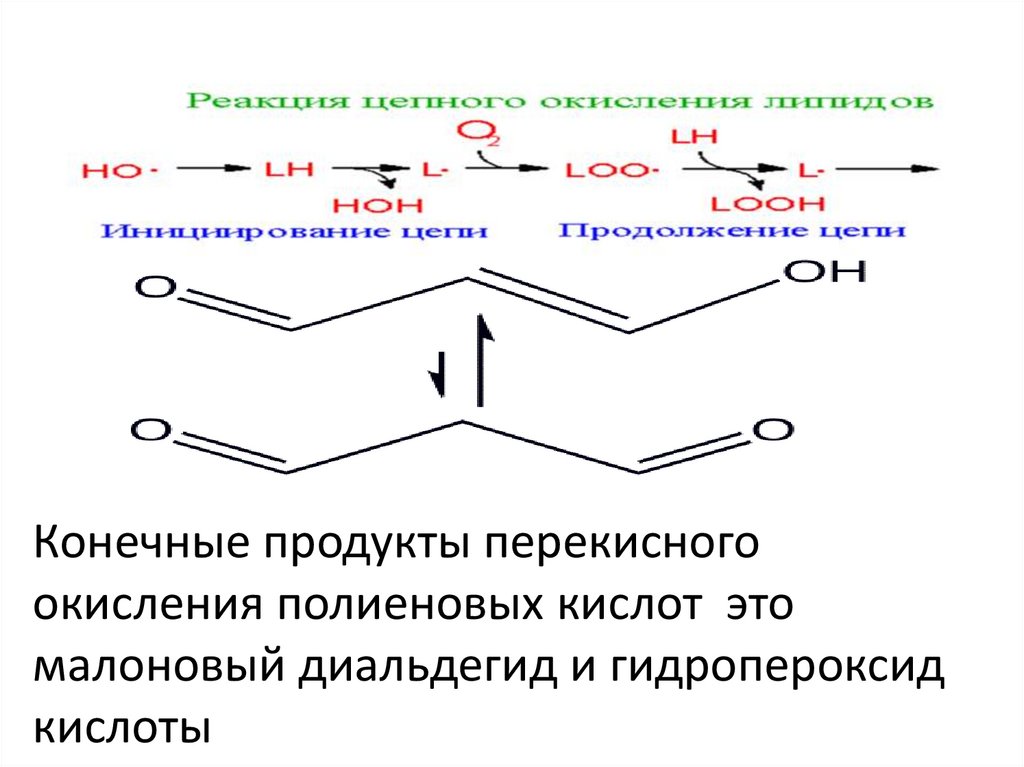
Реакция цепного окисления липидов играет важнуюроль в клеточной патологии. Она протекает в несколько
стадий: инициирование, продолжение, разветвление и
обрыв цепи. Инициирование цепной реакции
начинается с того, что в липидный слой мембран или
липопротеинов внедряется свободный радикал. Чаще
всего это радикал гидроксила ОН.. Будучи небольшой
по размеру незаряженной частицей, он способен
проникать в толщу гидрофобного липидного слоя и
вступать в химическое взаимодействие с
полиненасыщенными жирными кислотами (которые
принято обозначать как RH), входящими в состав
биологических мембран и липопротеинов плазмы
крови. При этом образуются липидные радикалы.
29.
30.
Активные формы кислорода оказываютповреждающее воздействие на структуры клеток и
тканей, активируя процесс перекисного окисления
липидов (ПОЛ).
ПОЛ – это цепная реакция расширенного
воспроизводства свободных радикалов, когда
каждый свободный радикал обеспечивает
образование нового свободного радикала
31.
32.
OН· + RH > H2O + R·Липидный радикал (R·) вступает в реакцию с
растворенным в среде молекулярным кислородом; при
этом образуется новый свободный радикал – радикал
липоперекиси (ROO·):
R· + O-2 > ROO·
Этот радикал атакует одну из соседних молекул
фосфолипида с образованием гидроперекиси липида
ROOH и нового радикала R·:
ROO· + RH. > ROOH + R·
Чередование двух последних реакций как раз и
представляет собой цепную реакцию перекисного
окисления липидов.
33.
Конечные продукты перекисногоокисления полиеновых кислот это
малоновый диальдегид и гидропероксид
кислоты
34.
Активные формы кислорода повреждают структуруДНК, белков и различные мембранные структуры
клеток. В мембране образуются гидропероксиды
жирных кислот. В клетки начинает проникать вода,
ионы натрия, кальция. Это приводит к набуханию
клеток, органелл и их разрушению. Активация
перекисного окисления приводит к ряду
заболеваний: дистрофия мышц, болезнь Паркинсона
(разрушение нервных клеток), развитие опухолей.
Перекисное окисление приводит к спазму
коронарных артерий, образованию тромба в сосуде,
питающего миокард. С возрастом благодаря ПОЛ на
коже появляются пигментные пятна (пигмент
липофусцин – смесь липидов и денатурированных
белков с продуктами ПОЛ).
35.
36. Защита от активных форм кислорода
Защита клетки обеспечивается благодаря работеантиоксидантной системы (АОС), которая может
осуществляться энзиматическим и неэнзиматическим путем.
Основным способом защиты от АФК является их
инактивация. Это достигается работой высокомолекулярных
соединений, таких как ферменты: супероксиддисмутаза,
каталаза и глутатионпероксидаза (расщепляют перекись).
Супероксиддисмутаза (СОД) — фермент, который широко
распространен в природе. В активном центре цитозольной
СОД содержатся ионы металлов (меди, железа, марганца,
цинка). СОД присутствует во всех аэробных организмах и
служит для эффективного удаления супероксидных
радикалов.
СОД катализирует реакцию превращения двух анионрадикалов в перекись водорода (Н202 ) и молекулярный
кислород:
202- + 2Н+ -> Н202 + 02
37.
Каталаза расщепляет пероксид водорода собразованием воды и молекулярного кислорода:
2Н2О2 → 2Н2О + О2
Глутатионпероксидаза использует восстановленный
глутатион для восстановления пероксида водорода и
гидропероксиды жирных кислот:
Эта реакция служит для предотвращения
гемолиза при образовании пероксида
водорода (Н2О2 ) и гидропероксидов
жирных кислот ( ROOH ) в мембране
эритроцитов.
38. Каталаза
расщепляет перекись водорода собразованием воды и молекулярного
кислорода, а пероксидазы восстанавливают
перекись до воды специальными
субстратами, например, глютатионом.
Глютатиону принадлежит особая роль, что
связано со способностью восстанавливать
перекись водорода, гидропероксиды ROOH, а
также обезвреживать вторичные метаболиты
2Н2О2 + каталаза → 2Н2О + О2
39. Глутатионпероксидаза
Используется восстановленный глутатион дляутилизации пероксида водорода:
Н2О2 + 2GSH → GS-SG + 2H2O
Эта реакция служит для предотвращения
гемолиза эритроцитов при образовании
пероксида водорода Н2О2
40. Реакции, обеспечивающие антиоксидантную защиту в эритроцитах
2 G-SH + 2 H2O2Глутатионпероксидаза
Глутатион
восстановленный
G-S-S-G + 2 H2O
Глутатион
окисленный
Глутатионредуктаза
НАДФ+
Глюкозо-6-фосфат
НАДФН + Н
Глюкозо-6-фосфатдегидрогеназа
+
6-фосфоглюконолактон
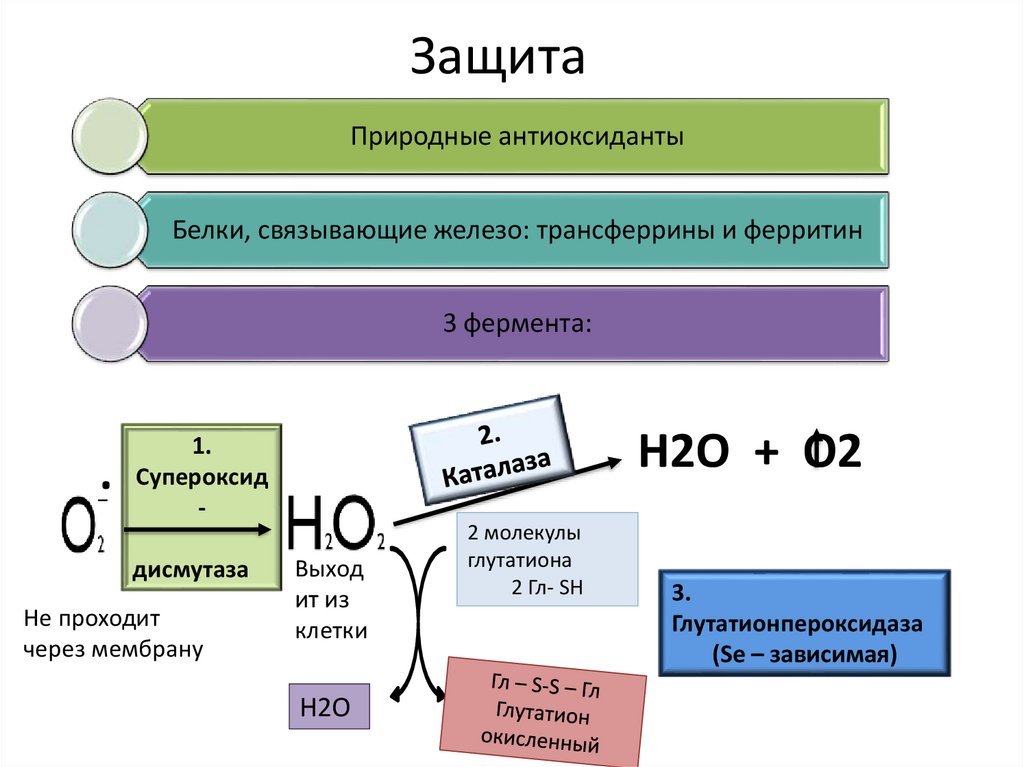
41. Защита
Природные антиоксидантыБелки, связывающие железо: трансферрины и ферритин
3 фермента:
.
Н2О + О2
1.
Супероксид
дисмутаза
Не проходит
через мембрану
Выход
ит из
клетки
Н2О
2 молекулы
глутатиона
2 Гл- SH
3.
Глутатионпероксидаза
(Se – зависимая)
42. Неферментативные антиоксиданты
• Ионы металлов способны образовыватьактивные формы кислорода. В связанном с
белком состоянии эти металлы неактивны.
Транспорт ионов металлов с переменной
валентностью в плазме крови осуществляют
специальные белки-переносчики:
Церулоплазмин транспортирует медь,
Трансферрин – железо,
Альбумин связывает ион меди,
Металлотионеины связывают ионы цинка, меди,
кадмия, ртути
43.
44. Превентивные антиоксиданты
Источником электронов для образованияактивных форм кислорода служат металлы с
переменной валентностью:
Fe, Cu, Zn. В связанном с белком состоянии эти
металлы неактивны.
Транспорт ионов металлов с переменной
валентностью в плазме крови осуществляют
специальные белки-переносчики:
- Церулоплазмин транспортирует медь,
- Трансферрин – железо,
- Альбумин связывает ион меди,
Металлотионеины (цитоплазматические белки
богатые цистеином) связывают ионы цинка, меди,
кадмия, ртути
45. АНТИОКСИДАНТЫ
Действие ферментных антиоксидантовдополняется в целостном организме
естественными антиоксидантами, в частности,
витаминами группы Е, стероидными гормонами,
серусодержащими аминокислотами,
аскорбиновой кислотой, витаминами K и P, βкаротином, убихиноном, пептидами,
производными гаммааминомасляной кислоты,
фосфолипидами, продуктами метаболизма
эйкозаноидов, а также тиолами, в частности,
эрготионеином, содержащимся в эритроцитах
печени, мозге.
46.
47. Низкомолекулярные антиоксиданты
• Витамин С: Аскорбат инактивируетпрактически все активные формы
кислорода
• Глутатион – перехватчик гидроксильных
радикалов и синглетного кислорода
• Мочевая кислота – мощный перехватчик
синглетного кислорода, пероксильных и
гироксильных радикалов,
• Витамин Е – α-токоферол реагирует с .ОНрадикалами и способен защищать
мембраны от синглетного кислорода
48.
Антиоксидантным эффектом обладаютвитамины Е и К, убихиноны, триптофан и
фенилаланин, а также большинство
растительных и животных пигментов, в
частности, каротиноиды, флавоноиды,
фенокарбоксильные кислоты.
Cамый эффективный из антиоксидантов,
принимаемых с пищей можно отнести
витамин Е. Недостаток витамина Е
способствует деструкции мембран.
49.
Витамин Е чаще всего принимается вместе свитамином С. Аскорбиновая кислота может
выступать в качестве донора и акцептора
ионов водорода благодаря наличию в
структуре двух фенольных групп, ее
антиоксидантные свойства характеризуются
широким спектром инактивирующего
действия на различные свободные радикалы.
Аскорбиновая кислота превосходит другие
антиоксиданты плазмы крови в защите
липидов мембран от перекисного окисления.
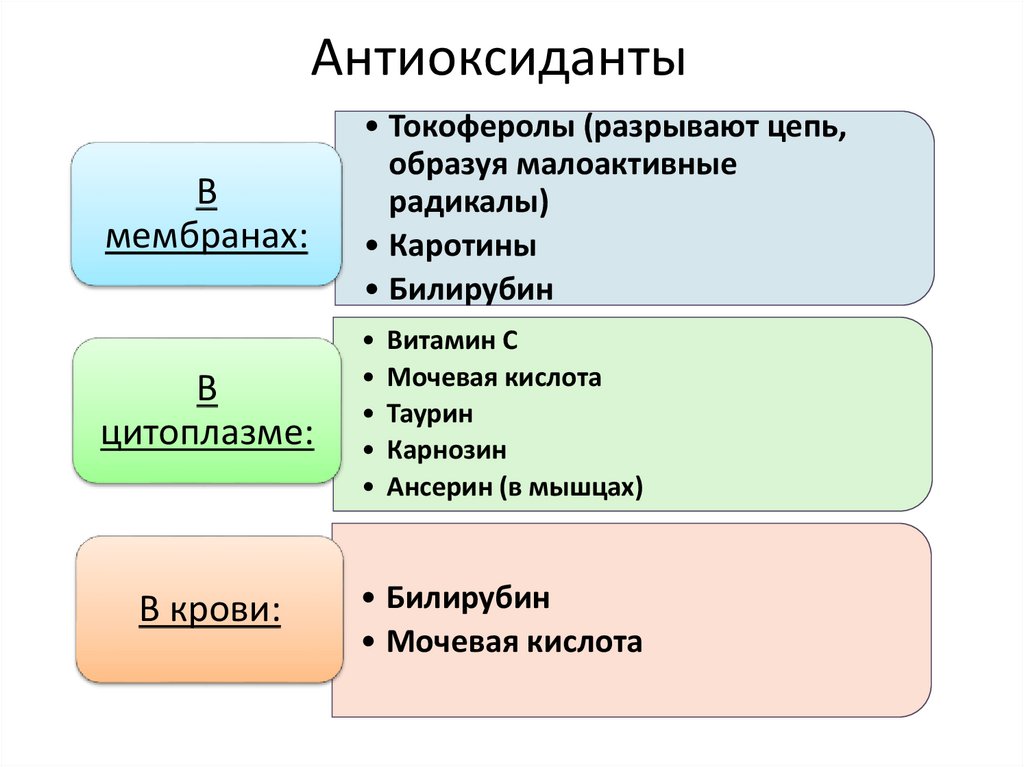
50. Антиоксиданты
Вмембранах:
• Токоферолы (разрывают цепь,
образуя малоактивные
радикалы)
• Каротины
• Билирубин
В
цитоплазме:
В крови:
Витамин С
Мочевая кислота
Таурин
Карнозин
Ансерин (в мышцах)
• Билирубин
• Мочевая кислота
51. ПРОДУКЫ C АНТИОКСИДАНТНЫМИ КОМПОНЕНТАМИ
Ягоды и фрукты:Клюква
Черника (дикорос)
Чёрная слива
Синяя слива
Черника (культивируемая)







































 chemistry
chemistry








