Similar presentations:
Свободные радикалы и болезни человека
1. Свободные радикалы и болезни человека
Биофизические основыпатологии клетки
Свободные радикалы и болезни человека
Ю.А. Владимиров, А.Н. Осипов
2018
2. Антиоксиданты, и способы их изучения
3.
Антиоксиданты - соединения,тормозящие процессы
оксидативного стресса
Оксидативный стресс - процесс,
повреждения биологических структур,
протекающий с участием свободных
радикалов и/или активных форм
кислорода
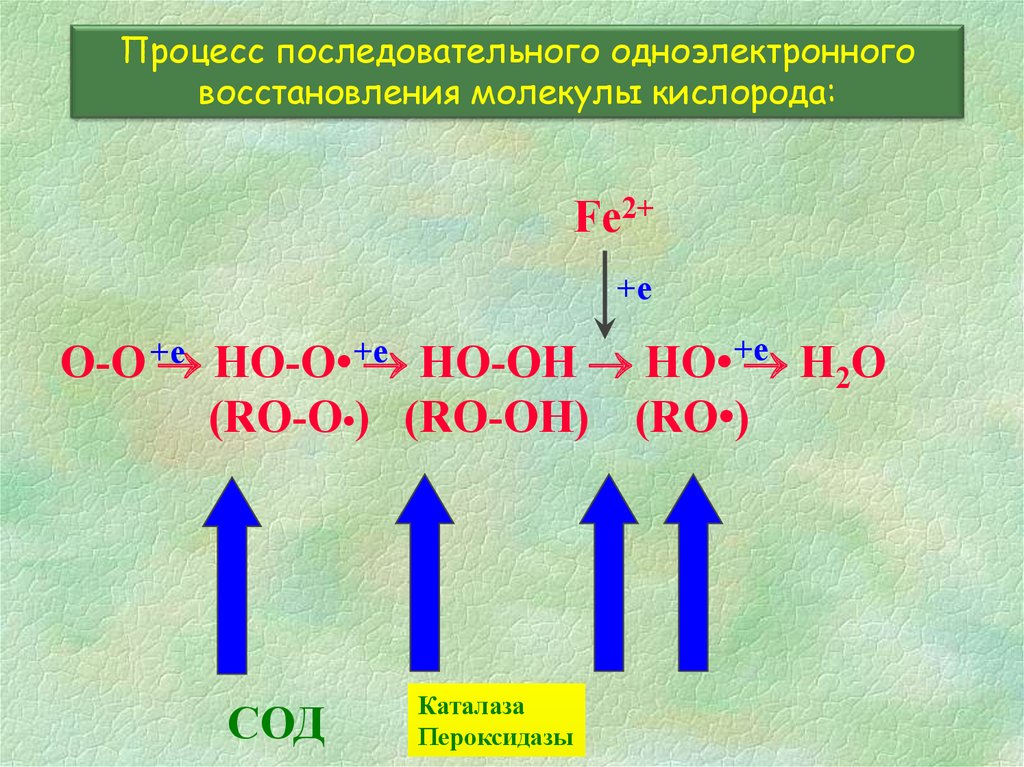
4.
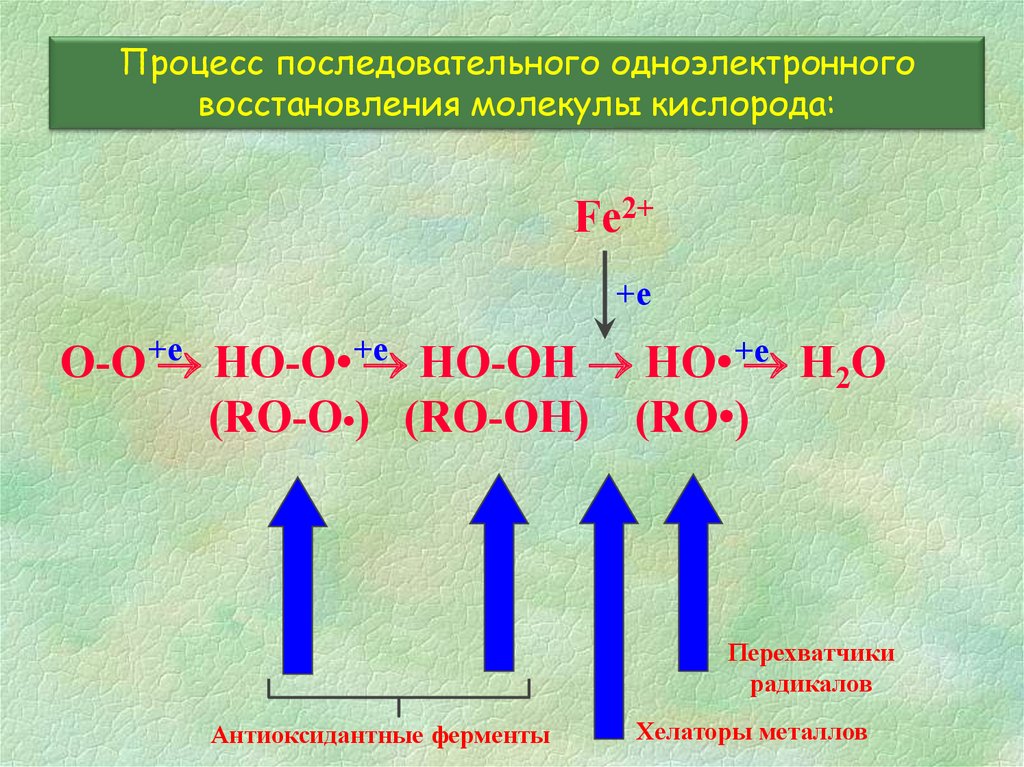
Процесс последовательного одноэлектронноговосстановления молекулы кислорода:
Fe2+
+е
O-O +е
HO-O• +е
HO-OH HO• +е
H2O
(RO-O•) (RO-OH) (RO•)
Перехватчики
радикалов
Антиоксидантные ферменты
Хелаторы металлов
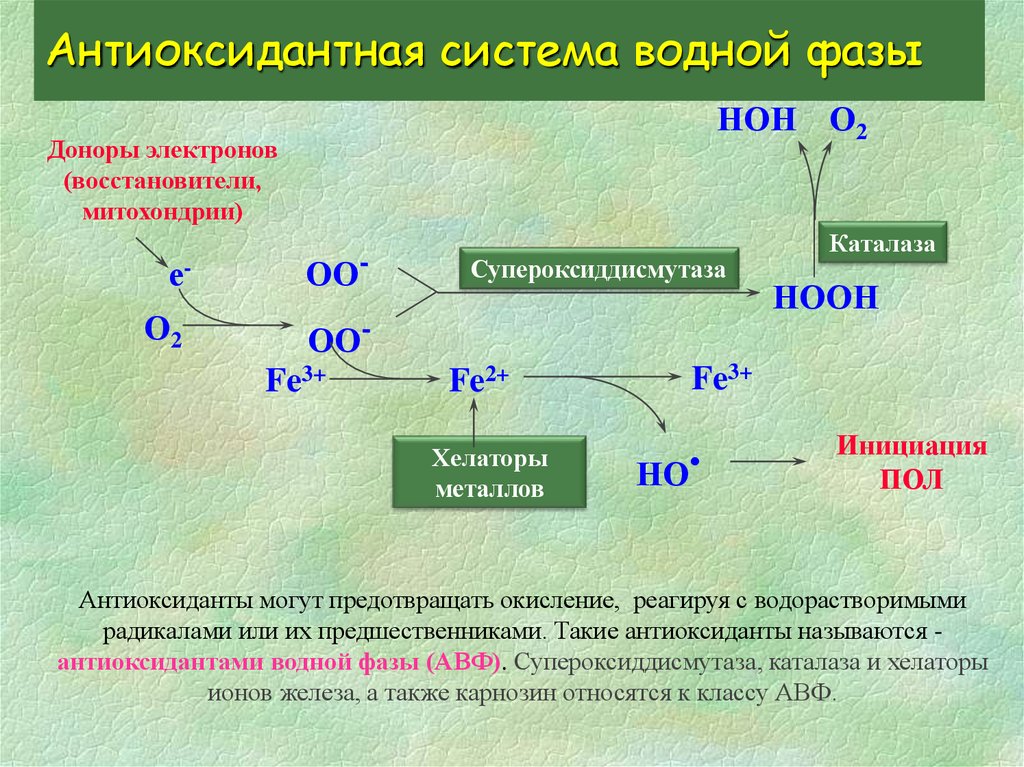
5. Антиоксидантная система водной фазы
НОН О2Доноры электронов
(восстановители,
митохондрии)
е-
ОО-
О2
ООFe3+
Супероксиддисмутаза
Fe2+
Хелаторы
металлов
Каталаза
НООН
Fe3+
НО
Инициация
ПОЛ
Антиоксиданты могут предотвращать окисление, реагируя с водорастворимыми
радикалами или их предшественниками. Такие антиоксиданты называются антиоксидантами водной фазы (АВФ). Супероксиддисмутаза, каталаза и хелаторы
ионов железа, а также карнозин относятся к классу АВФ.
6. Антиоксидантные ферменты
Супероксид дисмутаза7.
Процесс последовательного одноэлектронноговосстановления молекулы кислорода:
Fe2+
+е
O-O +е
HO-O• +е
HO-OH HO• +е
H2O
(RO-O•) (RO-OH) (RO•)
СОД
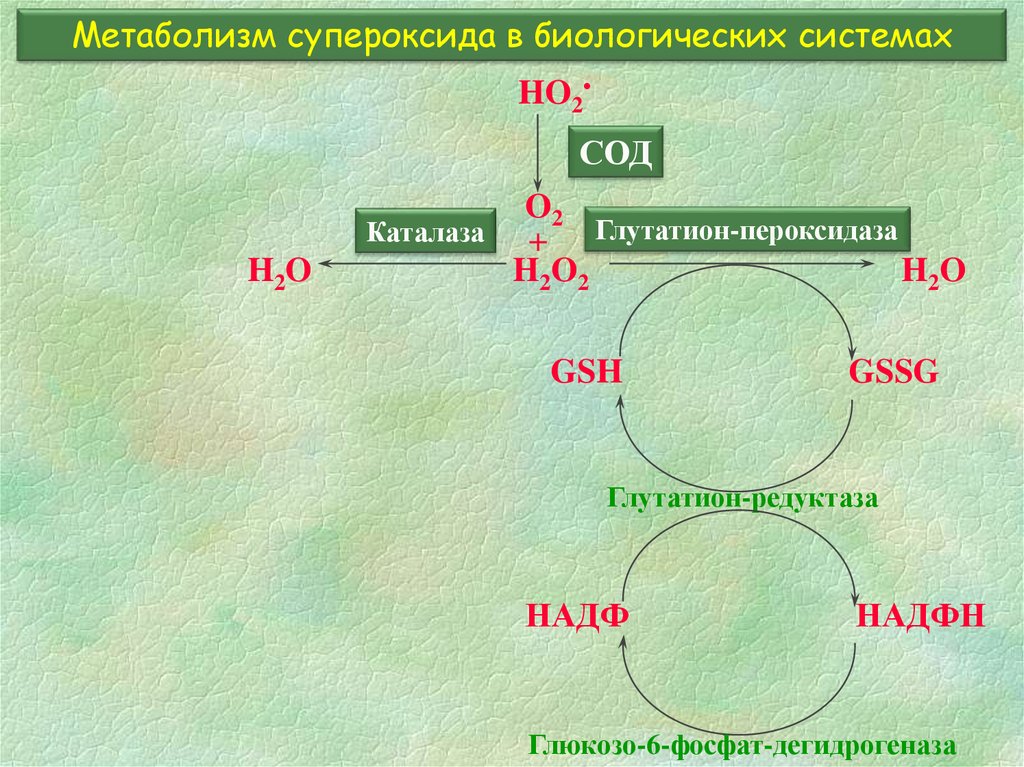
8. Метаболизм супероксида в биологических системах
HO2СОД
H2O
O2
Каталаза
+ Глутатион-пероксидаза
H2O 2
H2O
GSH
GSSG
Глутатион-редуктаза
НАДФ
НАДФН
Глюкозо-6-фосфат-дегидрогеназа
9. Супероксиддисмутаза
Супероксиддисмутаза (СОД) - единственный известный внастоящее время фермент, субстратом которого являются
свободные радикалы.
Супероксиддисмутаза катализирует следующую реакцию:
2HO2• O2 + H2O2
Фермент, обнаруженный МакКордом и Фридовичем, имеет
молекулярную массу 32 кД и состоит из двух субъединиц,
каждая из которых содержит по одному атому Сu и одному
атому Zn:
Сu2+
Сu2+
Zn2+
Zn2+
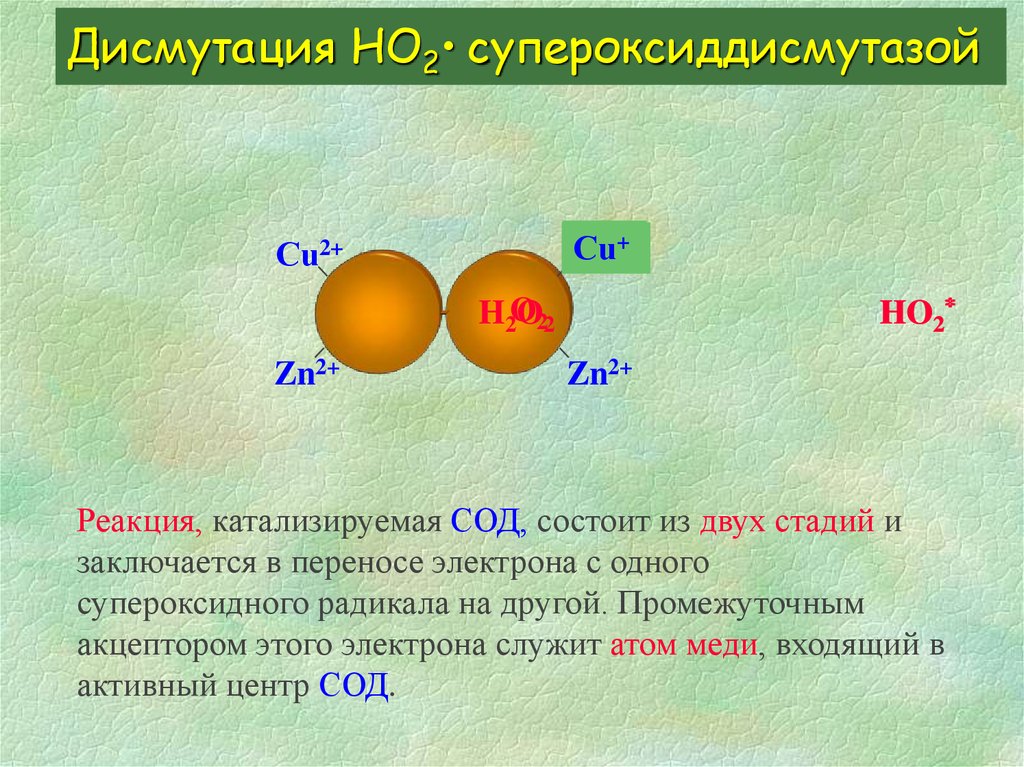
10. Дисмутация HО2• супероксиддисмутазой
Реакция, катализируемая СОД, состоит из двух стадий изаключается в переносе электрона с одного
супероксидного радикала на другой. Промежуточным
акцептором этого электрона служит атом меди, входящий в
активный центр СОД:
1. СОД-Сu2+ + HO2
2. СОД-Сu+
+ HO2
СОД-Сu+ + O2
СОД-Сu2+ + Н2О2
Zn2+ не участвует в каталитическом цикле, хотя и входит в
активный центр. Ионы металлов защищают молекулу СОД
от воздействий различных протеаз.
11. Дисмутация HО2• супероксиддисмутазой
+Сu2+
Сu2+
H2O
O22
Zn2+
HO2*
Zn2+
Реакция, катализируемая СОД, состоит из двух стадий и
заключается в переносе электрона с одного
супероксидного радикала на другой. Промежуточным
акцептором этого электрона служит атом меди, входящий в
активный центр СОД.
12. Измерение активности СОД
Генерацию радикалов осуществляют:-физически (например, радиолиз, электролиз);
-химически (например, распад пероксида и автоокисление);
-биохимически (например, энзиматически с помощью КсО).
Индикацию О2*- можно проводить непосредственно, измеряя его
поглощение, либо опосредованно, с помощью измерения изменения
свойств вспомогательного вещества или образования нового
продукта.
Y
ХЛ(units)
Здесь представлен метод
контроль(без СОД) фотохемилюминесценции:
интенсивность
люминесценции рибофлавина
в присутствии СОД падает при добавлении СОД.
Количество фермента
приводящее к 50% падению
сигнала принимается за
единицу его активности
20 Время (сек) 40
X
13. Антиоксидантные ферменты
Каталаза и Пероксидазы14.
Процесс последовательного одноэлектронноговосстановления молекулы кислорода:
Fe2+
+е
O-O +е
HO-O• +е
HO-OH HO• +е
H2O
(RO-O•) (RO-OH) (RO•)
СОД
Каталаза
Пероксидазы
15. Дезактивация перекиси водорода
Перекись водорода (Н2О2) - основной источник самыхтоксичных радикалов в живых системах - НО радикалов.
Следовательно, снижение уровня Н2О2 приведет к снижению
концентрации НО радикалов.
Удаление Н2О2 осуществляют два класса ферментов:
Каталаза:
2Н2О2
каталаза
Пероксидазы: Н2О2 + АН2
2Н2О + О2
пероксидаза
2Н2О + А
16. Как работают каталаза и пероксидаза?
Стадии ферментативного цикла каталазы:Cat-Fe5+(соединение 1) + 2H2O
1. Cat-Fe3+ + H2O2
2. Cat-Fe5+(соединение 1) + H2O2
каталаза:
2Н2О2
Cat-Fe3+ + О2
2Н2О + О2
Стадии ферментативного цикла пероксидазы:
1. Per-Fe3+ + H2O2
Per-Fe5+(соединение 1) + 2H2O
2. Per-Fe5+(соединение 1) + AH2
пероксидаза: Н2О2 + АН2
Per-Fe3+ + A
2Н2О + А
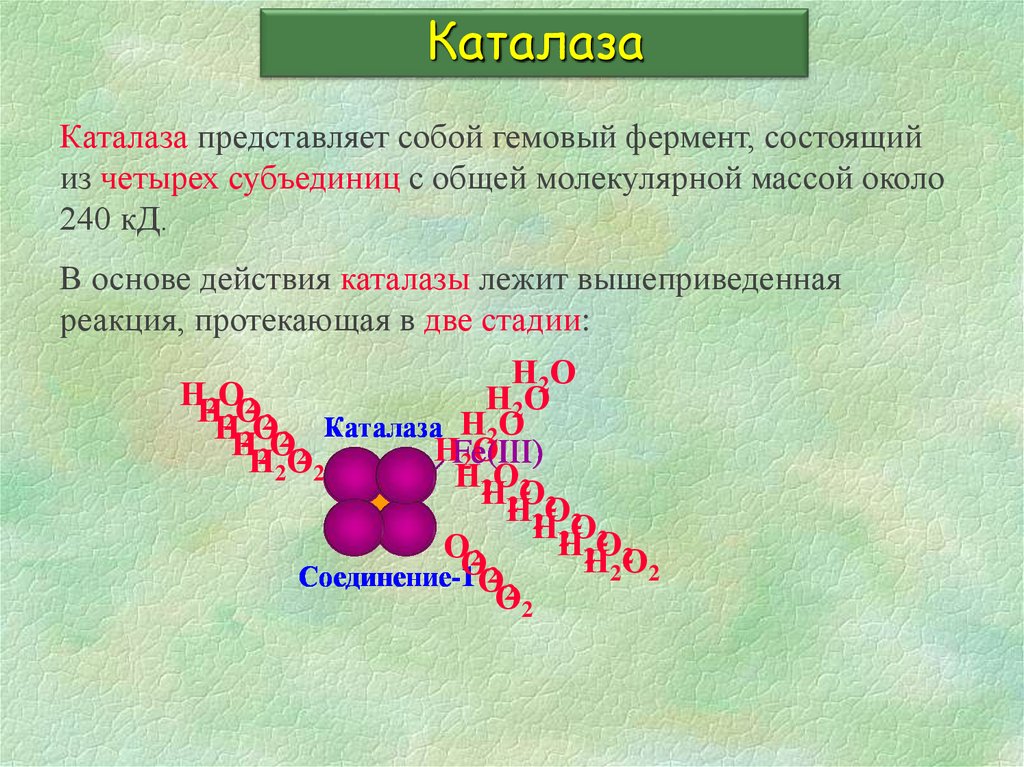
17. Каталаза
Каталаза представляет собой гемовый фермент, состоящийиз четырех субъединиц с общей молекулярной массой около
240 кД.
В основе действия каталазы лежит вышеприведенная
реакция, протекающая в две стадии:
Н 2О
НН2ОО2
Н2О
Н2Н2О2О2 Каталаза Н2О
НFe(III)
2О
Н2 2О2 2
НН
2ОО
2
2
2
НН
2ОО
2
2
2
НН
ОО2
2ОО
2
2
2
2
Соединение-1 О
О2
2
18. Пероксидазы
Пероксидазы также являются ферментами, разрушающимиН2О2 нерадикальным путем и образующими Н2О; при этом
окислению подвергается не вторая молекула Н2О2, как в случае
каталазы, а другие субстраты (АН2).
Рассмотрим реакцию с участием глутатион-пероксидазы:
GSSG
GSSG Н2О2
GSSGН2О2
GSSG
Н2О 2
GSSG
Н2О2
Н2О2
GSSG
2GSH
2H
2OO
2H
2 O
2GSH
2H
22GSH
Глутатион-пероксидаза
2H
2OO
2H
2H2 2GSH
2O 2GSH
19. Антиоксиданты, и способы их изучения
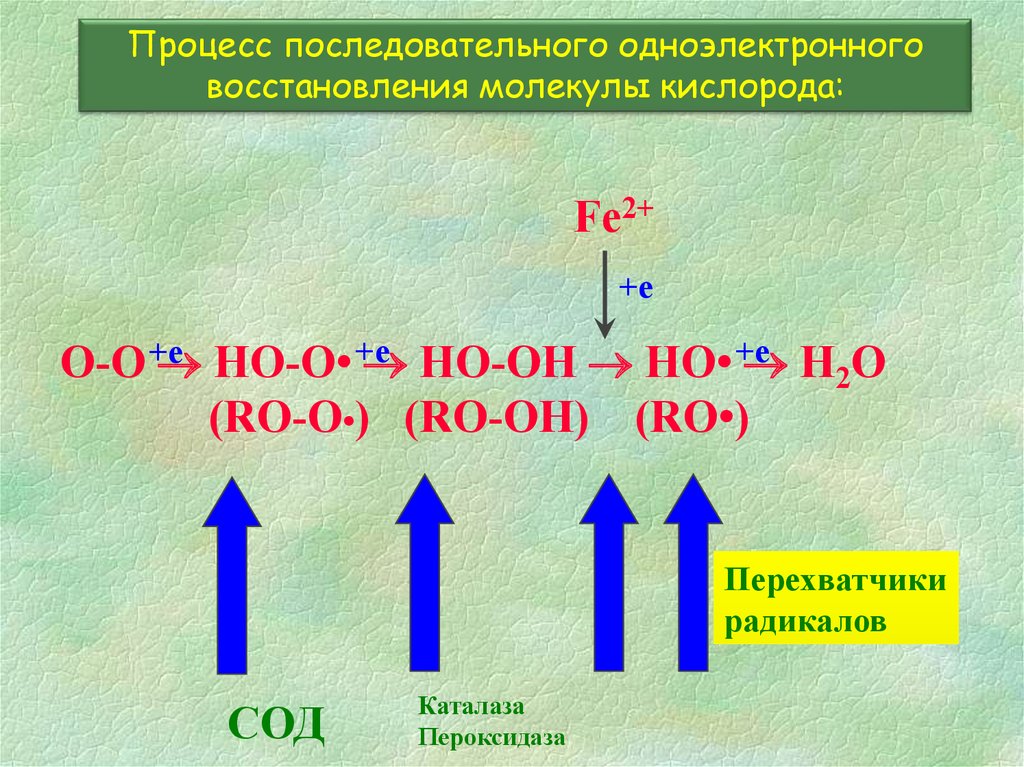
Перехватчики радикалов20.
Процесс последовательного одноэлектронноговосстановления молекулы кислорода:
Fe2+
+е
O-O +е
HO-O• +е
HO-OH HO• +е
H2O
(RO-O•) (RO-OH) (RO•)
Перехватчики
радикалов
СОД
Каталаза
Пероксидаза
21. Перехватчики радикалов
В качестве системы защиты организма от повреждающегодействия радикалов кислорода могут выступать
низкомолекулярные вещества, имеющие высокую
константу скорости взаимодействия с этими радикалами:
Аскорбиновая кислота (витамин С)
a –токоферол (витамин Е)
Сульфгидрильные соединения (глутатион, цистеин)
Мочевая кислота
Одно- и многоатомные спирты (этанол, рибоза,
глюкоза)
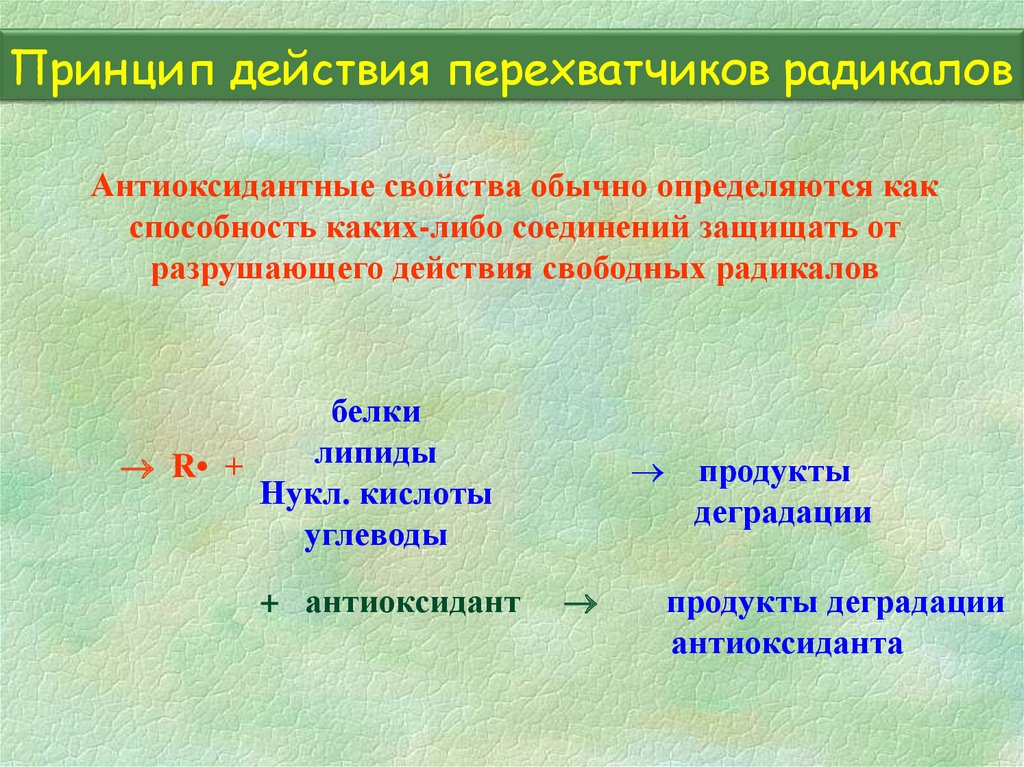
22. Принцип действия перехватчиков радикалов
Антиоксидантные свойства обычно определяются какспособность каких-либо соединений защищать от
разрушающего действия свободных радикалов
белки
липиды
R• +
Нукл. кислоты
углеводы
+ антиоксидант
продукты
деградации
продукты деградации
антиоксиданта
23.
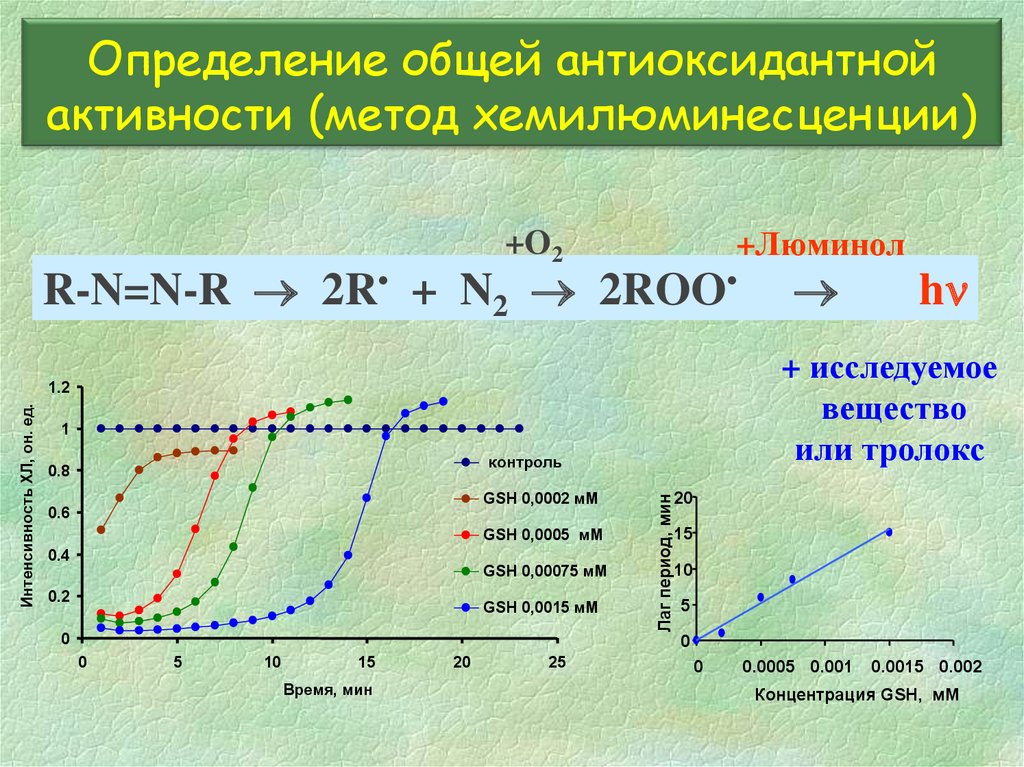
Определение общей антиоксидантнойактивности (метод хемилюминесценции)
+O2
+Люминол
R-N=N-R 2R• + N2 2ROO
контроль
GSH 0,0002 мМ
GSH 0,0005 мМ
0.4
GSH 0,00075 мМ
0.2
GSH 0,0015 мМ
0
20
Лаг период, мин
Интенсивность ХЛ, он. ед.
1
0.6
hn
+ исследуемое
вещество
или тролокс
1.2
0.8
15
10
5
0
0
5
10
15
Время, мин
20
25
0
0.0005 0.001
0.0015 0.002
Концентрация GSH, мМ
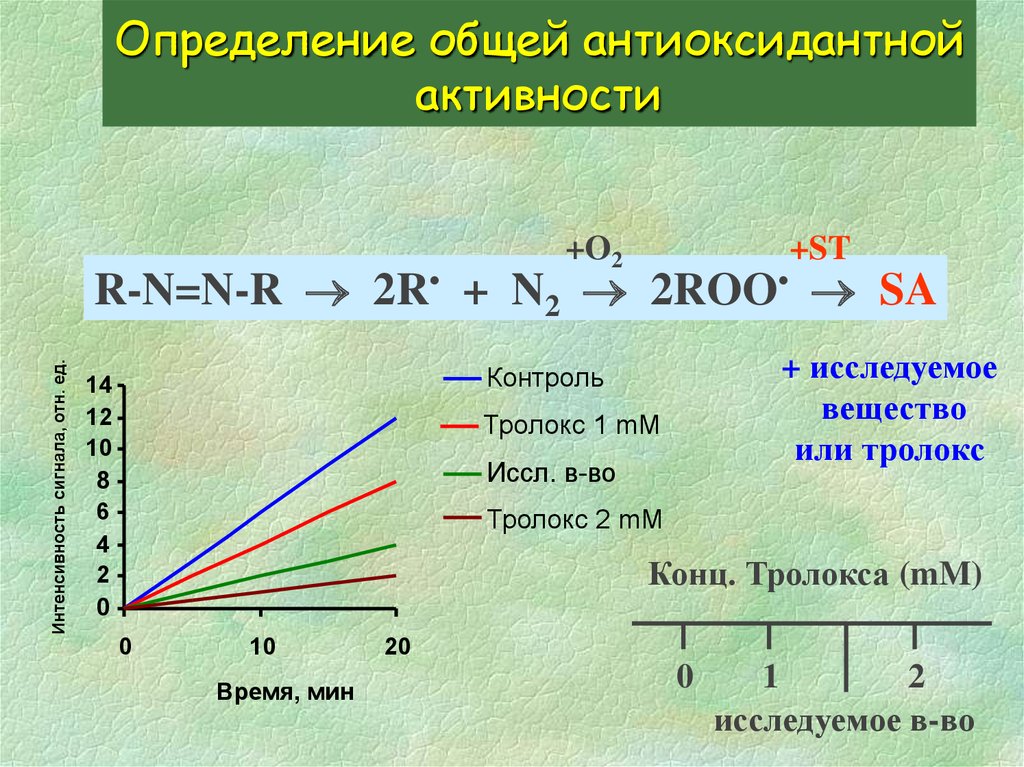
24. Определение общей антиоксидантной активности
+O2+ST
Интенсивность сигнала, отн. ед.
R-N=N-R 2R• + N2 2ROO• SA
+ исследуемое
вещество
или тролокс
Контроль
14
12
10
8
6
4
2
0
Тролокс 1 mM
Иссл. в-во
Тролокс 2 mM
Конц. Тролокса (mM)
0
10
Время, мин
20
0
1
2
исследуемое в-во
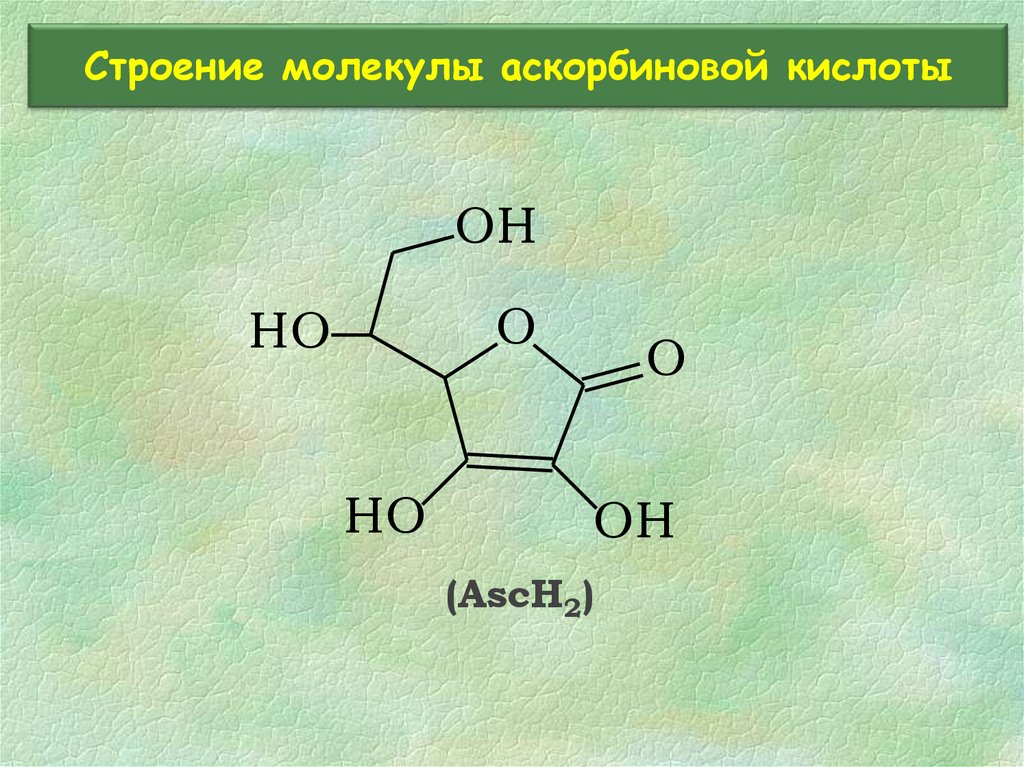
25. Строение молекулы аскорбиновой кислоты
OHO
HO
HO
O
OH
(AscH2)
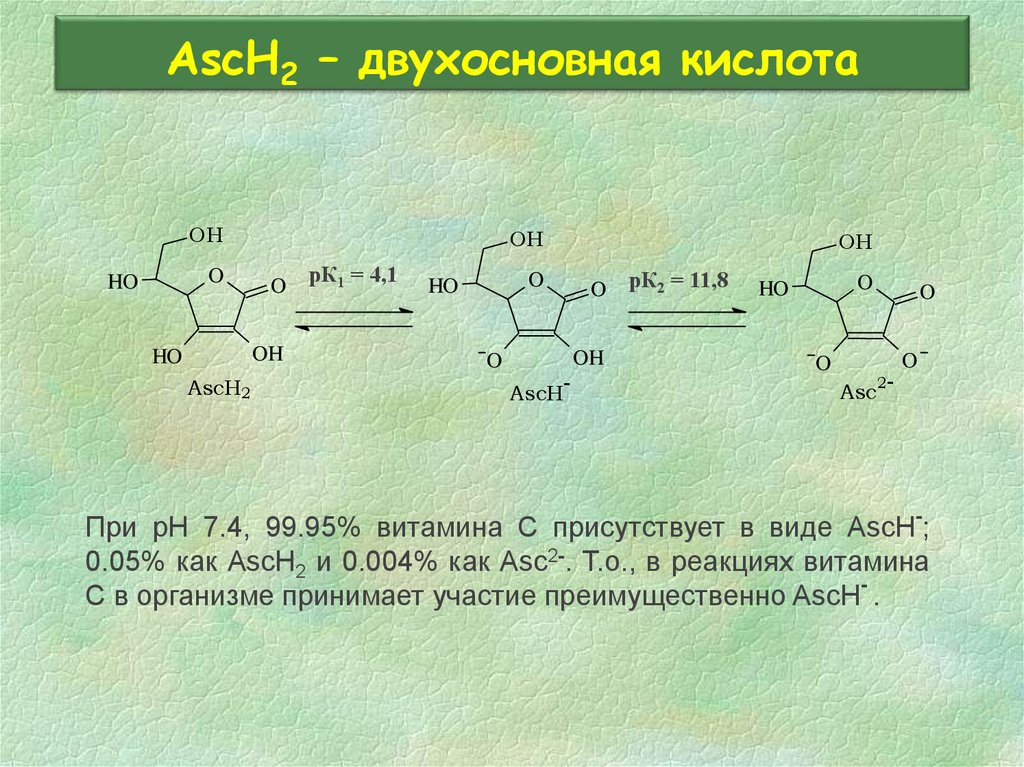
26. AscH2 – двухосновная кислота
OHO
HO
OH
O
OH
HO
AscH2
рК1 = 4,1
OH
O
HO
O
O
-
AscH
OH
рК2 = 11,8
O
HO
O
O
2-
O
Asc
При pH 7.4, 99.95% витамина C присутствует в виде AscH-;
0.05% как AscH2 и 0.004% как Asc2-. Т.о., в реакциях витамина
С в организме принимает участие преимущественно AscH- .
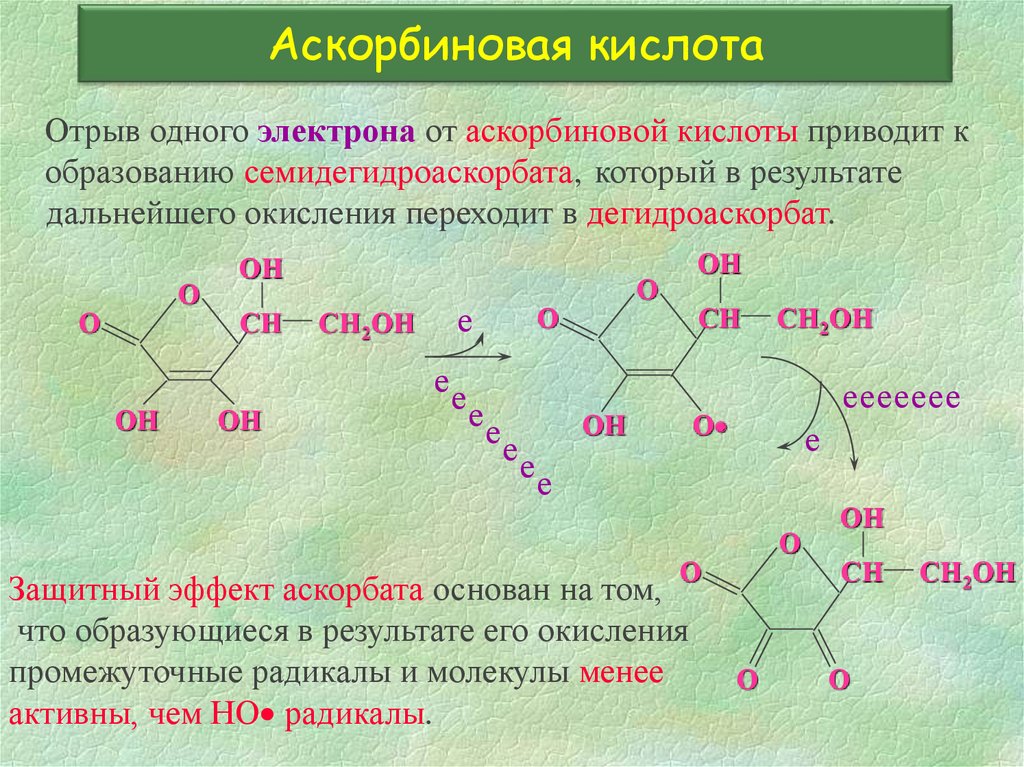
27. Аскорбиновая кислота
Отрыв одного электрона от аскорбиновой кислоты приводит кобразованию семидегидроаскорбата, который в результате
дальнейшего окисления переходит в дегидроаскорбат.
О
О
ОН
СН
е
СН2ОН
е
ОН
ОН
ее
О
О
ее
ОН
СН
ОH
е
СН2ОН
еееееее
О
е
е
О
О
Защитный эффект аскорбата основан на том,
что образующиеся в результате его окисления
промежуточные радикалы и молекулы менее
активны, чем НО радикалы.
О
ОН
СН
О
СН2ОН
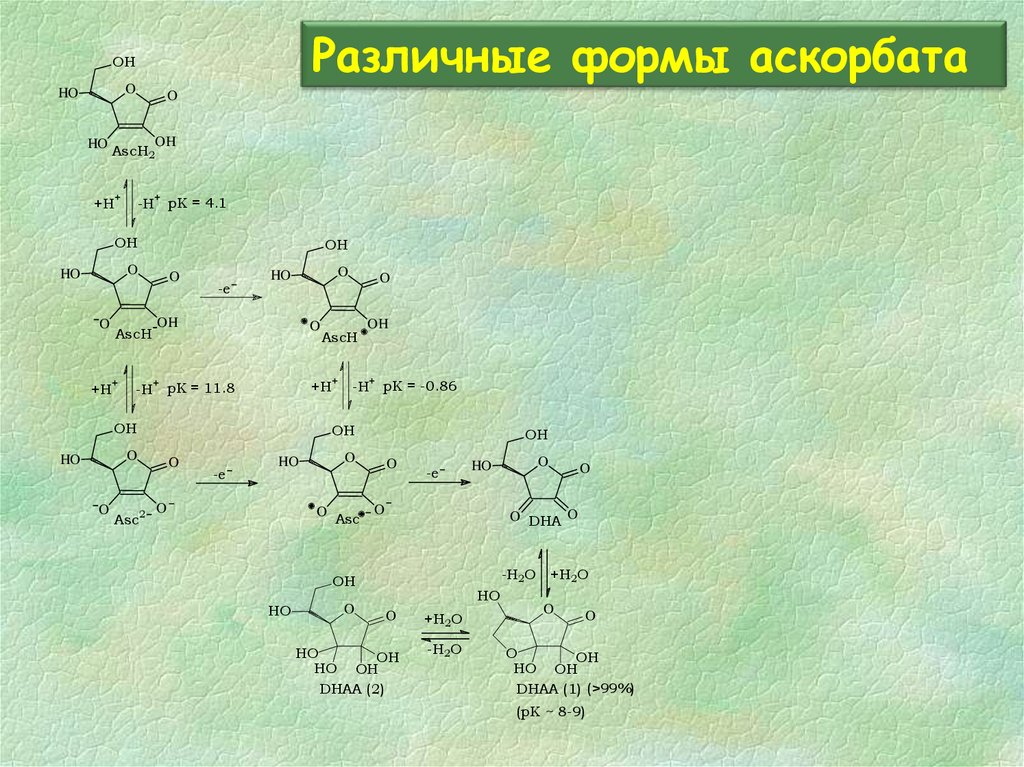
28. Различные формы аскорбата
OHO
HO
HO
O
OH
AscH2
+H
+
+
-H pK = 4.1
OH
OH
O
HO
O
+H
O
AscH
+
-e
O
HO
-OH
O
+
+H
-H
pK = 11.8
AscH
OH
O
+
OH
-H
+
pK = -0.86
OH
O
HO
O
O
2
Asc
-e
O
HO
O
OH
O
Asc
O
-e
O
O
O
O
O DHA O
-H2O +H2O
OH
HO
HO
HO
O
+H2O
HO
OH
HO OH
DHAA (2)
-H2O
O
O
O
OH
HO OH
DHAA (1) (>99%)
(pK ~ 8-9)
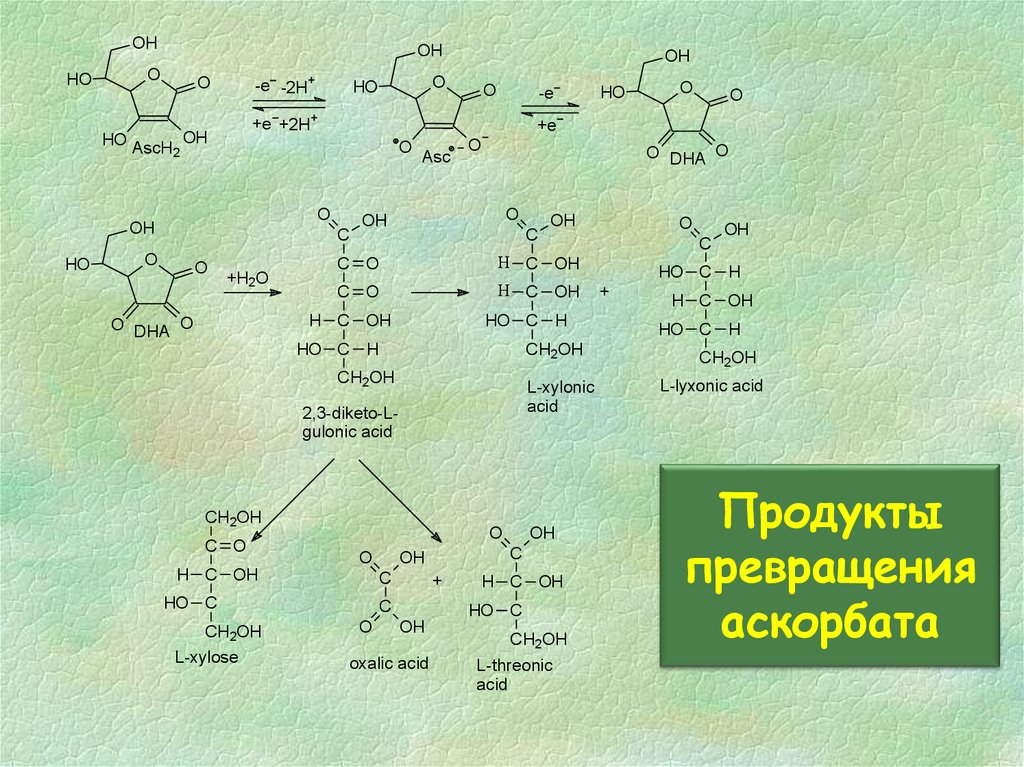
29. Продукты превращения аскорбата
OHHO
OH
O
-e -2H+
O
OH
O
HO
O
-e
+
+e +2H
HO AscH OH
HO
O
O
C
O
O
+H2O
Asc
O
O
C
H C OH
C O
H C OH
HO C H
CH2OH
CH2OH
L-xylonic
acid
2,3-diketo-Lgulonic acid
CH2OH
O
O
H C OH
+
C
O
OH
C
OH
C
HO C
CH2OH
L-xylose
OH
C O
HO C H
C O
O
O DHA O
OH
H C OH
O DHA O
O
+e
2
OH
HO
H C OH
HO C
OH
oxalic acid
CH2OH
L-threonic
acid
O
C
OH
HO C H
+
H C OH
HO C H
CH2OH
L-lyxonic acid
Продукты
превращения
аскорбата
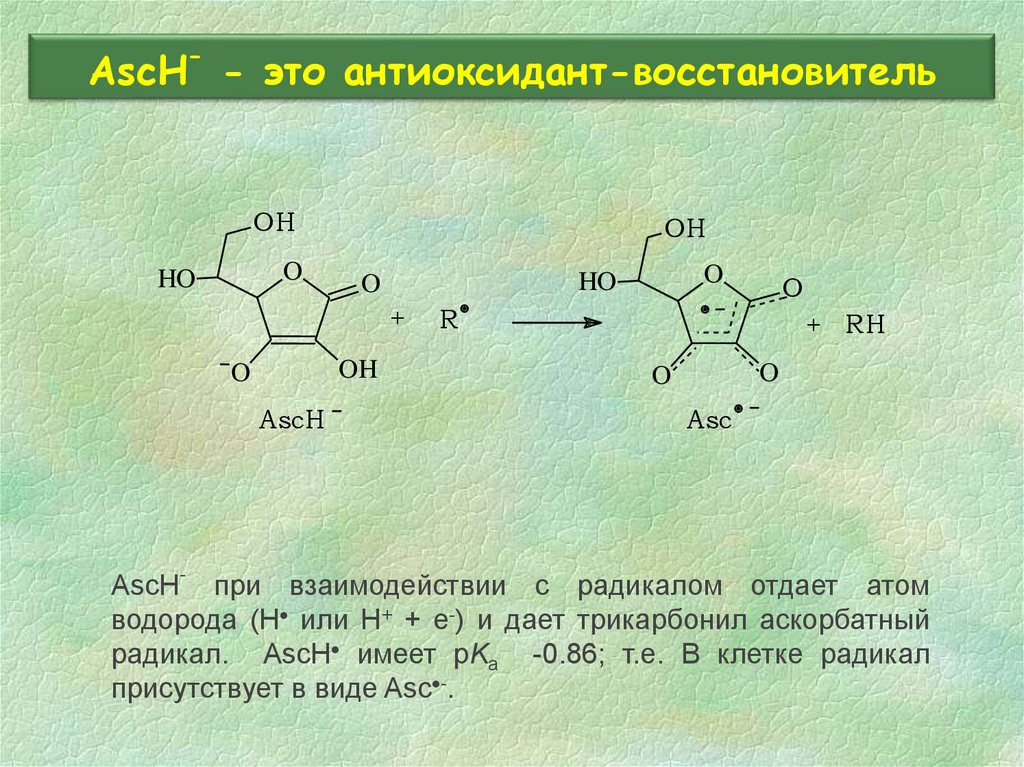
30. AscH- - это антиоксидант-восстановитель
-AscH - это антиоксидант-восстановитель
OH
O
HO
OH
+
OH
O
AscH
O
HO
O
O
R
+ RH
O
O
Asc
AscH- при взаимодействии с радикалом отдает атом
водорода (H или H+ + e-) и дает трикарбонил аскорбатный
радикал. AscH имеет pKa -0.86; т.е. В клетке радикал
присутствует в виде Asc -.
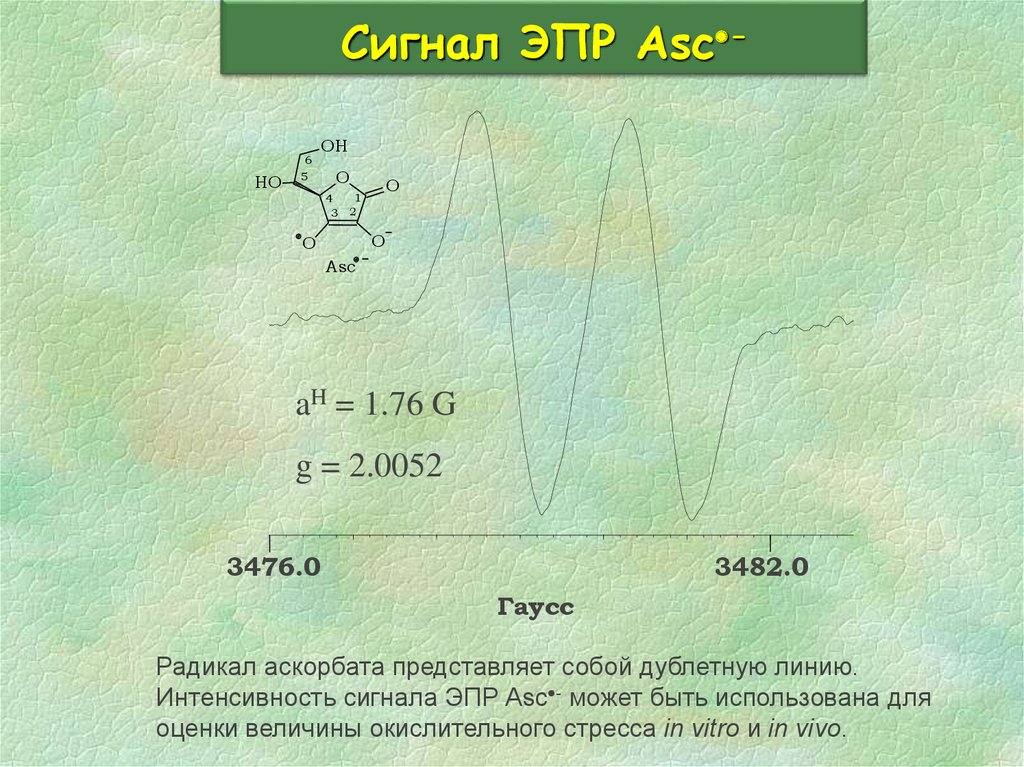
31. Сигнал ЭПР Asc-
Сигнал ЭПР Asc HO6
5
OH
O
O
1
4
3 2
O
O
Asc
aH = 1.76 G
g = 2.0052
3476.0
3482.0
Гаусс
Радикал аскорбата представляет собой дублетную линию.
Интенсивность сигнала ЭПР Asc - может быть использована для
оценки величины окислительного стресса in vitro и in vivo.
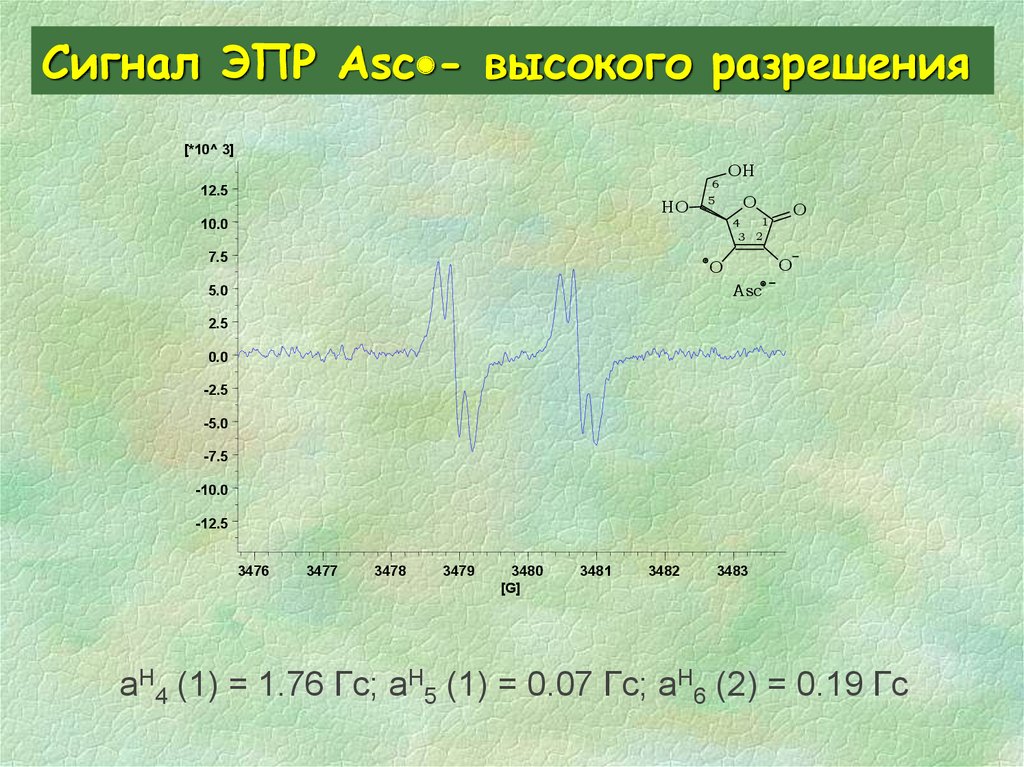
32. Сигнал ЭПР Asc- высокого разрешения
Сигнал ЭПР Asc - высокого разрешения[*10^ 3]
12.5
HO
6
5
O
O
1
4
3 2
10.0
7.5
OH
O
O
Asc
5.0
2.5
0.0
-2.5
-5.0
-7.5
-10.0
-12.5
3476
3477
3478
3479
3480
[G]
3481
3482
3483
aH4 (1) = 1.76 Гс; aH5 (1) = 0.07 Гс; aH6 (2) = 0.19 Гс
33. Константы скорости взаимодействия аскорбата с некоторыми радикалами
Радикал (R•)kэфф/М-1с-1 (рН=7,4)
HO (гидроксильный радикал)
1.1 x 1010
RO (трет-бутил алкоксильный
радикал
1.6 x 109
RОO (алкил перекисный радикал)
2 x 106
GS (глутатиильный радикал)
6 x 108
UH (радикал мочевой кислоты)
1 x 106
TO (токофероксильный радикал)
2 x 105
Asc (дисмутация)
2 x 105
102
Fe(III)EDTA/ Fe(II)EDTA
O2 -/НО2
2.7 x 105
Fe(III)десферал/ Fe(II) десферал
Очень медленно
Приведенные константы скорости соответствуют реакции:
AscH + R Asc + RH
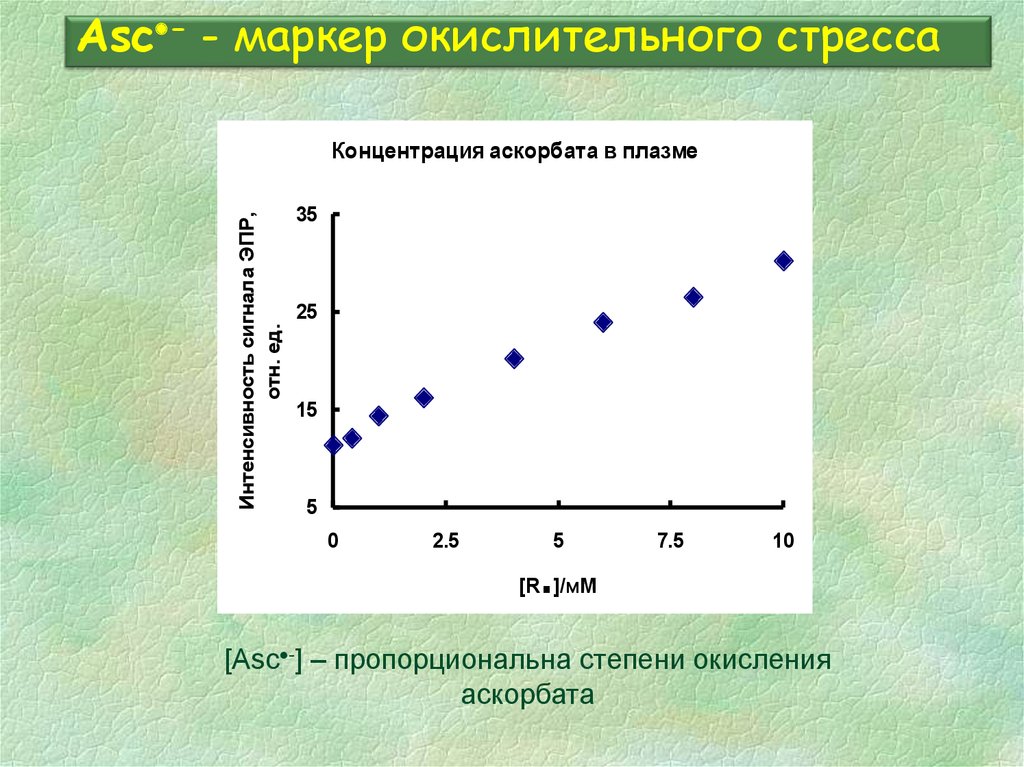
34. Asc- - маркер окислительного стресса
Asc - - маркер окислительного стрессаИнтенсивность сигнала ЭПР,
отн. ед.
Концентрация аскорбата в плазме
35
25
15
5
0
2.5
5
7.5
10
.
[R ]/мМ
[Asc -] – пропорциональна степени окисления
аскорбата
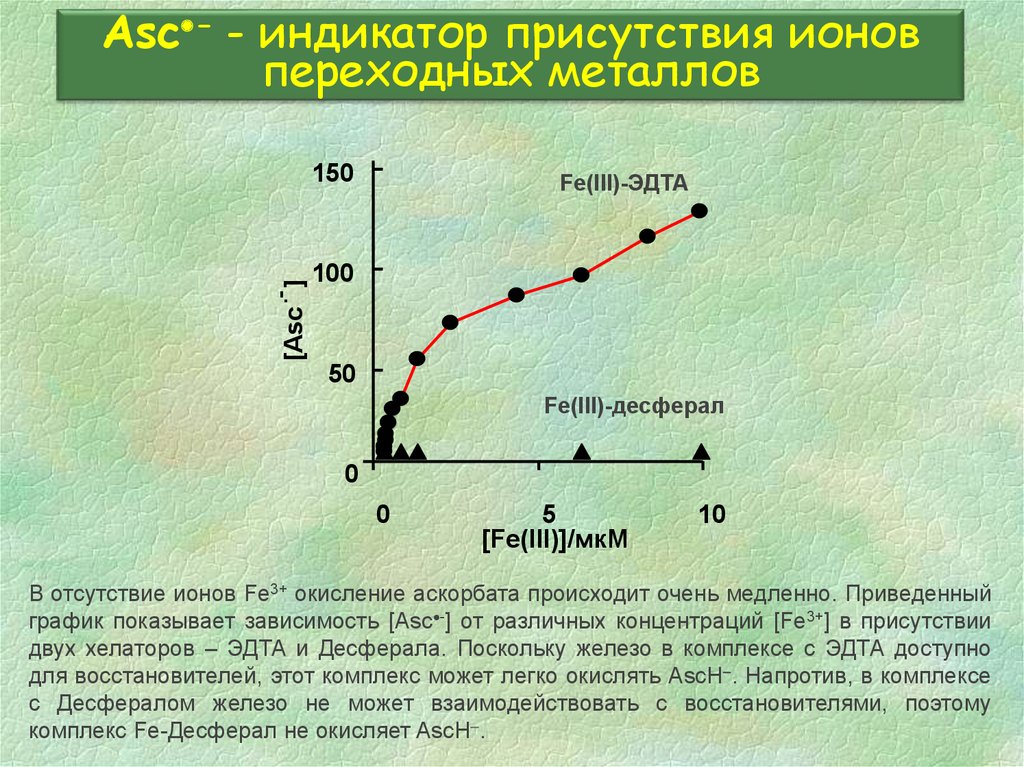
35. Asc- - индикатор присутствия ионов переходных металлов
Asc - - индикатор присутствия ионовпереходных металлов
Fe(III)-ЭДТА
100
.-
[Asc ]
150
50
Fe(III)-десферал
0
0
5
[Fe(III)]/мкM
10
В отсутствие ионов Fe3+ окисление аскорбата происходит очень медленно. Приведенный
график показывает зависимость [Asc -] от различных концентраций [Fe3+] в присутствии
двух хелаторов – ЭДТА и Десферала. Поскольку железо в комплексе с ЭДТА доступно
для восстановителей, этот комплекс может легко окислять AscH . Напротив, в комплексе
с Десфералом железо не может взаимодействовать с восстановителями, поэтому
комплекс Fe-Десферал не окисляет AscH .
36. Аскорбиновая кислота
Здесь представлено изменение кинетики хемилюминесценции,сопровождающей перекисное окисление липосом в присутствии
аскорбиновой кислоты.
ХЛ (мВ)
4
0 мкМ
3
2
5 мкМ
1
10 мкМ
0
0
1
2
3
4
5
Время (мин)
Аскорбат увеличивает латентный период хемилюминесценции
в результате регенерации двухвалентного железа, окисляющегося в
ходе процесса липидной пероксидации.
















 chemistry
chemistry








