Similar presentations:
Соли серной кислоты
1. 22. Соли серной кислоты
Из всех, прошедших этот трудный путь,Вернулся ли назад хоть кто-нибудь?
В дороге ничего не оставляйте –
Обратно
не
удастся
повернуть
О. Хайям
2. Соли серной кислоты
Сульфаты (от лат. sulphur, sulfur – сера), сернокислые соли, соли
серной кислоты H2SO4. Имеются два ряда сульфатов – средние
(нормальные) общей формулы M2SO4 и кислые (гидросульфаты) –
MHSO4, где М – одновалентный металл.
Сульфаты – кристаллические вещества, бесцветные (если катион
бесцветен), в большинстве случаев хорошо растворимые в воде.
Малорастворимые сульфаты встречаются в виде минералов: гипса
CaSO4·2H2O, целестина SrSO4, англезита PbSO4 и др.
Практически нерастворимы барит BaSO4 и RaSO4.
Кислые сульфаты выделены в твёрдом состоянии лишь для наиболее
активных металлов – Na, K и др. Они хорошо растворимы в воде, легко
плавятся.
Нормальные сульфаты можно получить растворением металлов в
H2SO4, действием H2SO4 на окиси, гидроокиси, карбонаты металлов и
др.
Гидросульфаты получают нагреванием нормальных сульфатов с
концентрированной H2SO4: K2SO4 + H2SO4 = 2KHSO4.
Кристаллогидраты сульфатов некоторых тяжёлых металлов
называются купоросами.
Широкое применение во многих отраслях промышленности находят
природные сульфаты.
3. Урок №53. Сульфати
4. Соли серной кислоты
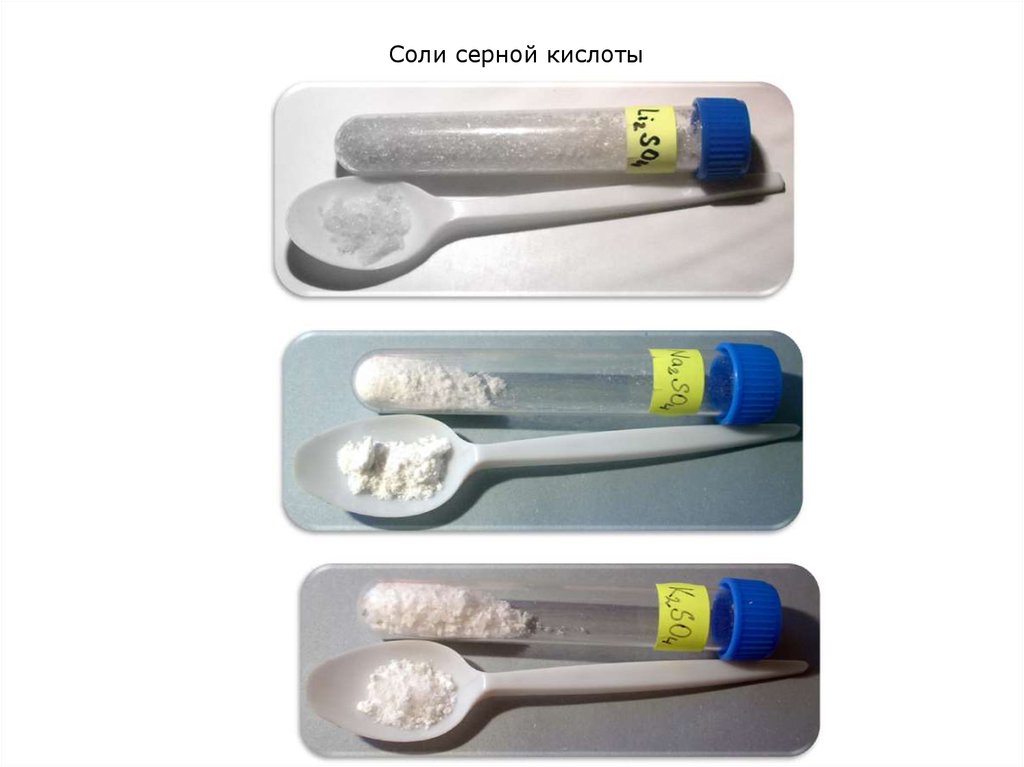
5. Соли серной кислоты
6. Соли серной кислоты
7. Соли серной кислоты
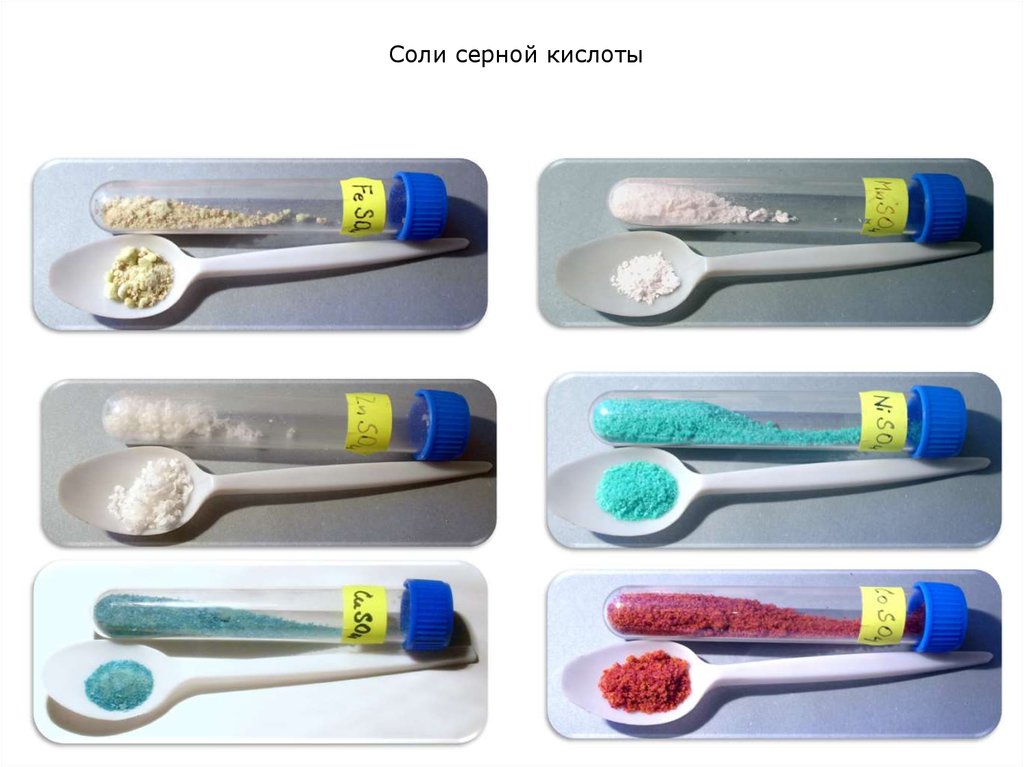
Na2SO4FeSO4·7H2O
CuSO4·5Н2О
MnSO4·5Н2О
NiSO4·7Н2О
Fe2(SO4)3·5H2O
MgSO4
8.
Ce(SO4)2·4H2OMnSO4·H2O
CoSO4·7H2O
FeSO4·7H2O
VOSO4·xH2O
9. Соли серной кислоты
CuSO4CuSO4·5H2O
[Cu(NH3)4SO4]·H2O
10. Соли серной кислоты
NiSO4·6H2ONiSO4
11.
Fe (NH4)2(SO4)2·6H2OСоль Мора
12. Соли серной кислоты
KAl(SO4)2·12H2OKCr(SO4)2·12H2O










 chemistry
chemistry








