Similar presentations:
Ионная химическая связь
1. Ионная химическая связь
30.09.20172. Благородные газы
Благородные или инертные газыНазваны так, потому что эти элементы
отличаются малой химической активностью,
инертные газы практически не встречаются в
составе сложных веществ
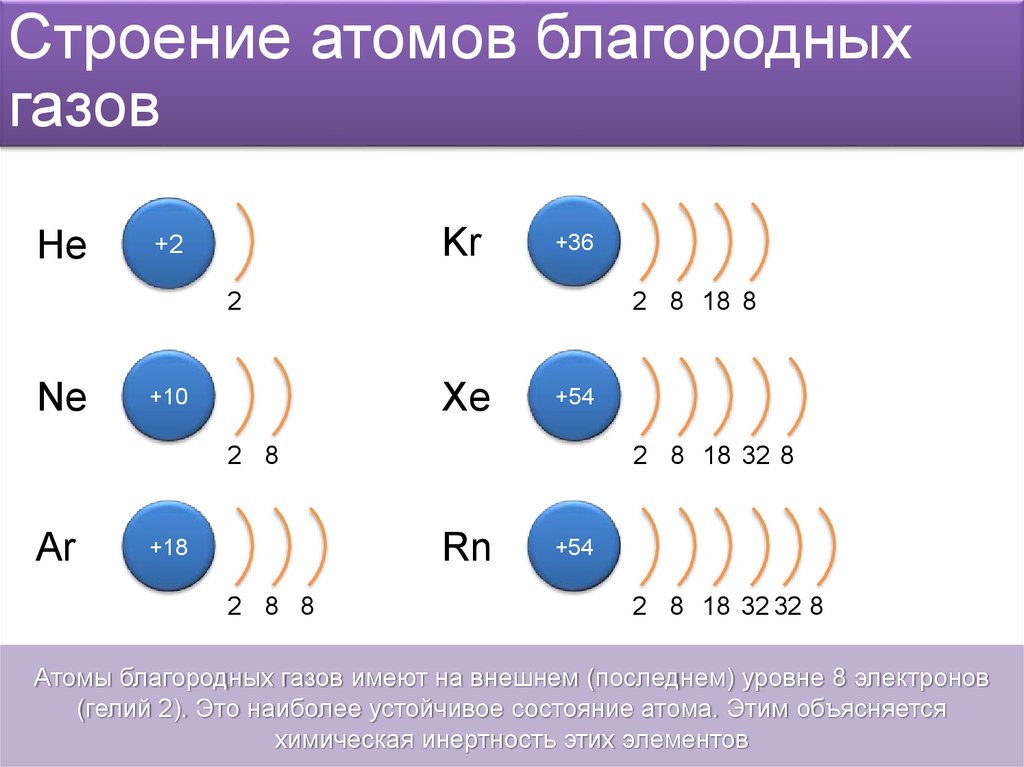
3. Строение атомов благородных газов
HeKr
+2
+36
2
Ne
2 8 18 8
Xe
+10
+54
2 8
Ar
2 8 18 32 8
Rn
+18
2 8 8
+54
2 8 18 32 32 8
Атомы благородных газов имеют на внешнем (последнем) уровне 8 электронов
(гелий 2). Это наиболее устойчивое состояние атома. Этим объясняется
химическая инертность этих элементов
4. Что делать атомам других элементов?
Na+11
Cl
+17
2 8 1
2 8 8
7
заветная восьмерка
не хватает 1 еത до заветной
восьмерки
Химические элементы
Ме
НеМе
металлы
неметалл
Имеют тенденцию к отдаче
электронов
Имеют тенденцию к принятию
электронов
5.
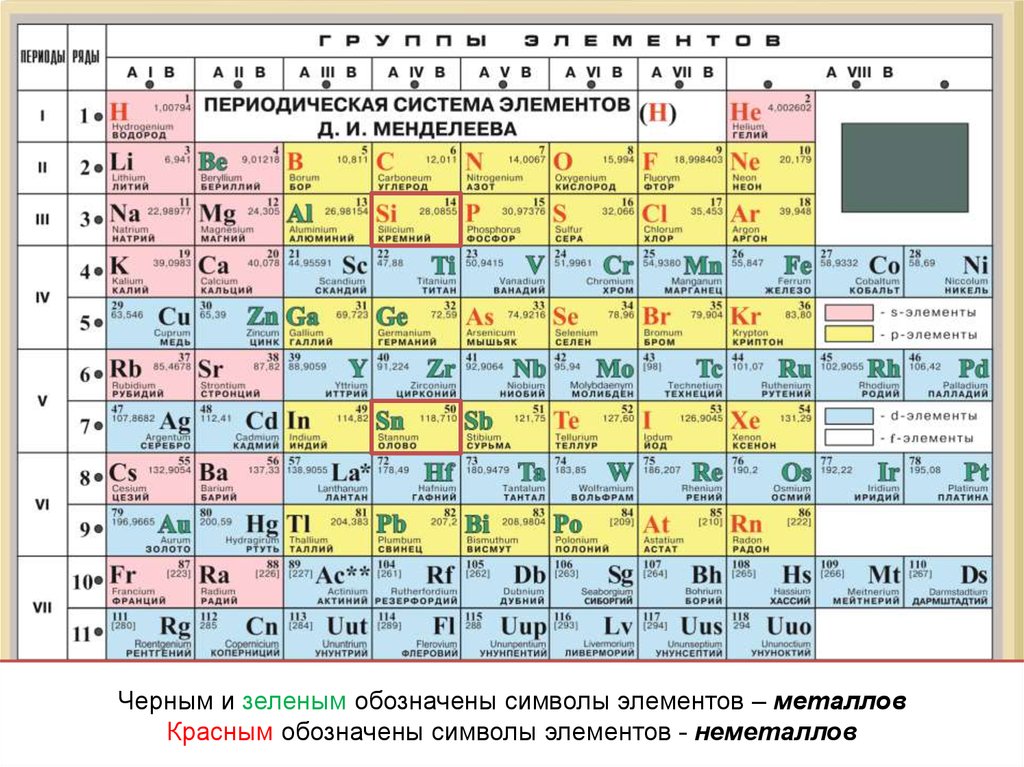
Черным и зеленым обозначены символы элементов – металловКрасным обозначены символы элементов - неметаллов
6. Элементы IV группы, главной подгруппы
SiSn
+18
2 8 4
У атома кремния 4 внешних
электрона находятся на небольшом
расстоянии от ядра, сила притяжения
этих электронов к ядру велика,
поэтому атом кремния – неметалл
(принимает электроны)
+50
2 8 18 32 4
У атома олова 4 внешних электрона
находятся на большом расстоянии от
ядра, сила притяжения этих
электронов к ядру невелика, поэтому
атом кремния –металл (отдает
электроны)
Вывод: способность принимать или отдавать электроны зависит не только от того,
сколько электронов на внешнем уровне, но и от того, как далеко эти электроны
находятся от ядра
7.
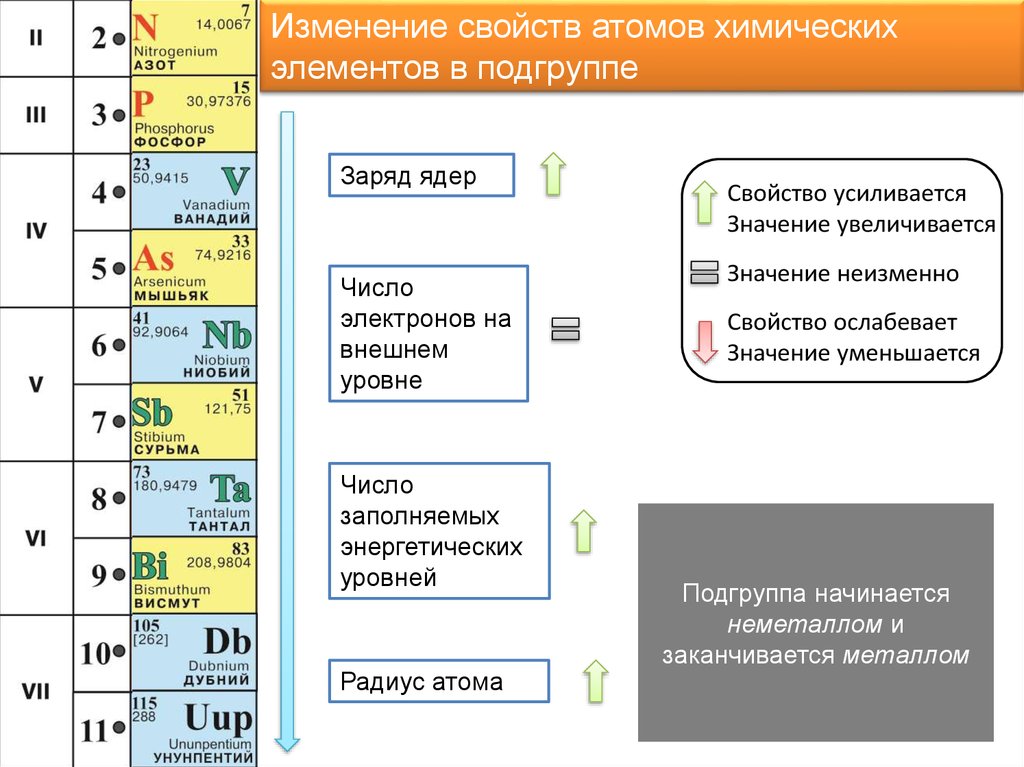
Изменение свойств атомов химическихэлементов в подгруппе
Заряд ядер
Число
электронов на
внешнем
уровне
Число
заполняемых
энергетических
уровней
Радиус атома
Свойство усиливается
Значение увеличивается
Значение неизменно
Свойство ослабевает
Значение уменьшается
Подгруппа начинается
неметаллом и
заканчивается металлом
8.
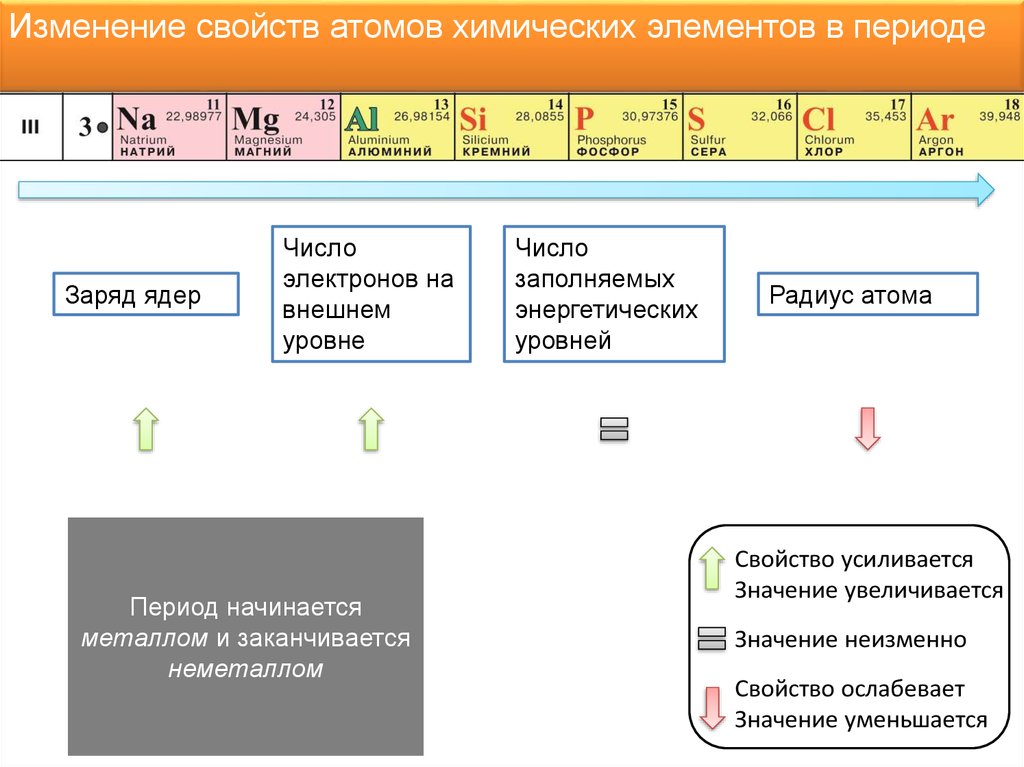
Изменение свойств атомов химических элементов в периодеЗаряд ядер
Число
электронов на
внешнем
уровне
Период начинается
металлом и заканчивается
неметаллом
Число
заполняемых
энергетических
уровней
Радиус атома
Свойство усиливается
Значение увеличивается
Значение неизменно
Свойство ослабевает
Значение уменьшается
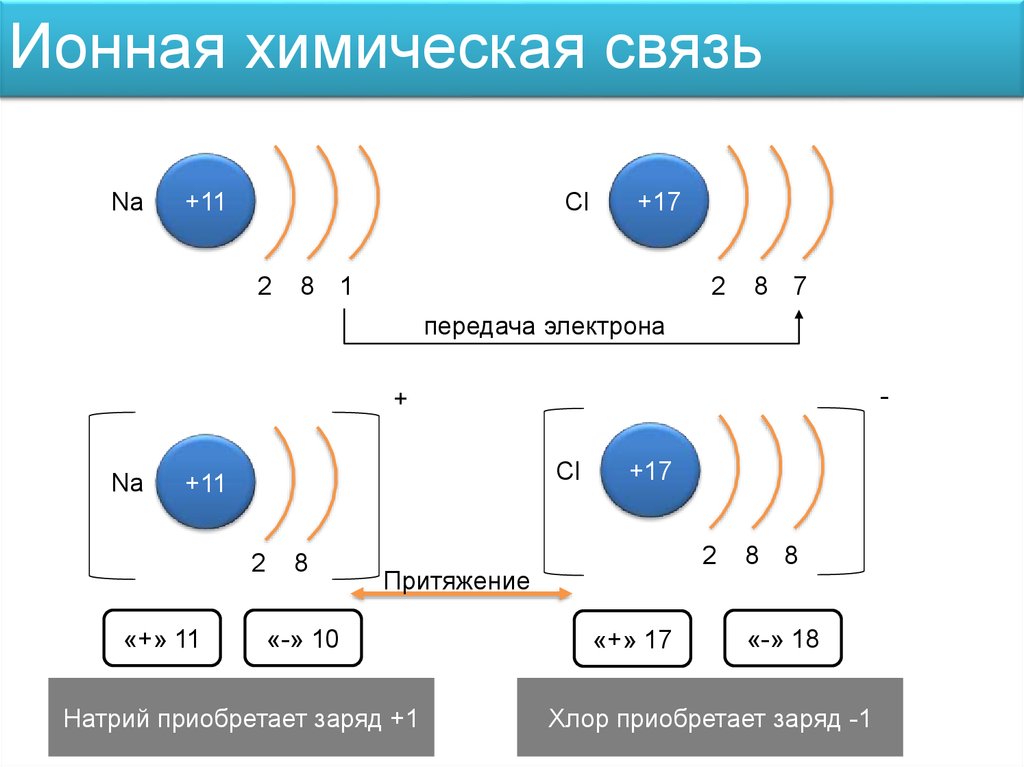
9. Ионная химическая связь
NaCl
+11
2
+17
8 1
2
8 7
передача электрона
-
+
Na
Cl
+11
2
«+» 11
8
+17
2
Притяжение
«-» 10
Натрий приобретает заряд +1
«+» 17
8 8
«-» 18
Хлор приобретает заряд -1
10.
Ионная химическая связьСхема образования ионной связи





 chemistry
chemistry








