Similar presentations:
Химическая связь
1.
Химическая связь2.
Атомы благородных газов имеютзавершённый внешний энергетический
уровень. Он наиболее устойчив и
стабилен, что является причиной
инертности атомов благородных газов.
Атомы других элементов пытаются
приобрести конфигурацию ближайшего
благородного газа и перейти в наиболее
устойчивое состояние.
Такое состояние атомы приобретают,
взаимодействуя между собой, в
результате между ними возникает
химическая связь.
3. Химическая связь.
Под химической связью понимают такоевзаимодействие атомов,
которое связывает их в
молекулы, ионы, радикалы,
кристаллы.
4.
5.
Величина валентности элемента определяетсячислом химических связей, которые атом
элемента образует с другими атомами.
6.
У элементов главных подгрупп это электронывнешнего энергетического уровня. Они
расположены дальше от ядра и менее прочно
связаны с ним. В зависимости от способа
образования завершённых электронных структур
атомов различают несколько видов химической
связи.
7.
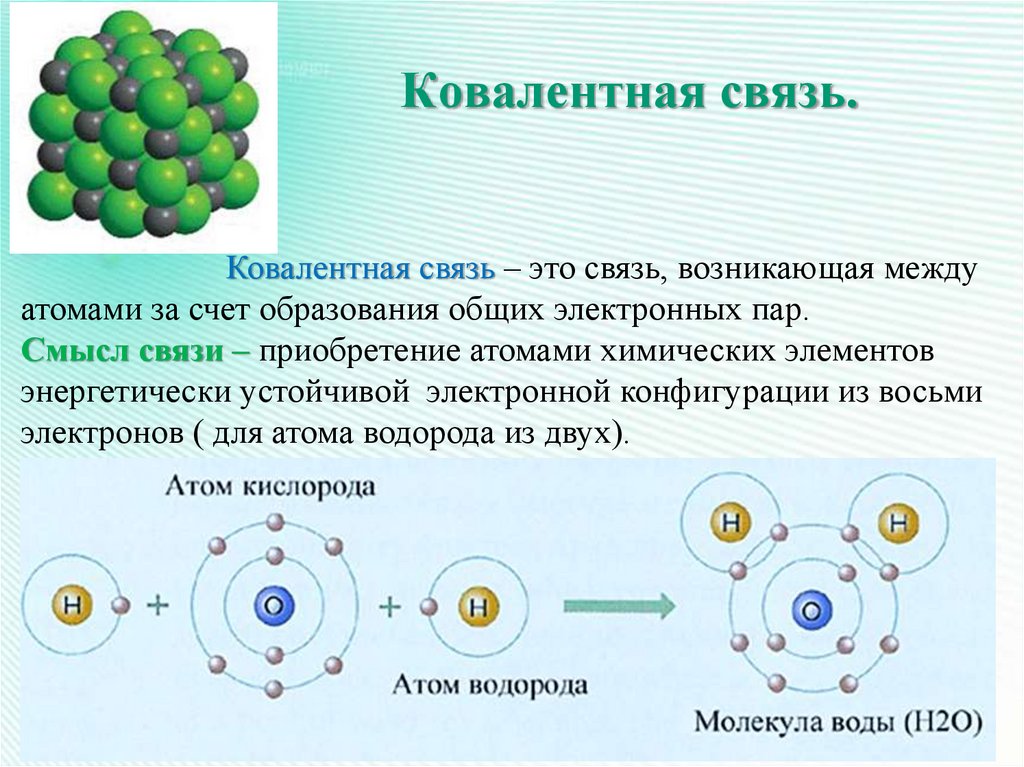
8. Ковалентная связь.
Ковалентная связь – это связь, возникающая междуатомами за счет образования общих электронных пар.
Смысл связи – приобретение атомами химических элементов
энергетически устойчивой электронной конфигурации из восьми
электронов ( для атома водорода из двух).
9.
10.
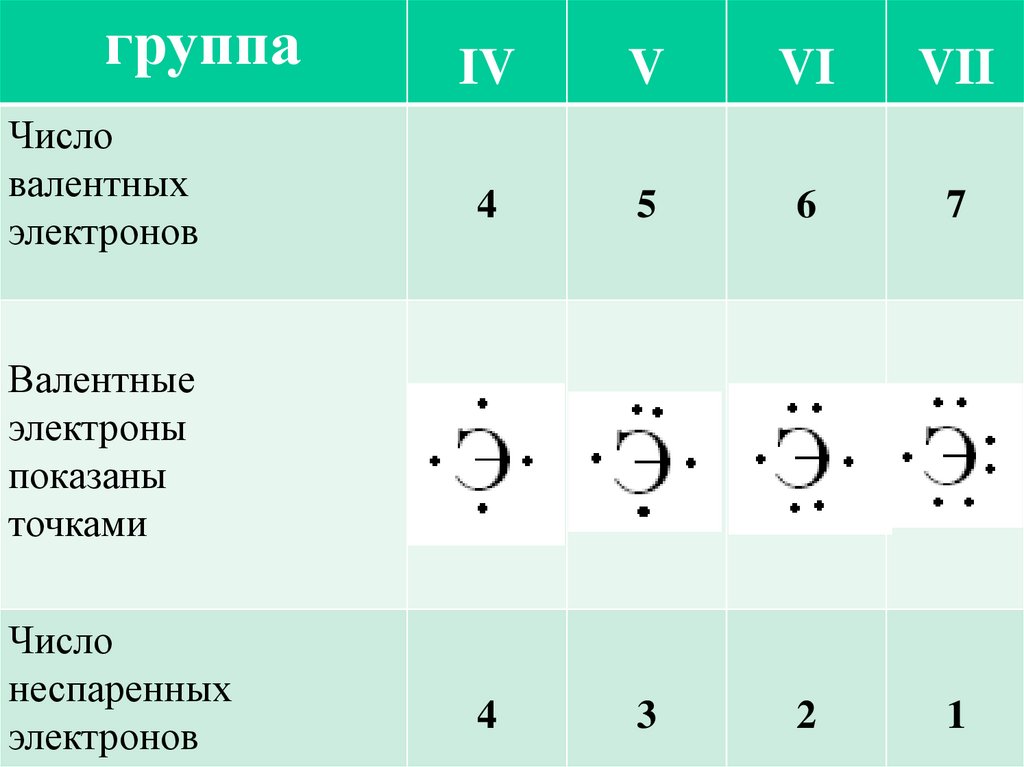
группаЧисло
валентных
электронов
IV
V
VI
VII
4
5
6
7
4
3
2
1
Валентные
электроны
показаны
точками
Число
неспаренных
электронов
11.
Неспаренные Общая или поделённаяэлектроны
пара электронов
Между ядрами образуется сгущение
отрицательного заряда, который
притягивает к себе ядра атомов.
12.
Для завершения внешнего слоя каждому атому нехватает по 1е-.За счёт образования ковалентной
связи каждый атом в молекуле приобретает
завершённый внешний слой.
13.
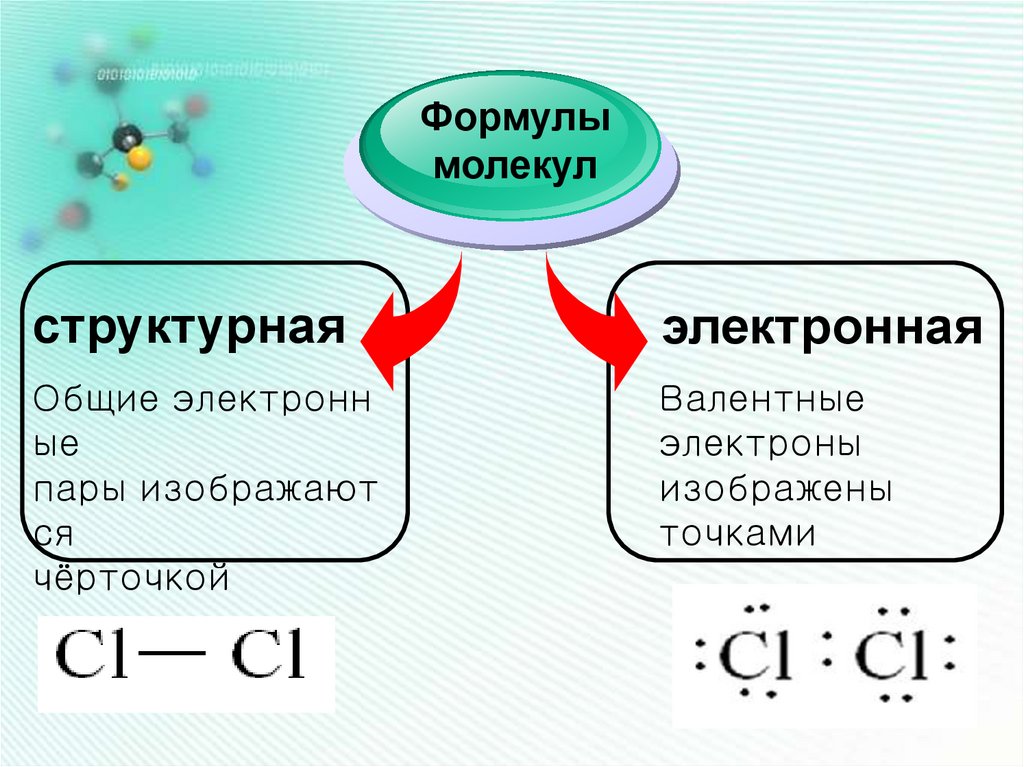
Формулымолекул
структурная
электронная
Общие электронн
ые
пары изображают
ся
чёрточкой
Валентные
электроны
изображены
точками
14.
двойныеодинарные
тройные
связи
Связь в молекуле хлора является одинарной.
15.
+7N2е- 5е-
16.
17.
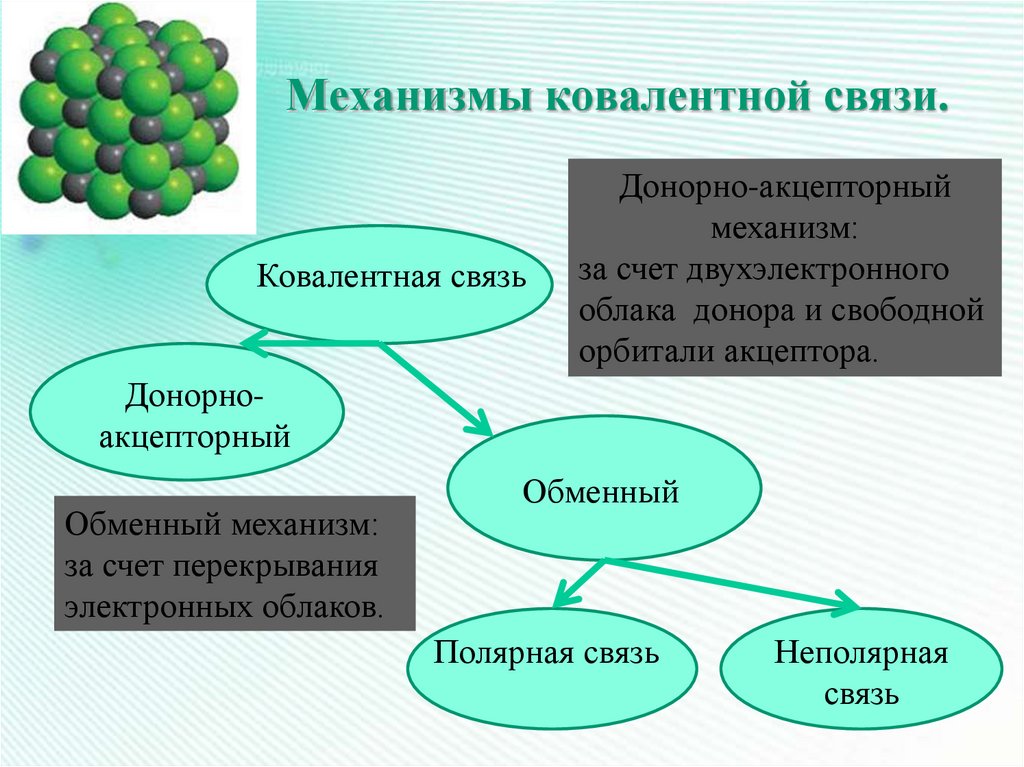
18. Механизмы ковалентной связи.
Ковалентная связьДонорно-акцепторный
механизм:
за счет двухэлектронного
облака донора и свободной
орбитали акцептора.
Донорноакцепторный
Обменный механизм:
за счет перекрывания
электронных облаков.
Обменный
Полярная связь
Неполярная
связь
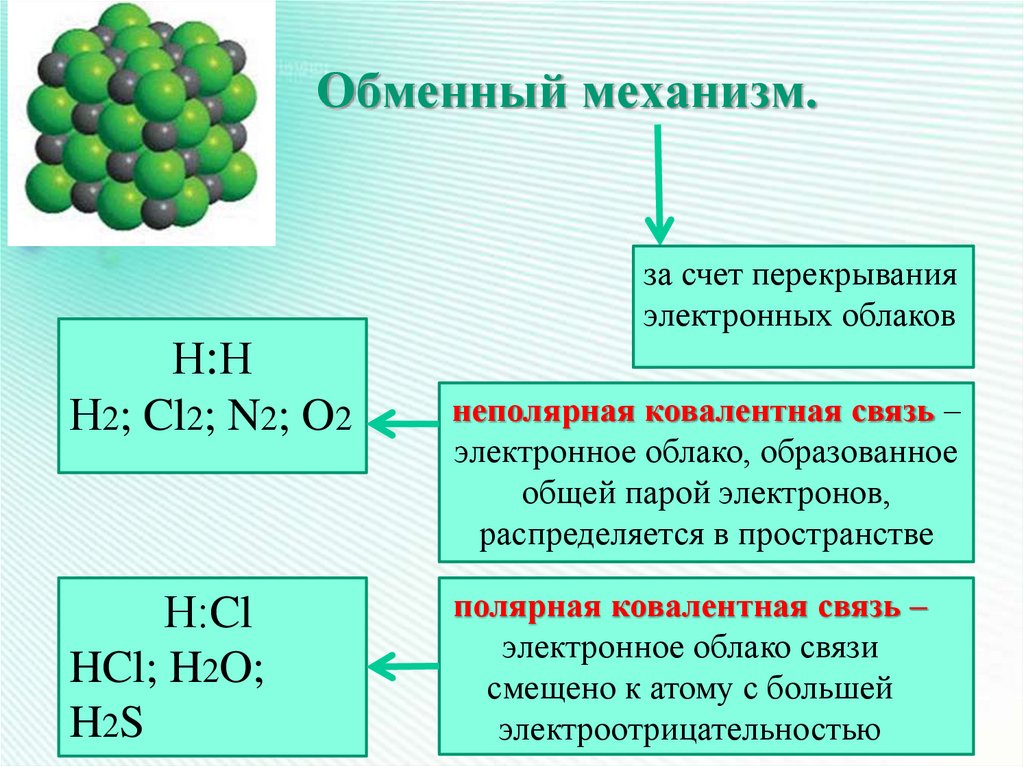
19. Обменный механизм.
за счет перекрыванияэлектронных облаков
Н:Н
Н2; Cl2; N2; O2
Н:Cl
HCl; H2O;
H2S
неполярная ковалентная связь –
электронное облако, образованное
общей парой электронов,
распределяется в пространстве
полярная ковалентная связь –
электронное облако связи
смещено к атому с большей
электроотрицательностью
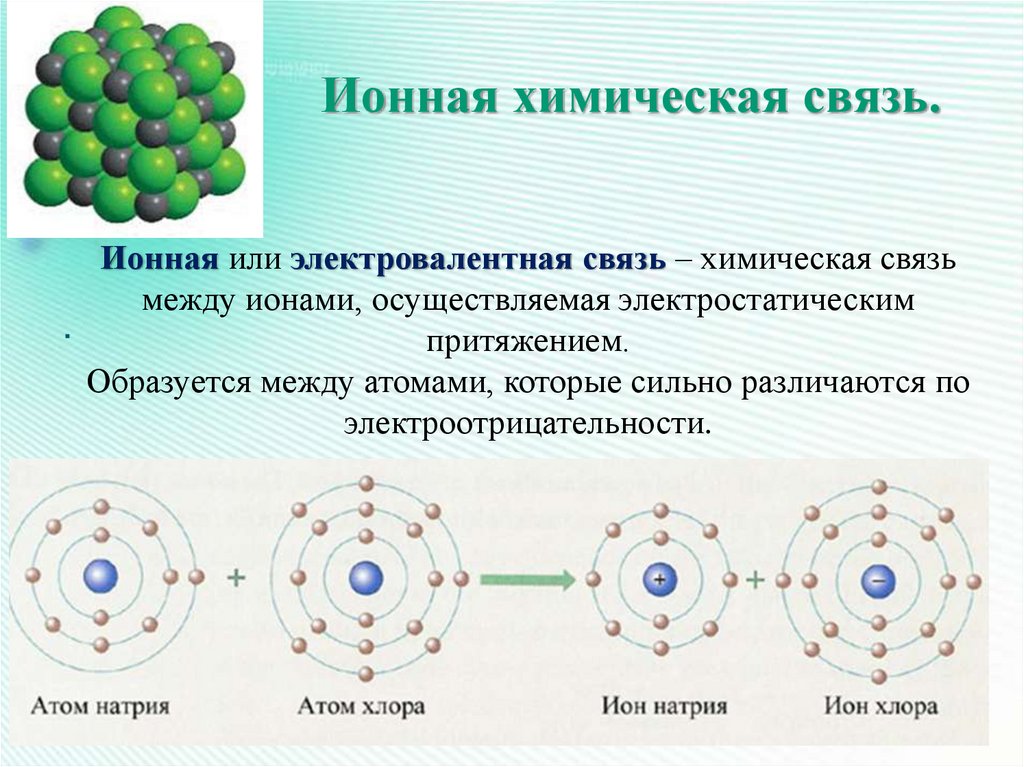
20. Ионная химическая связь.
Ионная или электровалентная связь – химическая связьмежду ионами, осуществляемая электростатическим
притяжением.
Образуется между атомами, которые сильно различаются по
электроотрицательности.
21.
Как правило, ионная связь возникаетмежду атомами металлов и
неметаллов.
22.
ИоныПоложительные
Отрицательные
Катионы
Анионы
23. Образование хлорида натрия.
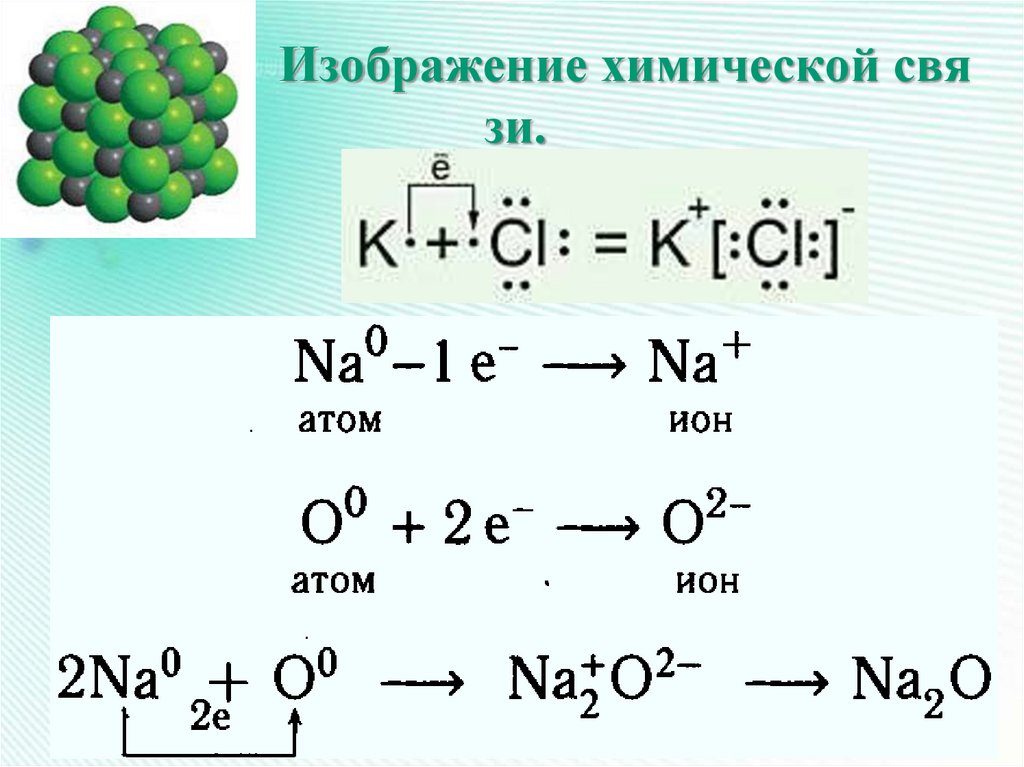
24. Изображение химической связи.
Изображение химической связи.

















 chemistry
chemistry








