Similar presentations:
Химическая связь
1.
Западный Административный округсредняя школа №1008
информационный проект по химии
тема: «Химическая связь».
Руководитель:
Учитель химии
Бочарова Ольга Николаевна
исполнитель:
ученица 11 А кл.
Хитрина Наталья
2. Цели проекта:
• 1. Ознакомиться с понятиями: химическая связь,типы химических связи.
• 2. Представить способы образования и разрыва
ковалентной связи.
• 3. Представить свойства ковалентной связи.
• 4. Представить примеры веществ с разными типами
связи.
• 5. Обучить работе с программной Microsoft Power
Point
Задача: Углубление материала по заданной теме.
3.
ХимияХимическая
связь
4. Что такое химическая связь?
• Химическая связь – взаимодействиеатомов, которое связывает их в
молекулы, ионы, радикалы, кристаллы.
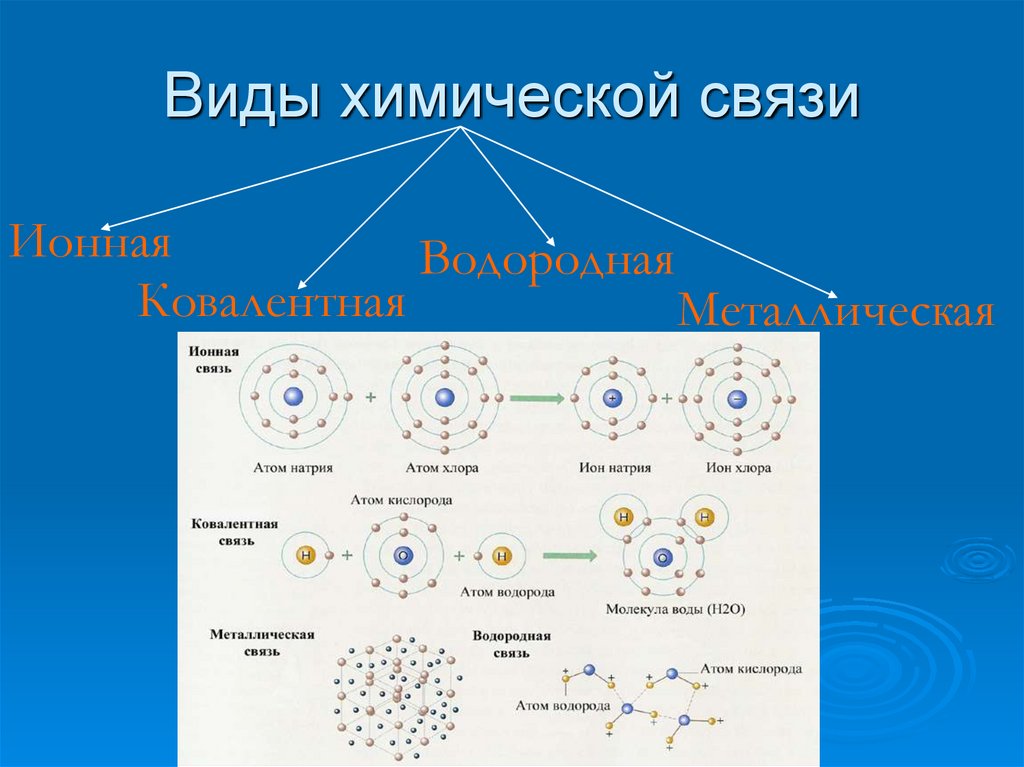
5. Виды химической связи
ИоннаяВодородная
Ковалентная
Металлическая
6.
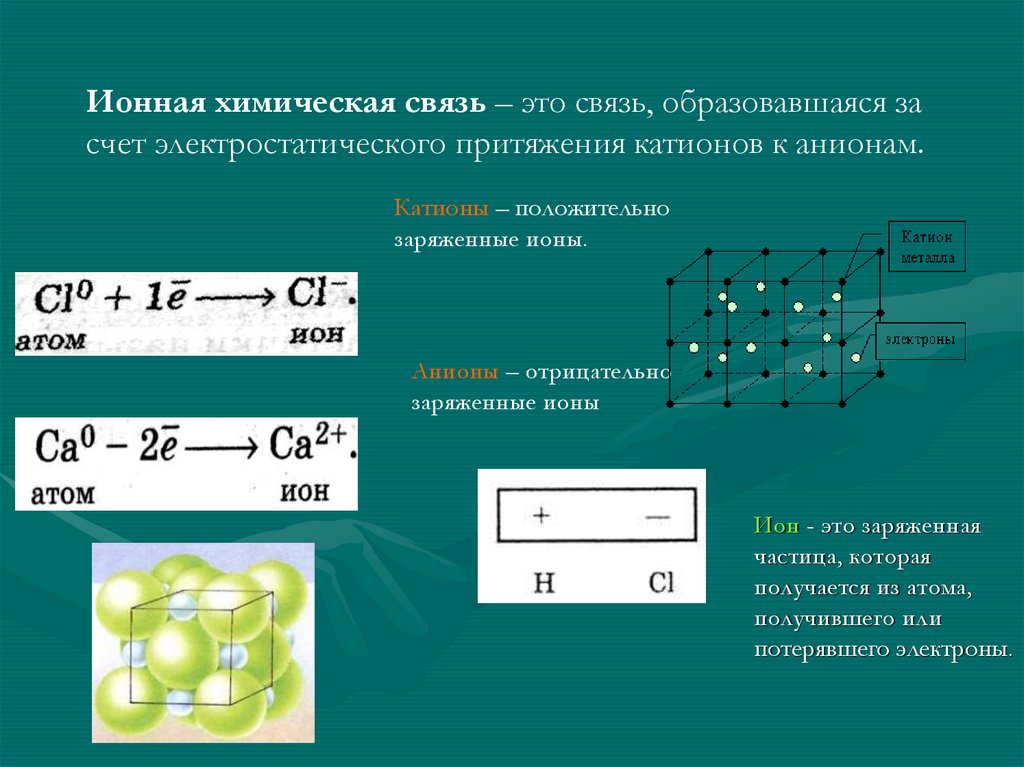
Ионная химическая связь – это связь, образовавшаяся засчет электростатического притяжения катионов к анионам.
Катионы – положительно
заряженные ионы.
Анионы – отрицательно
заряженные ионы
Ион - это заряженная
частица, которая
получается из атома,
получившего или
потерявшего электроны.
7. В каких веществах представлена?
• Гидроксиды типичных металлов и многиесоли, кислородосодержащие кислоты.
• Соли аммония, где нет атомов металлов
• В солях, образованных органическими
основаниями – аминами.
8.
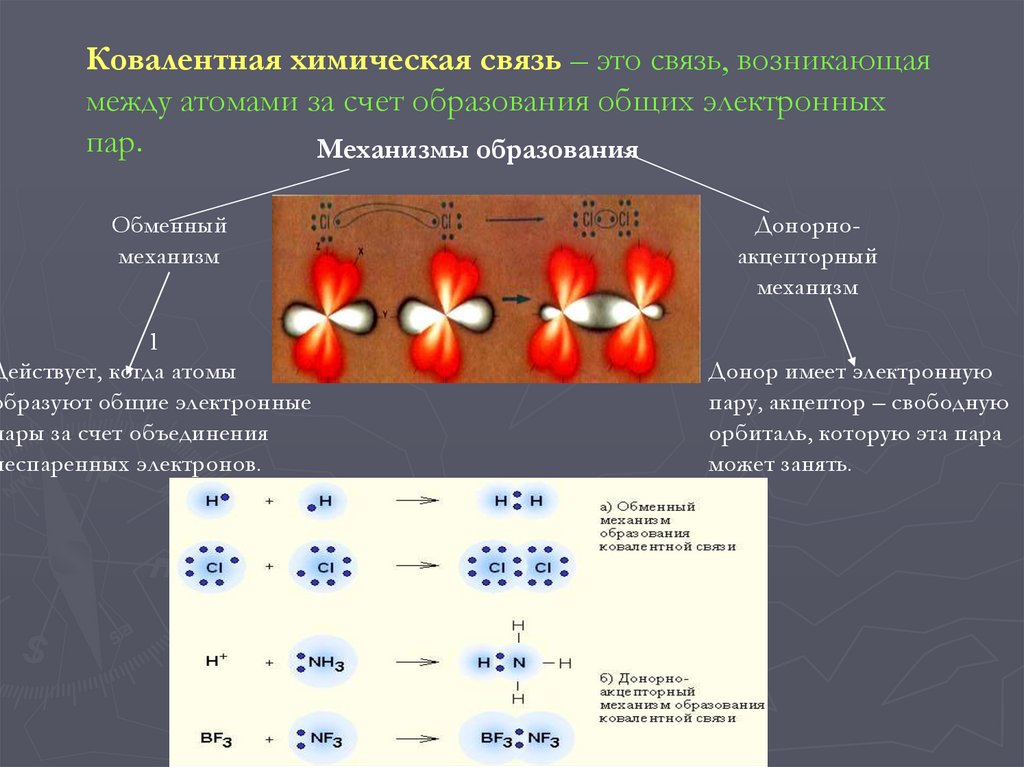
Ковалентная химическая связь – это связь, возникающаямежду атомами за счет образования общих электронных
пар.
Механизмы образования
Обменный
механизм
l
Действует, когда атомы
образуют общие электронные
пары за счет объединения
неспаренных электронов.
Донорноакцепторный
механизм
Донор имеет электронную
пару, акцептор – свободную
орбиталь, которую эта пара
может занять.
9. Классификация ковалентных связей
1. По способу перекрывания электронных орбиталейразличают σ- и ת-ковалентные связи
2. По числу общих электронных пар, связывающих
атомы, то есть по кратности. 1)Одинарные
2)Двойные 3)Тройные
3. По степени смещения общих электронных пар к одному
из связанных ими атомов ковалентная связь может быть
неполярной и полярной.
Неполярная – ковалентная химическая связь,
образующаяся между атомами с одинаковой
электроотрицательностью.
Полярная – ковалентная химическая связь между
атомами элементов, электроотрицательности которых
различаются.
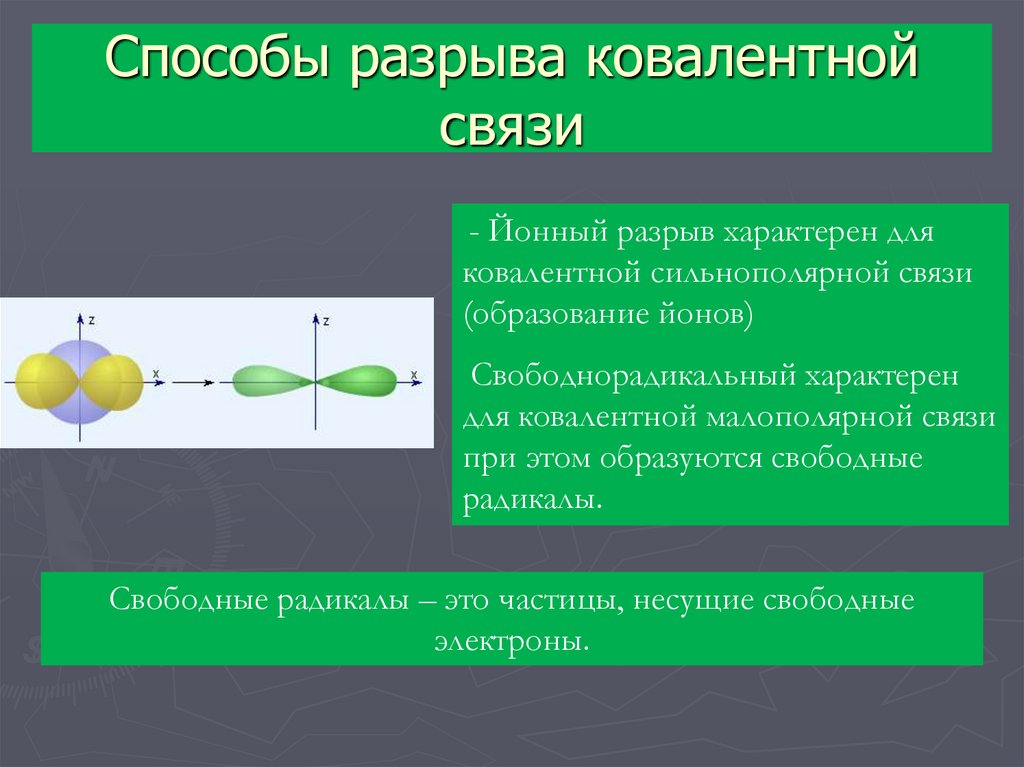
10. Способы разрыва ковалентной связи
- Йонный разрыв характерен дляковалентной сильнополярной связи
(образование йонов)
Свободнорадикальный характерен
для ковалентной малополярной связи
при этом образуются свободные
радикалы.
Свободные радикалы – это частицы, несущие свободные
электроны.
11. Свойства ковалентной связи
1. Энергия связи – это энергия, которая выделяется при образованииэтой связи или затрачивается на ее разрыв. Определяется:
радиусом атома,
глубиной перекрывания электронных облаков,
кратностью связи
2. Длина связи – это расстояние между центрами взаимодействующих
атомов.
3. Полярность связи – это смешение общей электронной пары к атому
с большим значением э.о.
4. Поляризуемость – это смещение облака П-связи вдоль сигма связи
под действием реагента.
5. Насыщаемость – это ограниченное число ковалентных связей,
определяемое валентными возможностями атомов: числом
12. Электроотрицательность
- это свойство атомов в соединениях оттягивать на себя общиеэлектронные пары.
-зависит от строения атома 1) заряд ядра
2) радиус атома
В периоде заряды ядер атомов увеличиваются, а радиусы их
уменьшаются, то электроотрицательность атомов возрастает.
В главных подгруппах с увеличением порядкового номера
электроотрицательность атомов химических элементов, как
правило, уменьшается.
13.
Металлическая связь – в металлах и сплавах, которуювыполняют относительно свободные электроны между ионами
металлов в металлической кристаллической решетке.
Связь в металлах между ионами
посредством обобществленных
электронов называется
металлической.
Электроны, из которых состоит
«электронный газ», непрерывно
и беспорядочно движутся
внутри кристаллической
решетки.
14. Где представлена?
МеталлыВещества с металлической связью
имеют металлическую кристаллическую
решетку. В ее узлах находятся ионы или
атомы металла, между которыми
свободно перемещаются электроны.
15.
Водородная связь – химическая связь между положительнополяризованными атомами водорода одной молекулы ( или её
части) и отрицательно поляризованными атомами сильно
электроотрицательных элементов, имеющих неподелённые
электронные пары ( F, O, N и реже Cl и S) другой молекулы (или её
части).
16. Источники данных.
О.С. Габриелян, Г.Г. Лысова Химия 11 класс,издательство «Дрофа», Москва 2006
Л.А. Цветков Органическая химия 10-11 класс,
издательство «Московский учебник», 2002
Е.Е. Минченков, А.А. Журин Химия 9 класс,
издательство «Московский учебник», 2006
М. Кременчук, С. Васильева Химия Справочник
школьника, издательство Филологическое общество
«Слово» 1995
И.Г. Хомченко Общая химия, издательство «Химия»,
1987
Различные Интернет источники












 chemistry
chemistry








