Similar presentations:
Комплексные соединения. Природа химической связи: метод молекулярных орбиталей
1.
Комплексные соединения.Природа химической связи:
метод молекулярных орбиталей
2.
между комплексообразователем и лигандом(двух центровые – двух электронные)
3. Орбитальное взаимодействие в октаэдрическом комплексе с 6 одинаковыми лигандами
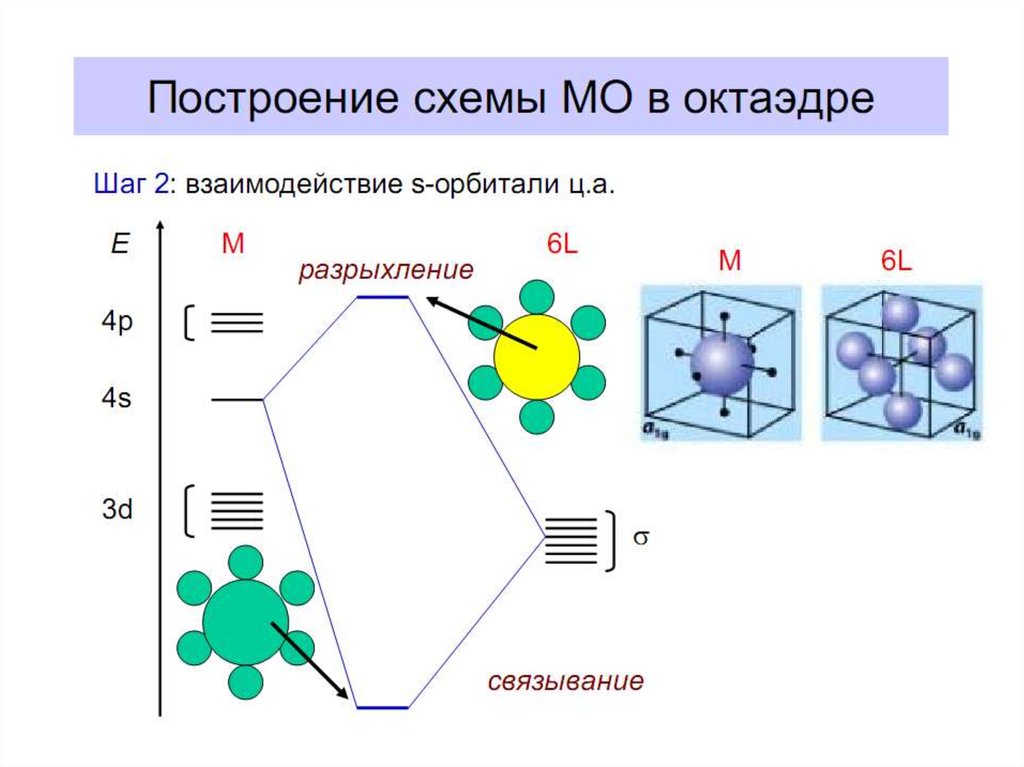
4. Построение схемы молекулярных орбиталей в октаэдре
Общие принципы:1. Центральный атом предоставляет 9 орбиталей–
5АО (n–1)d, 1АО ns, 3АО np(по возрастанию энергии);
для 3-d металлов: 5(3d)+1(4s)+3(4p)=9АО.
2. Шесть лигандов предоставляют по одной орбитали
σ-симметрии каждая.
3. Орбитали лигандов рассматриваются не независимо, а в совокупности
(подход групповых орбиталей).
4. Число молекулярных орбиталей равно сумме атомных орбиталей
(правило МО-ЛКАО).
5.
Взаимодействие
орбиталей
может
быть
конструктивным
(связывающее),
деструктивным (разрыхляющее) и безразличным
(несвязывающее).
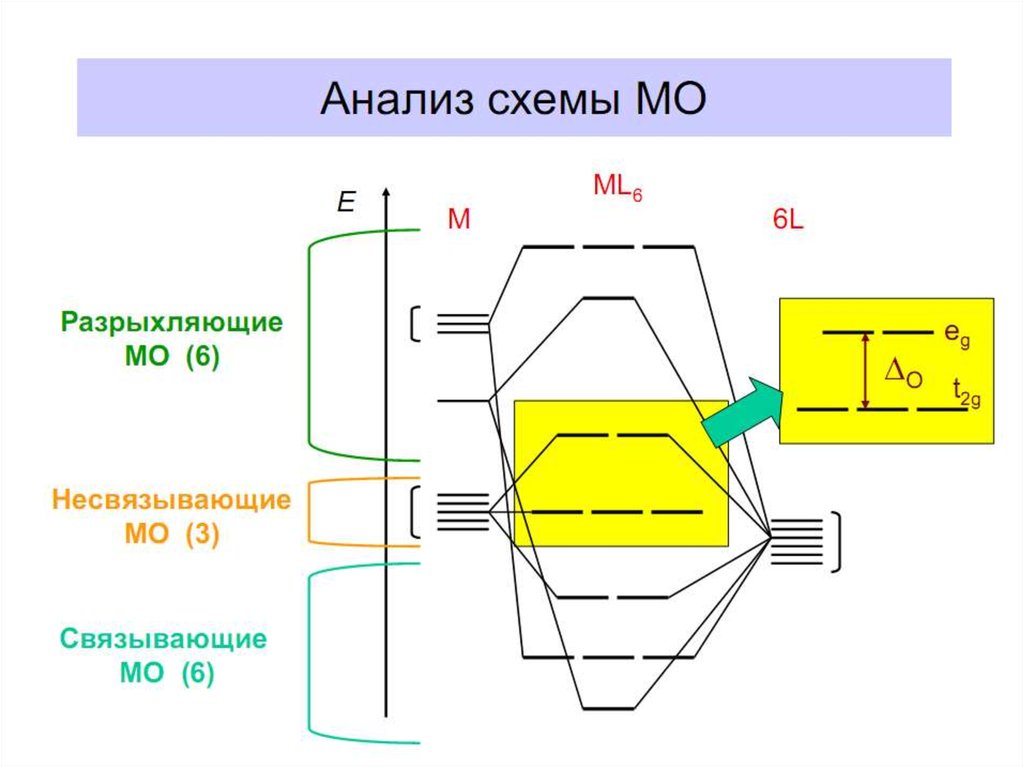
В октаэдрическом поле с 6 орбиталями лигандов перекрываются валентные орбитали 3-d
металлов: 2АО (3dz2 и 3dx2-y2)+1АО (4s)+3АО (4p) в соответствии с их пространственной
ориентацией вдоль осей координат. Из них образуются 6σсвяз МО и 6σ*разр МО. Три
валентные орбитали: dxy, dxz, dyz ориентированы между осями координат, так что их
перекрывание с орбиталями лигандов невозможно. Из них образуются несвязывающие МО.
5.
6.
7.
8.
9.
10.
11.
12.
13. Энергетическая диаграмма МО для октаэдрических комплексов: высокоспинового [FeF6]4- (а) и низкоспинового [Fe(CN)6]4- (б)
14. Энергетическая диаграмма молекулярных орбиталей в тетраэдрическом комплексе
15. Энергетическая диаграмма молекулярных орбиталей в плоско квадратном комплексе
16.
Литература1.Неорганическая химия: в 3 т. /Под ред. Ю.Д. Третьякова. — М.:
Издательский центр «Академия»; Т.3, 2007, кн.1, — 352 с.; кн.2, — 400 с.;
2.Ахметов Н.С. Общая и неорганическая химия: Учебник для ВУЗов – 4-е изд.
испр.–М: Высшая школа, 2002.–743 с.
3.Шрайвер Д., Эткинс П. Неорганическая химия. В 2-х т. пер с англ. — М.:
Мир, 2004. Т.1 – 679 с.
4. Хаускрофт К., Констебл Э. Современный курс общей химии. В 2-х т. пер с
англ. — М.: Мир, 2002. Т.2 — 528 с.
5. Браун Т., Лемей Г.Ю. Химия – в центре наук в 2 ч; пер. с англ.–М. Мир,1983
–ч.1.–448 с.; ч.2.–520 с.
Использованные интернет-ресурсы
http://www.chem.msu.su/rus/teaching/thermo/Lectures_2-3_complexes.pdf
htpp://www.chem.msu.su/rus/teaching/thermo/welcome.html
www.alhimik.ru










![Энергетическая диаграмма МО для октаэдрических комплексов: высокоспинового [FeF6]4- (а) и низкоспинового [Fe(CN)6]4- (б) Энергетическая диаграмма МО для октаэдрических комплексов: высокоспинового [FeF6]4- (а) и низкоспинового [Fe(CN)6]4- (б)](https://cf.ppt-online.org/files/slide/k/k7aqd4HRLiCh3Q25yDMeNg6Kz9UcBVYbfxostZ/slide-12.jpg)



 chemistry
chemistry








