Similar presentations:
Химическая связь в комплексных соединениях
1.
ЛекцияХимическая связь в
комплексных соединениях
2.
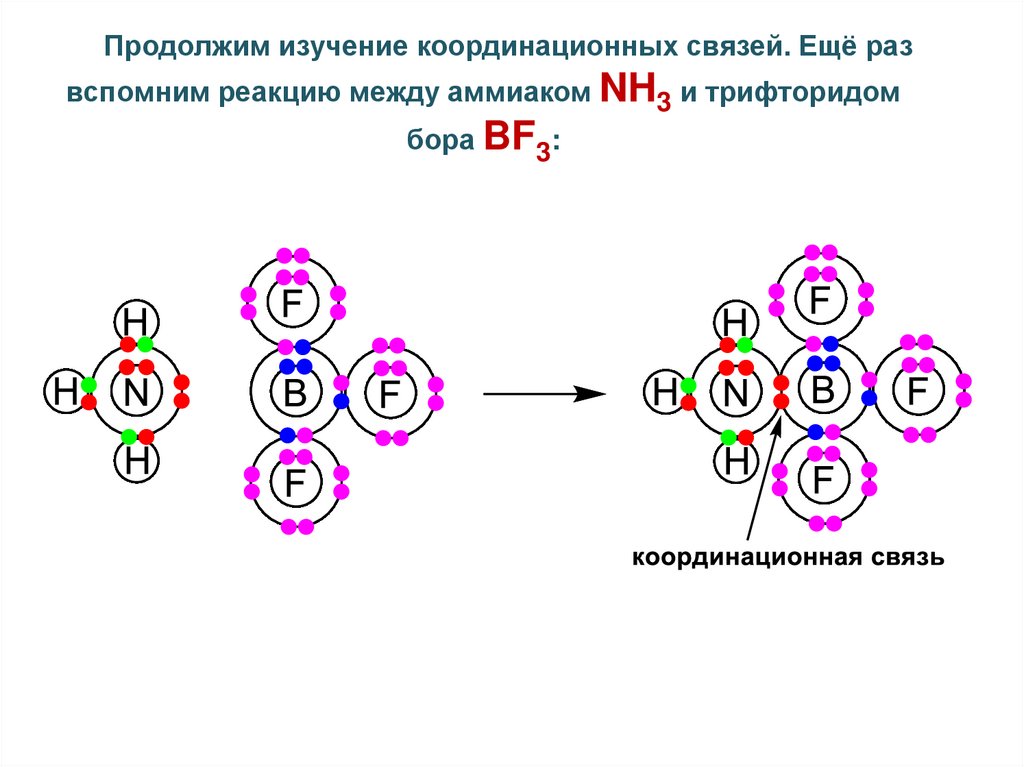
Продолжим изучение координационных связей. Ещё развспомним реакцию между аммиаком NH3 и трифторидом
бора BF3:
3.
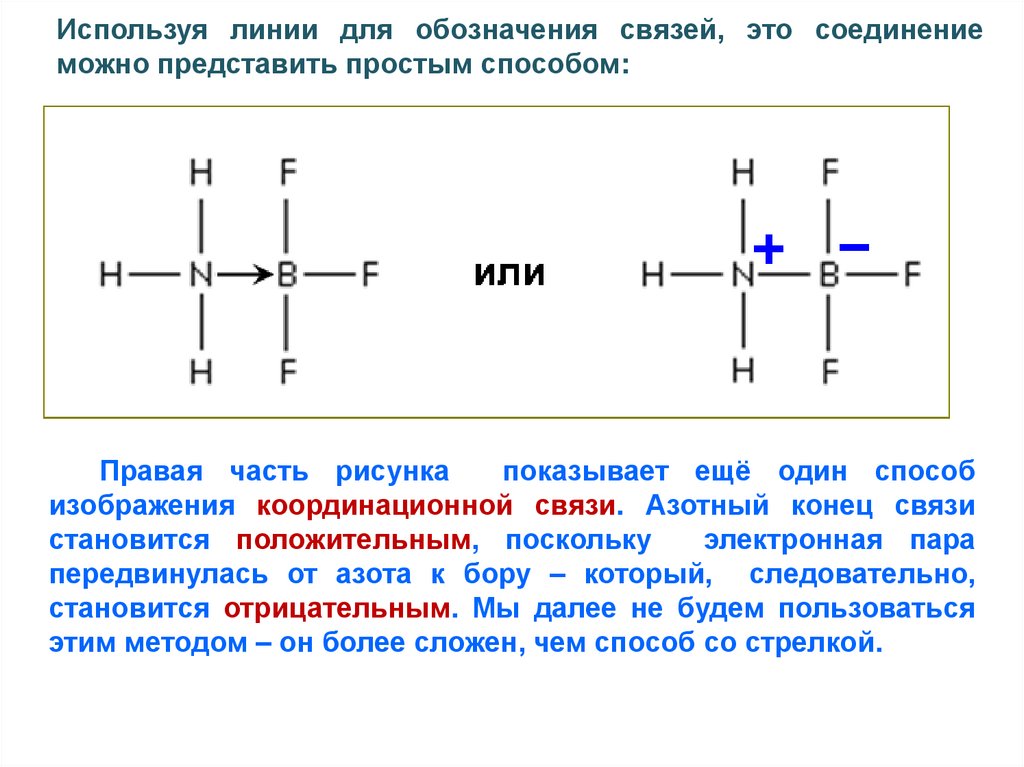
Используя линии для обозначения связей, это соединениеможно представить простым способом:
Правая часть рисунка
показывает ещё один способ
изображения координационной связи. Азотный конец связи
становится положительным, поскольку
электронная пара
передвинулась от азота к бору – который, следовательно,
становится отрицательным. Мы далее не будем пользоваться
этим методом – он более сложен, чем способ со стрелкой.
4.
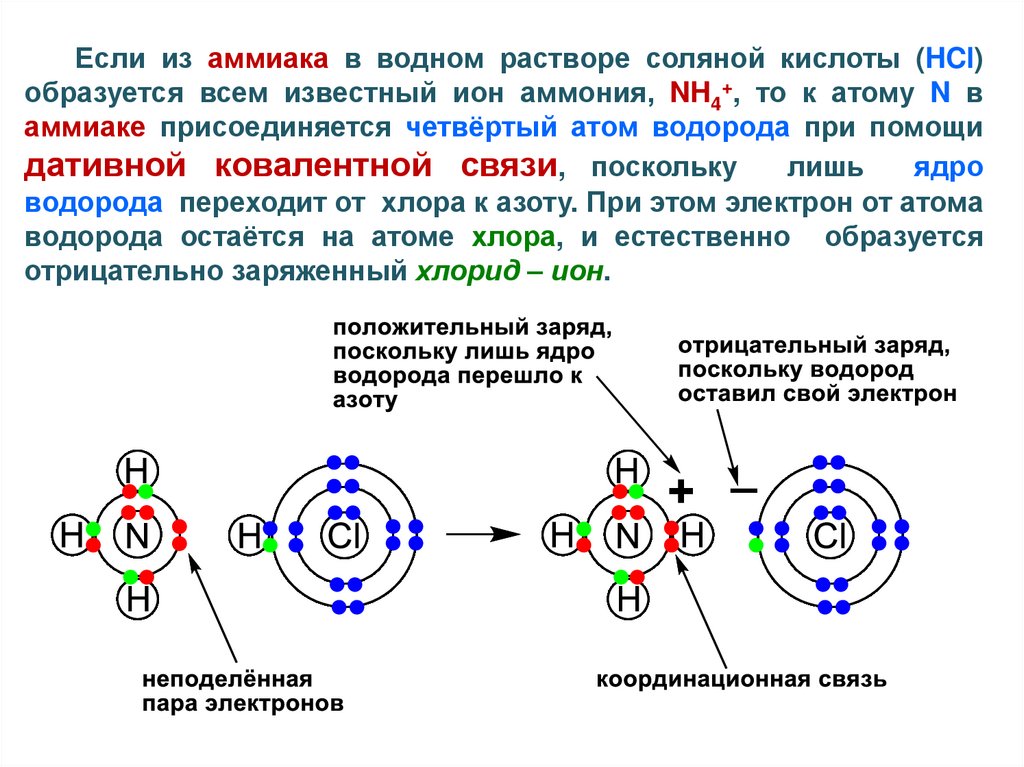
Если из аммиака в водном растворе соляной кислоты (HCl)образуется всем известный ион аммония, NH4+, то к атому N в
аммиаке присоединяется четвёртый атом водорода при помощи
дативной ковалентной связи, поскольку лишь ядро
водорода переходит от хлора к азоту. При этом электрон от атома
водорода остаётся на атоме хлора, и естественно образуется
отрицательно заряженный хлорид – ион.
5.
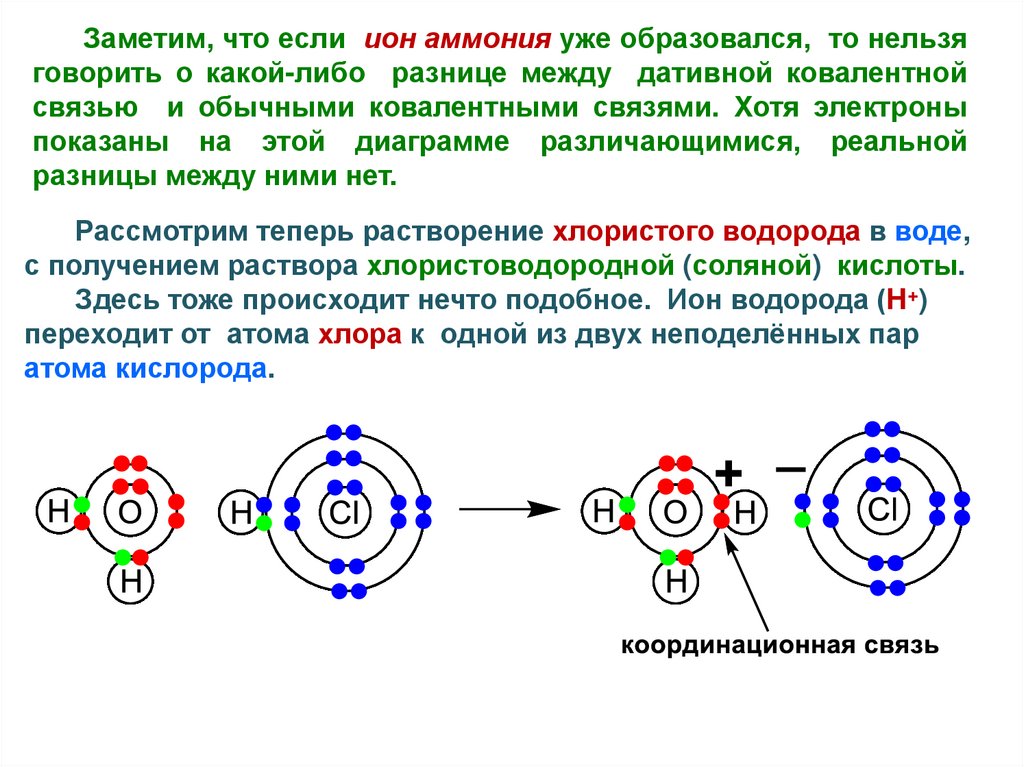
Заметим, что если ион аммония уже образовался, то нельзяговорить о какой-либо разнице между дативной ковалентной
связью и обычными ковалентными связями. Хотя электроны
показаны на этой диаграмме различающимися, реальной
разницы между ними нет.
Рассмотрим теперь растворение хлористого водорода в воде,
с получением раствора хлористоводородной (соляной) кислоты.
Здесь тоже происходит нечто подобное. Ион водорода (H+)
переходит от атома хлора к одной из двух неподелённых пар
атома кислорода.
6.
Или в обычном виде:Ион H3O+ называют ионом гидроксония, но иногда ионом
гидрония или ионом оксония.
Если мы записываем ион водорода в виде H+(aq) , то индекс
" (aq) " обозначает молекулу воды, к которой ион водорода
присоединён. Когда он (H+(aq) ) реагирует с чем-то (со щёлочью,
например), этот ион водорода просто снова отделяется от
молекулы воды.
Заметьте, что как только
координационная связь
образовалась, все атомы водорода, присоединённые к
кислороду, опять оказываются совершенно эквивалентными.
И когда ион водорода снова отделяется от иона Н3О+, им может
оказаться любой из трёх.
7.
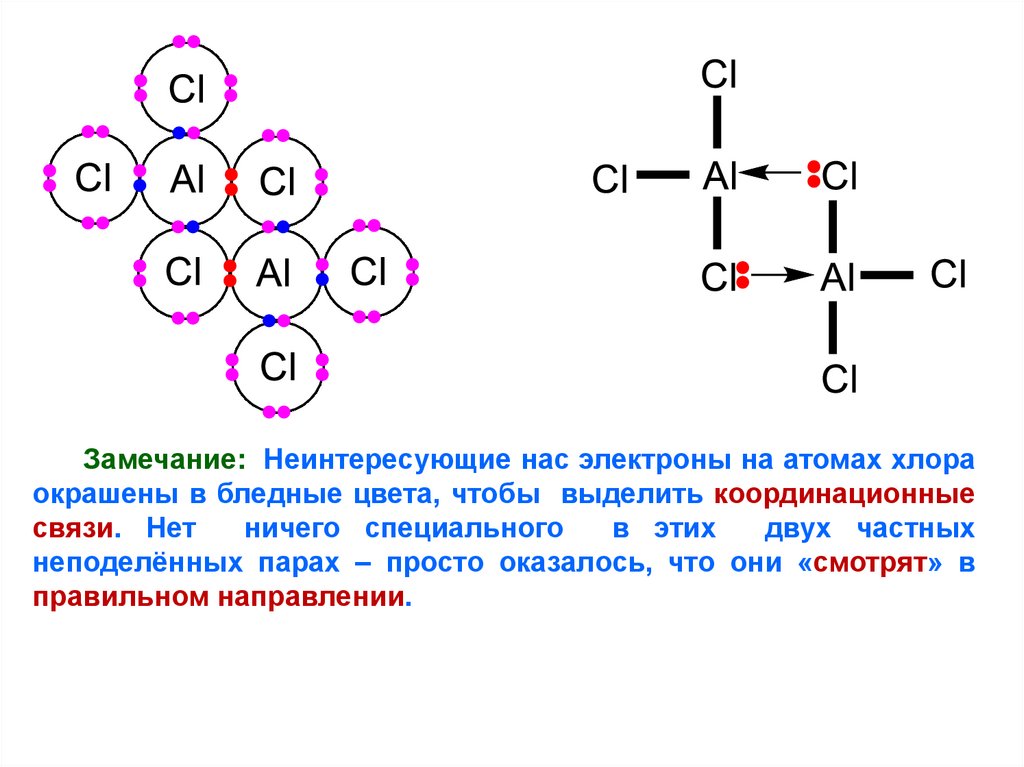
Рассмотрим более сложный пример димеризации солей:структура хлорида алюминия
Хлорид
алюминия
сублимируется
(превращается прямо из твёрдой фазы в газ)
примерно
при
180°C
(это
очень
низкая
температура для испарения соли). Если бы он
содержал просто ионы, он имел бы куда более
высокие температуры плавления
и кипения,
вследствие
сильных
притяжений
между
положительным и
отрицательными ионами.
Сложность состоит в том, что
если он
сублимируется
при этой
весьма низкой
температуре, он должен быть ковалентным
соединением.
Диаграмма с разноцветными
кружками
показывает
только внешние
электроны.
8.
AlCl3, подобно BF3, является электронно-дефицитным. Всамом деле, этого подобия следует ожидать, поскольку Al и B
находятся в одной группе Периодической Таблицы, так же, как
следует ожидать подобия фтора и хлора, или натрия и калия.
Измерения относительной формульной массы хлорида
алюминия показывают, что его формула в парах при
температуре сублимации не AlCl3, а Al2Cl6. Он существует в
виде димера (две молекулы объединены). Связи между двумя
молекулами
являются
координационными,
и
в
них
использованы неподеленные пары электронов атомов хлора.
Каждый атом хлора имеет 3 неподелённых пары, но только две
из них, важные для нас, показаны на диаграмме с валентными
связями. Энергия выделяется, когда образуются две
координационные связи, и поэтому димер более устойчив, чем
две отдельные молекулы AlCl3.
9.
Замечание: Неинтересующие нас электроны на атомах хлораокрашены в бледные цвета, чтобы выделить координационные
связи. Нет
ничего специального
в этих
двух частных
неподелённых парах – просто оказалось, что они «смотрят» в
правильном направлении.
10.
Связь в гидратированных металлическихионах
Водные молекулы сильно притягиваются к ионам в растворе
– молекулы воды образуют кластер вокруг положительных или
отрицательных ионов. Во многих случаях, притяжения столь
велики, что образуются формальные связи, и это верно по
отношению почти всех положительных ионов металлов. Ионы с
присоединёнными водными молекулами
описываются как
гидратированные ионы.
Хотя хлорид алюминия
является ковалентным, при его
растворении в воде, образуются ионы. Шесть молекул воды
связаны с алюминием и образуют ион с формулой Al(H2O)63+ .
Его называют ионом гексааквоалюминия – что переводится,
как шесть ("гекса") водных молекул ("аква"), окружающих ион
алюминия.
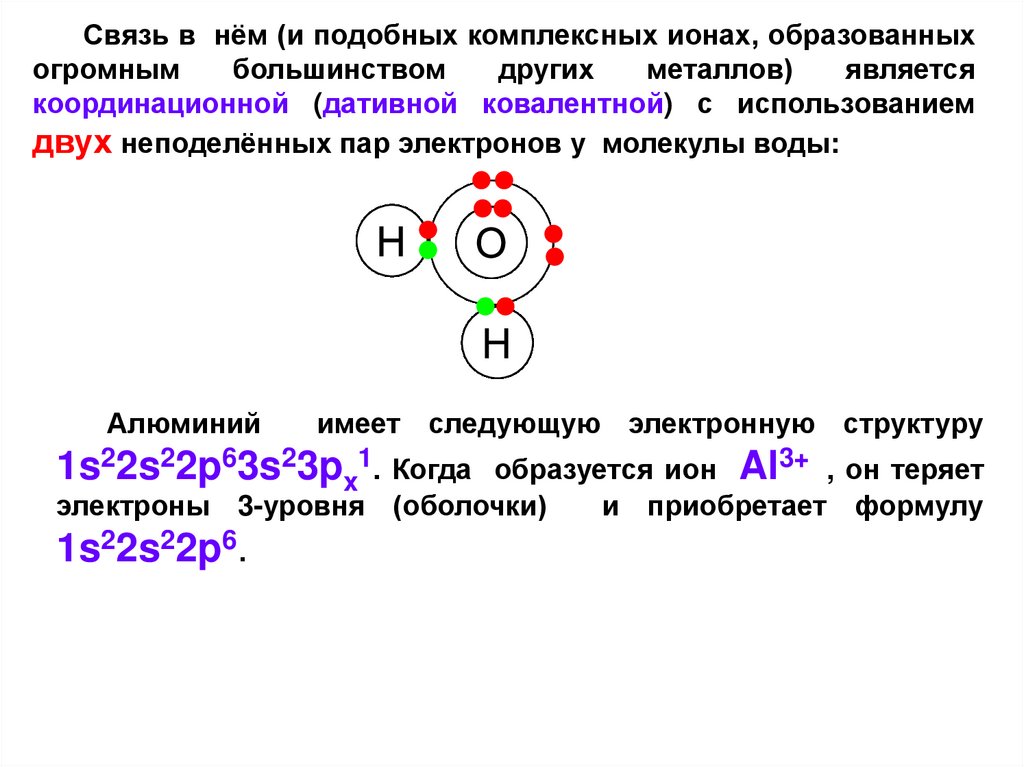
11.
Связь в нём (и подобных комплексных ионах, образованныхогромным
большинством
других
металлов)
является
координационной (дативной ковалентной) с использованием
двух неподелённых пар электронов у молекулы воды:
Алюминий
имеет следующую электронную структуру
1s22s22p63s23px1. Когда
образуется ион Al3+ , он теряет
электроны 3-уровня (оболочки)
и приобретает формулу
1s22s22p6.
12.
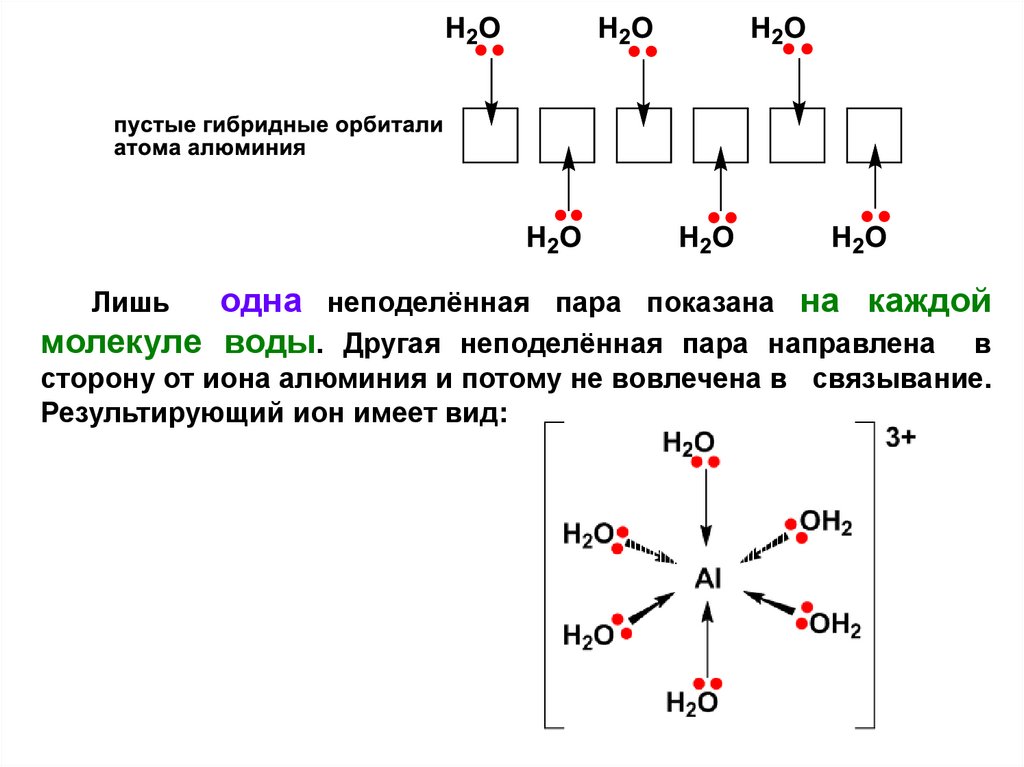
Это означает, что все орбитали 3-уровня теперь пусты.Алюминий перестраивает
(гибридизует) шесть этих
орбиталей (одну 3s, три 3p, и две 3d), чтобы образовать
шесть новых орбиталей, причём
все 6 с одинаковой
энергией. Эти шесть гибридных орбиталей
принимают
неподелённые пары от шести молекул воды.
Вы могли бы спросить о том, почему он выбирает именно
шесть орбиталей для использования, а не, скажем, четыре или
восемь или какое-то ещё число. Шесть это максимальное число
молекул воды, которые возможно расположить вокруг
алюминия
иона
(и большинства других металлических ионов).
Образовав максимальное число связей, он высвобождает
максимальную энергию и таким образом, становится самым
стабильным в энергетическом смысле.
13.
одна неподелённая пара показана на каждоймолекуле воды. Другая неподелённая пара направлена в
Лишь
сторону от иона алюминия и потому не вовлечена в связывание.
Результирующий ион имеет вид:
14.
Из-за движения электронов к центру иона, заряд 3+ теперь нерасположен полностью на алюминии, но распределён по всему
иону в целом.
Замечание: Прерывистые стрелки на рисунке представляют
неподелённые
пары,
пришедшие
с
молекул
воды,
расположенных за плоскостью листа бумаги. Клинообразные
стрелки представляют связи от молекул воды, расположенных
перед плоскостью листа бумаги.
Этот гидрат [Al(H2O)6]3+ относится к очень большому классу
неорганических
соединений,
так
называемых
координационных
комплексов.
Кстати,
этот
гидратированный ион является достаточно сильной кислотой,
т.к. отщепляет ион гидроксония (подобно кислоте). На самом
деле произошла, как вы знаете, реакция гидролиза иона Al3+:
15.
Al3+ + 6H2O → [Al(H2O)6]3+ + H2O → [Al(H2O)5(OH)]2+ + H3O+Очевидно, что и [Al(H2O)6]3+ и [Al(H2O)5(OH)]2+ являются
координационными комплексами.
16.
Помимо реакций между ионами и нейтральными полярнымимолекулами, связывание катионов с группами анионов также
приводит к возникновению координационных комплексов.
Например, ион двухвалентного железа Fe2+ соединяется с
цианидными ионами CN– в результате чего образуется
комплексный ион Fe(CN)64–. Этот ион настолько устойчив, что в
его растворах (которые можно получить, например, из жёлтой
кровяной соли K4Fe(CN)6 не обнаруживается почти никаких
признаков наличия простых ионов Fe2+ или CN–.
В молекуле любого комплексного соединения один из ионов
занимает центральное место и называется центральным ионом
или
комплексообразователем.
По
большей
части
координационные
комплексные
соединения
образованы
катионом, к которому присоединены несколько анионов или
нейтральных молекул. Про эти последние говорят, что они
координированы и называют их лигандами. Они образуют так
называемую внутреннюю координационную сферу комплекса.
Остальные ионы составляют внешнюю координационную сферу.
Число лигандов, окружающих центральный ион, называется
координационным числом.
17.
Существованиекоординационных
комплексных
соединений
основано на образовании координационной химической связи, для
которой требуется наличие акцептора электронной пары и
донора электронной пары. Акцептор – это центральный ион, а
лиганды являются донорами. В общем виде образование
координационного комплекса можно записать в виде:
M
n
m
x:L
M (: L)
( n xm )
x
Координационная связь в большинстве случаев носит
ковалентный характер, причём связи между центральным атомом
и лигандом могут быть не только простыми, но и двойными, в
некоторых случаях координационные комплексы образованы
ионными связями.
18.
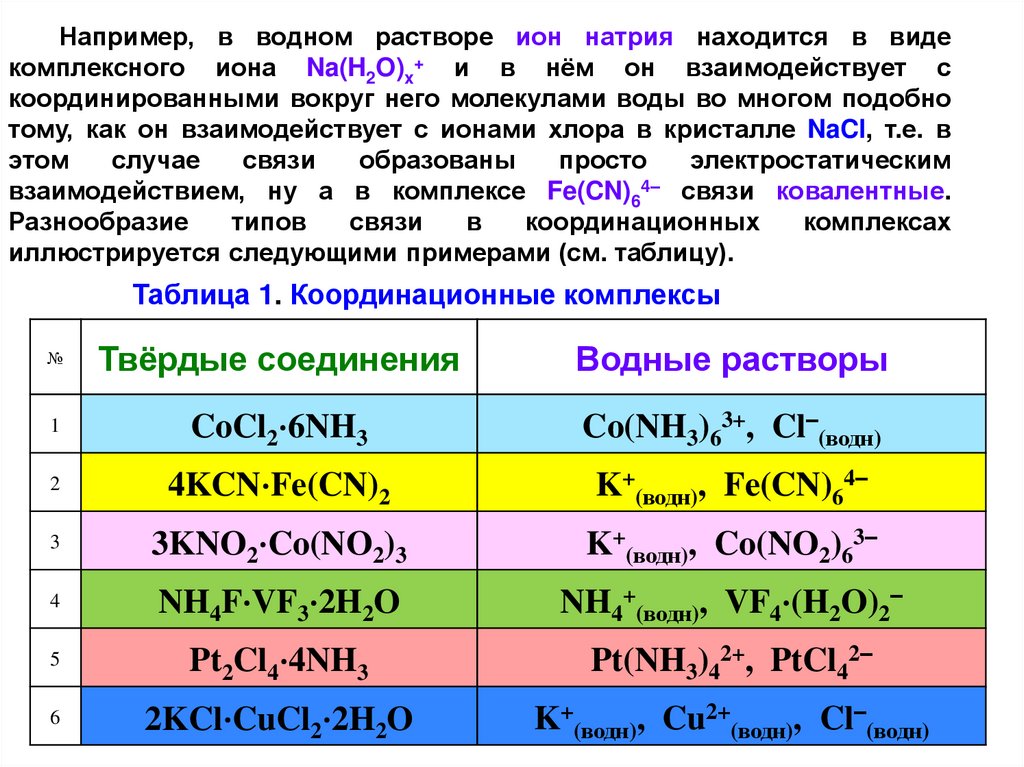
Например, в водном растворе ион натрия находится в видекомплексного иона Na(H2O)x+ и в нём он взаимодействует с
координированными вокруг него молекулами воды во многом подобно
тому, как он взаимодействует с ионами хлора в кристалле NaCl, т.е. в
этом
случае
связи
образованы
просто
электростатическим
взаимодействием, ну а в комплексе Fe(CN)64– связи ковалентные.
Разнообразие
типов
связи
в
координационных
комплексах
иллюстрируется следующими примерами (см. таблицу).
Таблица 1. Координационные комплексы
№
Твёрдые соединения
Водные растворы
1
CoCl2·6NH3
Co(NH3)63+, Cl–(водн)
2
4KCN·Fe(CN)2
K+(водн), Fe(CN)64–
3
3KNO2·Co(NO2)3
K+(водн), Co(NO2)63–
4
NH4F·VF3·2H2O
NH4+(водн), VF4·(H2O)2–
5
Pt2Cl4·4NH3
Pt(NH3)42+, PtCl42–
6
2KCl·CuCl2·2H2O
K+(водн), Cu2+(водн), Cl–(водн)
19.
Первые четыре соединения можно рассматривать, как соли скомплексным катионом или анионом, что особенно
хорошо видно по составу их водных растворов. Эти же
комплексные ионы содержатся и в твёрдом состоянии, хотя в
таблице они записаны в виде двойных солей. В каждом из этих
случаев комплексный ион сохраняется в процессе растворения
как единое целое и нет никаких доказательств существования в
растворе свободных лигандов и /или гидратированных простых
катионов (очевидно центральных ионов).
Отметим, что лигандами в этих примерах являются либо
нейтральные молекулы NH3, H2O, либо анионы F–, CN–, NO2–.
В комплексном ионе
VF4·(H2O)2– ион V3+ координирован
одновременно анионными и нейтральными лигандами.
20.
Пятое соединение Pt2Cl4·4NH3 и в твёрдом кристаллическомсостоянии , и в водном растворе содержит одновременно и
комплексный катион и комплексный анион.
Наконец, шестое соединение в кристаллическом состоянии
обладает структурой, в которой имеются комплексные ионы
CuCl42–. Однако, при растворении в воде образуется смесь
гидратированных одноатомных ионов. Это показывает, что ионы
Cu2+ образуют более устойчивые комплексы с водой, чем с
хлорид – ионами.
На примере координационных комплексов Ni2+ можно
рассмотреть понятие внутренней координационной сферы
комплекса, устойчивости связей между центральным ионом и
лигандами, входящими в эту сферу.
Демонстрация.
Лиганды, входящие во внутреннюю координационную сферу Ni:
H2O, NH3, en – этилендиамин (H2NCH2CH2NH2), диметилглиоксим –
dmg ( CH3CNOH–CNOHCH3), CN–.
Наблюдаемые нами реакции:
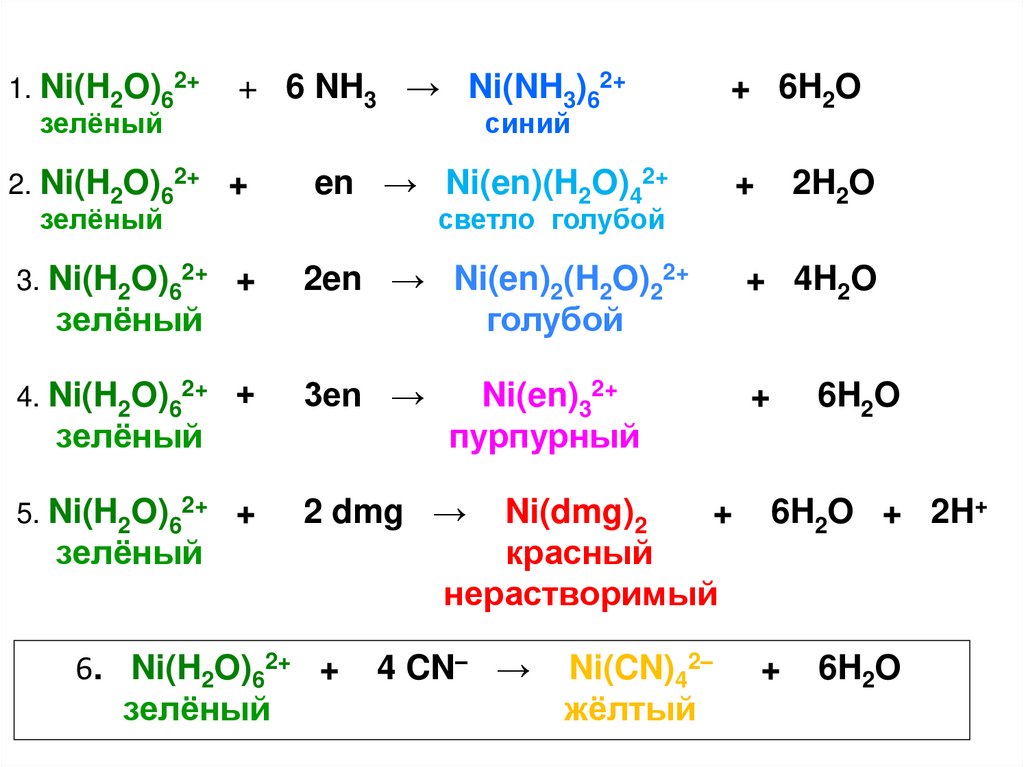
21.
1. Ni(H2O)62+зелёный
+ 6 NH3 → Ni(NH3)62+
синий
+ 6H2O
2. Ni(H2O)62+ +
зелёный
en → Ni(en)(H2O)42+
3. Ni(H2O)62+ +
2en → Ni(en)2(H2O)22+
голубой
+ 4H2O
4. Ni(H2O)62+ +
3en →
+
5. Ni(H2O)62+ +
2 dmg →
зелёный
+
2H2O
светло голубой
зелёный
зелёный
6. Ni(H2O)62+ +
зелёный
Ni(en)32+
пурпурный
Ni(dmg)2
+
красный
нерастворимый
4 CN– →
Ni(CN)42–
жёлтый
6H2O
6H2O + 2H+
+
6H2O
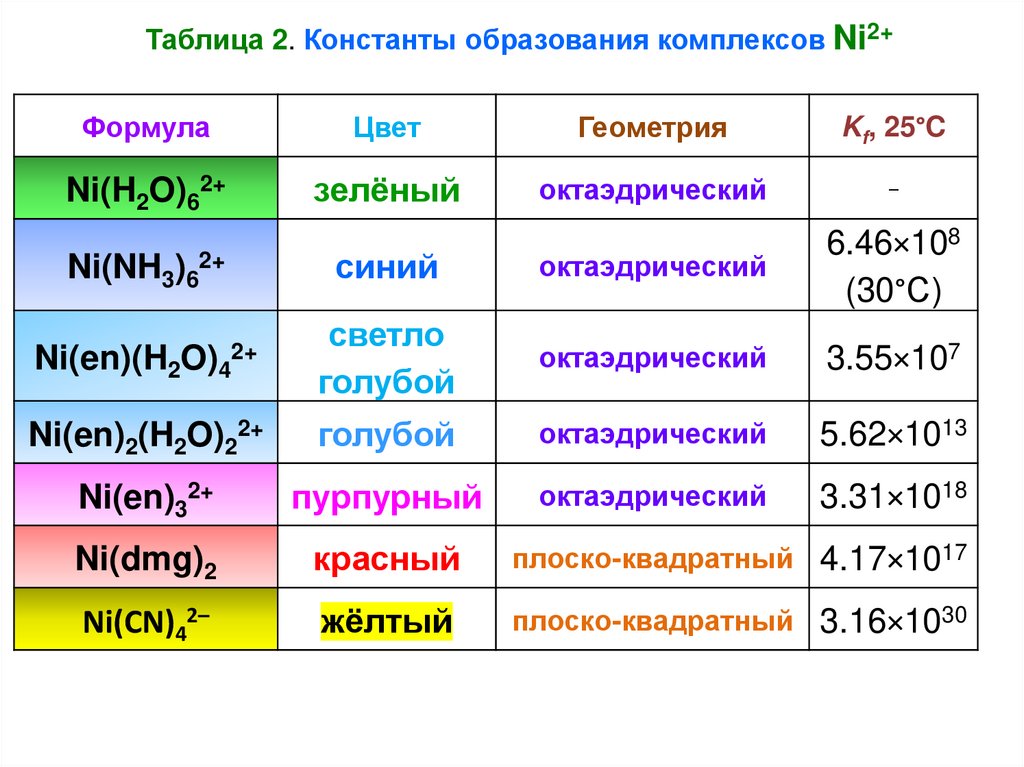
22.
Таблица 2. Константы образования комплексов Ni2+Формула
Цвет
Геометрия
Kf, 25°C
Ni(H2O)62+
зелёный
октаэдрический
–
синий
октаэдрический
6.46×108
(30°С)
2+
светло
голубой
октаэдрический
3.55×107
Ni(en)2(H2O)22+
голубой
октаэдрический
5.62×1013
Ni(en)32+
пурпурный
октаэдрический
3.31×1018
Ni(dmg)2
красный
плоско-квадратный 4.17×1017
Ni(CN)42–
жёлтый
плоско-квадратный 3.16×1030
Ni(NH3)62+
Ni(en)(H2O)4
23.
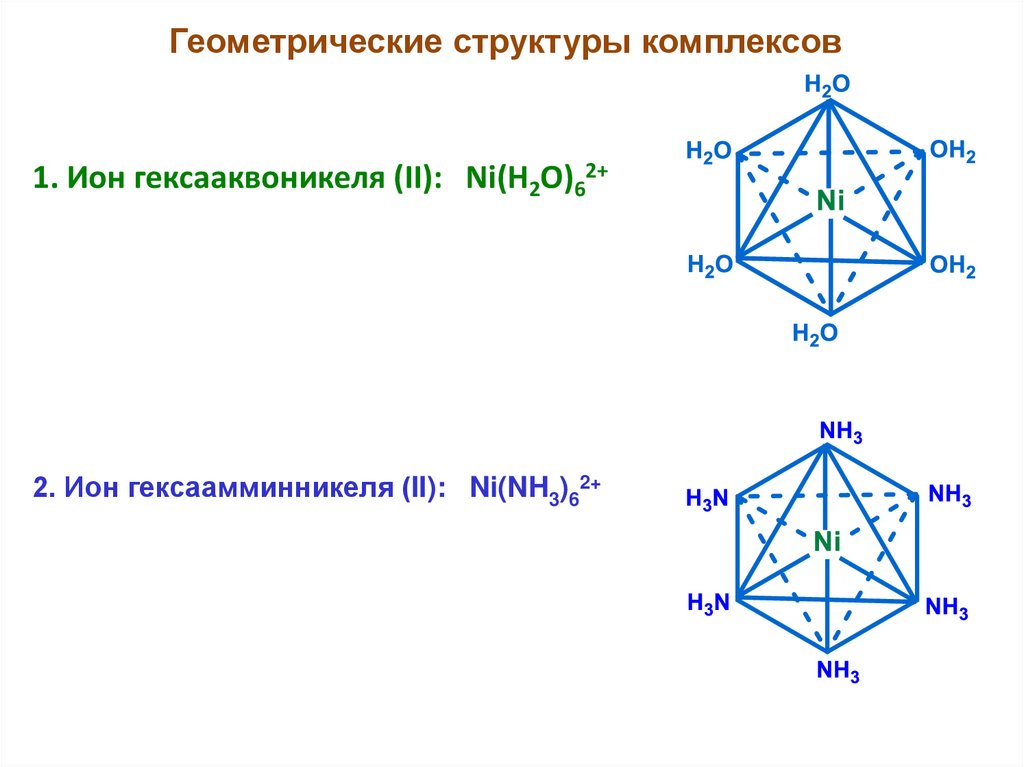
Геометрические структуры комплексов1. Ион гексааквоникеля (II): Ni(H2O)62+
2. Ион гексаамминникеля (II): Ni(NH3)62+
24.
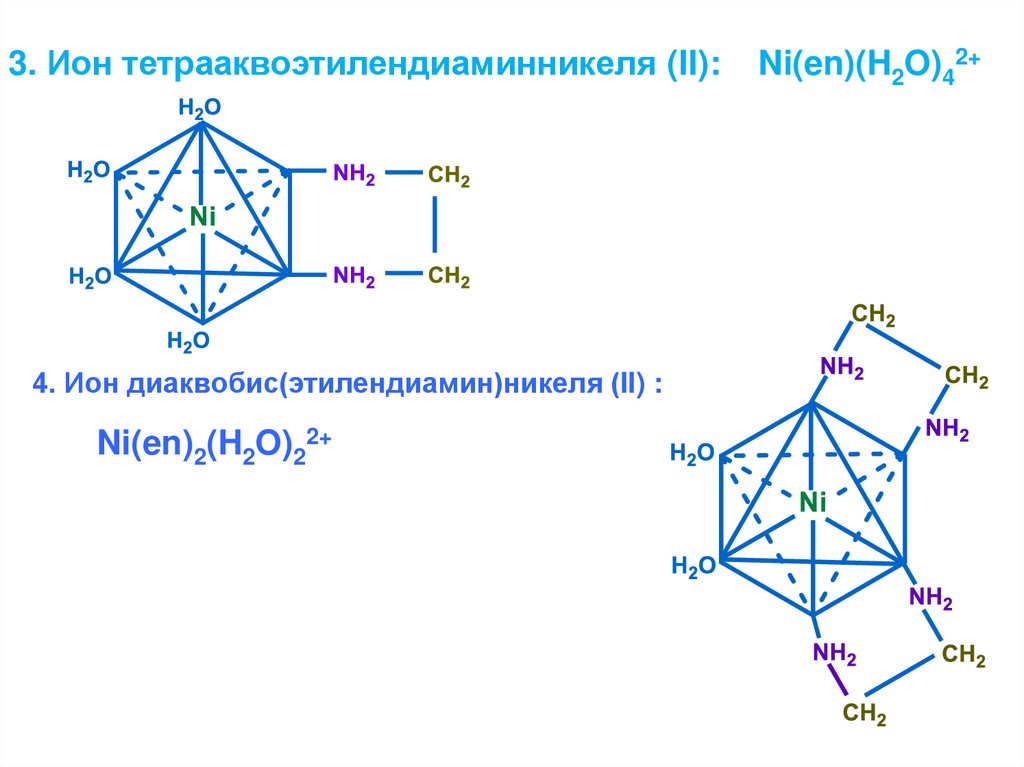
3. Ион тетрааквоэтилендиаминникеля (II):4. Ион диаквобис(этилендиамин)никеля (II) :
Ni(en)2(H2O)22+
Ni(en)(H2O)42+
25.
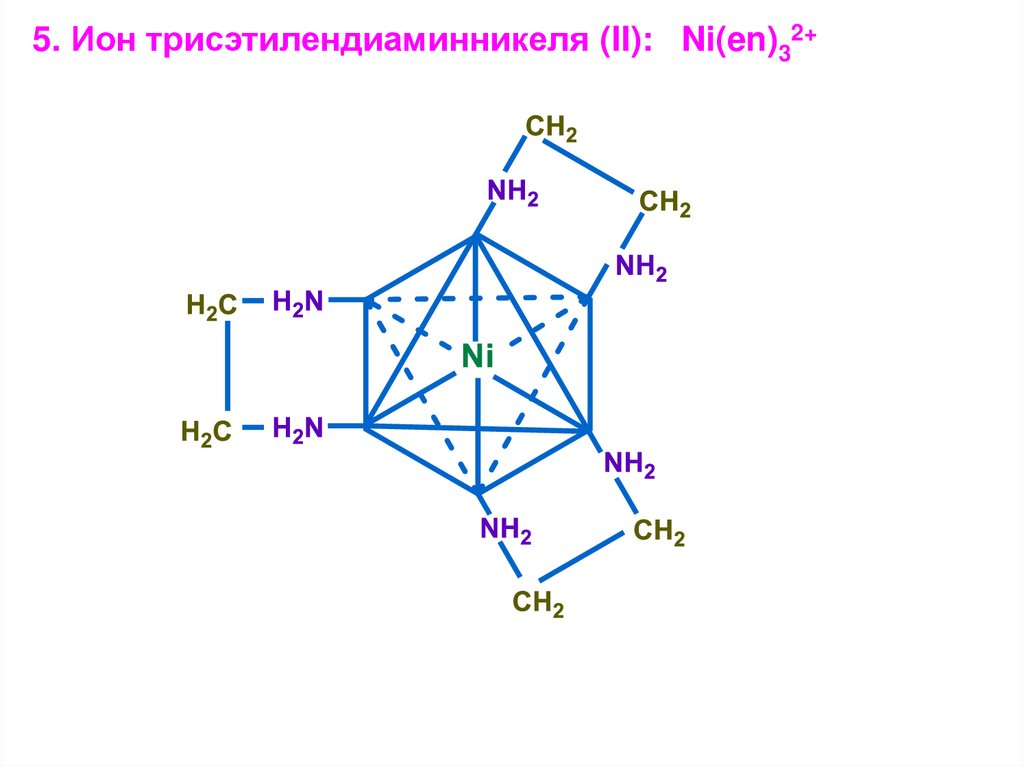
5. Ион трисэтилендиаминникеля (II): Ni(en)32+26.
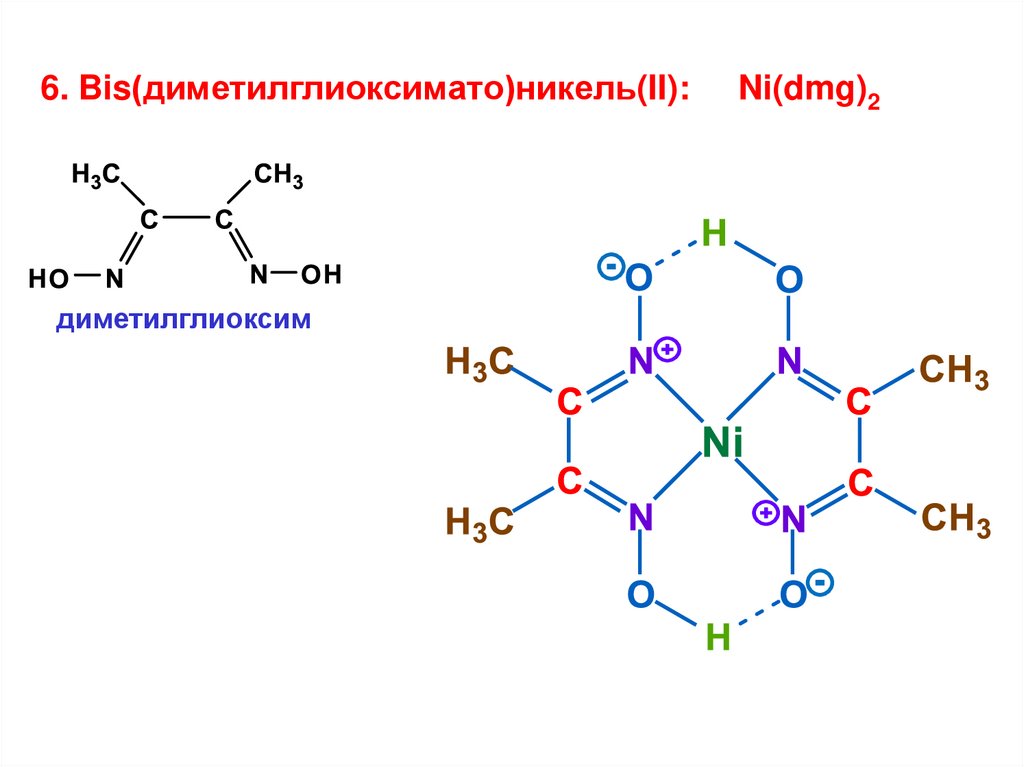
6. Bis(диметилглиоксимато)никель(II):диметилглиоксим
Ni(dmg)2
27.
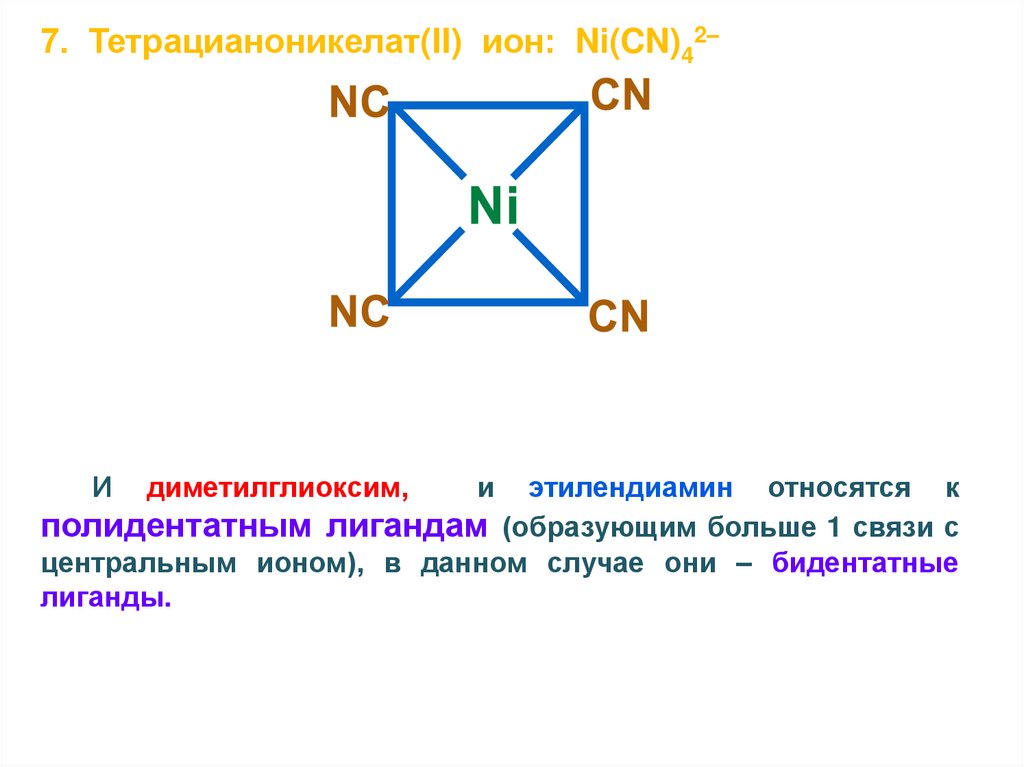
7. Тетрацианоникелат(II) ион: Ni(CN)42–И
диметилглиоксим,
и
этилендиамин относятся к
полидентатным лигандам (образующим больше 1 связи с
центральным ионом), в данном случае они – бидентатные
лиганды.
28.
Пример практического использования комплексов.3
4 Feaq
3Fe(CN )64
Fe4 Fe(CN ) 6 3 xH 2O
(x 14 16)
(Берлинская лазурь)
Fe3 Fe(CN )6 2
Турнбуллева синь
В обоих пигментах имеется эта группировка
Fe( III ) N C Fe
так что по сути Турнбуллева синь и Берлинская лазурь (или
Прусский голубой или Французский голубой) это одно и то
же соединение.
29.
Применяется:При производстве вина, когда избыток железа в вине удаляют
контролирующими добавками K4Fe(CN)6.
Главное применение – голубой пигмент низкой стоимости.
Получают в промышленности по реакции Na4Fe(CN)6 и
FeSO4·7H2O в присутствии (NH4)2SO4 происходит образование
нерастворимого осадка ферроцианида Fe(II) белого цвета. Затем
его окисляют дихроматом или хлоратом, при этом получают
Прусский голубой. В 60-х годах США производили ~ 5 млн. кг
в год. Пигмент – для приготовления чернил, для полиэтилена,
для красочной печати.
30.
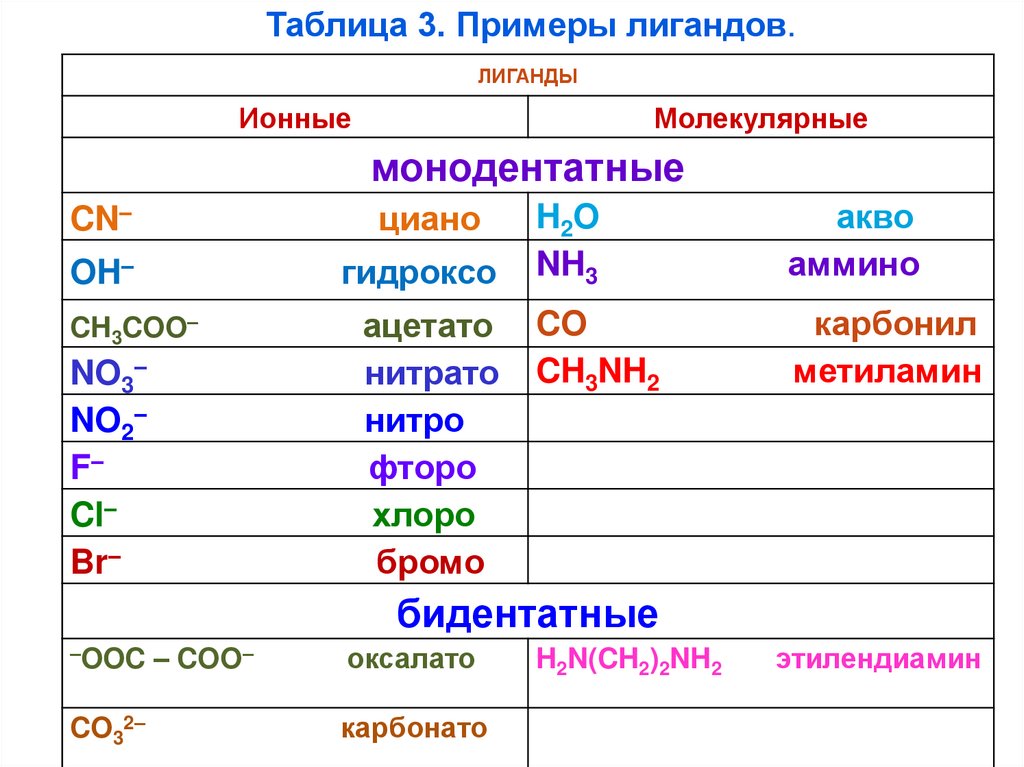
Таблица 3. Примеры лигандов.ЛИГАНДЫ
Ионные
Молекулярные
монодентатные
циано
CN–
гидроксо
OH–
CH3COO–
NO3–
NO2–
F–
Cl–
Br–
ацетато
нитрато
нитро
фторо
хлоро
бромо
H2O
NH3
акво
аммино
CO
CH3NH2
карбонил
метиламин
бидентатные
–OOC
CO32–
– COO–
оксалато
карбонато
H2N(CH2)2NH2
этилендиамин
31.
Координационное число и геометрическоестроение комплексов
Вернёмся
к
реакции
образования
комплекса
из
центрального атома и нескольких лигандов за счёт
неподелённых электронных пар последних:
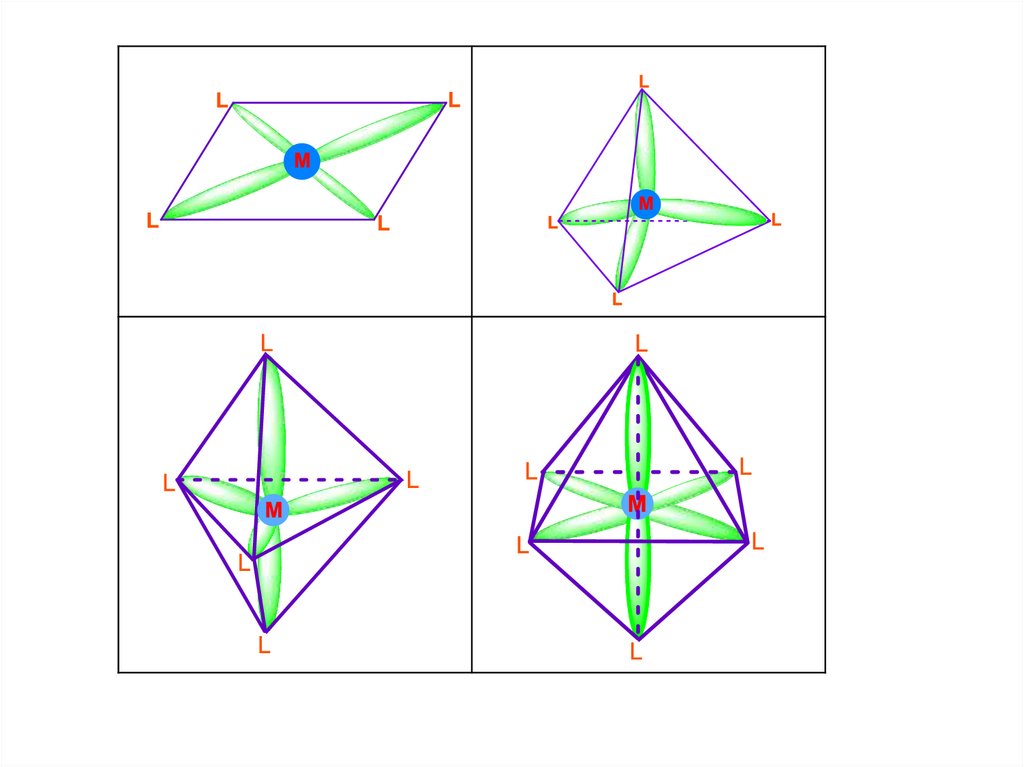
Поскольку каждый монодентатный лиганд расходует на
образование связи с центральным ионом 1 электронную
пару, то число электронных пар, расположенных в
пространстве
вокруг
этого
иона,
равно
числу
координированных лигандов, т.е. координационному
числу. Поскольку эти пары располагаются в пространстве,
их называют стереоактивными.
32.
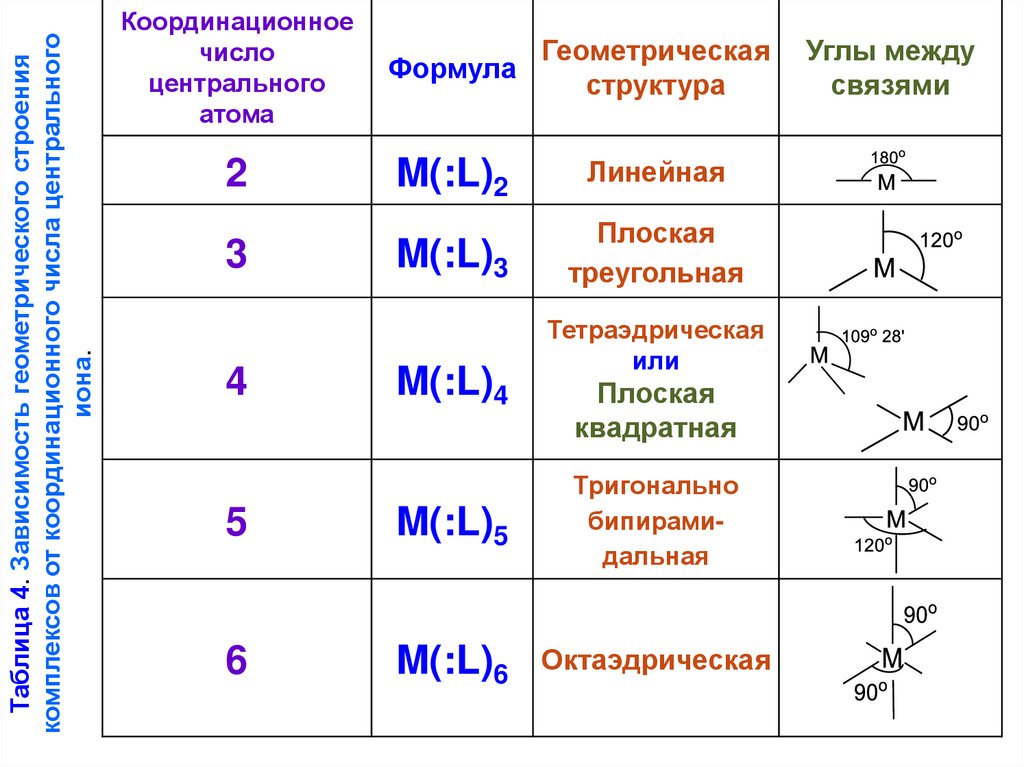
Таблица 4. Зависимость геометрического строениякомплексов от координационного числа центрального
иона.
Координационное
число
центрального
атома
2
3
4
Геометрическая
Формула
структура
M(:L)2
Линейная
M(:L)3
Плоская
треугольная
M(:L)4
Тетраэдрическая
или
Плоская
квадратная
5
M(:L)5
Тригонально
бипирамидальная
6
M(:L)6
Октаэдрическая
Углы между
связями
33.
34.
Интересно выяснить, каково предельное число лигандов,которое может координироваться вокруг центрального иона. В
некоторых комплексах координационное число равно 8, в то же
время другие катионы способны координировать не более 2
лигандов. В подавляющем числе комплексов координационное
число равно 6 или 4. Для каждого катиона характерно
определённое координационное число, остающееся почти всегда
постоянным (выше приведенный пример с комплексами Ni).
Максимальное
значение
координационного
числа
определяется
главным
образом
возрастанием
сил
отталкивания между лигандами по мере их накопления в
координационной сфере катиона. Эти силы уравновешиваются
силами притяжения лигандов к катиону. Таким образом,
координационное число катиона зависит от плотности
заряда катиона, а также от величины заряда (или
полярности) лигандов.
35.
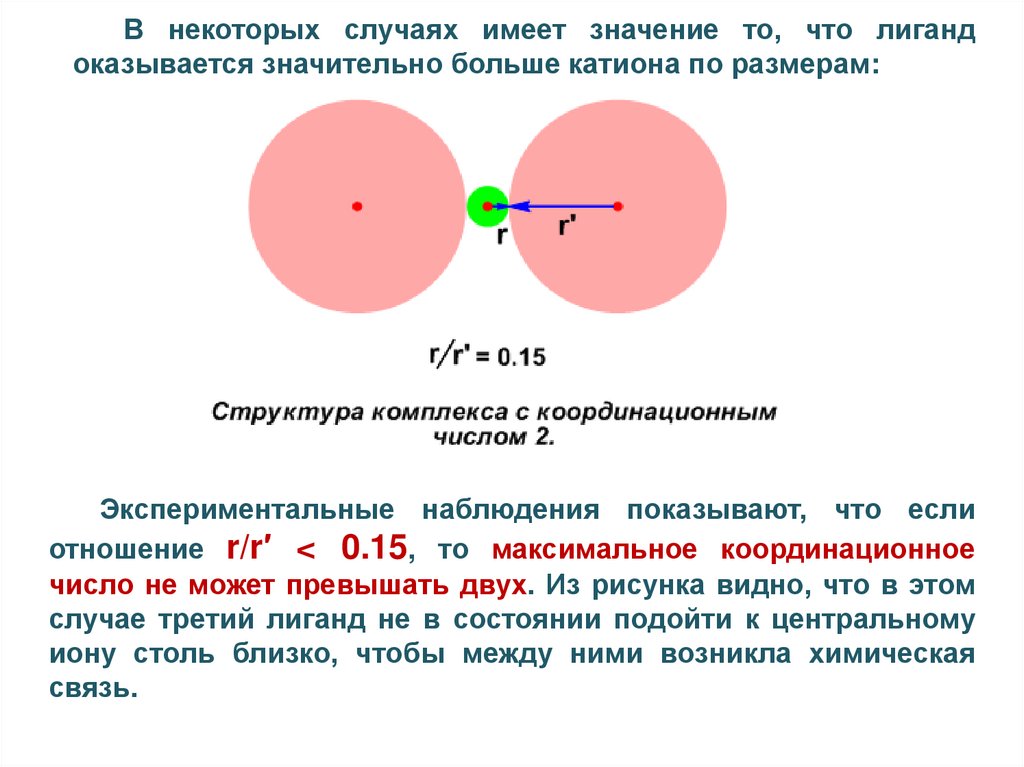
В некоторых случаях имеет значение то, что лигандоказывается значительно больше катиона по размерам:
Экспериментальные наблюдения показывают, что если
отношение r/r′ < 0.15, то максимальное координационное
число не может превышать двух. Из рисунка видно, что в этом
случае третий лиганд не в состоянии подойти к центральному
иону столь близко, чтобы между ними возникла химическая
связь.
36.
Однако, если это отношение радиусов очень мало, болееважным фактором является не геометрические соотношения, а
баланс
сил
притяжения
и
отталкивания.
Например,
двухвалентный
ион
Pt2+ имеет радиус 0.93Å
и
координационное число 4. Он легко образует, например,
плоскоквадратный комплекс [PtCl4]2–. Если же взять ион Pt4+ ,
то он будет иметь радиус всего лишь 0.69Å, но очень мощный
электростатический заряд. В результате он координирует около
себя 6 лигандов в октаэдрическом комплексе [PtCl6]2–.
37.
ПРИРОДА ХИМИЧЕСКОЙ СВЯЗИ В КООРДИНАЦИОННЫХКОМПЛЕКСАХ
Как уже говорилось, во многих отношениях связи в
комплексных соединениях ничем не отличаются от связи в
ковалентных молекулах: в обоих случаях образование
направленных связей приводит к возникновению линейных,
тетраэдрических и октаэдрических структур. Но есть и отличия,
например, откуда у комплексов берётся плоскоквадратная
структура? Зададимся вопросом, как влияет на координационное
число катиона число имеющихся у него валентных орбиталей?
У элементов с порядковыми номерами от 3 до 10 (элементов
второго периода) имеется всего 4 валентных орбитали: одна 2s
и три 2р – орбитали. Эти элементы и их ионы образуют
комплексные соединения с координационным числом не
превышающим 4 (например, комплексные ионы BF4– или BeF42– ).
38.
У всех элементов с порядковыми номерами больше 10имеется по крайней мере 9 валентных орбиталей: одна 2s , три
2р – типа и пять 3d – типа и этого более, чем достаточно для
расселения связывающих электронов в комплексах с любой из
известных структур.
Геометрическое строение координационных комплексов в
целом удаётся объяснить с помощью представлений о
гибридизации
орбиталей
центрального
атома.
Пространственное расположение гибридных орбиталей мы
обсуждали ранее и я напомню о них
с небольшими
дополнениями.
39.
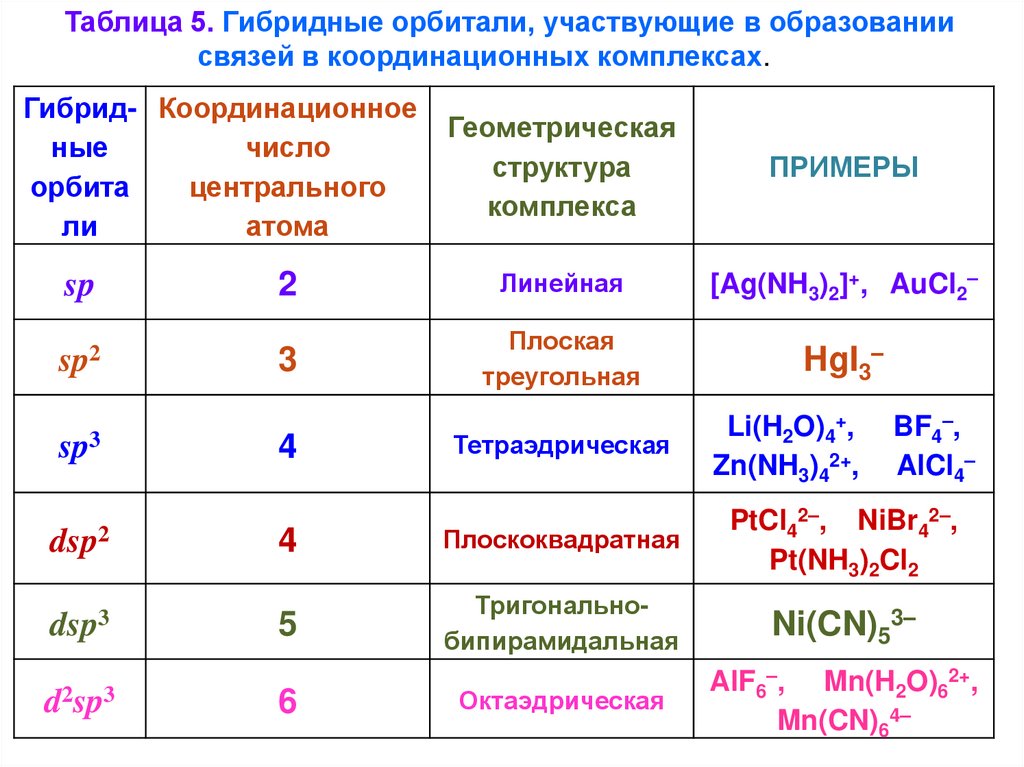
Таблица 5. Гибридные орбитали, участвующие в образованиисвязей в координационных комплексах.
Гибрид- Координационное
ные
число
орбита
центрального
ли
атома
sp
sp2
sp3
dsp2
dsp3
d2sp3
Геометрическая
структура
комплекса
ПРИМЕРЫ
2
Линейная
[Ag(NH3)2]+, AuCl2–
3
Плоская
треугольная
HgI3–
4
Тетраэдрическая
Li(H2O)4+,
Zn(NH3)42+,
BF4–,
AlCl4–
4
Плоскоквадратная
PtCl42–, NiBr42–,
Pt(NH3)2Cl2
5
Тригональнобипирамидальная
Ni(CN)53–
Октаэдрическая
AlF6–, Mn(H2O)62+,
Mn(CN)64–
6
40.
Следует отметить, что подходящая для образованияхимических связей группа гибридизованных орбиталей
центрального иона должна быть незанятой, поскольку
предполагается, что связывающие электроны поставляются
лигандами.
Поясним сказанное примерами.
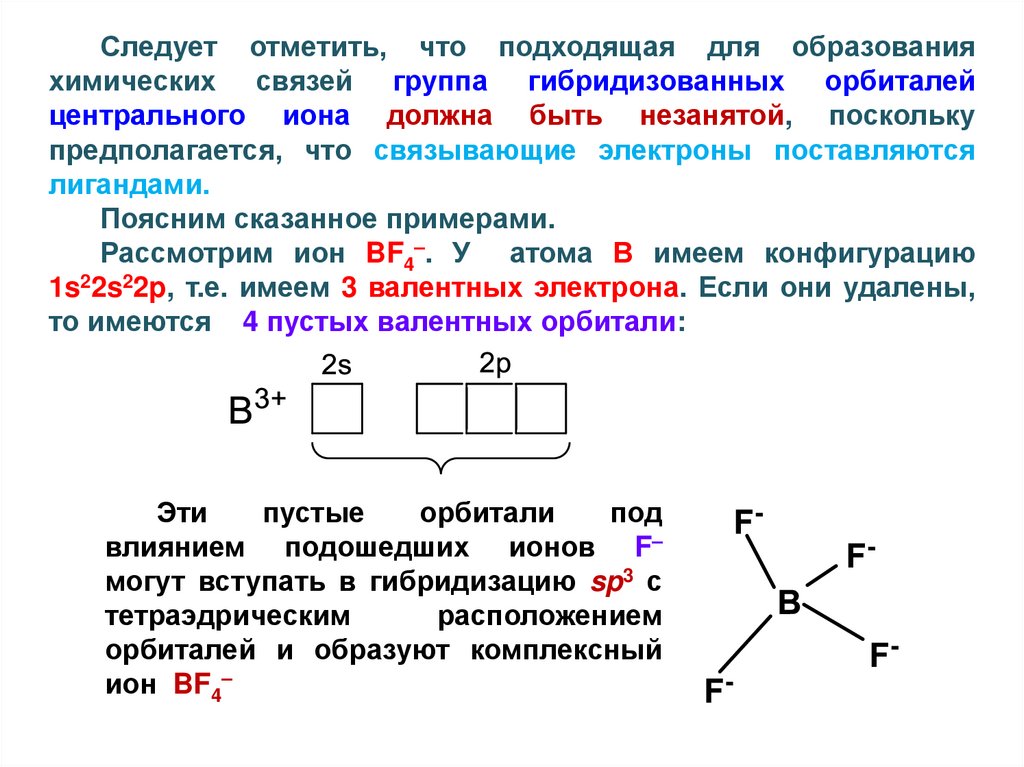
Рассмотрим ион BF4–. У атома В имеем конфигурацию
1s22s22p, т.е. имеем 3 валентных электрона. Если они удалены,
то имеются 4 пустых валентных орбитали:
Эти
пустые
орбитали
под
влиянием подошедших ионов F–
могут вступать в гибридизацию sp3 с
тетраэдрическим
расположением
орбиталей и образуют комплексный
ион BF4–
41.
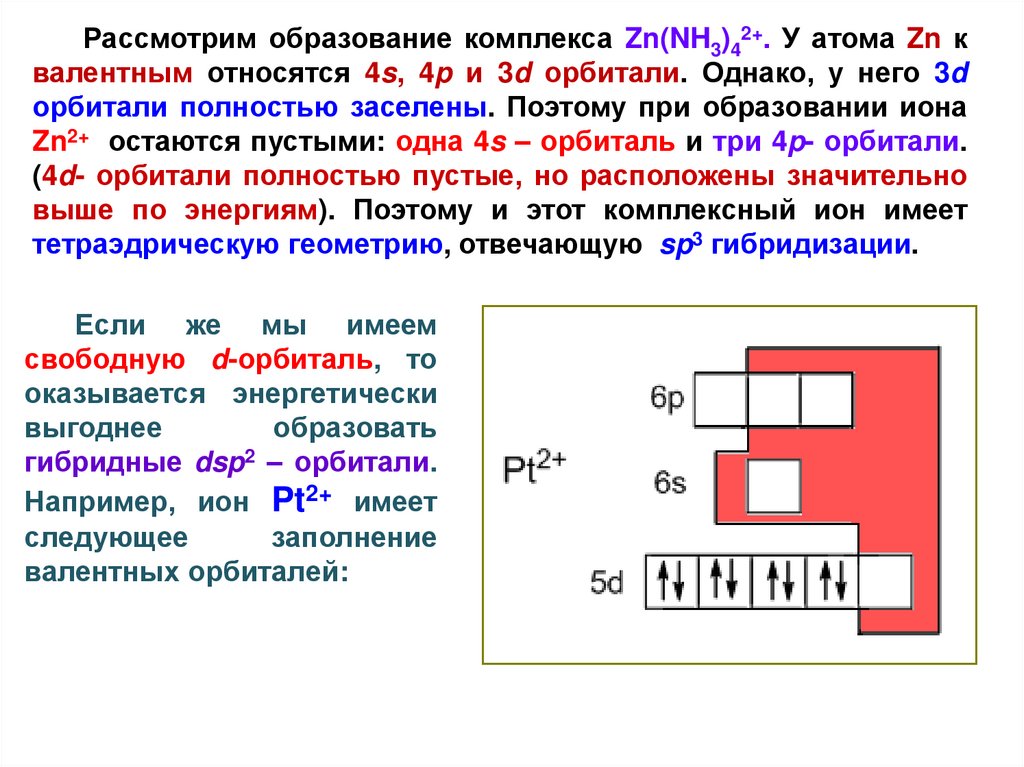
Рассмотрим образование комплекса Zn(NH3)42+. У атома Zn квалентным относятся 4s, 4p и 3d орбитали. Однако, у него 3d
орбитали полностью заселены. Поэтому при образовании иона
Zn2+ остаются пустыми: одна 4s – орбиталь и три 4p- орбитали.
(4d- орбитали полностью пустые, но расположены значительно
выше по энергиям). Поэтому и этот комплексный ион имеет
тетраэдрическую геометрию, отвечающую sp3 гибридизации.
Если же мы имеем
свободную d-орбиталь, то
оказывается энергетически
выгоднее
образовать
гибридные dsp2 – орбитали.
Например, ион Pt2+ имеет
следующее
заполнение
валентных орбиталей:
42.
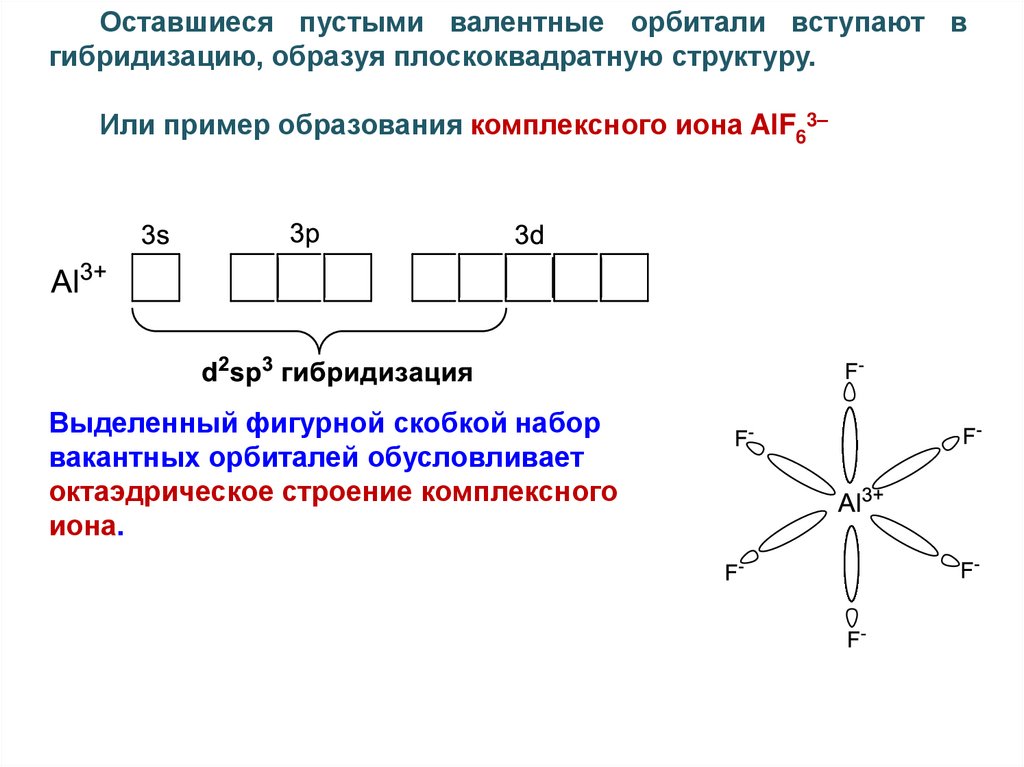
Оставшиеся пустыми валентные орбитали вступают вгибридизацию, образуя плоскоквадратную структуру.
Или пример образования комплексного иона AlF63–
Выделенный фигурной скобкой набор
вакантных орбиталей обусловливает
октаэдрическое строение комплексного
иона.
43.
Устойчивость комплексовЧаще всего представляет интерес степень диссоциации
комплекса на катион и лиганды в равновесных условиях. Строго
говоря, процессы в водных растворах представляют собой не
диссоциацию, а замещение лигандов молекулами воды, так что
координационное число центрального иона должно оставаться
постоянным. Подобные равновесия описываются уравнением
общего вида:
M(:L)xn+
+ x H2O ⇄
M(H2O)xn+
+ x(:L)
Однако, поскольку концентрация воды в разбавленных
растворах
остаётся
практически
постоянной,
вполне
допустимо пренебрегать гидратацией и рассматривать
указанную выше реакцию, как процесс диссоциации:
[M(:L)x]n+
⇄
Mn+
+
x(:L)
44.
Это уравнение представляет собой сумму уравненийотдельных стадий диссоциации, каждой из которых
соответствует
своя
константа
равновесия,
например,
комплексный ион Ag(NH3)2+ диссоциирует в две стадии:
Ag(NH3)2+
Ag(NH3)+
Ag(NH3)+
⇄
⇄
Ag+
+ NH3
+ NH3
[ Ag ( NH 3 ) ] [ NH 3 ]
K1
[ Ag ( NH 3 ) 2 ]
[ Ag ] [ NH 3 ]
K2
[ Ag ( NH 3 ) ]
45.
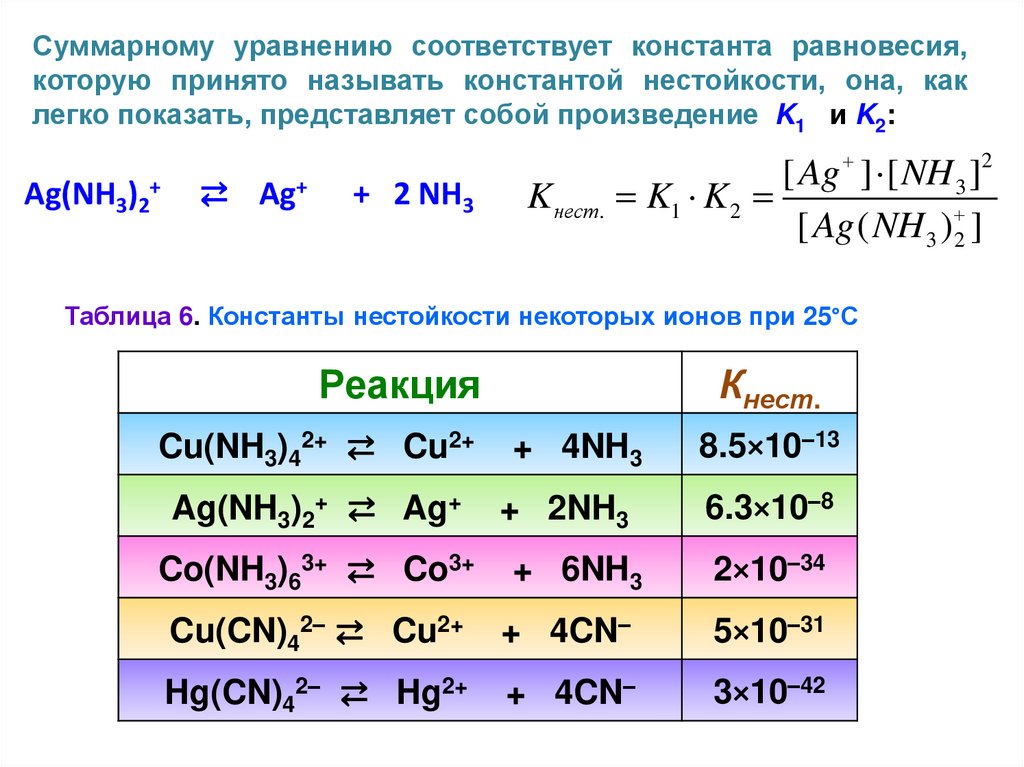
Суммарному уравнению соответствует константа равновесия,которую принято называть константой нестойкости, она, как
легко показать, представляет собой произведение K1 и K2:
Ag(NH3)2+
⇄ Ag+
+ 2 NH3
K нест.
[ Ag ] [ NH 3 ]2
K1 K 2
[ Ag ( NH 3 ) 2 ]
Таблица 6. Константы нестойкости некоторых ионов при 25°С
Реакция
Cu(NH3)42+ ⇄ Cu2+
Ag(NH3)2+ ⇄ Ag+
Co(NH3)63+ ⇄ Co3+
Кнест.
+ 4NH3
+ 2NH3
+ 6NH3
8.5×10–13
6.3×10–8
2×10–34
Cu(CN)42– ⇄ Cu2+
+ 4CN–
5×10–31
Hg(CN)42– ⇄ Hg2+
+ 4CN–
3×10–42
46.
При прочих равных условиях лиганды, которые являютсяхорошими донорами электронов, дают наиболее устойчивые
комплексы.
Применение координационных комплексов.
Применяются чрезвычайно широко:
аналитической химии, в катализе.
в
биохимии,
Равновесия в реакциях замещения лигандов
Комплексы элементов платиновой группы.
[M n ( H2O)7 q Lmq 1 ]n ( q 1) m Lm
[M n ( H 2O)6 q Lmq ]n qm H 2O
Константа образования
Kq
[ M ( H 2O)6 q Lq ]
[ M ( H 2O )7 q Lq 1 ] [ L]
q K1K 2 ...K q
1
Размерность: K ( )
M
[ M ( H 2O)6 q Lq ]
[ M ( H 2O ) 6 ] [ L]
q
в
47.
Факторы, определяющие устойчивостькомплексов в зависимости от типа лигандов.
Основность
(способность отдавать электронную пару,
быть донором) лигандов зависит от вида атомов, участвующих
в координации. В подгруппе VIIA основность ослабляется в
ряду: F–, Cl–, Br–, I–.
Лиганды, имеющие координируемых атомов в своём составе
элементы подгрупп VA и VIA с низкими атомными номерами,
имеют
высокую
основность.
Установлена
следующая
зависимость: O > S > Se > Te;
N > P > As > Sb.
48.
Факторы, определяющие устойчивостькомплексов в зависимости от природы катиона.
Стабильность комплексов возрастает по мере повышения
заряда центрального катиона, а в случае одинаковых зарядов
катионов – по мере уменьшения ионного радиуса. Эта
зависимость без исключений (при одинаковой основной
структуре) применима к монодентатным лигандам, имеющим
в качестве координируемых атомов O и N. Например, для
катионов с почти одинаковыми ионными радиусами
устойчивость комплекса изменяется в следующем порядке:
Na+ < Ca2+ < Y3+ < Th4+ ; K+ < Sr2+ < La3+
Al 3+ > Ga3+ > In3+;
Al3+ > Sc3+ > Y3+ > La3+
49.
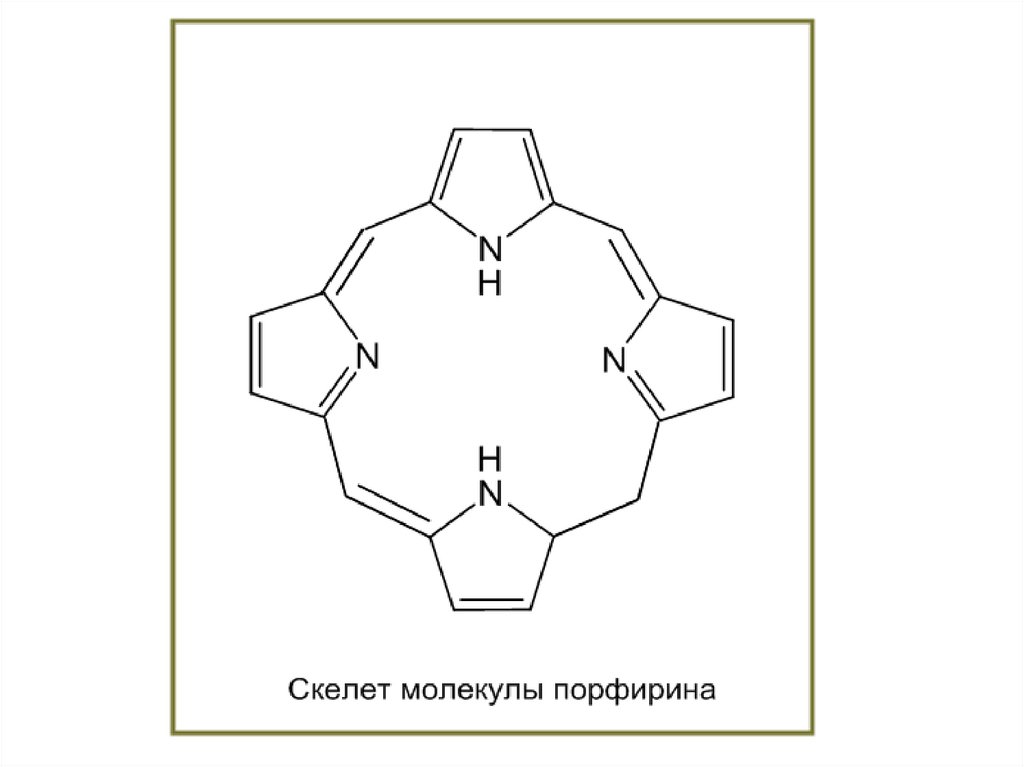
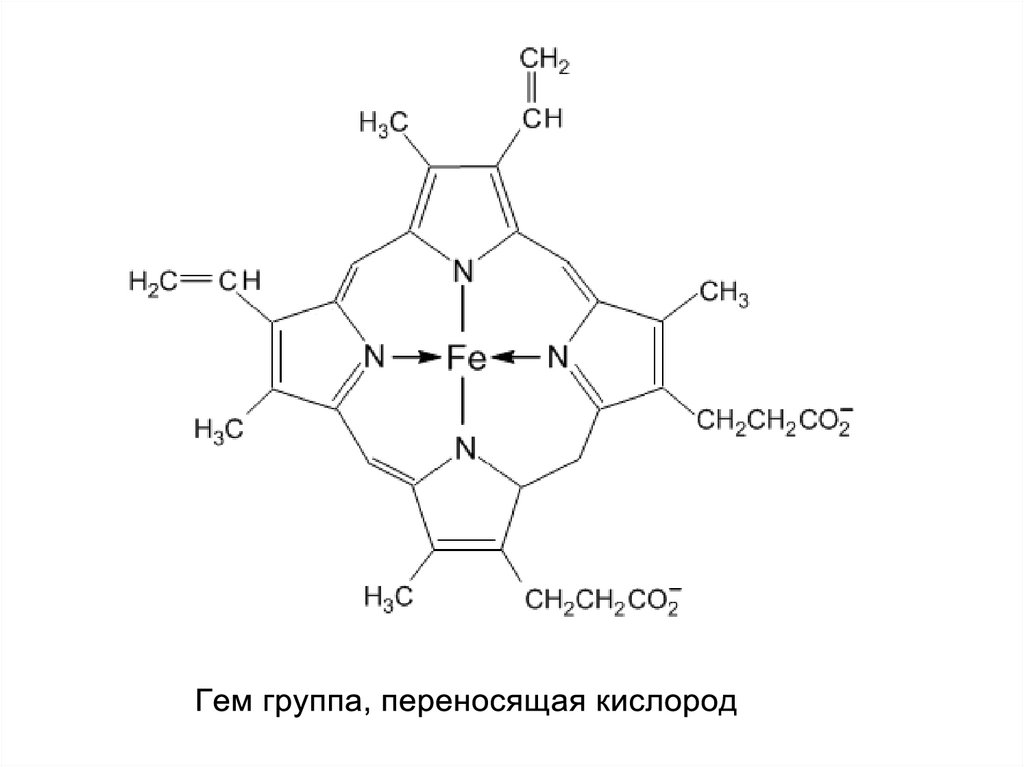
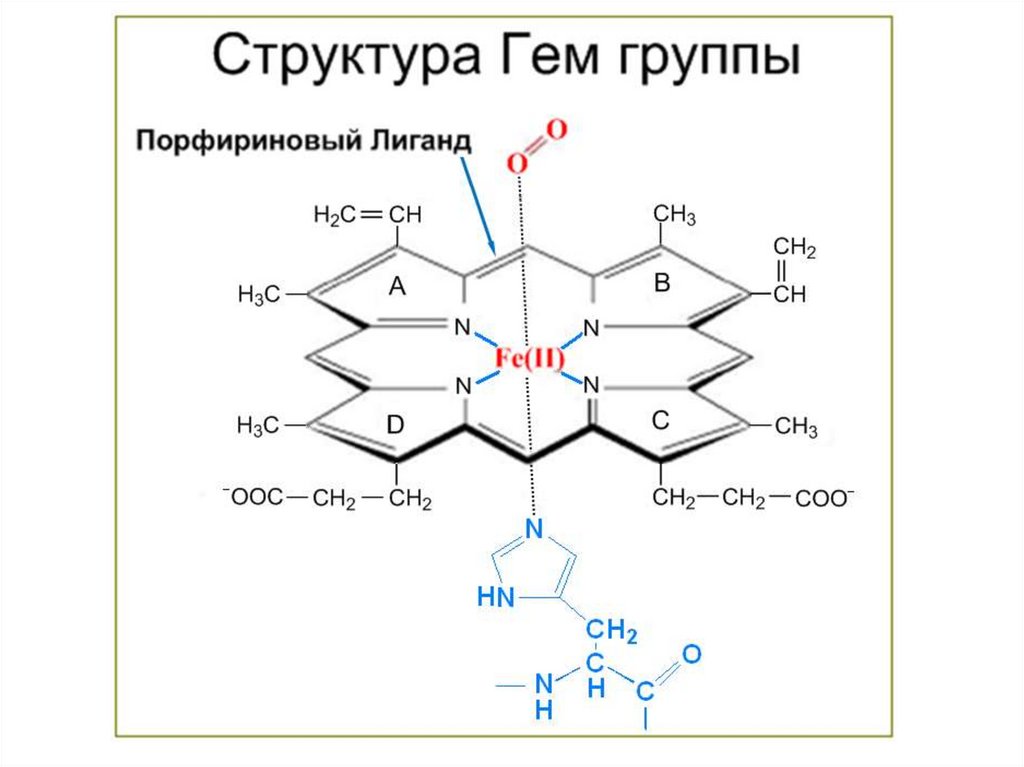
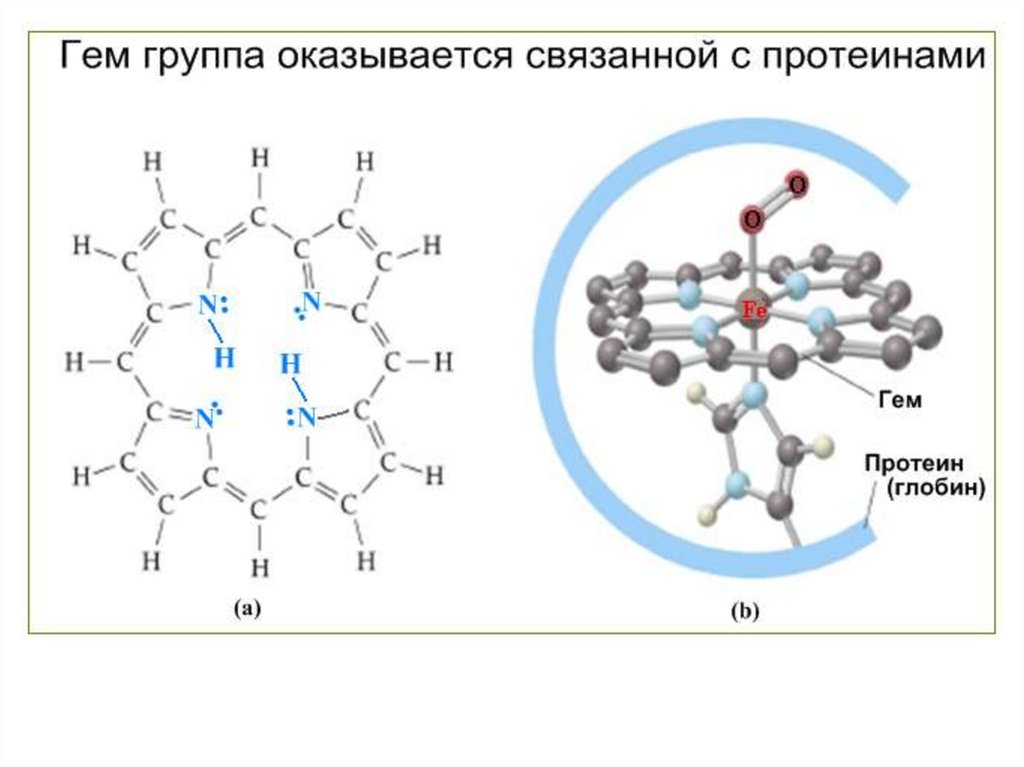
Протеин, переносящий кислород в крови:гемоглобин
Один из наиболее важных способов связывания
металлических ионов – образование комплексов с
макроциклическими
лигандами,
которые
называются
порфиринами. Порфирины являются
производными
порфина и отличаются друг от друга расположением
заместителей по периферии системы. Молекула порфина
представлена на Рис.1, а на Рис.2 приведён один из
важнейших металлических порфириновых комплексов – гем
группа гемоглобина.
50.
51.
Образование шестидентатного комплекса ЭДТА сионом кальция


























 chemistry
chemistry








