Similar presentations:
Валентность связи и локальный баланс валентности
1.
Валентность связи и локальный баланс валентностиПо аналогии с порядком ковалентной связи, каждому контакту металл-неметалл
приписывается валентность связи S– доля степени окисления данного элемента (по
абсолютной величине), приходящаяся на одного соседа. Разница лишь в том, что в
классических ковалентных структурах порядок связи не меньше единицы, а в
ионных обычно меньше, поэтому изобразить прочность связи числом палочек нельзя.
Если все связи равноценны, то можно делить валентность поровну: S = |Ст.Ок.|/КЧ.
Если нет, то существуют формулы, связывающие длину и валентность связи (см.
далее). Валентность связи позволяет сравнивать связи по прочности, прогнозировать
структуры и многие физико-химические свойства, исправлять ошибки в
расшифровках структур. При этом действует один из фундаментальных законов
неорганической химии (который, к сожалению, игнорируется в традиционных
учебниках, при том, что гораздо менее общие идеи излагаются):
принцип локального баланса валентности (ЛБВ): всякая ковалентная,
ионная или ионно-ковалентная структура должна быть электронейтральна не только
в целом, но и в каждой точке, т.е. сумма валентностей связей каждого атома или иона
должна равняться его валентности или степени окисления. В структурах, где все
"катионы" или все "анионы" имеют одинаковое окружение (NaCl, SiO2), это выполняется автоматически, а в более сложных – не всегда, и этот принцип позволяет
отбраковывать ошибочные структуры и уточнять структурные расшифровки.
Точность расчётов ЛБВ – 3-6%. Более серьёзные отклонения требуют объяснений.
Некоторые примеры
1) Рентгеновские лучи рассеиваются электронами, поэтому рентгеноструктурным
анализом (РСА) очень трудно различить изоэлектронные ионы: O2– и F–, Pb2+ и Bi3+ и
др. А по сумме валентностей связей они различаются. Точно так же, при РСА трудно
найти позицию водорода, а по недостатку валентности видно, куда он присоединён.
2.
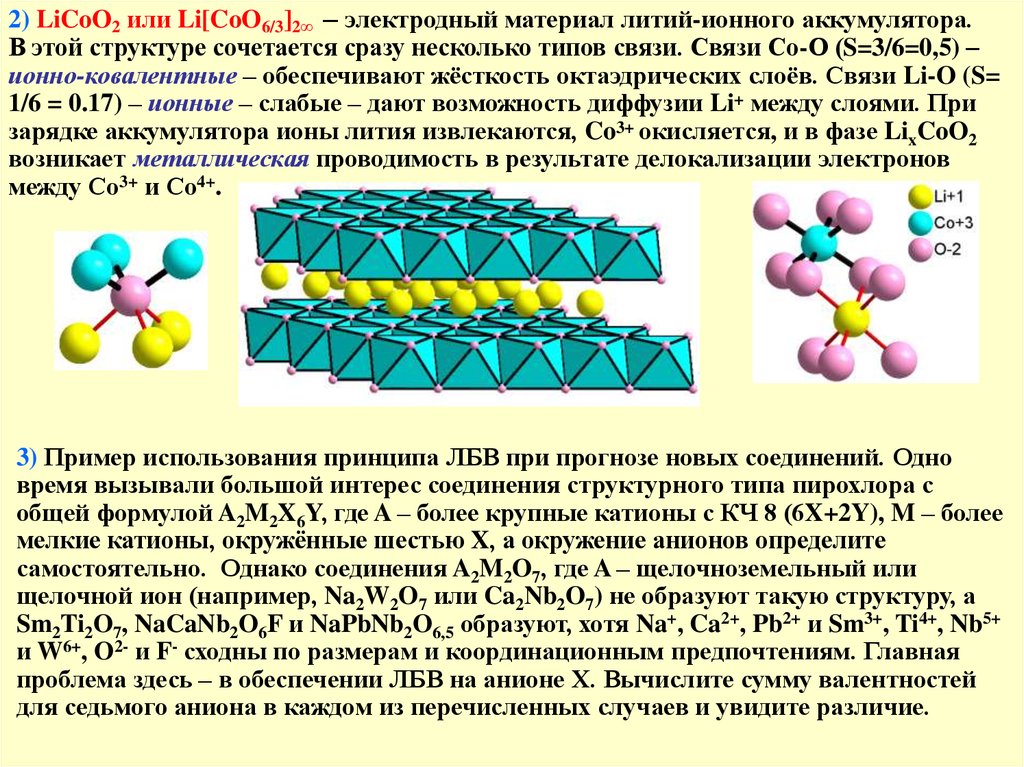
2) LiCoO2 или Li[CoO6/3]2∞ – электродный материал литий-ионного аккумулятора.В этой структуре сочетается сразу несколько типов связи. Связи Со-О (S=3/6=0,5) –
ионно-ковалентные – обеспечивают жёсткость октаэдрических слоёв. Связи Li-O (S=
1/6 = 0.17) – ионные – слабые – дают возможность диффузии Li+ между слоями. При
зарядке аккумулятора ионы лития извлекаются, Co3+ окисляется, и в фазе LixCoO2
возникает металлическая проводимость в результате делокализации электронов
между Со3+ и Со4+.
3) Пример использования принципа ЛБВ при прогнозе новых соединений. Одно
время вызывали большой интерес соединения структурного типа пирохлора с
общей формулой A2M2X6Y, где A – более крупные катионы с КЧ 8 (6X+2Y), M – более
мелкие катионы, окружённые шестью X, а окружение анионов определите
самостоятельно. Однако соединения A2M2O7, где A – щелочноземельный или
щелочной ион (например, Na2W2O7 или Ca2Nb2O7) не образуют такую структуру, а
Sm2Ti2O7, NaCaNb2O6F и NaPbNb2O6,5 образуют, хотя Na+, Ca2+, Pb2+ и Sm3+, Ti4+, Nb5+
и W6+, O2- и F- сходны по размерам и координационным предпочтениям. Главная
проблема здесь – в обеспечении ЛБВ на анионе Х. Вычислите сумму валентностей
для седьмого аниона в каждом из перечисленных случаев и увидите различие.
3.
4) Обсудим склонность гидратированного катиона алюминия к гидролизу – отрывуиона водорода от гидратной оболочки – и к конденсации гидролизованных ионов.
В водном растворе каждый ион связан с молекулами воды.
На рисунке показана только одна молекула воды, а реально они со
всех сторон катиона. У кислорода КЧ 3, а валентность в любом
случае 2, и чем прочнее связь М-О, тем слабее связи О-Н.
Соотношение радиусов ионов Al3+ и кислорода позволяет катиону
иметь максимальное КЧ 6. В ионном кристалле КЧ может быть меньше по условиям
координационного баланса или совместимости координационных групп, но с
нейтральными молекулами таких ограничений нет, поэтому неизбежно КЧ 6. Тогда
S(Al-O)=3/6=0,5. Тогда у кислорода на связи с Н остаётся 1,5, и S(O-H)=0.75 – связь
довольно прочна, но всё же слабее, чем в свободной молекуле воды. Поэтому отрыв
протона маловероятен, но иногда возможен. При такой схеме у атома водорода до его
валентности 1 не хватает 0,25 единиц валентности. Они восполняются водородной
связью с молекулой воды из второй гидратной оболочки. Сравнение величин S(O-H)
у разных гидратированных катионов позволяет сравнивать их по кислотности
водных растворов их солей.
Но что происходит, когда протон оторвался? Атом кислорода сразу становится
валентно ненасыщенным: даже если от оставшегося Н он получит не 0,75, а 1,00, всё
равно в сумме со связью O-Al получается лишь 1,5. Чтобы восстановить ЛБВ, есть
два варианта: а) резкое упрочнение данной связи
Al-O за счёт ослабления других, что нехарактерно
для Al3+ в отличие, например, от d0-ионов (Ti4+, V5+);
б) присоединение второго Al3+, который даст недостающие 0,5 единиц валентности. Идёт конденсация,
два октаэдра соединяются общим ребром:
4.
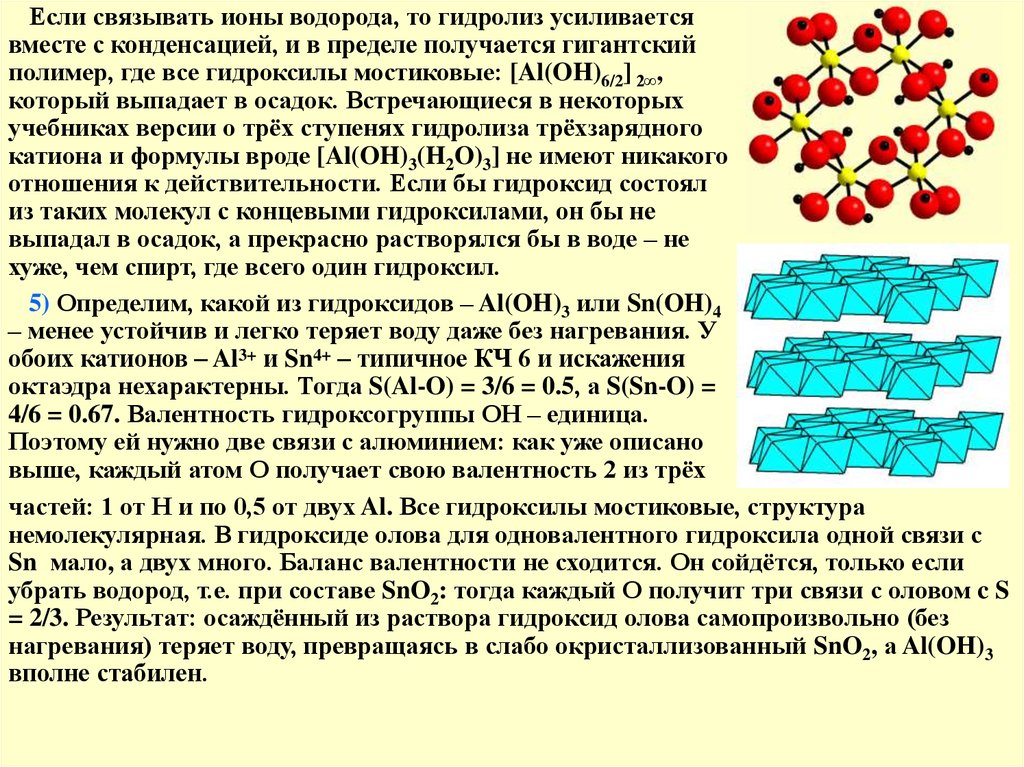
Если связывать ионы водорода, то гидролиз усиливаетсявместе с конденсацией, и в пределе получается гигантский
полимер, где все гидроксилы мостиковые: [Al(OH)6/2] 2∞,
который выпадает в осадок. Встречающиеся в некоторых
учебниках версии о трёх ступенях гидролиза трёхзарядного
катиона и формулы вроде [Al(OH)3(H2O)3] не имеют никакого
отношения к действительности. Если бы гидроксид состоял
из таких молекул с концевыми гидроксилами, он бы не
выпадал в осадок, а прекрасно растворялся бы в воде – не
хуже, чем спирт, где всего один гидроксил.
5) Определим, какой из гидроксидов – Al(OH)3 или Sn(OH)4
– менее устойчив и легко теряет воду даже без нагревания. У
обоих катионов – Al3+ и Sn4+ – типичное КЧ 6 и искажения
октаэдра нехарактерны. Тогда S(Al-O) = 3/6 = 0.5, а S(Sn-O) =
4/6 = 0.67. Валентность гидроксогруппы ОН – единица.
Поэтому ей нужно две связи с алюминием: как уже описано
выше, каждый атом О получает свою валентность 2 из трёх
частей: 1 от Н и по 0,5 от двух Al. Все гидроксилы мостиковые, структура
немолекулярная. В гидроксиде олова для одновалентного гидроксила одной связи с
Sn мало, а двух много. Баланс валентности не сходится. Он сойдётся, только если
убрать водород, т.е. при составе SnO2: тогда каждый О получит три связи с оловом c S
= 2/3. Результат: осаждённый из раствора гидроксид олова самопроизвольно (без
нагревания) теряет воду, превращаясь в слабо окристаллизованный SnO2, а Al(OH)3
вполне стабилен.
5.
Варианты расчёта валентности связиВ общем случае связи у данного атома неравноценны по длинам, а часто – и по
природе соседей. Ясно, что для данной пары элементов чем больше расстояние, тем
связь слабее. Но нужны количественные соотношения. На этот счёт нет какой-т о
строгой теории, предложены экспоненциальные или степенные зависимости,
параметры которых подобраны путём подгонки к экспериментальным данным
рентгеноструктурного анализа. Рассмотрим два способа расчёта.
1) Метод Полинга-Брауна – наиболее универсальный и общепринятый.
S=exp[(L0-L)/B], где
L – длина связи А-Х, L0 – константа, специфичная для данной пары элементов с
учётом степеней окисления, а B – константа, обычно принимаемая за 0,37 Å. Из
формулы следует, что при L= L0 валентность связи S=1, значит L0 имеет смысл длины
ординарной связи. В ионно-ковалентных структурах обычно КЧ>валентности, L>L0,
а S<1. Сокращённый список значений L0 есть в «Задачнике по структурной химии»
(Приложение 3), а более полный можно найти в виде текстового файла bvparm2013.cif
на сайте Межународного союза кристаллографов:
http://www.iucr.org/resources/data/datasets/bond-valence-parameters
Оборотная сторона универсальности этого метода – невысокая точность. В частности,
одинаковая величина В для всех связей предполагает, что у них с ростом расстояния
величины S убывают по одному и тому же закону. Между тем, достаточно очевидно,
что ионная связь – более дальнодействующая, т.е. S должна убывать не так круто, как
при ковалентной связи, которая резко ослабевает с уменьшением перекрывания АО.
2) Метод Пятенко – более узко применимый, но при этом более точный. Его
особенности:
– применим только к соединениям с однотипными анионами (к оксидам);
6.
– вместо однозначной связи между L и S даётся закон распределения степени окисления («валентности») катиона между его соседями; при этом баланс валентности накатионе сходится по определению, и его нужно проверять только на анионах;
– вместо экспоненциальной используется степенная зависимость, где показатель
степени n зависит от разности электроотрицательностей: для наиболее ионных
связей он равен 2 (закон Кулона!), а для ковалентных доходит до 7.
SAX = KA × LAX–n,
где SAX – валентность связи между атомами А и Х, LAX – её длина, n – показатель,
зависящий от степени ионности связи (см. таблицу на следующем слайде), KA –
нормирующий множитель для катиона А, определяемый из условия баланса
валентности на катионе А:
KA = ZA/Σ(LAX(i) –n),
где ZA – степень окисления А, i – номер его соседа, и суммирование проводится по
всем его соседям.
Разумеется, те же формулы можно применять не только к оксидам, но и к сульфидам,
галогенидам и т.д., но тогда нужно будет подобрать иные значения n.
Задача 23. В той же структуре, которая предложена для реферата, найдите обоими
методами валентности всех связей и проверьте выполнение локального баланса
валентности на каждом атоме. Заметьте, что даже если структура ошибочная и ЛБВ в
ней не сходится, глобальный баланс всегда сходится: сумма валентностей связей всех
катионов должна равняться сумме валентностей связей всех анионов, ведь это одни и
те же цифры. Это надо проверить с учётом кратностей позиций. Если совпадения нет
– есть ошибка в расчёте (2 балла).
Задача 24. Вычислите валентность связи О-Н в данных аквакатионах и определите,
какой из них более склонен к гидролизу, какой – к конденсации гидролизованных
форм (1 балл).
7.
Показатели степени в формуле Пятенко для оксидовЕсли нужного элемента нет в таблице, поищите в ней близкие к нему по
электроотрицательности и возьмите соответствующее значение n. Как
показывает опыт, изменение n на единицу слабо влияет на результат.
Катионы с учетом координации
n
Cs
2
Na, K, Rb, Ba
Li, Ca, Sr, La, Ce
Pr – Dy, Y
2,5
3
3,5
Mg, Sc, Ho – Lu, Zr
4
Be, Al (октаэдр.), Fe (октаэдр.), Ti, Nb, Ta, Pb
5
Cd, Zn, B (тетр.), Al (тетр.), Fe (тетр.), Si, Cu
6
Hg, B (тригон.), C, P, As
7
8.
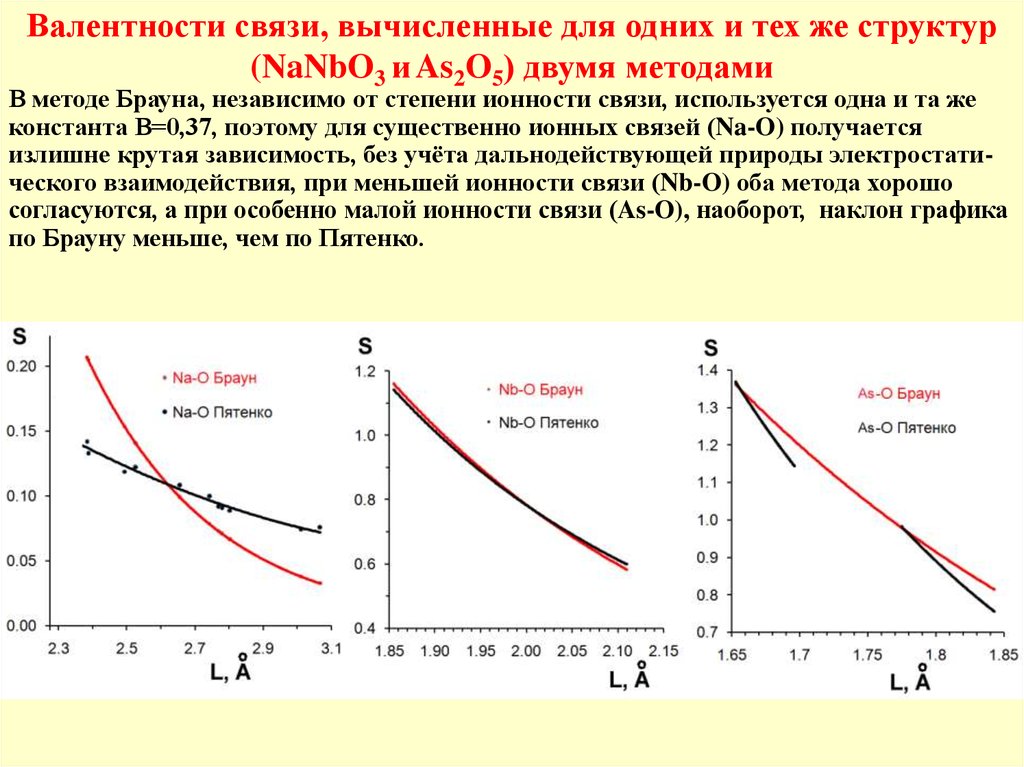
Валентности связи, вычисленные для одних и тех же структур(NaNbO3 и As2O5) двумя методами
В методе Брауна, независимо от степени ионности связи, используется одна и та же
константа В=0,37, поэтому для существенно ионных связей (Na-O) получается
излишне крутая зависимость, без учёта дальнодействующей природы электростатического взаимодействия, при меньшей ионности связи (Nb-O) оба метода хорошо
согласуются, а при особенно малой ионности связи (As-O), наоборот, наклон графика
по Брауну меньше, чем по Пятенко.





 chemistry
chemistry








