Similar presentations:
Химическая связь
1.
ХИМИЧЕСКАЯ СВЯЗЬ2.
ЧТО ТАКОЕ ХИМИЧЕСКАЯ СВЯЗЬ?Химическая связь – это
совокупность сил, удерживающих
вместе два или несколько атомов
или ионов.
3.
ПОЧЕМУ ОБРАЗУЕТСЯ ХИМИЧЕСКАЯСВЯЗЬ?
Возникает энергетическое состояние с
более низкой полной энергией, чем у
непрореагировавших исходных атомов.
Иными словами молекулярное состояние
вещества устойчивее, чем атомное. А
при образовании связей всегда выделяется энергия:
атом 1 + атом 2 + …
молекула + энергия
4.
КАК ОБРАЗУЕТСЯ ХИМИЧЕСКАЯ СВЯЗЬ,ИЛИ КАКОВА ПРИРОДА ХИМИЧЕСКОЙ СВЯЗИ ?
Фундаментальную роль в образовании
химических связей играют электроны,
расположенные на внешней оболочке и,
следовательно,
связанные
с
ядром
наименее
прочно,
так
называемые
валентные электроны.
5.
С В О Й С Т В А Х И М И Ч Е С К ОЙ С В Я З ИЭНЕРГИЯ И ДЛИНА СВЯЗИ.
Энергией химической связи Есв кДж/моль называется количество энергии, выделяющееся при образовании химической связи. Чем больше энергия химической связи, тем устойчивее молекулы.
Длиной связи называется межъядерное расстояние
взаимодействующих атомов. Она зависит от размеров
электронных оболочек и степени их перекрывания.
С уменьшением длины связи обычно увеличивается энергия связи и соответственно устойчивость молекул.
6.
Валентный угол – угол, образованныйдвумя
направлениями
химических
связей, исходящих от одного атома.
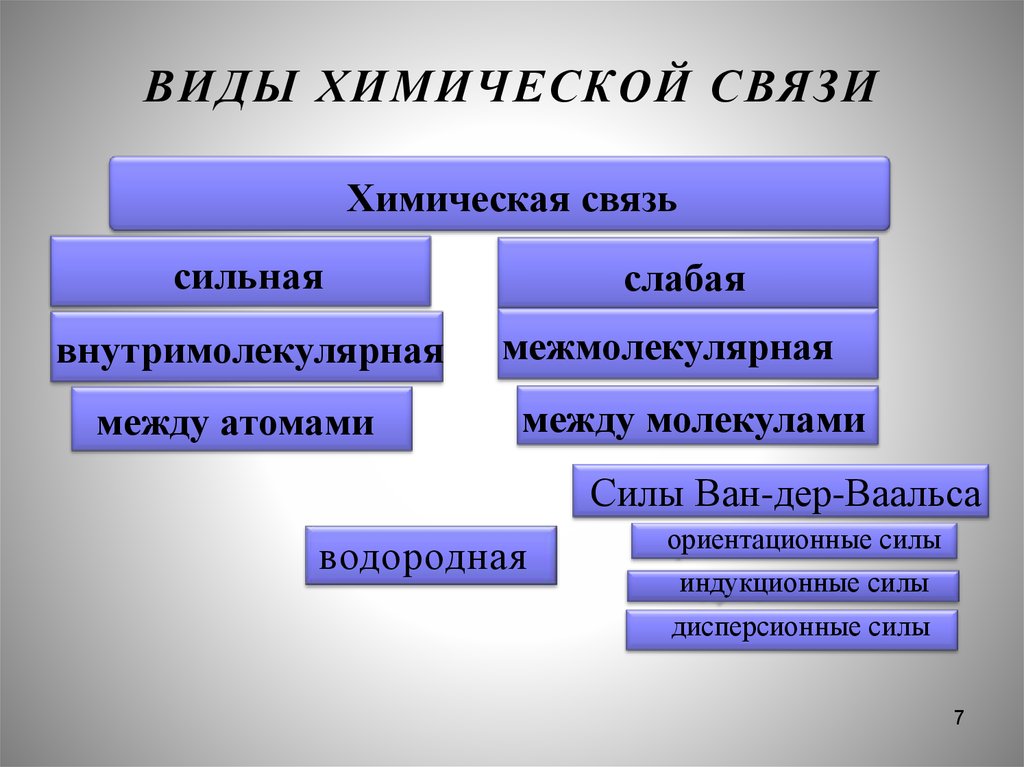
7. ВИДЫ ХИМИЧЕСКОЙ СВЯЗИ
Химическая связьсильная
внутримолекулярная
между атомами
слабая
межмолекулярная
между молекулами
Силы Ван-дер-Ваальса
водородная
ориентационные силы
индукционные силы
дисперсионные силы
7
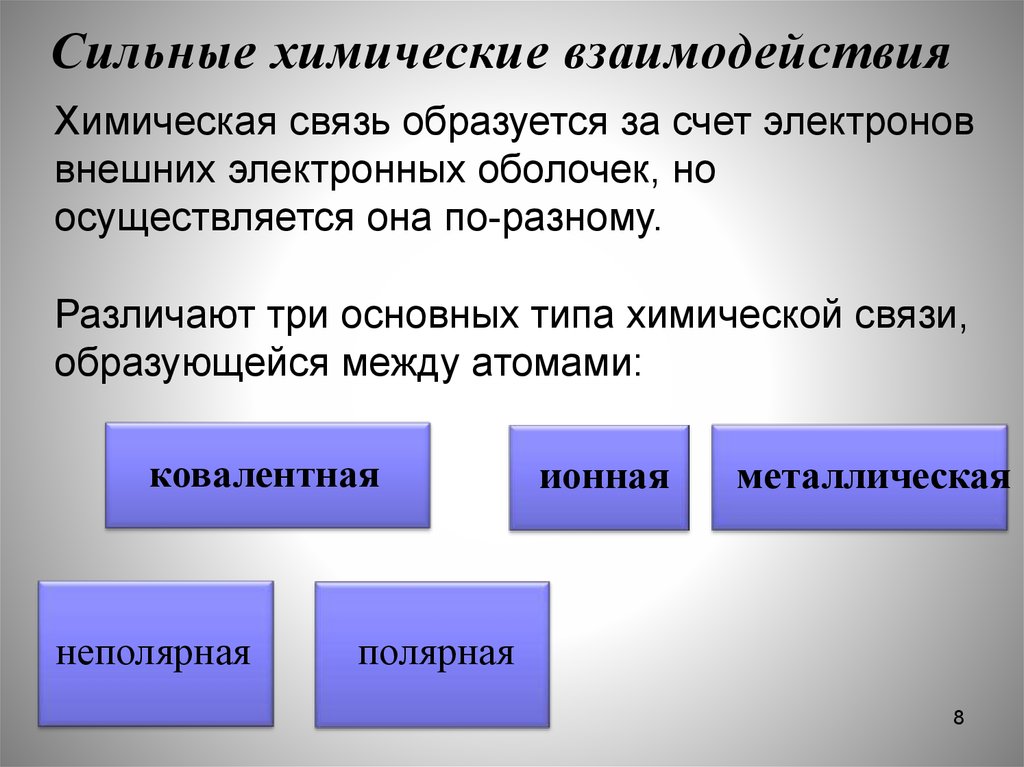
8. Сильные химические взаимодействия
Химическая связь образуется за счет электроноввнешних электронных оболочек, но
осуществляется она по-разному.
Различают три основных типа химической связи,
образующейся между атомами:
ковалентная
неполярная
ионная
металлическая
полярная
8
9.
ТЕОРИЯ КОВАЛЕНТНОЙ СВЯЗИКовалентная связь – связь, образуемая парой
электронов, распределенной (обобществленной)
между двумя или большим числом атомов.
10.
Существуют три принципиальныхобразования ковалентной связи:
1. Обменный:
А· + ·В
А:В
2. Донорно-акцепторный:
А: + □В
3. Дативный.
А–В
механизма
11.
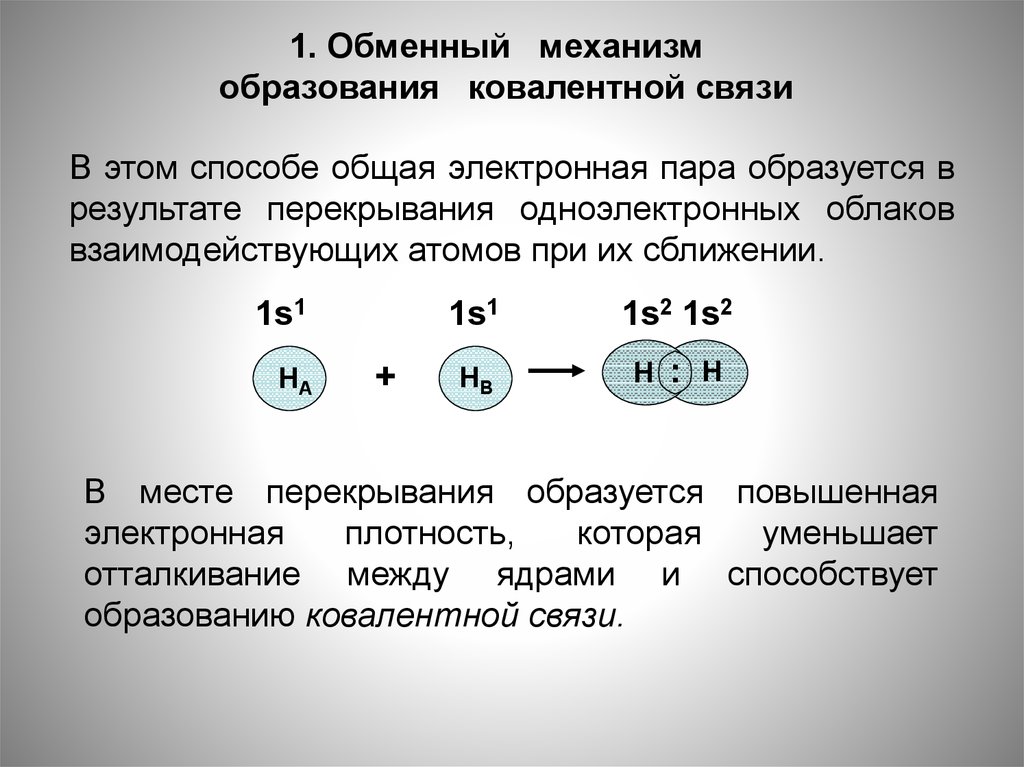
1. Обменный механизмобразования ковалентной связи
В этом способе общая электронная пара образуется в
результате перекрывания одноэлектронных облаков
взаимодействующих атомов при их сближении.
1s1
НА
+
1s1
1s2 1s2
НВ
Н : Н
В месте перекрывания образуется повышенная
электронная
плотность,
которая
уменьшает
отталкивание между ядрами и способствует
образованию ковалентной связи.
12.
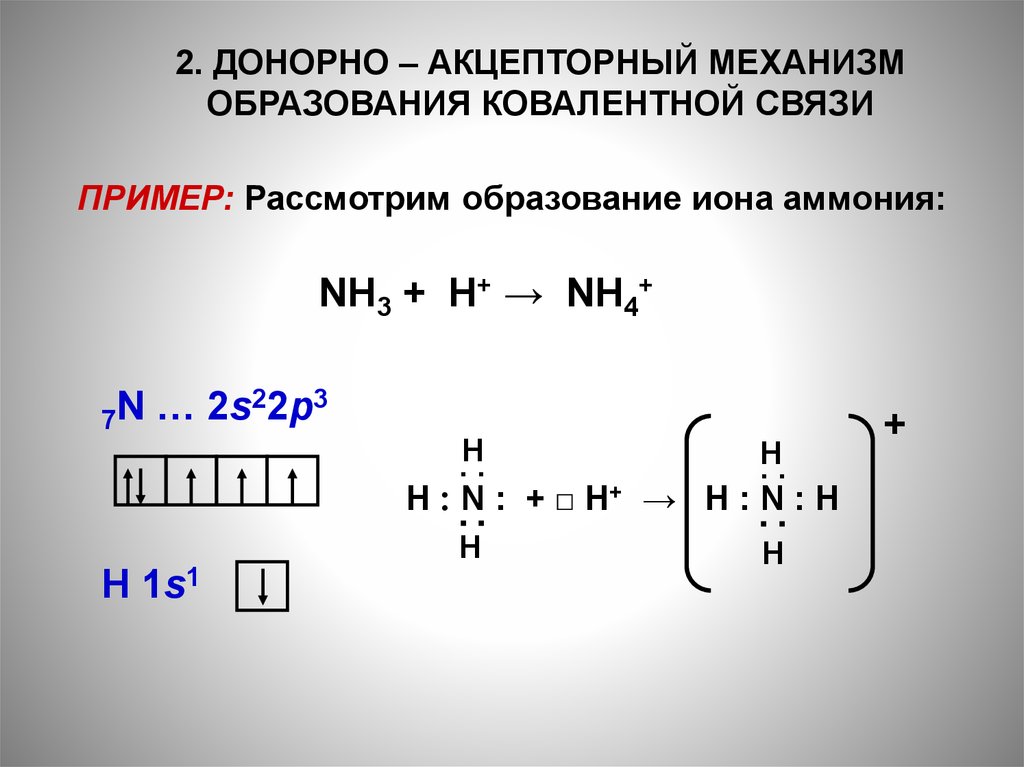
2. ДОНОРНО – АКЦЕПТОРНЫЙ МЕХАНИЗМОБРАЗОВАНИЯ КОВАЛЕНТНОЙ СВЯЗИ
ПРИМЕР: Рассмотрим образование иона аммония:
NH3 + H+ → NH4+
22p3
N
…
2s
7
.H.
H
..
▪ ▪
▪ ▪
H
H
H ׃N ׃+ □ H+ → H ׃N ׃H
H
1s1
+
13.
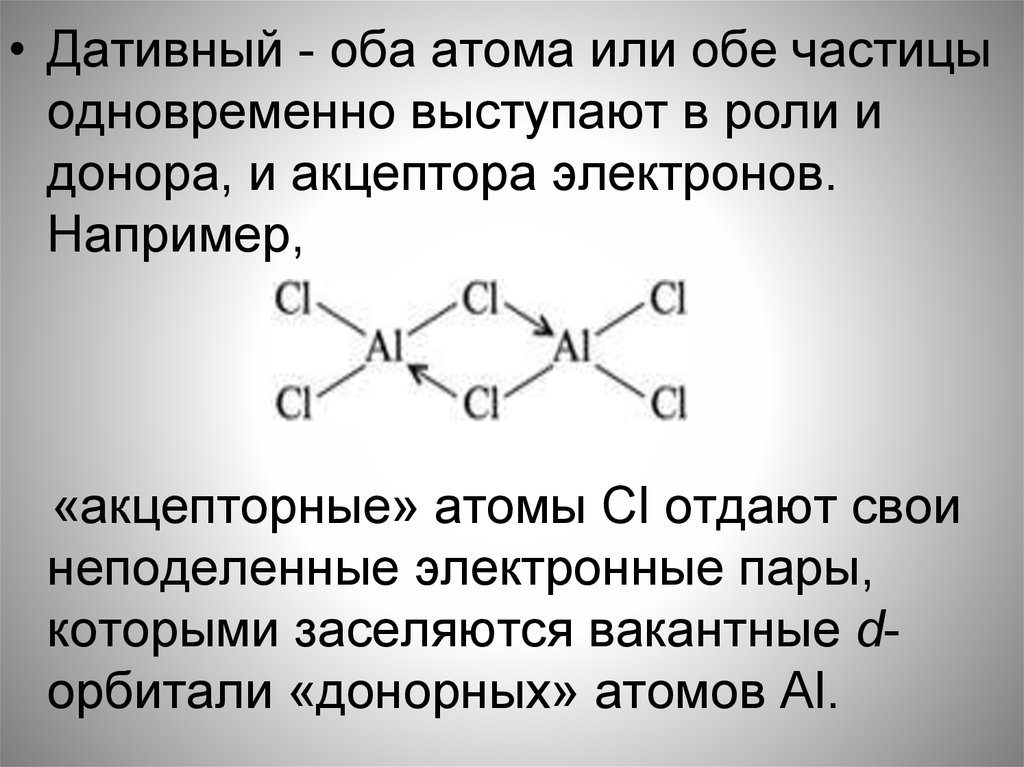
• Дативный - оба атома или обе частицыодновременно выступают в роли и
донора, и акцептора электронов.
Например,
«акцепторные» атомы Cl отдают свои
неподеленные электронные пары,
которыми заселяются вакантные dорбитали «донорных» атомов Al.
14.
ПОЛЯРНОСТЬ КОВАЛЕНТНОЙ СВЯЗИПолярность связи количественно оценивается
дипольным моментом μ, который является
произведением длины диполя l — расстояния между
двумя равными по величине и противоположными по
знаку зарядами +q и -q — на абсолютную величину
заряда:
μ=l∙q
15.
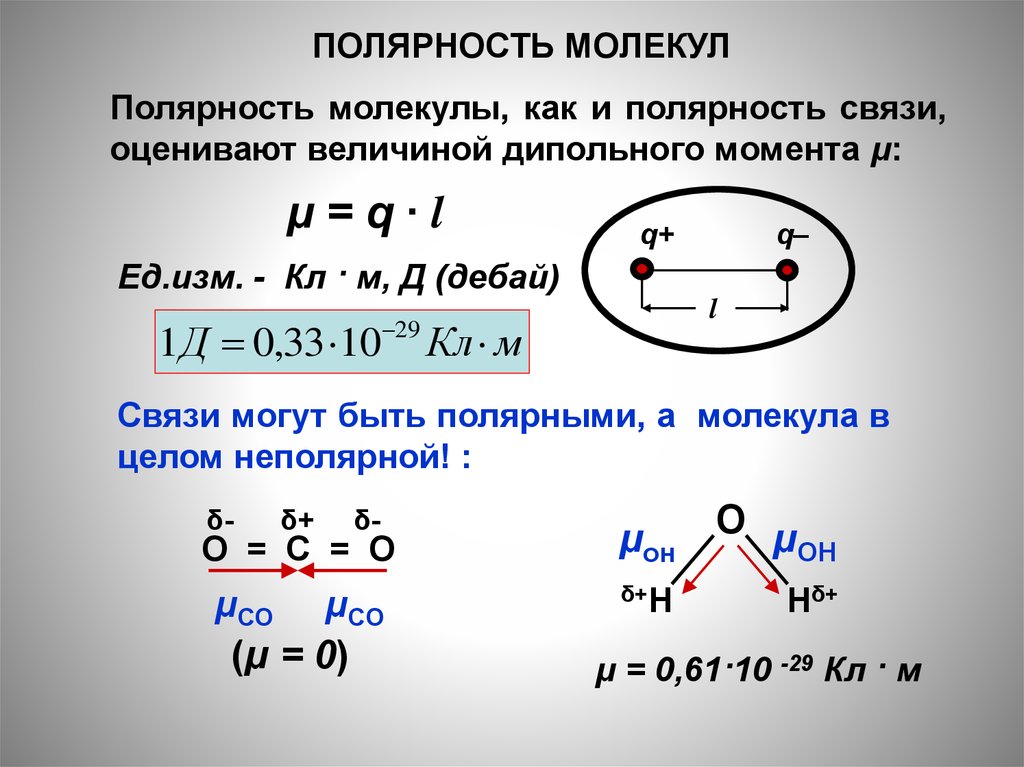
ПОЛЯРНОСТЬ МОЛЕКУЛПолярность молекулы, как и полярность связи,
оценивают величиной дипольного момента μ:
μ=q∙l
q+
q–
Ед.изм. - Кл · м, Д (дебай)
l
1 Д 0,33 10 29 Кл м
Связи могут быть полярными, а молекула в
целом неполярной! :
δ-
δ+
δ-
O = C = O
μСО
μCO
(μ = 0)
μон
O μ
ОН
δ+H
Hδ+
μ = 0,61·10 -29 Кл · м
16.
Неполярные молекулыМолекула неполярна, если суммарный всех
связей = 0.
1
F
-
Ве
2
2 +
F
-
1 2 0
17.
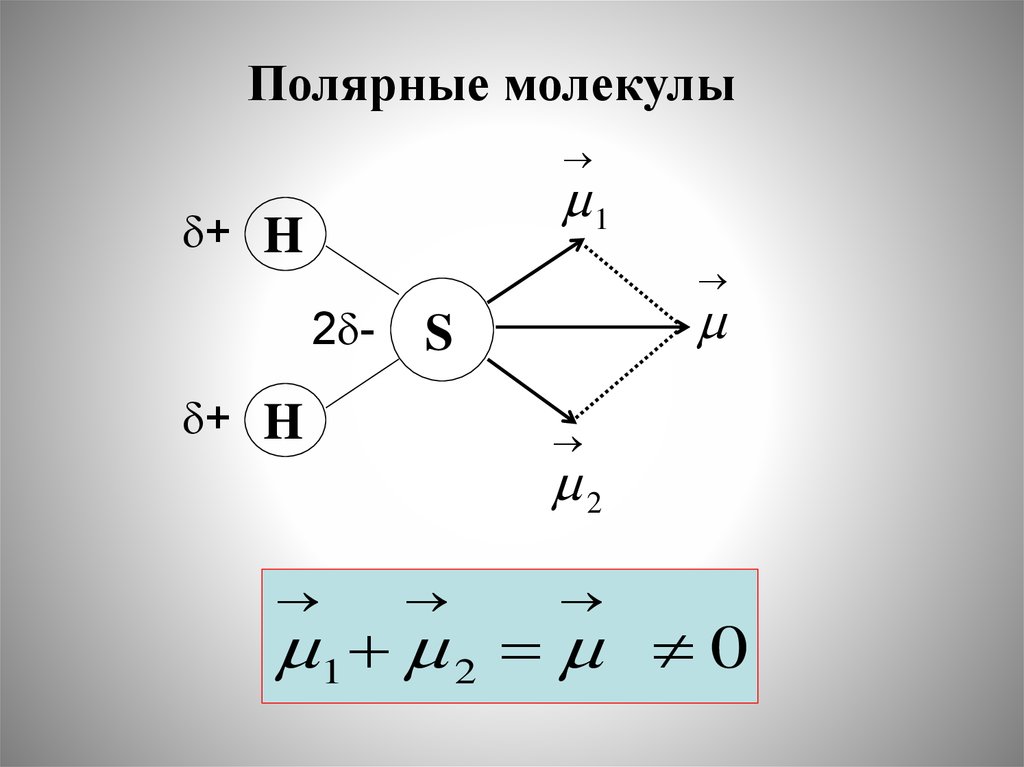
Полярные молекулы1
+ H
2 + H
S
2
1 2 0
18.
КЛАССИФИКАЦИЯ КОВАЛЕНТНЫХ СВЯЗЕЙПО СПОСОБУ ПЕРЕКРЫВАНИЯ АО
а) Связь, образованная перекрыванием АО по
линии, соединяющей ядра взаимодействующих
атомов, называется ϭ-связью (сигма-свяью);
б) Связь, образованная перекрыванием АО по
обе стороны линии, соединяющей ядра атомов
(боковые перекрывания), называется π-связью;
в) Связь, образованная перекрыванием dорбиталей
всеми
четырьмя
лепестками,
называется δ-связью (дельта-связью).
19.
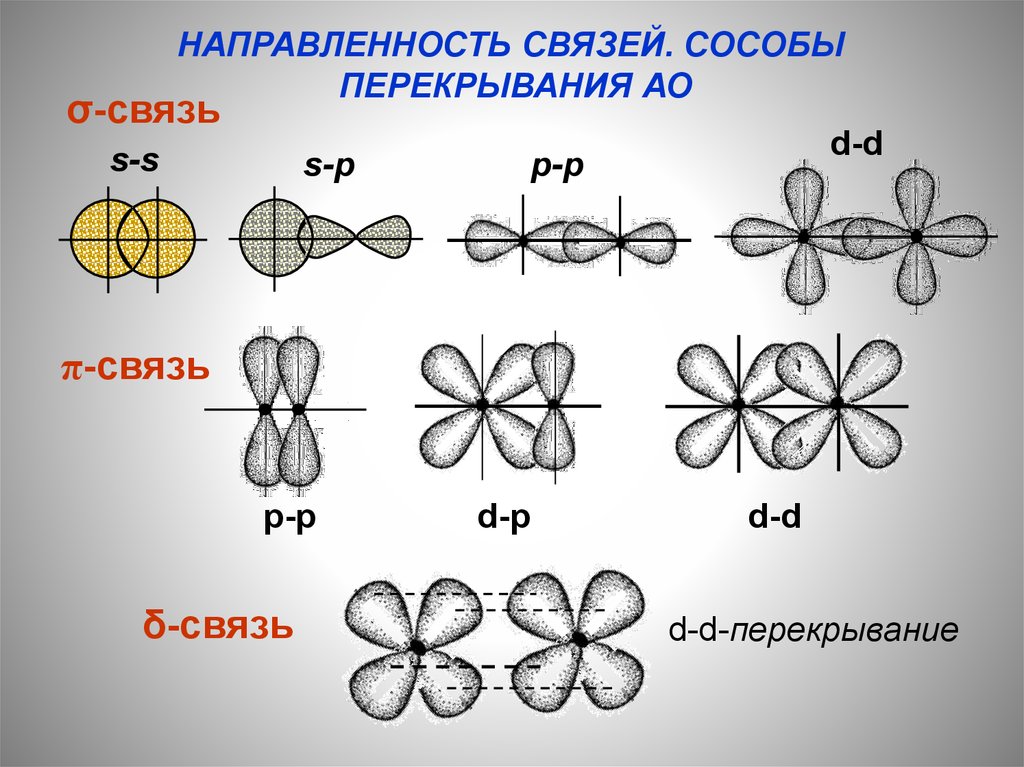
НАПРАВЛЕННОСТЬ СВЯЗЕЙ. СОСОБЫПЕРЕКРЫВАНИЯ АО
σ-связь
s-s
s-p
d-d
p-p
π-связь
p-p
δ-связь
d-p
d-d
d-d-перекрывание
20.
Гибридизацияатомных
орбиталей – смешение в процессе
образования химической связи разных
по форме и энергии АО (s-, p-, d- или f),
с образованием новых, но уже
одинаковых по
форме и энергии
орбиталей.
В гибридизации участвуют близкие по
значению
энергии
орбитали.
Химические
связи,
образованные
гибридными орбиталями, прочнее, а
полученная молекула более устойчива.
21.
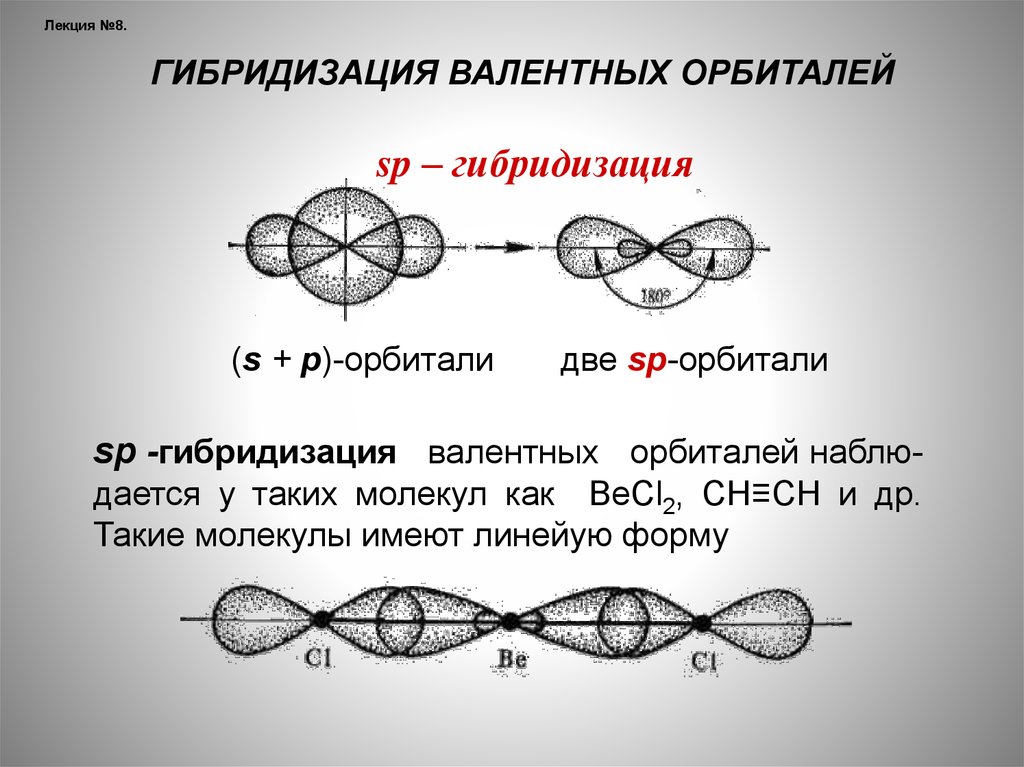
Лекция №8.ГИБРИДИЗАЦИЯ ВАЛЕНТНЫХ ОРБИТАЛЕЙ
sp – гибридизация
(s + р)-орбитали
две sр-орбитали
sр -гибридизация валентных орбиталей наблюдается у таких молекул как ВеСl2, СН≡СН и др.
Такие молекулы имеют линейую форму
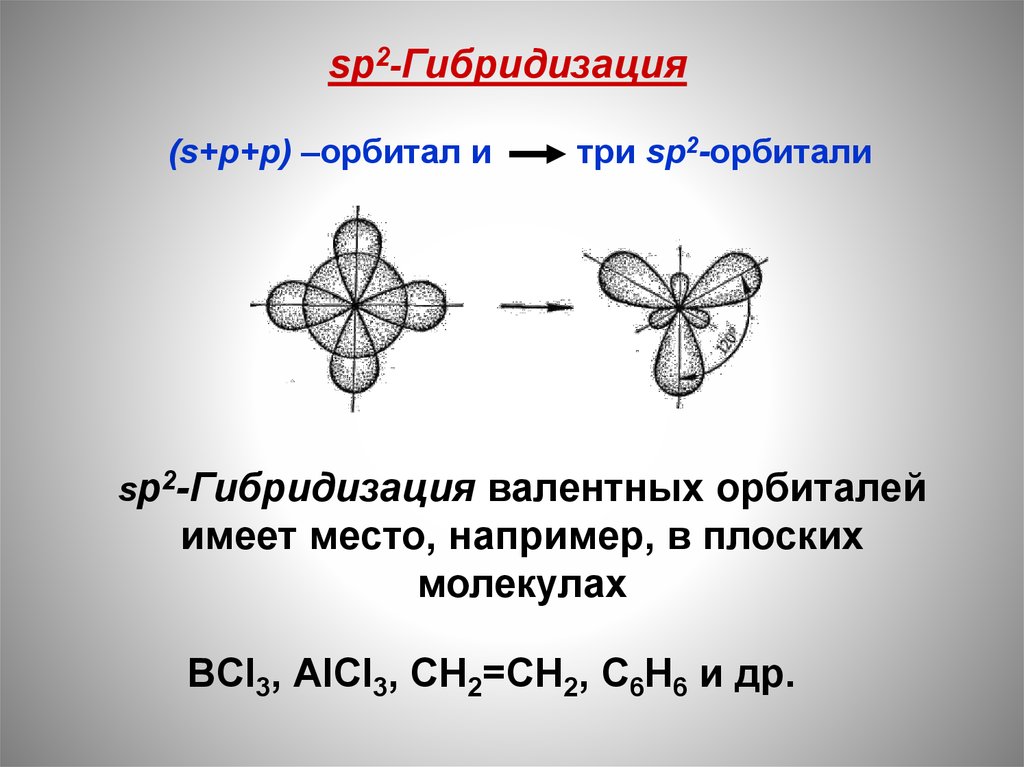
22.
sp2-Гибридизация(s+p+p) –орбитал и
три sp2-орбитали
sр2-Гибридизация валентных орбиталей
имеет место, например, в плоских
молекулах
ВCl3, АlСl3, CН2=CH2, С6Н6 и др.
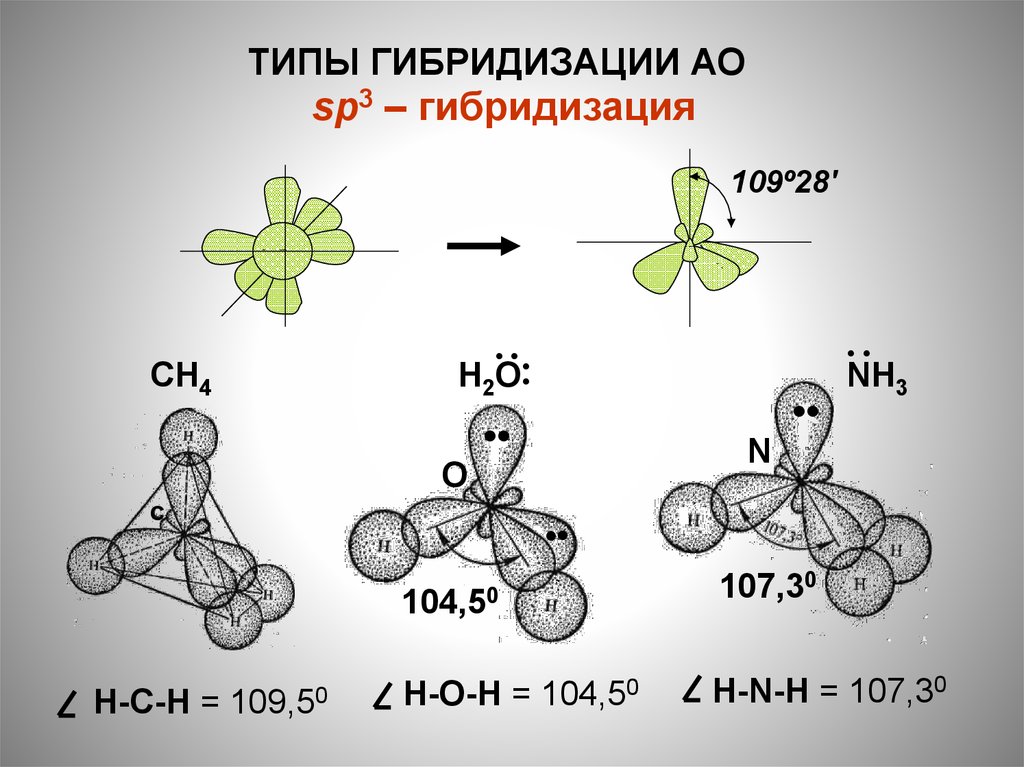
23.
ТИПЫ ГИБРИДИЗАЦИИ АОsp3 – гибридизация
109º28'
CН4
2
О
•
C
Н-C-Н =
··
Н ··
О
•
··
NН
3
N
•
109,50
104,50
107,30
Н-О-Н = 104,50
Н-N-Н = 107,30
24.
ИОННАЯ СВЯЗЬИонная химическая связь представляет
собой электростатическое взаимодействие
отрицательно и положительно заряженных
ионов в химическом соединении.
Такая связь возникает лишь в случае большой
разности ЭО атомов, например между катионами
s-металлов I и II групп периодической системы и
анионами неметаллов VI и VII групп (LiF, CsCl,
K2O и др.).
25.
СТЕПЕНЬ (ДОЛЯ) ИОННОСТИ СВЯЗИЧисто ионной связи не существует. Можно лишь
говорить о степени (доле) ионности связи.
Для оценки способности атома данного элемента
оттягивать к себе электроны, осуществляющие связь,
пользуются значением относительной электроотрицательности (ЭО)
Под ЭО атома понимают его способность
притягивает к себе обобществленные электроны. Поэтому, чем больше разность электроотрицательностей (∆ЭО) взаимодействующих атомов, тем
выше степень ионности связи.
26.
При образовании связи между атомамиэлементов, сильно различающихся по
величине электроотрицательности,
связующая электронная пара может
полностью переместиться в поле ядра
этого атома, который характеризуется
большей величиной электроотрицательности. В результате такого
перемещения возникают заряженные
частицы – ионы, одни из которых имеют
положительный заряд, а другие –
отрицательный.
27.
Разноименно заряженные частицысвязываются друг с другом за счет сил
электростатического притяжения. Возникшую
связь называют ионной.
Рассмотрим молекулу LiF (газ). При сближении
атомов Li и F происходит взаимодействие sэлектронов лития и р-электронов фтора и их
облака перекрываются.
Lio – e- → Li+
F2o + 2e- → 2F2e-
2Lio + F2o → 2Li+ + 2F..
..
..
..
Li + : F : → Li+ [: F :]-
28.
Вследствие большого различия вэлектроотрицательности электронное
облако почти полностью смещено в
сторону фтора. Молекулу LiF можно
рассматривать как ионную Li+ F-. Ионы Li+ и
F- имеют структуру внешнего
электронного слоя, характерную для
ближайшего к ним инертного элемента.
29.
Металлическая связьОсобенности образования этой связи
связаны со строением атомов металлов:
1. На внешнем энергетическом уровне
атомов большинства металлов содержится
небольшое число электронов.
2. На внешних уровнях много свободных
орбиталей, что позволяет электронам
близко подходить к положительным ядрам.
3. Электроны в металле подвижны.
4. Металлы имеют низкую энергию
ионизации, поэтому могут легко утрачивать
связь с отдельными атомами и
«обобществляться».
30.
• Металлическая связь – связь междуположительными ионами в кристаллах
металлов, осуществляемая за счет притяжения
электронов, свободно перемещающихся по
кристаллу.
• В кристаллической решетке металлов
электроны свободно перемещаются, образуя
так называемый «электронный газ». В
результате свободного перемещения
электронов, одни атомы будут терять свои
электроны, переходя в положительно
заряженные иона, а образующиеся ионы, могут
принимать электроны.
• Характерными особенностями металлической
связи является ее ненаправленность и
меньшая прочность по сравнению с
ковалентной.
31.
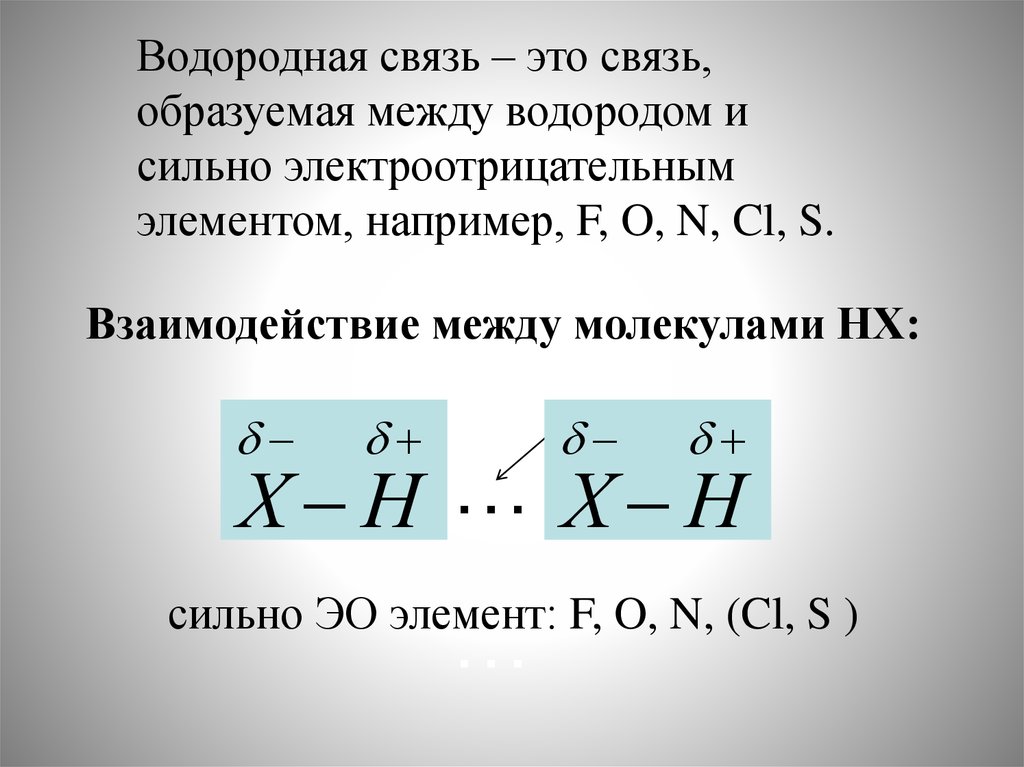
Водородная связь32.
Водородная связь – это связь,образуемая между водородом и
сильно электроотрицательным
элементом, например, F, O, N, Cl, S.
Взаимодействие между молекулами НХ:
Х Н … Х Н
сильно ЭО элемент: F, O, N, (Cl, S )
…
33.
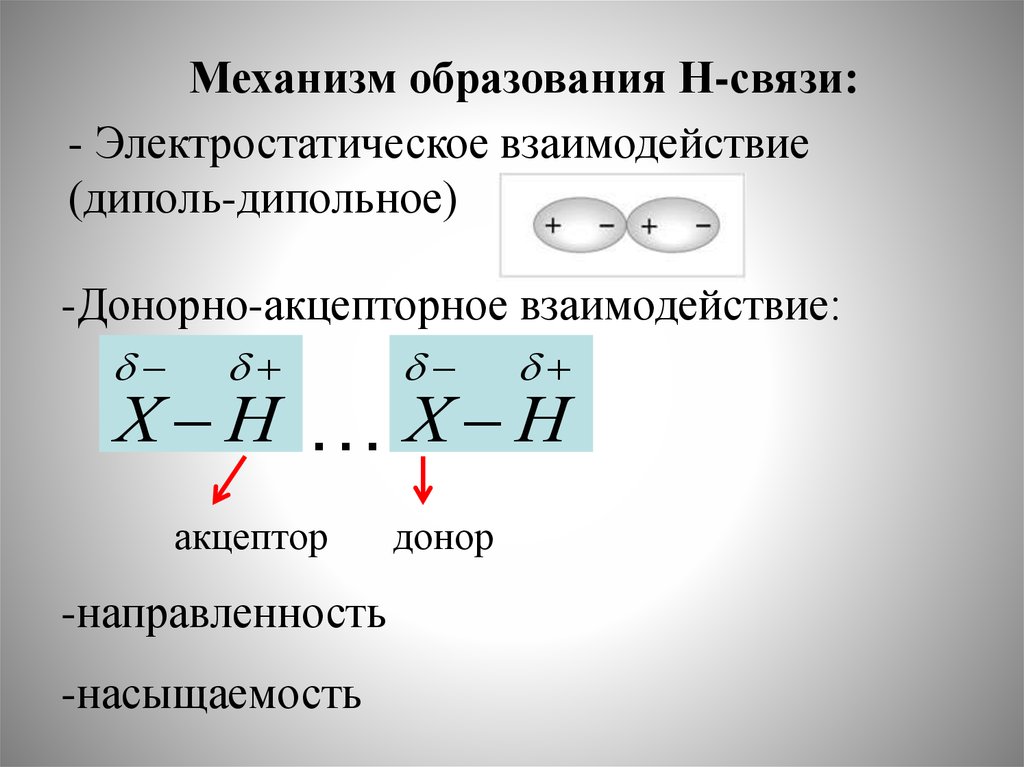
Механизм образования Н-связи:- Электростатическое взаимодействие
(диполь-дипольное)
-Донорно-акцепторное взаимодействие:
Х Н
…Х Н
акцептор
-направленность
-насыщаемость
донор
34.
Классификация Н-связи:- внутримолекулярная;
- межмолекулярная.
35.
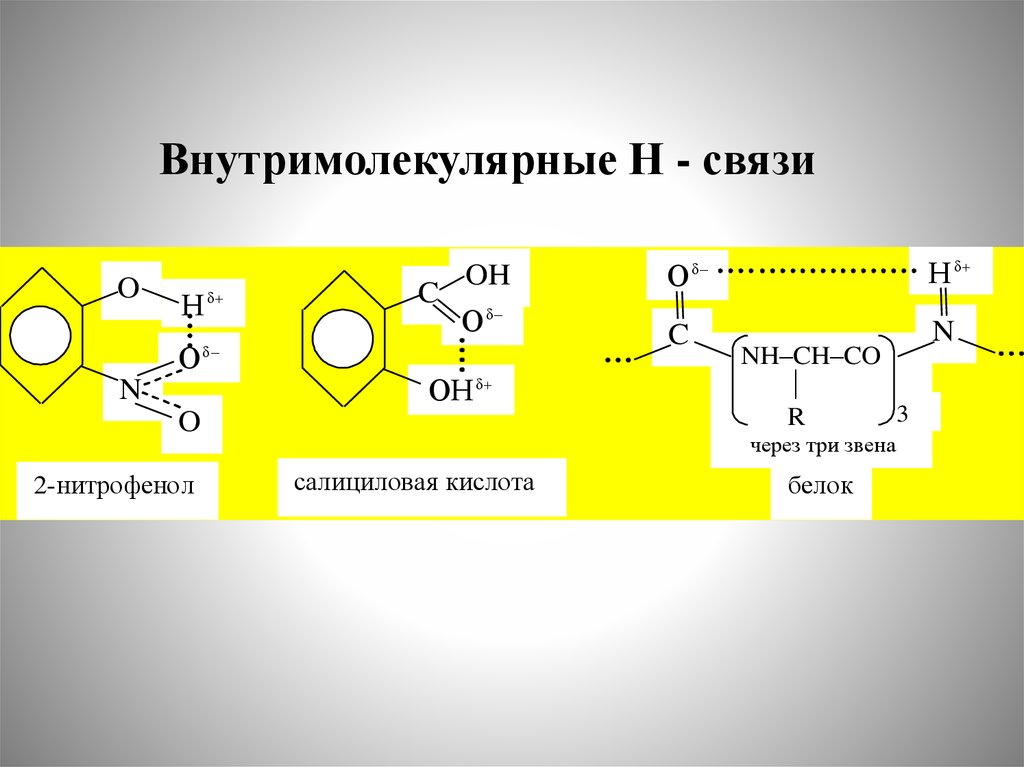
Внутримолекулярные Н - связиO
Н δ
О
N
C
OH
Оδ
Н δ
Оδ
C
N
δ
ОН δ
O
2-нитрофенол
NH–CH–CO
3
R
через три звена
салициловая кислота
белок






















 chemistry
chemistry








