Similar presentations:
Бордың квантық теориясы. Бор постулаттары. Франк-Герц тәжірибелері. Сутегі атомының. Бор ұсынған моделі
1. Бордың квантық теориясы. Бор постулаттары. Франк-Герц тәжірибелері. Сутегі атомының Бор ұсынған моделі. Бор теориясының
кемістіктері.• Бордың постулаттары.
1. Классикалық механика тұрғысынан атомда мүмкін болатын шексіз көп
электрон орбиталары ішінен, шындығында m r=n (n=1,2,…) белгілі
кванттық шарттарды қанағаттандыратын тек кейбір дискретті
орбиталар іске асады. Электрон осы стационарлық орби-талардың
біреуінің бойымен үдей қозғалғанмен ешбір электромагнит-тік толқын
(жарық) шығармайды. Осындай орбиталарға сай атомның
стационарлық (орнықты) күйдегі энергиясының дискретті мәндері (Е1,
Е2, Е3,...) болады.
2. Электрон бір стационарлық күйден екінші стационарлық күйге көшкенде
ғана жарық энергиясы кванттары түрінде шығарылады немесе
жұтылады.
2.
Жарық квантының шамасы араларында электрон кванттық көшу жасайтынстационарлық күйлер энергияларының айырмасына тең:
En Em
Ридберг-Ритцтің комбинациялық принципі
~
1
T( m ) T( n )
, n>m .
Спектроскопиялық толқындық сан үшін Бордың жиіліктер ережесі мына түрде жазылад
~
E En
Em
En
m
2 c
2 c 2 c 2 c
Em
En
T( m )
,T ( n )
2 c
2 c
3.
Франк-Герц тәжірибелері.3.1-сурет
3.2-сурет
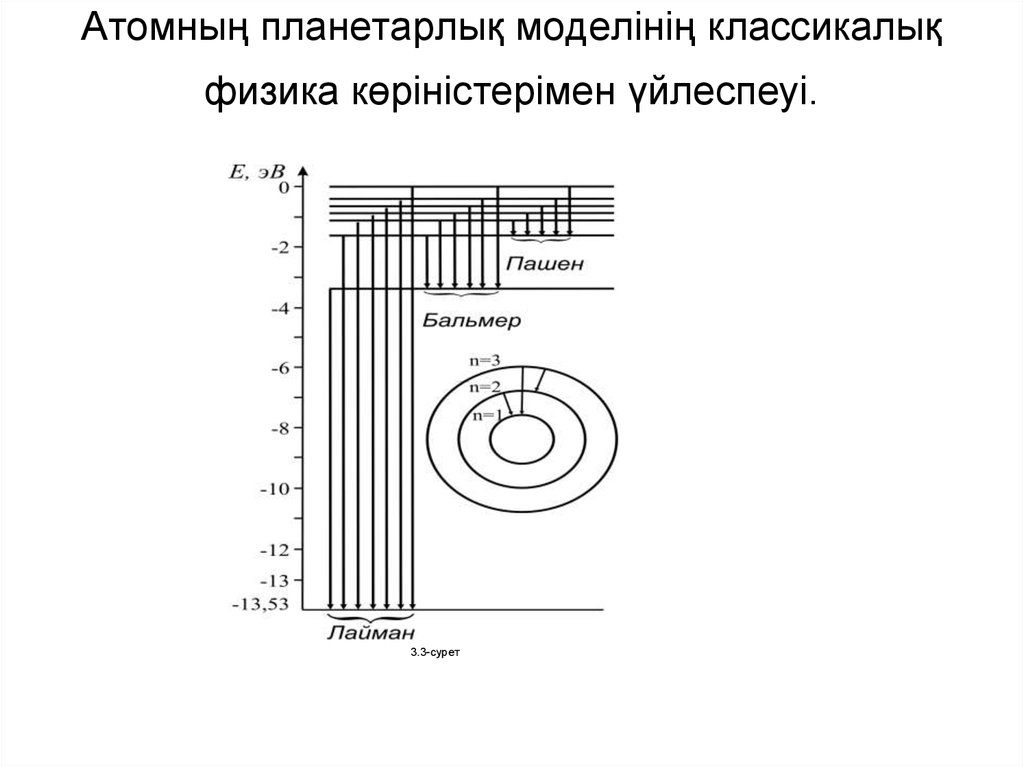
4. Сутегі атомының энергетикалық күйлері
r rn 4 0 n /( me Z ) 0h n /( me Z )2 2
2
2 2
2
n
e2 Z
e2 Z
n
mr 4 0 n 2 0 h n
me 4 Z 2
n
4 02 n3h3
n=1 мәніне сәйкес келетін, энергиясы ең аз күй, негізгі немесе қалыпты күй
деп аталады, өйткені осы төменгі энергетикалық күйде атом уақыттың
көп бөлігін өткізеді. n=2, 3, 4,... мәндерге сәйкес күйлер қозған күйлер деп
аталады, өйткені осы күйлердің кез-келгенінде атом негізгі күйге қарағанда
көбірек энергия қабылдайды.
E Ek E
me 4 Z 2 1
me 4 Z 2
1
2 2 2
8 0 h n
32 2 02 2 n 2
5. Сутегі атомының спектрі
me4 Z 2 11
Ek Ei
2 2 2 2
32 0 ni nk2
4 2
E
E
me
Z 1
1
~
k
i
3 2 3 2
2 c 2 c 64 0 c ni nk2
4
me 4
me 4
me
1
1
R 2 3
,
м
,
R
,
c
3 2 3
8 0 h c 64 0 c
64 3 02 3
mM
m M
e4
R
64 3 02 3c
R=109677,6 см-1
6. Спектрлік сызықтардың изотоптық ығысуы
• Сутегі атомы мен сутегі тәрізді иондардың жиіліктері үшінформулалар мына түрге келеді
nk
R
1
1
2
2
m
k
n
1
MH
R
1
1
2
,
Z
2
nk
2
m
n
k
1
MZ
Әр түрлі изотоптар ядроларының массаларындағы айырмашылық
ұлардың шығару спектрлеріндегі сызықтардың бір-біріне қатысты ығысуын
туғызады. Сызықтардың осы ығысуы изотоптық ығысу деп аталады.






 physics
physics








