Similar presentations:
Катаболизмнің жалпы жолдары
1. Катаболизмнің жалпы жолдары
2.
• Основные вопросы лекции:1.Макроэргтік қосылыстар.Тіндік
тыныс алу боитотығу туралы түсінік
2.Тотығып фосфорлану, Р/0
коэффициенті және АДФ/О.Тіндік
тыныс алу мен тотығу
фосфорланудың ажыруы
3. Пирожүзім қышқылының тотығып
декарбоксильденуі
4.Үш карбон қышқылы циклі
5.Қайықша(челнок) механизмы
3. Специфические и общие пути катаболизма
• . Катаболитикалық процесстер екіге бөлінеді:- катаболизмнің өзіндік жолы, барлық
класстарға (белоктар,майлар, көмірсулар .)
бөлек жүреді,
- катаболизмнің жалпы жолы катаболизмнің өзіндік жолының жалғасы
болатын барлық класстарға бірдей жол
• . катаболизмнің жалпы жолы биоэнергетикалық
процесстермен,энергия жиналуы мен
босауымен тығыз байланысты.
• катаболизмнің өзіндік жолына ас-қазан
жолдарында жүретін майлар
,белоктар,көмірсулар гидролизімен,
жасушаларда жүретін моносахаридтердің,
аминоқышқылдарының, май қышқылдарының,
спирттердің ыдырауымен тығыз байланысты.
4.
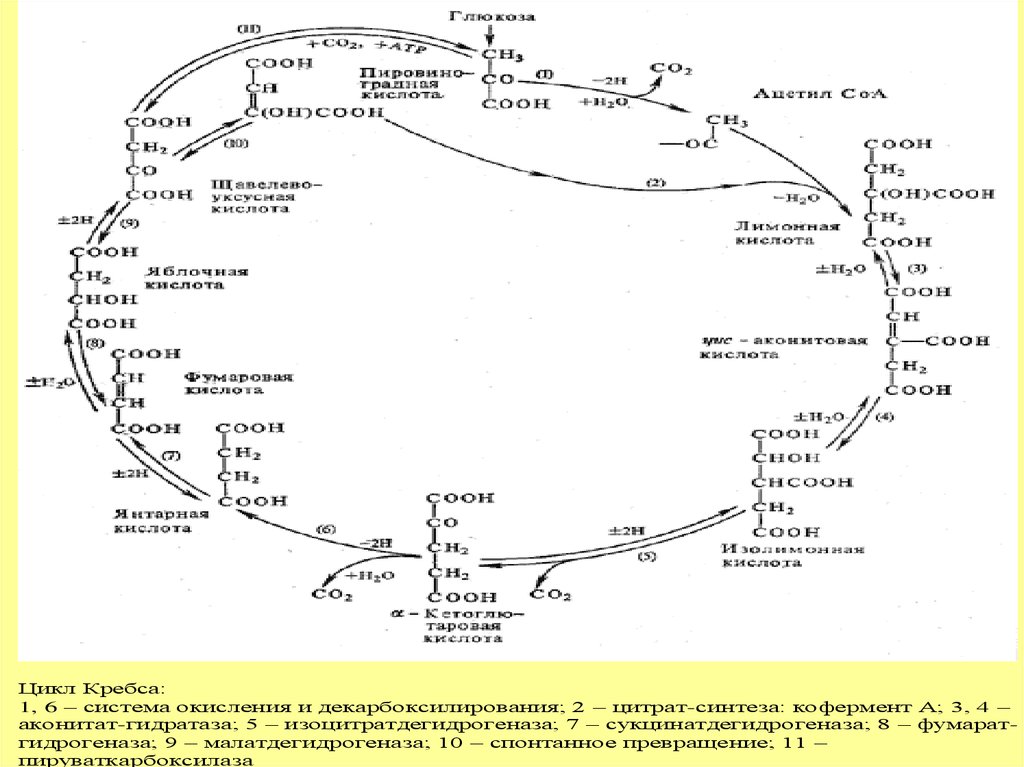
Цикл Кребса:1, 6 – система окисления и декарбоксилирования; 2 – цитрат-синтеза: кофермент А; 3, 4 –
аконитат-гидратаза; 5 – изоцитратдегидрогеназа; 7 – сукцинатдегидрогеназа; 8 – фумаратгидрогеназа; 9 – малатдегидрогеназа; 10 – спонтанное превращение; 11 –
пируваткарбоксилаза
5. Пирожүзім қышқылының тотығып декарбоксильденуі
Пирожүзім қышқылының тотығып
декарбоксильденуі митохондрияның ішкі
мембрананасында орналасқан
мультиэнзимді пируват-дегидрогеназды
комплекспен катализденеді.
ОЛ үш ферменттен тұрады(Е1,Е2,Е3):
Е1-пируватдекарбоксилаза, коферменті
ТПФ (тиаминпирофосфат),
Е2-дигидролипоил-трансацетилаза,
коферменті липой қышқылы (ЛК),
кофакторы - НS-КоА,
Е3-дигидролипоил-дегидрогеназа,
коферменті ФАД , кофакторы - НАД
6.
• катаболизмнің жалпыжолына кіреді:
- Пирожүзім
қышқылының тотығып
декарбоксильденуі
• - Үш карбон қышқылы
циклінде ацетил-КоА
айналуы
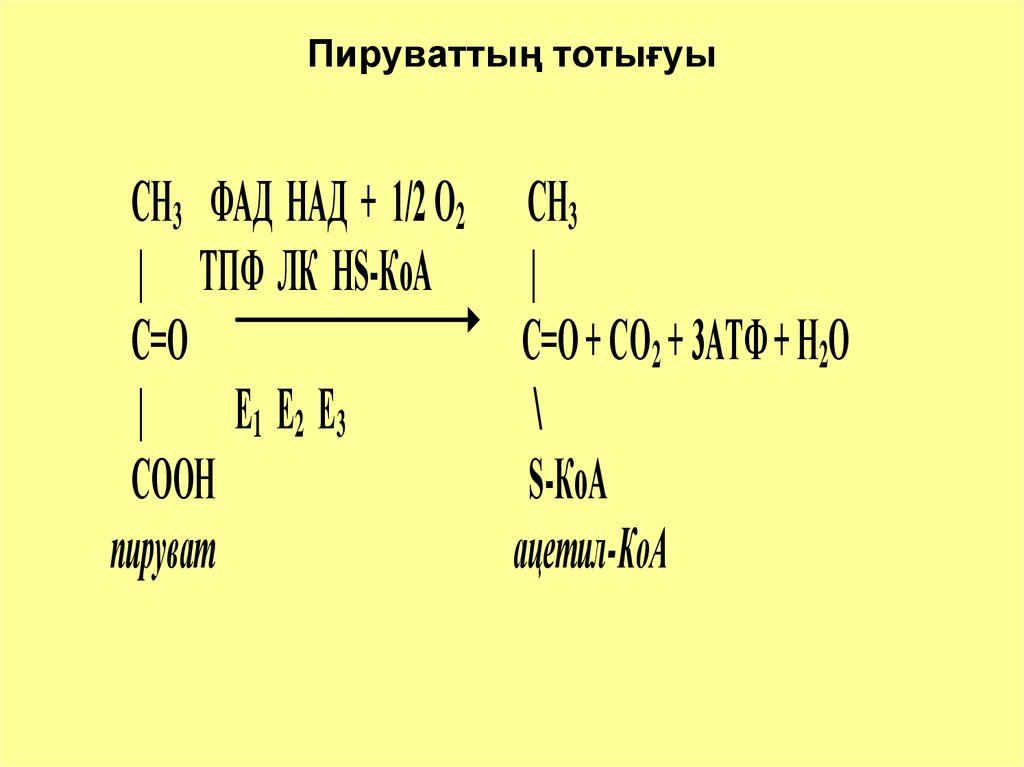
7. Пируваттың тотығуы
СН3 ФАД НАД + 1/2 О2 СН3| ТПФ ЛК НS-КоА
|
С=О
С=О + СО2 + 3АТФ + Н2О
|
Е 1 Е2 Е3
\
СООН
S-КоА
пируват
ацетил-КоА
8.
В результатедействия
пируватдекарбоксилазы (Е1) при участии ТПФ
(тиаминпирофосфата) от пирувата отщепляется карбоксильная группа, образуется
углекислый газ, а ацетильный остаток присоединяется к атому серы липоевой кислоты:
S-S
СН3
CН3
| |
|
|
ТПФ
Л-К
С=О
С=О
\
+ СО2
|
E1
S SH
СООН
| |
пируват
Л-К
9.
Второй энзим Е2 - дигидролипоилтрансацетилаза - катализирует переносацетильного радикала на НS-КоА. При этом освобождается дигидролипоевая кислота и
образуется ацетил-КоА :
СН3
СН3
|
НS SH
С=О НS-КоА |
С=О + | |
\
Л-К
\
S SH E2
S-КоА дигидролипоевая
||
ацетил-КоА кислота
Л-К
ацетил-дигидролипоевая
кислота
10.
На третьей стадии под воздействием фермента Е3 - дигидролипоилдегидрогеназы приучастии ФАД и НАД, происходит окисление дигидролипоевой кислоты и восстановление
НАД:
НS SH ФАД НАД S-S
| |
| | + НАДН2
Л-К
Е3 Л-К
Далее, восстановленный НАД окисляется в цепи переноса протонов и электронов
митохондрий, образуется вода и синтезируется 3 молекулы АТФ в реакциях
окислительного фосфорилирования.
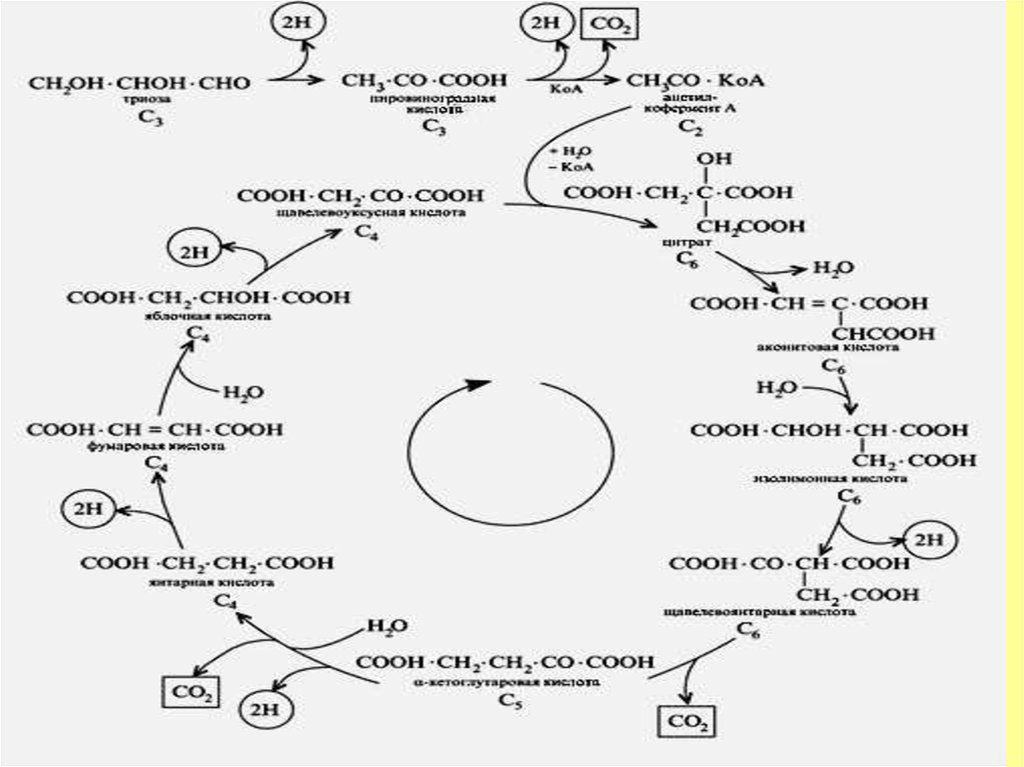
11. Үш карбон қышқылы циклі
СН3|
С=О +
\
S-КоА
ацетил-КоА
СООН
|
С=О
|
СН2 цитратсинтетаза
|
СООН
оксалоацетат
( ЩУК)
S-КоА
/
С=О
|
HS-КоА
СН 2
+ НОН
|
НО-С-СООН цитратсинтетаза
|
СН2
|
СООН цитрил-КоА
СООН
СООН
|
|
СН2
СН2
|
-НОН |
+НОН
НО-С-СООН
С-СООН
|
||
СН2
аконитаза СН
аконитаза
|
( Fe++ )
|
( Fe++ )
СООН
СООН
цитрат
цис-аконитат
СООН
|
СН2
|
Н-С-СООН
|
Н-С-ОН
|
СООН
изоцитрат
12. Цикл трикарбоновых кислот
СООН|
НАДН 2
СН2
|
НАД
Н-С-СООН
|
( Мn ++) изоцитрат
Н-C-ОН
дегидрогеназа
|
СООН
изоцитрат
СООН
СООН
|
|
СН2
CO2
СН2
СО2
|
|
Н-С-СООН
СН2
|
изоцитрат
|
( Е 1` Е2 Е3 )
С=О дегидрогеназа
С=О
|
|
СООН
СООН
оксалосукцинат
альфа-кетоглутарат
Затем идут последовательные реакции окисления изоцитрата с образованием
-кетоглутарата, который подвергается окислительному декарбоксилированию
мультиэнзимным -кетоглутарат дегидрогеназным комплексом (Е 1,Е2,Е3), где
Е1`- -кетоглутаратдекарбоксилаза, Е2-дигидролипоилтрансацилаза,
Е3- дигидролипоилдегидрогеназа:
НАДН2
ФАД НАД
ТПФ ЛК НS-КоА
СООН
ГТФ
|
HS-КоА
СН2
Рн + ГДФ
|
СН2 сукцинаттиокиназа
|
С=О
\
S-КоА
сукцинил-КоА
СООН
|
СН2
|
СН2
|
СООН
сукцинат
13.
Сукцинил-КоА как макроэрг, разрушается сукцинаттиокиназой собразованием сукцината. Энергия связи используется для субстратного
фосфорилирования ГДФ до ГТФ. Под воздействием нуклеозид дифосфаткиназы
происходит перенос остатка фосфорной кислоты с ГТФ на АДФ и синтезируется
АТФ.
СООН ФАДН2 СООН
СООН НАДН2 СООН
|
|
|
|
СН2 ФАД
СН + НОН НО-С-Н НАД
С=О
|
||
|
|
СН2 СДГ(Fe)
СН фумараза
СН2 МДГ
СН2
|
|
|
|
СООН
СООН
СООН
СООН
сукцинат
фумарат
малат
оксалоацетат
(ЩУК)
Цикл Сент-Дьёрди -Кребса завершается регенерацией оксалоацетата и
окислением ацетильного радикала до углекислого газа и воды.
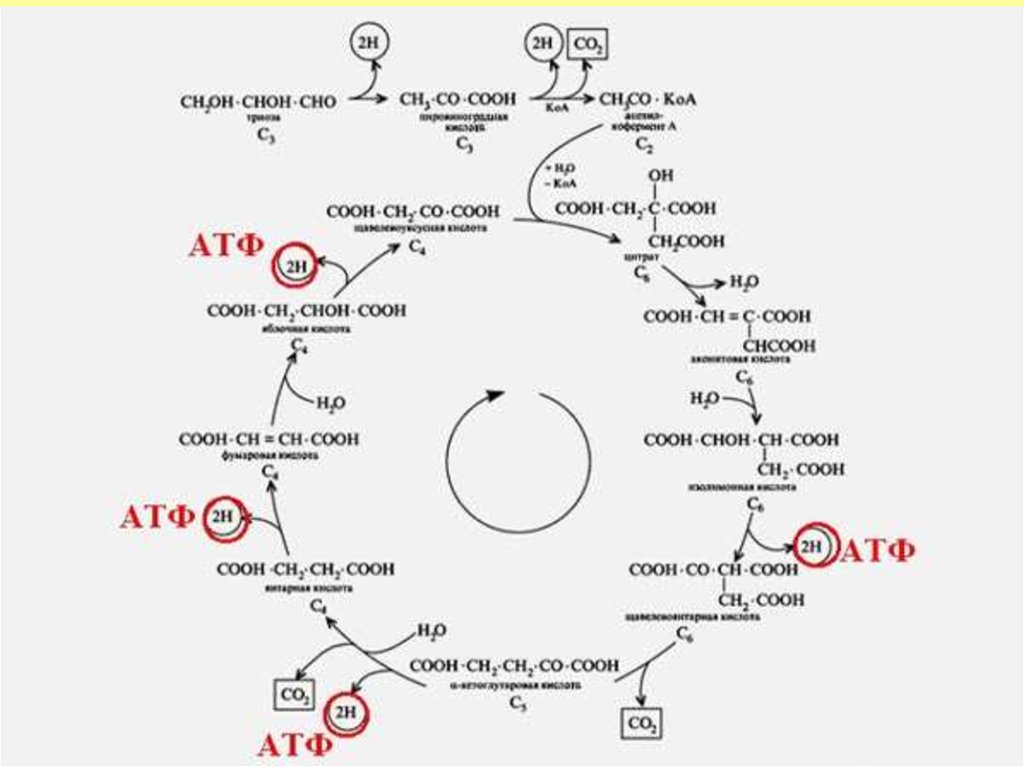
14. Энергия шығымы
• Дегидрогеназалармен төрт реакциядасубстрат дегидрирленуі жүреді
• изоцитратдегидрогеназа, кофермент
НАД,
• альфа-кетоглутаратдегидрогеназалар,
кофактор НАД
• сукцинатдегидрогеназа, кофермент
ФАД,
• малатдегидрогеназа, кофермент НАД.
• 1 молекула ацетил-КоА ҮКЦ
тотыққанда - 12 АТФ синтезделеді
• - катаболизмнің жалпы жолының
барлық реакцияларында 15 молекула
АТФ синтезделеді
15.
16.
17.
18. Челночные механизмы транспорта
• Своеобразным вариантом групповойтранслокации является механизм переноса
протонов (Н+) через митохондриальные
мембраны.
• Мембраны митохондрий не проницаемы для
образующихся в цитозоле при окислении
различных субстратов молекул НАД Н+.
• Оказалось, что перенос
восстанавливающих эквивалентов НА Д Н+
осуществляется косвенным путем глицерофосфатным и малатным
челночными механизмами транспорта
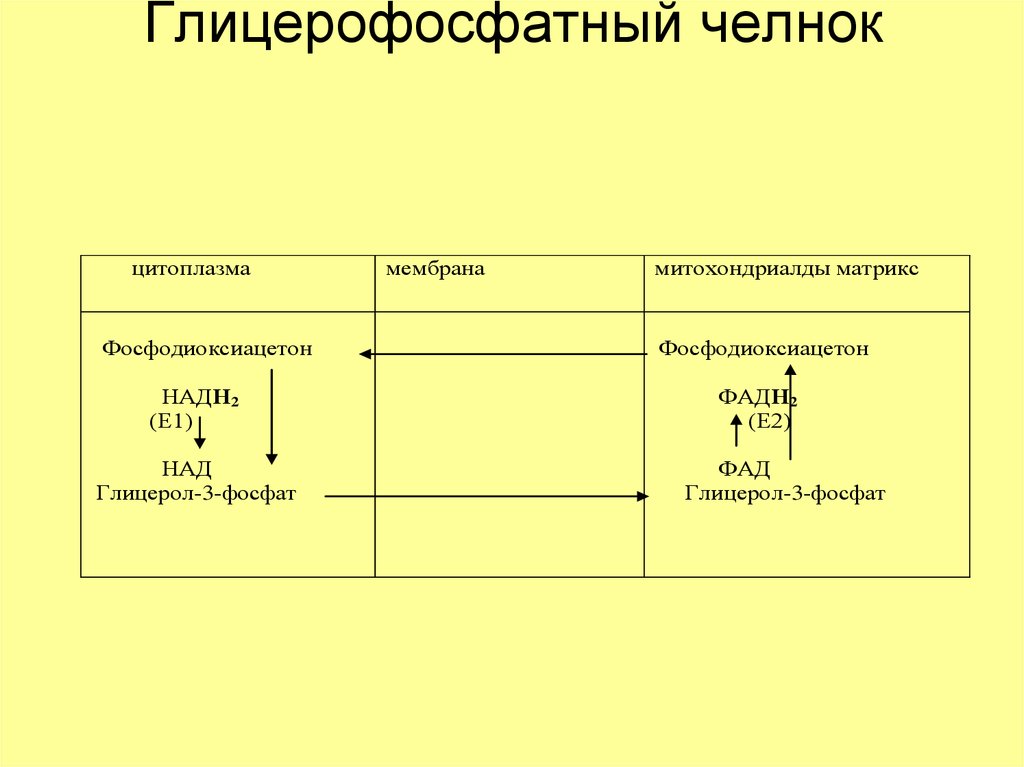
19. Глицерофосфатный челнок
цитоплазмаФосфодиоксиацетон
НАДН2
(Е1)
НАД
Глицерол-3-фосфат
мембрана
митохондриалды матрикс
Фосфодиоксиацетон
ФАДН2
(Е2)
ФАД
Глицерол-3-фосфат
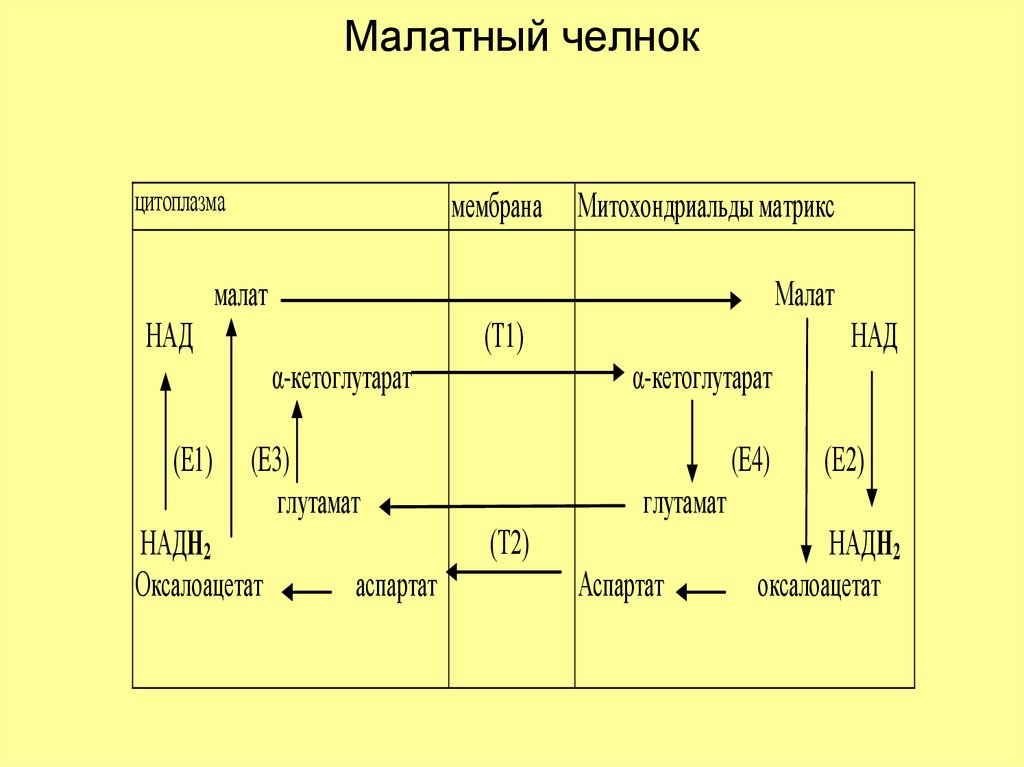
20. Малатный челнок
цитоплазмамембрана Митохондриальды матрикс
малат
Малат
НАД
(Т1)
α-кетоглутарат
(Е1)
α-кетоглутарат
(E3)
глутамат
НАДН2
Оксалоацетат
НАД
(E4)
глутамат
(Т2)
аспартат
(Е2)
Аспартат
НАДН2
оксалоацетат
21. Основные типы окисления
• Реакции катаболизма органическихсоединений (субстратов), сопряженные с
высвобождением свободной энергии в
биосистемах, в своей основе являются
окислительно-восстановительными
реакциями и катализируются ферментами
из класса оксидоредуктаз и локализованы в
разных компартментах клетки:
• Оксидазное - в митохондриях
• Микросомальное - в мембранах
эндоплазматического ретикулума
• Пероксидное в пероксиомах
22. Маркоэрги
• К энергетическим субстратам для клеток животногоорганизма относятся углеводы, липиды и аминокислоты.
Удельная калорийность углеводов равна 4,1 ккал/г,
липидов - 9,3 ккал/г и белков (аминокислот) - 4,1 ккал/г.
• Высвобождение свободной энергии из основных
энергетических субстратов идет в катаболических
процессах. При этом свободная энергия может
накапливаться в макроэргической связи некоторых
фосфорорганических соединений, в маркоэргах.
• К макроэргическим соединениям относятся АТФ и другие
нуклеотид-5`-трифосфаты (ГТФ, УТФ, ЦТФ),
креатинфосфат, 1,3- дифосфоглицерат,
фосфоенолпируват.
• Из всех макроэргов АТФ - главный химический
посредник клетки, связывающий между собой процессы
идущие с выделением и поглощением энергии
(катаболизма и анаболизма), служит общим
промежуточным продуктом в реакциях переноса энергии с
фосфатными группами.
23. Механизмы трансформация энергии в клетке
• Высвобождение свободной энергии при катаболизмеуглеводов, липидов и аминокислот может
происходить в животном организме в аэробных и
анаэробных условиях.
• Энергетически более выгоден аэробный путь
катаболизма, который сопровождается в обязательном
порядке поглощением тканями кислорода и выделением
углекислого газа, т.е. явления называемое тканевое
дыхание или внутреннее, клеточное дыхание.
• Реакции катаболизма органических соединений,
сопряженные с высвобождением свободной энергии в
биосистемах, в своей основе являются окислительновосстановительными реакциями и катализируются
ферментами из класса оксидоредуктаз и
локализованы в митохондриях
• В этой связи, этот процесс получил название биологическое окисление.
24.
25. Механизм биологического окисления
В основе биологического окисления лежит серия последовательныхреакций дегидрирования субстратов, переноса протонов и электронов к
кислороду с образованием воды и выделением свободной энергии:
+
2Н +2еSН2
2Н
S
__
½О2 O
(ΔG)
Н 2О
26.
Основной функцией этого процесса является
обеспечение организма энергией в доступной
для использования форме (прежде всего в
форме АТФ)
В переносе электронов от субстратов к
молекулярному кислороду принимают
участие:
1.Пиридинзависимые анаэробные
дегидрогеназы, для которых коферментами
служат либо НАД, либо НАДФ
2.Флавинзависимые аэробные
дегидрогеназы, у которых коферментом
является ФАД или ФМН;
3.Цитохромы, содержащие в качестве
коферментов используются
железопорфирины ( гем и его производные).
4.Убихинон (коэнзим Q) и белки, содержащие
негемовое железо
27. Анаэробные дегидрогеназы
• Эти ферменты катализируют реакции переноса атомовводорода (протоны и электроны) на любой акцептор кроме
кислорода
• Представители:
• альфа-кетоглутарат дегидрогеназа
• Пируват дегирогеназа
• Изоцитратдегирогеназа
• Малатдегирогеназа
• Коферментом этих ферментов являются
• НАД, НАДФ- производные витамина РР
• ( В5- никотиновая кислота)
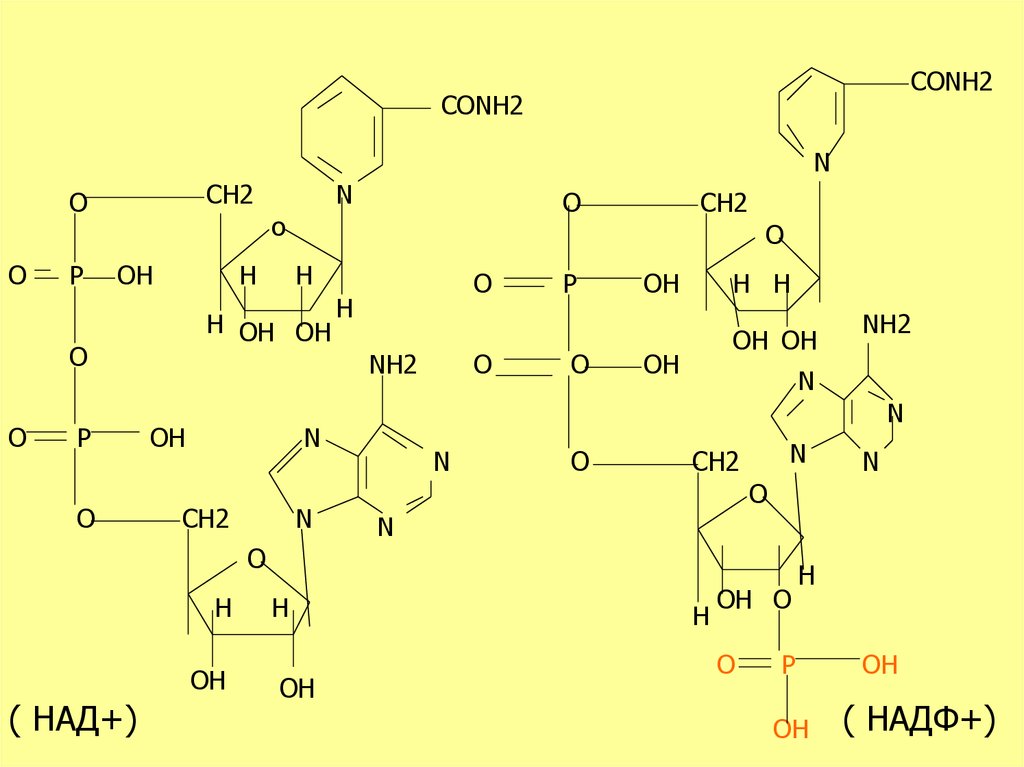
28.
CONH2CONH2
N
CH2
O
O
P
O
o
OH
H
P
O
H
O
H
NH2
OH
N
O
P
O
OH
H H
OH OH
OH
N
N
O
N
CH2
OH
( НАД+)
H
OH
N
O
N
O
H
NH2
N
N
CH2
CH2
O
H OH OH
O
O
N
H
OH O
O
H
P
OH
OH
( НАДФ+)
29. АЭРОБНЫЕ ДЕГИДРОГЕНАЗЫ
• Эти ферменты катализируют реакции переноса атомовводорода (протоны и электроны) на любой акцептор в
том числе и на кислород
• Представители:
• сукцинатдегидрогеназа
• глицероосфатдегирогеназа
• Ацил-КоА-дегирогеназа
• Коферментом этих ферментов являются
• ФАД, ФМН- производные витамина В2
• ( рибофлавин)
30.
HС
N
С
С
С
NH
H3 С
С
С
С
С
N
N
С
С
С
NH
Н3 С
С
С
С
С
N
С
H
CH2
Н
ОН
Н
ОН
Н
H C OH
OH
О
N
CH
OH
О
NH2
H C OH
O P
ОН
СН2
H C OH
O
N
СН2
O
N
CH2
С
Н3 С
С
H3 С
С
H
H
С
C
C
N
C
N
О
N
Н
Р
ОН
О
О
Н
ОН
О
CH
ФМН
Р
Н
СН2
Н
ФАД
O
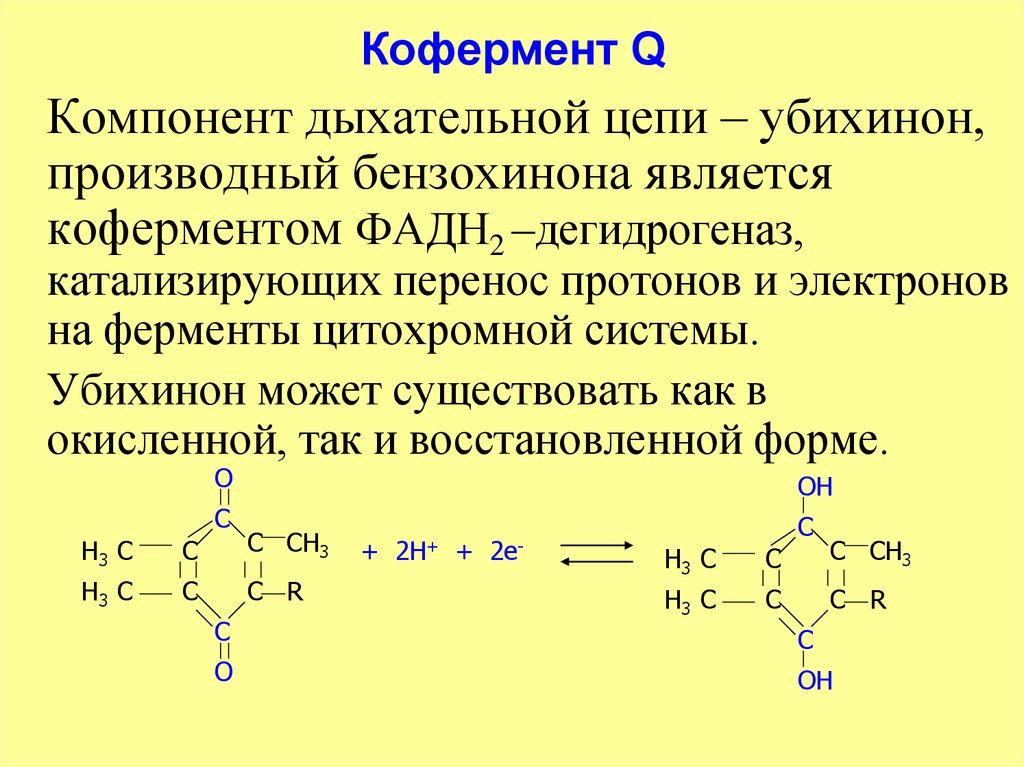
31. Кофермент Q
Компонент дыхательной цепи – убихинон,производный бензохинона является
коферментом ФАДН2 –дегидрогеназ,
катализирующих перенос протонов и электронов
на ферменты цитохромной системы.
Убихинон может существовать как в
окисленной, так и восстановленной форме.
О
С
ОH
H3 С
С
С СН3
H3 С
С
С R
С
O
+
2H+
+
2е-
С
H3 С
С
С СН3
H3 С
С
С R
С
OH
32. ЦИТОХРОМЫ
Дальнейший перенос электронов от убихинона на кислородосуществляет система цитохромов:
b, c1, c,
a- a3.
Все они имеют в качестве кофермента геминовую группу.
В ходе каталитического процесса валентность содержащегося в
цитохромах железа обратимо изменяется:
Fe++
Fe+++
Величины окислительно-восстановительного потенциала у разных
цитохромов неодинаковы. В цепи окисления они располагаются
между убихиноном и кислородом :
b
С1
С
aa
3
Цитохромы b, c1, c выполняют функцию промежуточных
переносчиков электронов, а цитохром аа3 является терминальным
дыхательным ферментом, непосредственно взаимодействующим с
кислородом.
33. Механизм действия цитохромов в окислительно-восстановительных реакциях
Fe3+ + eFe2+Fe2+ - e Fe3+
Cu2+ + e Cu+
Cu+ - e Cu2+
Цитохромы b и с1 действуют как фермент КоQH2-дегидрогеназа и катализируют
реакцию:
КоQH2 + 2C1(Fe3+)
КоQ + 2H+ + 2C1 (Fe2+)
Цитохромы аа3 действуют как цитохромоксидаза. Это конечные продукты:
2аа3 (Fe2+) + О2
2аа3 (Fe3+) + 2O-2O-- + 4e- + 4H+
2H2O
Представители цитохромов:
аскорбат ДГ,
адреналин ДГ,
норадреналин ДГ.
34. СТРУКТУРА ДЫХАТЕЛЬНОЙ ЦЕПИ
• Перенос электронов и протонов в митохондриальнойдыхательной цепи происходит по градиенту их
окислительно-восстановительного потенциала (редокс
потенциал), который отражает величину свободной
энергии в соответствии с редокс системой.
• Каждый фермент дыхательной цепи имеет свою величину
редокс- потенциала. Его величина возрастает от НАД (0,32в) до О2(+0,82в) и общая разность редокс потенциала
между ними равна 1,14 Вольт.
• Такое количество энергии, освобождаемой при окислении
1 молекулы субстрата НАДН2 –дегидрогеназами,
достаточно для синтеза трех АТФ.
• В дыхательной цепи имеются 3 участка в которых энергии
разности редокс потенциалов достаточно для
фосфорилирования (присоединения фосфорной кислоты)
3-х молекул АДФ, с образованием 3 молекул АТФ
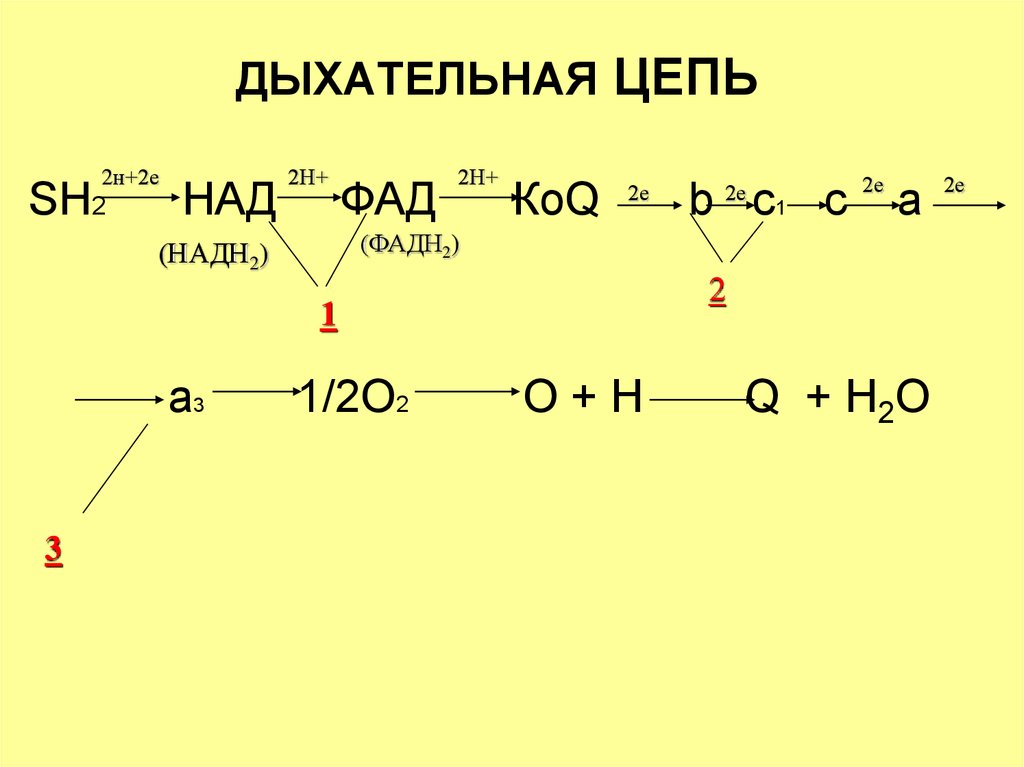
35. ДЫХАТЕЛЬНАЯ ЦЕПЬ
2н+2еSH2
НАД
2Н+
ФАД
2Н+
КоQ
2е
a
2
1
3
b c1 c
2е
(ФАДН2)
(НАДН2)
a3
2е
1/2O2
O+H
Q + H 2O
2е
36. ДЫХАТЕЛЬНАЯ ЦЕПЬ И РЕДОКС ПОТЕНЦИАЛ
Ферменты дыхательной митохондриальной цепи:SmH2---->ФАД
SnH2
- 0.05в
SхH2-->НАД-->ФМН--->KoQH2---->b----->c1------>c------->a------->a3------->½O2
- 0,41в - 0,32в - 0,11в + 0,02в + 0,04в+ 0,23в + 0,25в + 0,29в + 0,55в + 0,82в
/\
АДФ+Рн=АТФ
/\
АДФ+Рн=АТФ
/\
АДФ+Рн=АТФ
37. ПУНКТЫ ФОСФОРИЛИРОВАНИЯ
Первый пункт фосфорилирования находится междуферментами НАД и ФАД, где разность их потенциала равна
0,246
АДФ + Н3РО4
АТФ
Второй пункт – между цитохромами В и С1, где разность их
потенциала равна 0,19
АДФ + Н3РО4
АТФ
Третий пункт - между цитохромами аа3 и 1/2О2, где разность
их потенциала равна 0,30 Вольт.
АДФ + Н3РО4
АТФ
38.
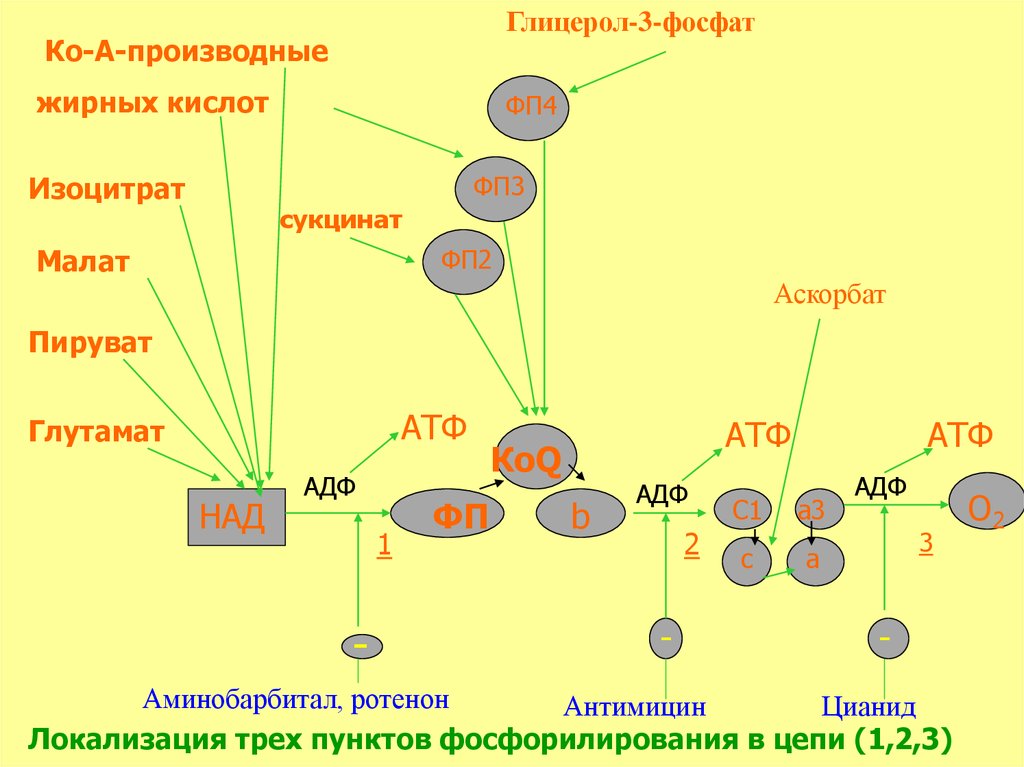
Глицерол-3-фосфатКо-А-производные
жирных кислот
ФП4
ФП3
Изоцитрат
сукцинат
ФП2
Малат
Аскорбат
Пируват
АТФ
Глутамат
НАД
АДФ
1
-
ФП
АТФ
КоQ
b
АДФ
2
-
АТФ
C1
a3
c
a
АДФ
3
-
Аминобарбитал, ротенон
Антимицин
Цианид
Локализация трех пунктов фосфорилирования в цепи (1,2,3)
О2
39. Окислительное фосфорилирование
• При окислении одной молекулы субстрата на один атомпоглощенного митохондриями кислорода может
использоваться от одного до трех молекул фосфорной
кислоты и синтезироваться при этом 1, 2 или 3
молекулы АТФ.
• Это процесс - процесс синтеза АТФ в реакциях
биологического окисления субстратов получил
название - окислительное фосфорилирование.
• Для его количественной оценки был введен показатель
окислительного фосфорилирования - коэффициент Р/О .
• Коэффициент Р/О (АДФ/О) - это есть отношение
количества молекул фосфорной кислоты (АДФ) к
количеству атомов кислорода использованных
митохондриями при окислении какого-либо субстрата.
40.
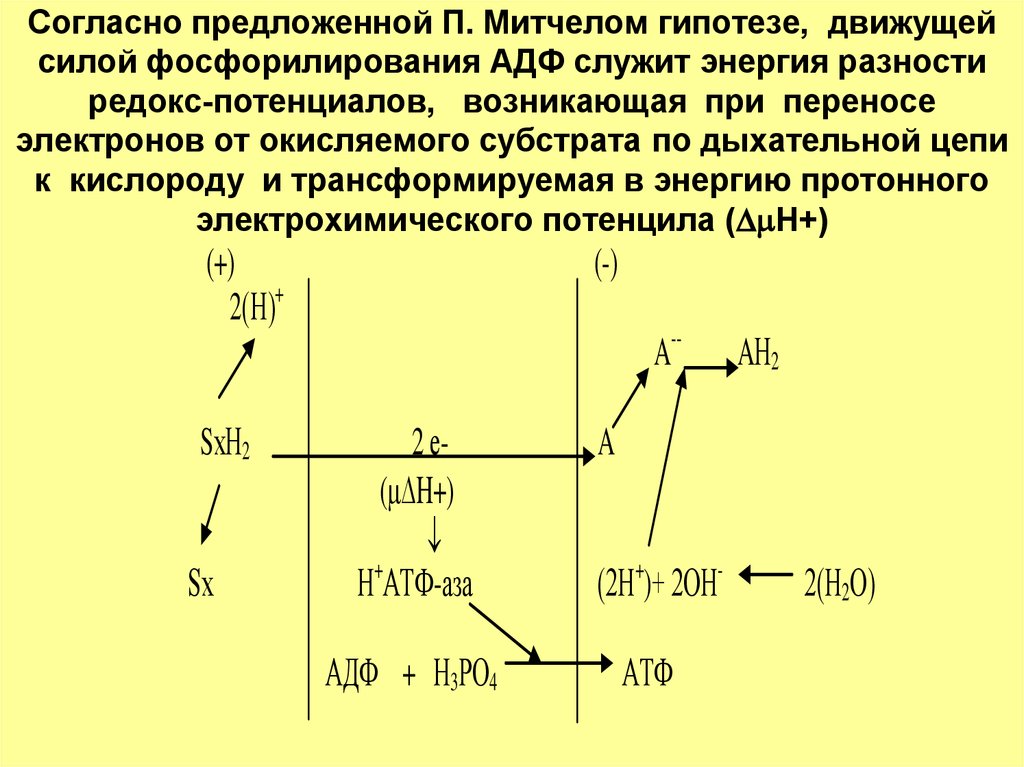
41. Согласно предложенной П. Митчелом гипотезе, движущей силой фосфорилирования АДФ служит энергия разности редокс-потенциалов,
возникающая при переносеэлектронов от окисляемого субстрата по дыхательной цепи
к кислороду и трансформируемая в энергию протонного
электрохимического потенцила ( H+)
(+)
2(Н)+
(-)
A--
SхН2
Sх
2 е( H+)
Н+АТФ-аза
АДФ + Н3РО4
AН2
A
(2Н+)+ 2ОНАТФ
2(Н2О)
42. Протонный (трансмембранный ) электрохимический потенциал (H+)
Протонный (трансмембранный )электрохимический потенциал ( H+)
• Трансмембранный электрохимический
потенциал, возникающий на мембране за
счет Н+-градиента, является универсальной
формой энергии в клетке и может быть
использован:
- для синтеза АТФ
- для транспорта ионов Са и других ионов
- для транспорта фосфатов
- для транспорта АДФ и АТФ
• - для теплообразования
• - для сократительной и двигательной
активности






























 biology
biology








