Similar presentations:
Оксидоредуктазалар. Оксидоредуктазалар–тотығу - тотықсыздану реакцияларын тездетеді
1.
ОКСИДОРЕДУКТАЗАЛАР2.
.3.
ОКСИДОРЕДУКТАЗАЛАР–ТОТЫҒУ–ТОТЫҚСЫЗДАНУ РЕАКЦИЯЛАРЫН ТЕЗДЕТЕДІ.
ОЛАР 2 КОМПОНЕНТТІ. ЖАСУША ІШІЛІК
ФЕРМЕНТТЕР.
ТОТЫҒУ ТҮРІНЕ ҚАРАЙ 4 ТОПҚА БӨЛЕДІ:
1)
2)
3)
4)
ДЕГИДРОГЕНАЗАЛАР(анаэробты,аэробты)
ЦИТОХРОМДАР
КАТАЛАЗА МЕН ПЕРОКСИДАЗАЛАР
ОКСИГЕНАЗАЛАР
4.
ДЕГИДРОГЕНАЗАЛАР–субстраттыдегидрлеу, яғни сутек атомын (Н) бөліп алу
арқылы тотықтырады.
Өкілдері:
1) пиридин ферменттер (ПФ);
2) флавин ферменттер (ФП);
3) кофермент Q немесе убихинон (КоQ)
5.
ПИРИДИН ФЕРМЕНТ (ПФ) 2 КОМПОНЕНТТІ.КОФЕРМЕНТТЕРІ:
НАД , НАДФ
(
никотинамидадениндинуклеотид)
(никотинамидадениндинуклеотид
фосфат)
6.
O НИКОТИНАМИДАДЕНИН
NH2
C NH2
O
N+
CH2O
O
H
H
H
OH
N
P O P O CH2
OH
H
O
N
O
OH
H
H
N
N
H
H
OH
OH
OH
никотинамидадениндинуклеотид (НАД)
НАД=АМФ+Н3РО4+РИБОЗА+НИКОТИНАМИД (РР -ВИТАМИНІ )
7.
OC
NH2
NH2
O
N+
CH2O
O
H
H
H
OH
H
OH
P
O
O
P
N
O
CH2
N
O
OH
H
N
N
H
H
H
OH
OH
O
O
P
OH
OH
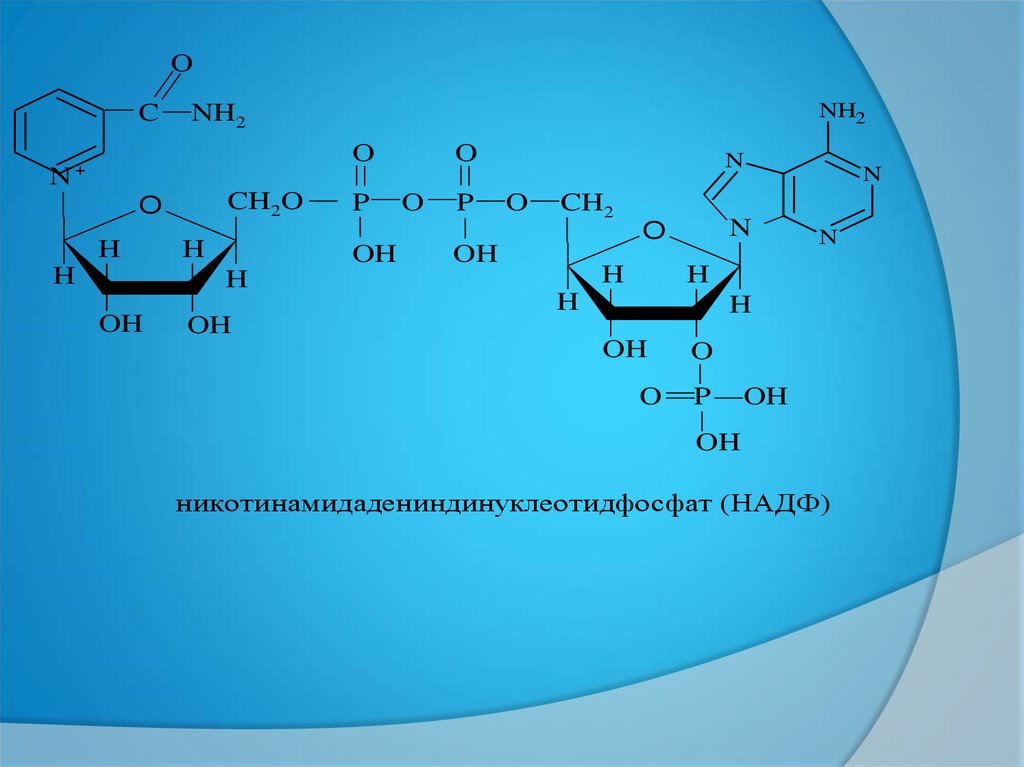
никотинамидадениндинуклеотидфосфат (НАДФ)
8.
ПФ СУБСТРАТТЫ ДЕГИДРЛЕНУЖОЛЫМЕН ТОТЫҚТЫРАДЫ.
ТОТЫҒУ-ТОТЫҚСЫЗДАНУ
РЕАКЦИЯСЫНА КОФЕРМЕНТТІҢ
ТЕК НИКОТИНАМИД БӨЛІГІ
ҚАТЫСАДЫ.
9.
O НИКОТИНАМИДАДЕНИН
NH2
C NH2
O
N+
CH2O
O
H
H
H
OH
N
P O P O CH2
OH
H
O
N
O
OH
H
H
H
H
OH
OH
OH
никотинамидадениндинуклеотид (НАД)
РР ―ВИТАМИНІ(В3 )- (НИКОТИНАМИД)
N
N
R
10.
Мысалы: коферменті НАД болатын ЛДГЛАКТАТ
ПИРУВАТ
Н+ +ē
ТОТЫҚҚАН
ТОТЫҚСЫЗДАНҒАН
11.
ЛАКТАТТАН 2Н АТОМЫ БӨЛІНЕДІ:БІР СУТЕК АТОМЫ НИКОТИНАМИДТЕГІ С-4
ОРНЫНА ҚОСЫЛАДЫ, АЛ ЕКІНШІ Н0→Н++еЫДЫРАЙДЫ.
е- БІРІНШІ ОРЫНДАҒЫ АЗОТҚА ҚОСЫЛЫП, АЗОТ
НЕЙТРАЛ КҮЙГЕ АЙНАЛАДЫ. АПОФЕРМЕНТ
КОФЕРМЕНТТЕН БӨЛІНІП КЕТЕДІ. ПРОТОН
ЕРТІНДІДЕ ҚАЛАДЫ.НИКОТИНАМИДТЕГІ 3 ҚОС
БАЙЛАНЫС 2 БАЙЛАНЫСҚА АЙНАЛАДЫ.
НАД НАДН2 Н/Е НАДФ НАДФН2
ТОТЫҚСЫЗДАНАДЫ,
НАДН2 ФП(ФМН)- МЕН ТОТЫҒАДЫ.
12.
ПФ - БІРІНШІ РЕТТІКДЕГИДРОГЕНАЗАЛАР , СЕБЕБІ
СУБСТРАТПЕН ТІКЕЛЕЙ
ӘРЕКЕТТЕСІП ОЛАРДАН
СУТЕГІН БӨЛІП АЛАДЫ.
13.
НАД- ПЕН НАДФ- ТІҢ БІР БІРІНЕНАЙЫРМАШЫЛЫҒЫ:
ҚҰРЫЛЫСЫНДА (НАДФ-ТЕ АМФ
ҚҰРАМЫНДАҒЫ РИБОЗАНЫҢ 2´―ОН
ТОБЫНА ФОСФОР ҚЫШҚЫЛЫ
БАЙЛАНЫСҚАН)
БИОЛОГИЯЛЫҚ ФУНКЦИЯСЫНДА
КЕЗДЕСЕТІН ОРНЫНДА
14.
Құрамында НАД бар ферменттермитохондрияларда кездеседі,
биологиялық тотығуға (БТ) қатысады.
Бір НАДН2 БТ тізбегінде тотыққанда
3АТФ түзіледі.
НАДФ бар ферменттер цитоплазма мен
микросомаларда кездеседі. НАДФН2
тотықсыздандырғыш ретінде БМҚ, ХС,
стероидты гормондардың синтезіне
қатысады.
15.
НАДФН2 микросомалды тотығупроцесіне қатысып гидрофобты
улы заттар, ксенобиотиктері
(сонымен қатар дәрілер)
залалсыздандырады.
16.
ФЛАВИНФЕРМЕНТІ (ФП)2 КОМПОНЕНТТІ. КОФЕРМЕНТТЕРІ:
ФМН
ФАД
(ФЛАВИНМОНОНУКЛЕОТИД)
(ФЛАВИНАДЕНИНДИНУКЛЕОТИД )
17.
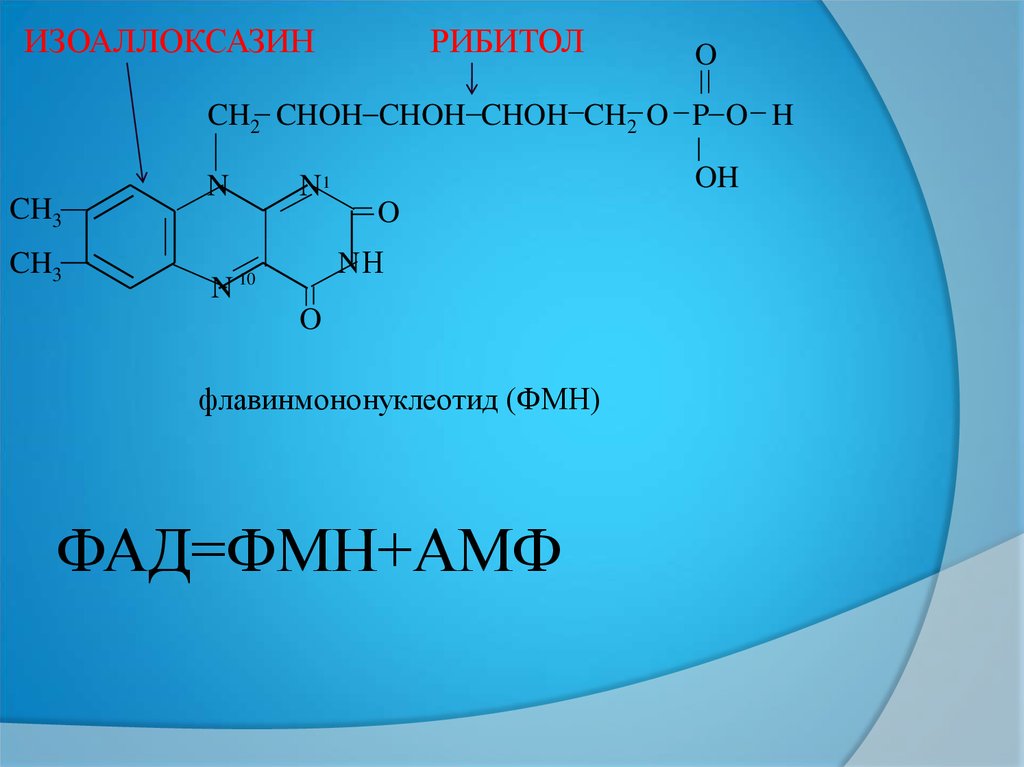
ФМНРИБОФЛАВИН
(В2 ВИТАМИН)
ДИМЕТИЛИЗОАЛЛОКСАЗИН
САҚИНАСЫ
Н3РО4
5АТОМДЫ СПИРТ
РИБИТОЛ
18.
ИЗОАЛЛОКСАЗИНРИБИТОЛ
O
CH2 CHOH CHOH CHOH CH2 O P O H
CH3
CH3
N
N
N1
OH
O
NН
10
O
флавинмононуклеотид (ФМН)
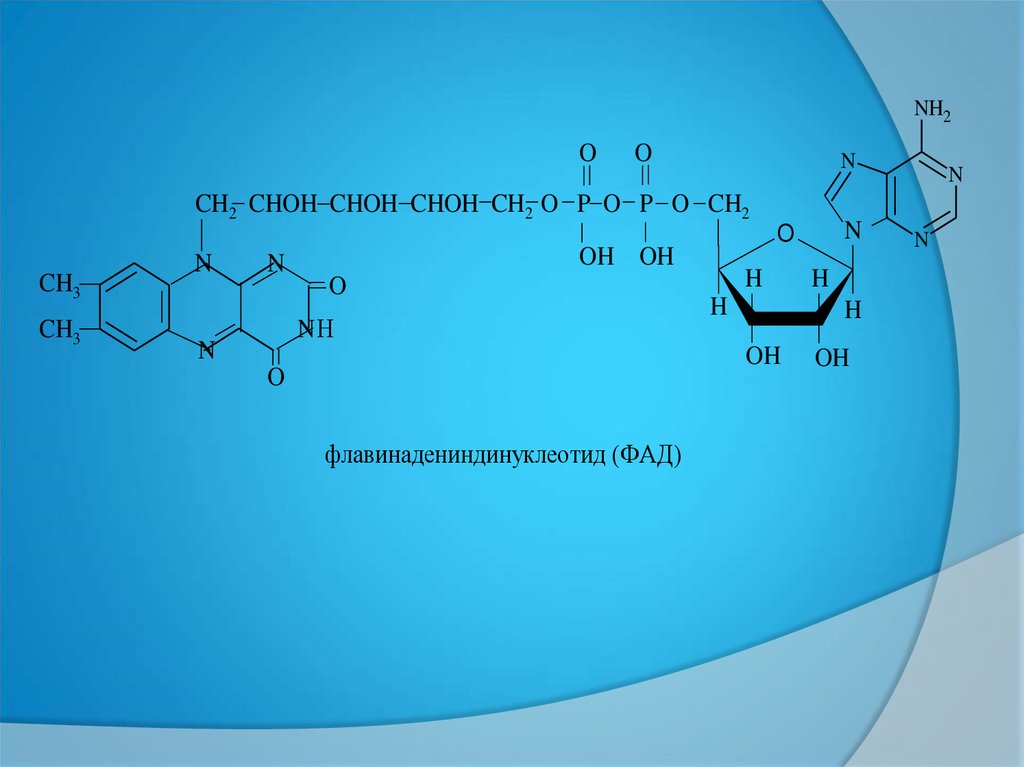
ФАД=ФМН+АМФ
19.
NH2O
O
N
CH2 CHOH CHOH CHOH CH2 O P O P O CH2
CH3
CH3
N
N
OH OH
O
NН
N
H
H
флавинадениндинуклеотид (ФАД)
H
H
OH
O
N
O
OH
N
N
20.
ФП СУБСТРАТТЫ ДЕГИДРЛЕНУЖОЛЫМЕН ТОТЫҚТЫРАДЫ.
ТОТЫҒУ־ТОТЫҚСЫЗДАНУ
РЕАКЦИЯСЫНА ТЕК
ИЗОАЛЛОКСАЗИН САҚИНАСЫ
ҚАТЫСАДЫ.
21.
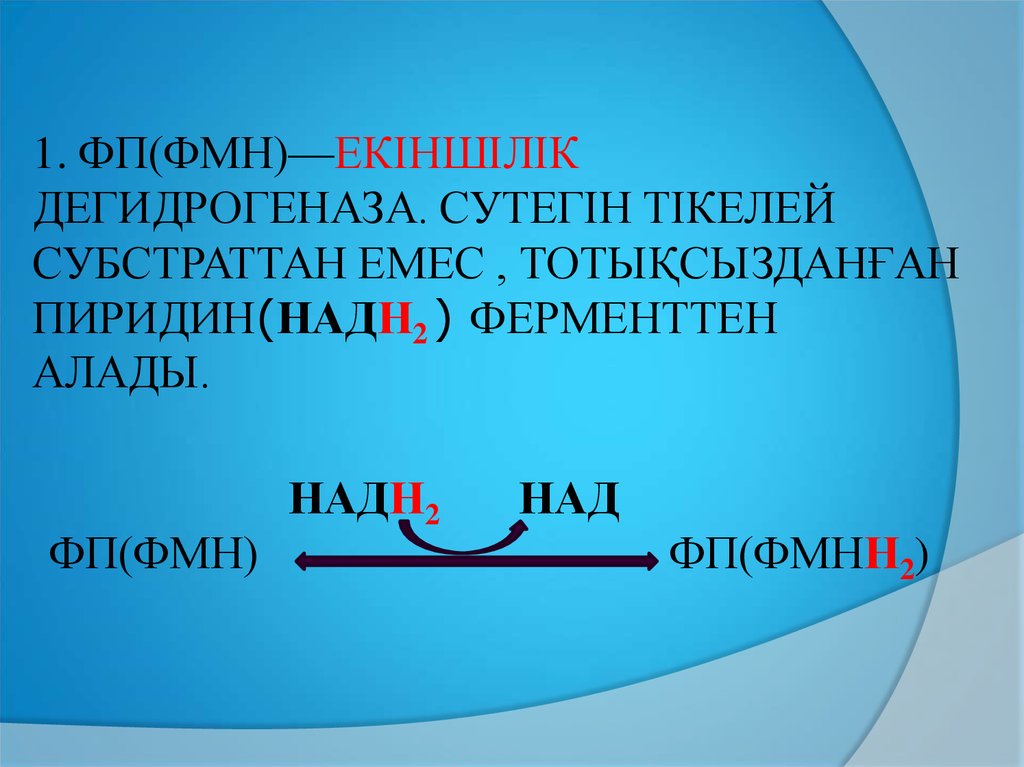
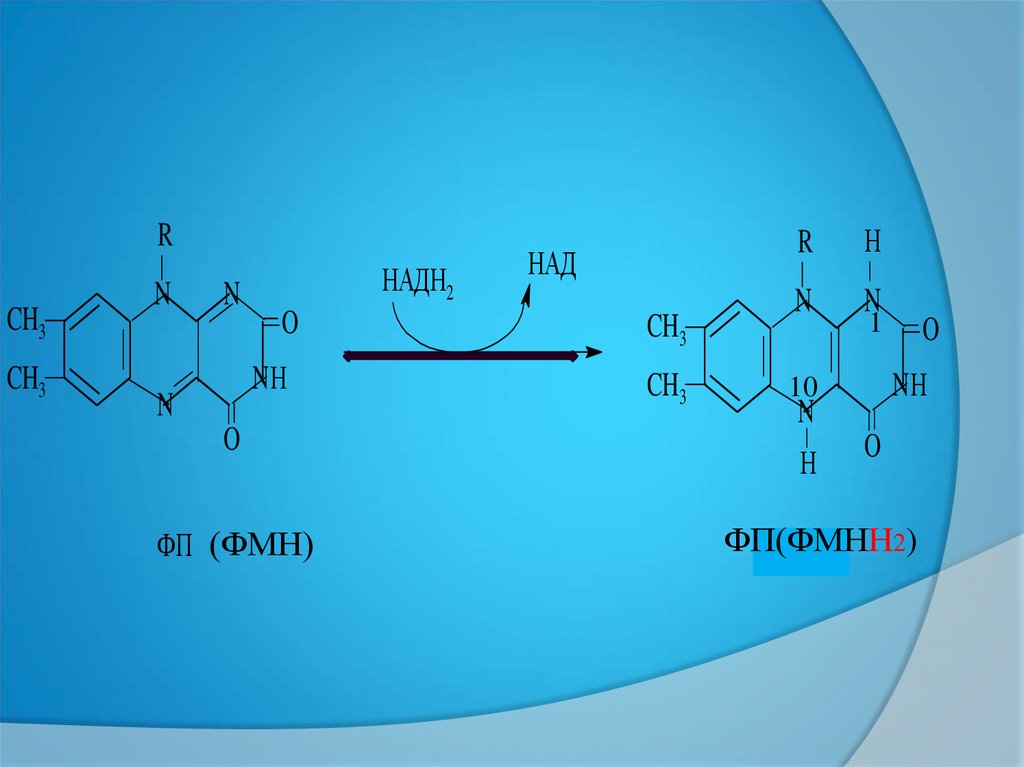
1. ФП(ФМН)—ЕКІНШІЛІКДЕГИДРОГЕНАЗА. СУТЕГІН ТІКЕЛЕЙ
СУБСТРАТТАН ЕМЕС , ТОТЫҚСЫЗДАНҒАН
ПИРИДИН(НАДН2 ) ФЕРМЕНТТЕН
АЛАДЫ.
ФП(ФМН)
НАДН2
НАД
ФП(ФМНН2)
22.
СУБСТРАТТАН БӨЛІНГЕН СУТЕГІНІҢБІР АТОМЫ ИЗОАЛЛОКСАЗИН
САҚИНАСЫНДАҒЫ N—1, АЛ, 2- ші
сутек N—10 қосылады.НӘТИЖЕСІНДЕ
ИЗОАЛЛОКСАЗИНДЕГІ—1,10
ОРЫНДАҒЫ ҚОС БАЙЛАНЫСТАР
ҮЗІЛІП ОНЫҢ ОРНЫНА БІР ҚОС
БАЙЛАНЫС ПАЙДА БОЛАДЫ.ФП
ТОТЫҚСЫЗДАНАДЫ
23.
RCH3
CH3
N
N
НАДН2
O
NН
N
O
ФП (ФМН)
НАД
CH3
CH3
R
Н
N
N
1
NН
10
N
Н
O
O
ФП(ФМНН
ФПН2 2)
24.
2. ФП(ФАД)—БІРІНШІЛІК ДЕГИДРОГЕНАЗА. СУТЕГІНТІКЕЛЕЙ СУБСТРАТТАН АЛАДЫ.
ФП(ФАД)
SН2
S
ФП(ФАДН2)
СOOН
СН2
СН2
СOOН
Сукцинат
ФПН2
ФП
СДГ
СOOН
СН
СН
СOOН
Фумарат
25.
ФП(ФАД) СУБСТРАТПЕН ТІКЕЛЕЙӘРЕКЕТТЕСІП 2СУТЕГІН ҚОСЫП
АЛЫП ТОТТЫҚҚАН САРЫ ТҮСТЕН
ТОТЫҚСЫЗДАНҒАН ФП(ФАДН2)
ТҮССІЗ КҮЙГЕ ӨТЕДІ. СУБСТРАТ
ТОТЫҒАДЫ.
ТОТЫҚСЫЗДАНҒАН ФП(ФАДН2) МЕН
ФП(ФМНН2) УБИХИНОН (КоQ)
ТОТЫҚТЫРАДЫ.
26.
КЕЙДЕФПН2
ТІКЕЛЕЙ ОТТЕКПЕН ТОТЫҒУЫ ДА МҮМКІН.
ФПН2 + О2
ФП+ Н2 О2
Реакция дегидрлену емес оттекпен тотығу
болғандықтан оларды оксидазалар деп атайды.
М/лы,моноаминооксидаза МАО, диаминоксидаза,
ксантиноксидаза т.б
27.
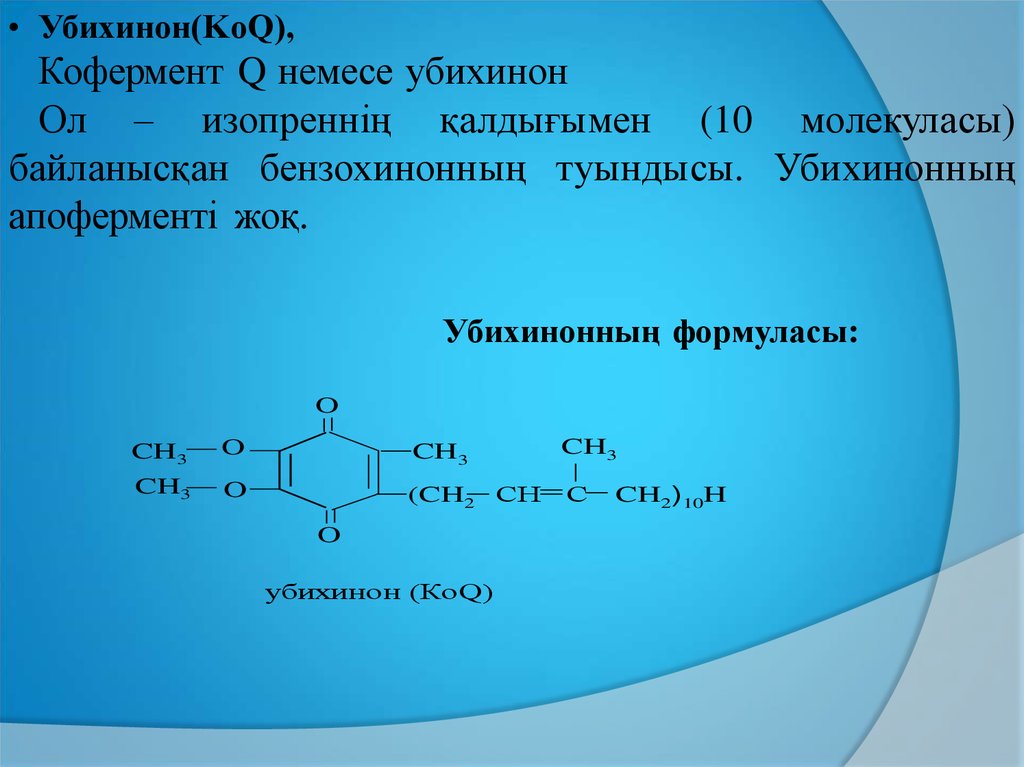
• Убихинон(KoQ),Кофермент Q немесе убихинон
Ол – изопреннің қалдығымен (10 молекуласы)
байланысқан бензохинонның туындысы. Убихинонның
апоферменті жоқ.
Убихинонның формуласы:
O
CH3
O
CH3
CH3
CH3
O
(CH2 СН
C
O
убихинон (КоQ)
CH2)10H
28.
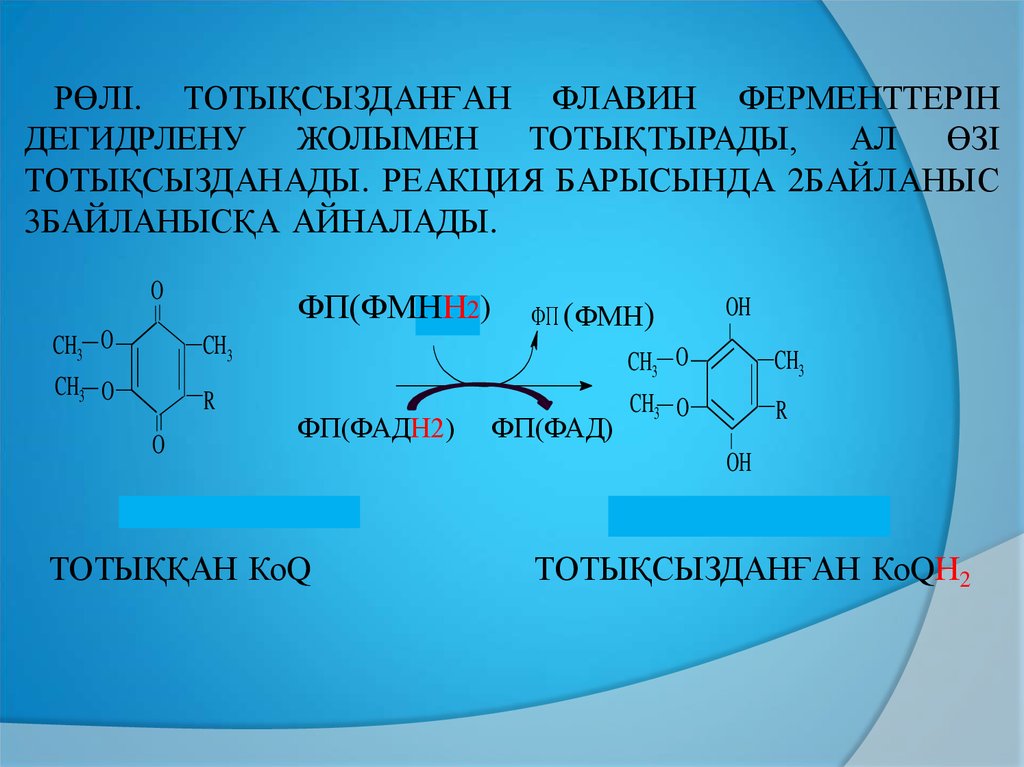
РӨЛІ. ТОТЫҚСЫЗДАНҒАН ФЛАВИН ФЕРМЕНТТЕРІНДЕГИДРЛЕНУ ЖОЛЫМЕН ТОТЫҚТЫРАДЫ,
АЛ ӨЗІ
ТОТЫҚСЫЗДАНАДЫ. РЕАКЦИЯ БАРЫСЫНДА 2БАЙЛАНЫС
3БАЙЛАНЫСҚА АЙНАЛАДЫ.
O
ФП(ФМНН
ФПН2 2)
ФП (ФМН)
OH
CH3 O
CH3
CH3 O
CH3 O
CH3
R
CH3 O
R
O
ФП(ФАДН2)
окисленный убихинон (КоQ)
ТОТЫҚҚАН КоQ
ФП(ФАД)
OH
восстановленный убихинон (КоQH2)
ТОТЫҚСЫЗДАНҒАН КоQН2
29.
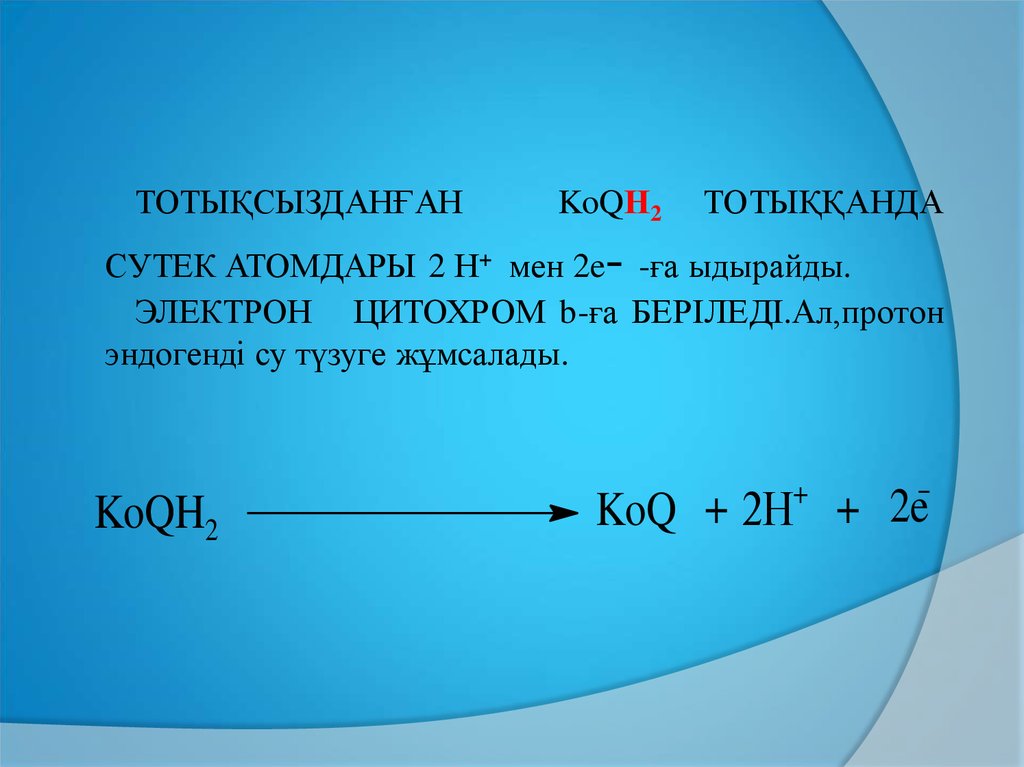
ТОТЫҚСЫЗДАНҒАНKoQН2
ТОТЫҚҚАНДА
-
СУТЕК АТОМДАРЫ 2 Н+ мен 2e -ға ыдырайды.
ЭЛЕКТРОН ЦИТОХРОМ b-ға БЕРІЛЕДІ.Ал,протон
эндогенді су түзуге жұмсалады.
KoQH2
+
+
KoQ 2Н + 2e
30.
ЦИТОХРОМДАР (Цх)Екі компонентті, коферменттері гем.
ЦХ-дар гемдерінің табиғатына байланысты
4 топқа бөлінеді: А,В,С,Д топтарының бір-бірінен
айырмашылығы: коферменттері мен апоферменттер
әртүрлі.Топтар ішіндегі өкілдерінде гемдері бірдей,
ал апоферменттері әртүрлі болады.
Цитохромы
А
a
В
a3
b
D
С
b5
c
c1
31.
Цитохромдар электрондарды (e—)тасымалдау жолымен субстратты
тотықтырады.
Цх маңызы: e— тотықсызданған КоQ Н2 ден
ОТТЕККЕ тасымалдау.
Ол кезде цх геміндегі Fе валенттігі өзгереді.
32.
Цх в – гемоглобиннің геміне ұқсас.Цх с1 мен с – Нв-нің гемінен
айырмашылығы: 2,4-диэтил.
Цх-дар а мен а3 – Нв-нің гемінен
айырмашылығы: С2-де – 15 көміртекті
радикал (R15); С8-де - формил тобы.
33.
Цх (Fe3+) + e ־ Цх (Fe2+)тотыққан
ферри
тотықсызданған
ферро
цха
b c1 c a a3 О2
цха
34.
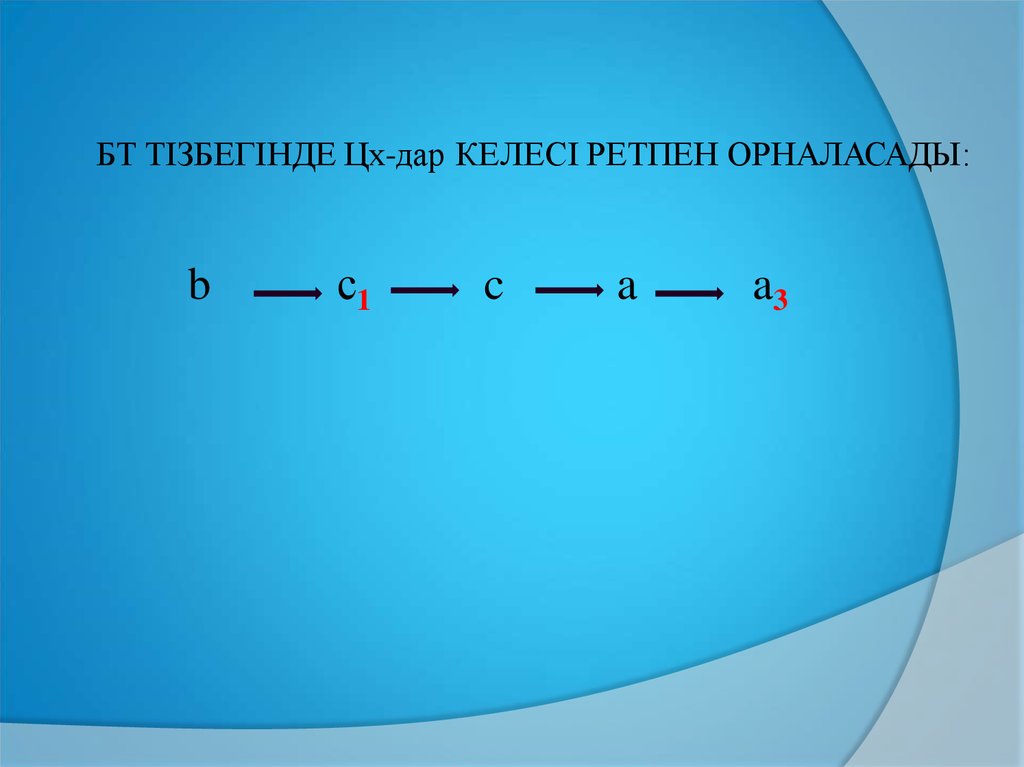
БТ ТІЗБЕГІНДЕ Цх-дар КЕЛЕСІ РЕТПЕН ОРНАЛАСАДЫ:b
с1
c
a
a3
35. Цх-дыѕ ќызметі
Цх-дың қызметіферри
2е־
2цхв (Ғе3+)
2цхв(Ғе2+)
2е־
2цхс1 (Ғе3+)
2цх с1(Ғе2+)
2е־
2цхс (Ғе3+)
2цхс (Ғе2+)
2е־
2цха (Ғе3+)
2цха (Ғе2+)
36.
2е־2цха3 (Ғе3+)
2цха3(Ғе2+)
2е־
1/2О2 1/2О2-
2Н+ + ½ O2 H2O
37.
Цитохром ВӨкілдері: цхb және цхb5. Цхb5 ксенобиотиктердің
метаболизміне қатысады, ал цхb БТ тізбегіне eтасымалдауға қатысады.
цхb екі компонентті, коферменті гем.
Рационалды аты:1,3,5,8- тетраметил, -2,4-дивинил,6,7- дипропион қышқылының темір порфині.
Гемнің құрылысы гемоглобин мен
миоглобиндікіндей.
38.
Цхb-ның рөлі 2e- тотықсызданғанKoQН2 ден алып цхс1-ге береді.
КоQ тотығады, цхb тотықсызданады.
KoQН2
2цхb(Fe3+)
КоQ+ 2H++ 2е־
2 цхb(Fe2+)
39.
Цитохром СӨкілдері: цхс ж/е цхс1 екі компонентті.
Коферменттері бірдей, апоферменттері әртүрлі.
Гемі:
-1,3,5,8- тетраметил, -2,4-диэтил, -6,7- дипропион
қышқылының темір порфині.
40.
цхс1–дің рөлі: ферро цхb-ны тотықтырады,цхс-ні тотықсыздандырады:
2Цхb(Fe ) 2Цхb(Fe )
2+
2Цх c1(Fe )
+3
3+
2e-
2Цхc1(Fe )
+2
цхс–нің рөлі: ферро цхс1-ді тотықтырады,
цхa-ні тотықсыздандырады:
2Ц хc1(Fe+ 2) 2Ц х c1(Fe+ 3)
2Ц х c(Fe+ 3)
2e-
2Цхc(Fe2+)
41.
Цитохром АӨкілдері: цха және цха3. Коферменттері бірдей,
апоферменттері әртүрлі. Гемі:С1,С3 ,С5 орындарда
метил тобы, С2 -15 көміртек атомдарынан тұратын
радикал, С4-ші винил тобы, С6 мен С7 орындарда
пропион қышқылының қалдықтары,С8-ші орында
формил тобы орналасқан.
42.
цха мен цха3 цитохромоксидаза (ЦХО)комплексін түзеді. ол 2цха+4цха3+6Сu
тұрады. ЦХО-дағы мыстың валентілігі
ауыспалы,сондықтан электрон көзі бола
алады.
43.
ПЕРЕНОС ЭЛЕКТРОНОВ ЦХ С НА ЦИТОХРОМОКСИДАЗУ1.2 Цх с(Fe2+) +2 Cu2+
2 цхс(Fe3+) + 2 Cu1+
2. 2 Cu1+ + 2цха(Fe3+)
2Сu2+ + 2цха(Fe2+)
3. 2цха(Fe2+) + 2цха3(Fe3+)
2цха3(Fe3+) + 2цха(Fe3+)
4.2Н+ + ½ O2 H2O
(эндогенная вода)
44.
Цитохромоксидаза(ЦХО) рөлі:цха ферро цхс- дан e-- ды алып цха3 - КЕ
тасымалдайды;
ал цха3 қосып алған электронды оттекке беріп
оны Оттектің активті түріне айналдырады.Бір
оттек атомын тотықсыздандыру үшін 2e-, ал
молекулалық О2 иондау үшін 4e- керек.
Әр ионданған активті оттек KoQН2
ТОТЫҚҚАНДА
ЕРТІНДІДЕ ҚАЛҒАН ПРОТОНМЕН (Н+) ӘРЕКЕТТЕСІП
ЭНДОГЕНДІ СУ ТҮЗЕДІ.
45.
2Цхc(Fe2+)2Ц х a(Fe+ 3)
2Ц х c(Fe+ 3)
2Ц хa(Fe+ 2)
2e+3
2Ц хa(Fe+ 2) 2Ц х a(Fe )
2Ц х a3(Fe+ 3)
1/2 О2
2e2 e-
2Цхa3(Fe2+)
1/2 О2-2
2Н+ + ½ O2 H2O
46.
Оксидоредуктаза ферменттерініңорналасу тәртібі олардың тотығутотықсыздану
потенциалдарының(ТТП) өсуіне
байланысты.ТТП жоғарысы өзінің
алдындағы ферментті тотықтырады,
кейінгісін тотықсыздандырады.
SН2 НАДН2 ФПН2
КоQН2 b c1 c a a3 О2
47.
• Каталаза мен пероксидазалар.Каталаза мен пероксидаза БТ-ға тікелей қатыспайды.
Каталаза 2 компонентті коферменті 4 гем , бірақ геміндегі
Fe3+. Қанда, сүйек кемігінде, шырышты қабаттардың
мембранасында, бүйрек, бауырда кездеседі.
Каталаза сутек пероксидін су мен молекулалық оттекке
ыдыратады:
2Н2О2
2Н2О + О2
Каталаза жасушаларды пероксидтік тотығудан қорғайды.
АКАТАЛАЗЕМИЯ
48.
Пероксидаза 2компонентті коферменті бір гем.Пероксидаза өсімдіктерде, лейкоциттерде,
тромбоциттерде, сүтте кездеседі.
Пероксидаза сутек пероксидін су мен атомдық
оттекке дейін ыдыратады:
Н2О2
Н2О + О
Атомдық оттек өте күшті тотықтырғыштық қасиет
көрсетеді. Бұл ферменттер ароматты
қосылыстарды тотықтыруға қатысады
Цхb, гемоглобин, миоглобин,
каталаза,пероксидазанің гемдері бірдей.
49.
ОКСИГЕНАЗАЛАРСтероидтар, ксенобиотиктер және басқа да циклді
қосылыстардың алмасуында маңызды рөл атқарады.
Екі компонентті, коферментінің құрамында С витамині бар
ферменттер.
ОКСИГЕНАЗАЛАР: монооксигеназалар мен диоксигеназалар.
Олар оттегін субстратқа қосушы ферменттер депте аталады.
Диоксигеназалар молекулалық оттектің 2атомын субстратқа
тікелей қосады:
R + О2 → RО2
50.
Монооксигеназалар ( гидроксилазалар) молекулалықоттектің 1атомын ғана субстратқа қосады, ал екінші оттек
атомы суға дейін тотықсызданады. Сутегінің доноры рөлін
НАДФН 2 атқарады.
RH + O2 + HADФН2 → ROH + Н2О + НАДФ+
Ксенобиотиктерді зиянсыздандырудың бірінші сатысына
монооксигеназа қатысады.
Гидроксилазалар холестерин мен адреналиннің, стероидты
гормондардың синтезіне де қатысады. Бұл ферменттер
цитоплазмада, эндоплазмалық ретикулм жүйесінде,
митохондрияларда және микросомаларда кездеседі.









































 biology
biology








