Similar presentations:
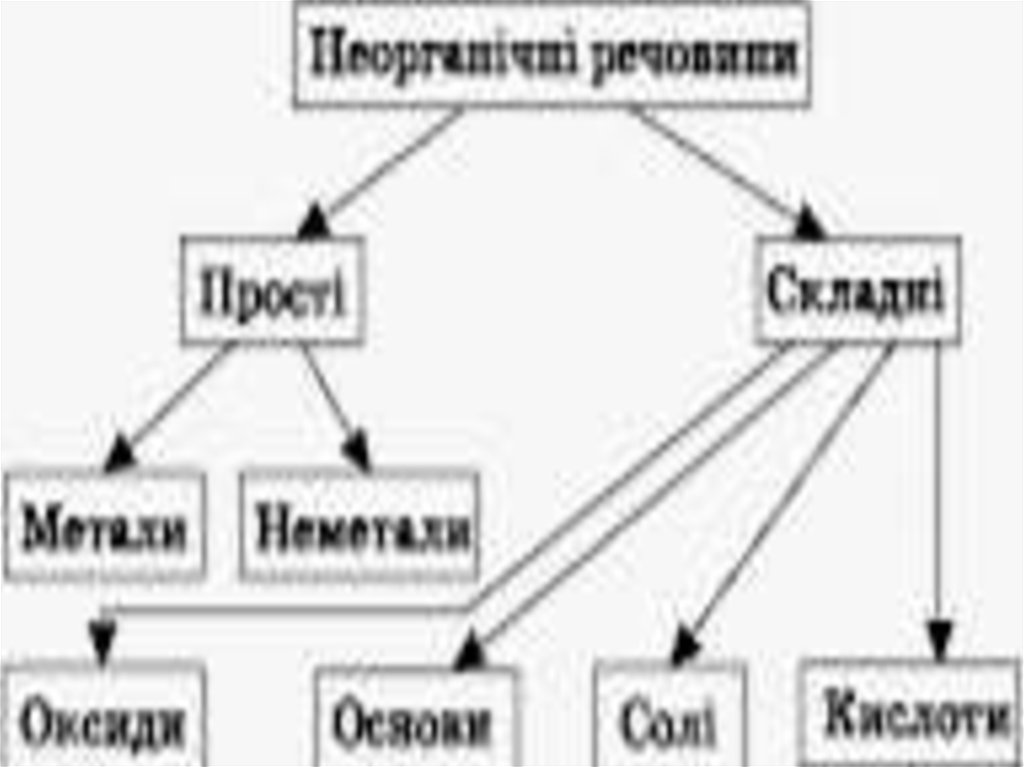
Класи неорганічних сполук
1. ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК
2. План
1. Оксиди.2. Основи.
3. Кислоти.
4. Солі.
3.
4. Класифікація оксидів
КласифікаціяСолетворні
Основні
(CaO, FeO)
Кислотні
(CO2, P2O5)
Амфотерні
(ZnO, Al2O3)
оксидів
Несолетворні
(SiO2, CO, N2O)
5.
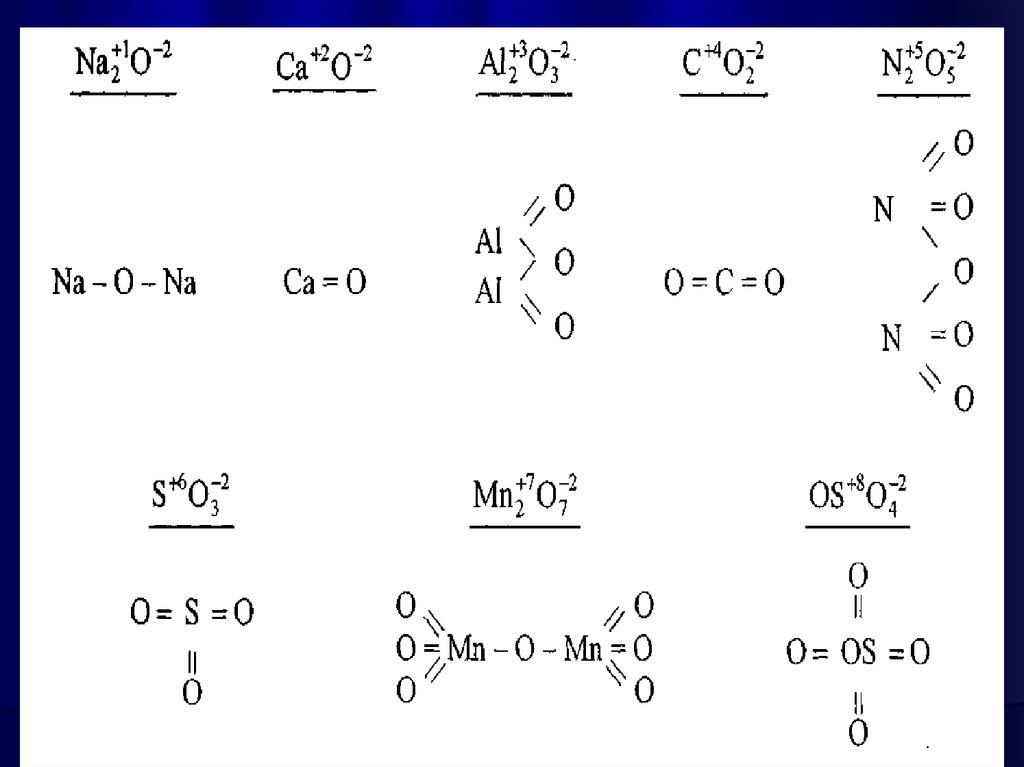
Окси́д — бінарна сполука, до складуякої входить Оксиген.
Майже всі елементи утворюють оксиди. Їх загальні
формули та міжнародна номенклатура:
6.
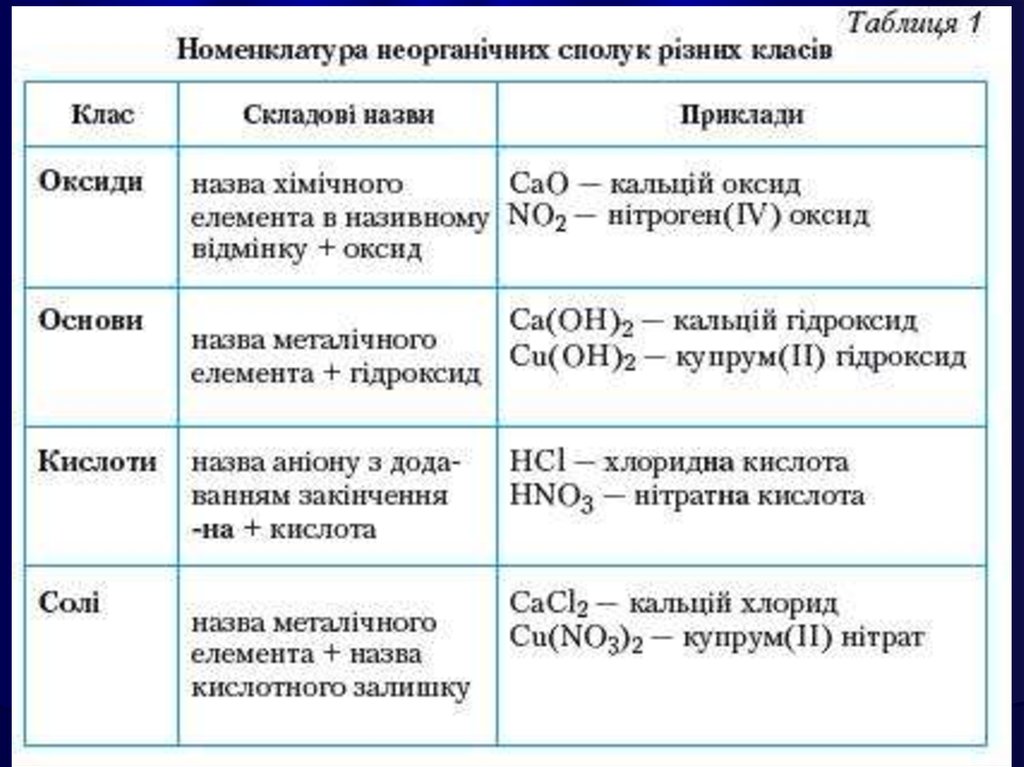
Назва оксидів складається зі слова«оксид» з додаванням спочатку назви
елемента, що входить до складу
речовини, у називному відмінку.
Назви оксидів елементів зі змінною
валентністю будують таким чином: після
слова "оксид" вказують назву елементу і
в дужках його валентність у цьому оксиді.
Наприклад: СuО – оксид Купруму (II).
7.
8.
ОСНОВНИМИ_ОКСИДАМИназивають оксиди металів,
гідрати яких є основами.
Наприклад: Lі2O, Nа2O, К2O,
Rb2O, CS2O, MgO, CaO, BaO,
Cu2O, Ag2O, Hg2O, VO, V2O3,
MnO, Mn2O3 та інші.
9.
КИСЛОТНИМИ_ОКСИДАМИназивають оксиди, гідрати яких
є кислотами.
Наприклад: Ва2О3, СО2, М2О5,
Р2О5, С12О7, СrО3, V2O5, МnО3,
Мn2О7.
10.
АМФОТЕРНИМИ_ОКСИДАМИназивають оксиди, гідрати яких є
амфотерними гідроксидами.
Наприклад: А12О3, Сг2О3, ВеО,
ZnО, SnО, Sn02, РbО, РbO2, TiO2,
МnO2 та інші.
11.
Методи одержання оксидів•Безпосереднім сполученням елементів з киснем:
2Zn + O2 = 2ZnO
4Р + 5О2 = 2Р2О5
•Окисленням різних сполук киснем:
СН4 + 2О2 = СО2 + 2Н2О
2Н2S = СаО + Н2О
2Fe(ОН)3 = Fe2О3 + 3Н2О
Розкладом солей кисневих кислот при нагріванні:
CaCO3 = CaO + СО2
•Розкладом гідроксидів при нагріванні:
Ca(ОН)2 О3 = CuO + СО2 + Н2О
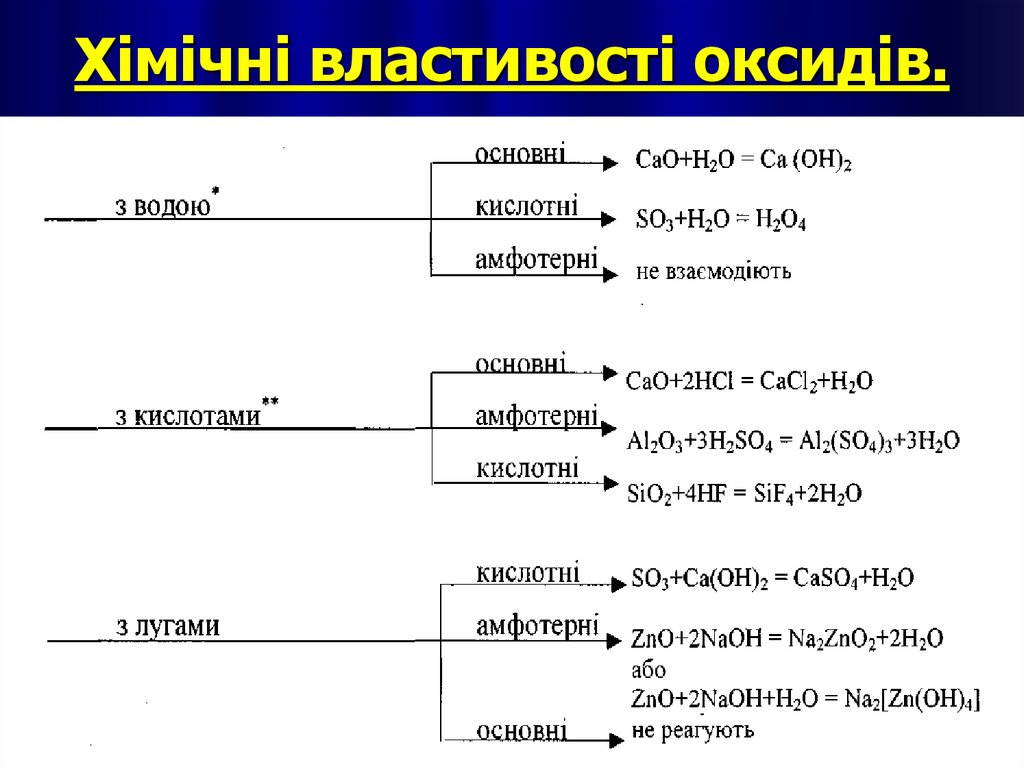
12. Хімічні властивості оксидів.
13.
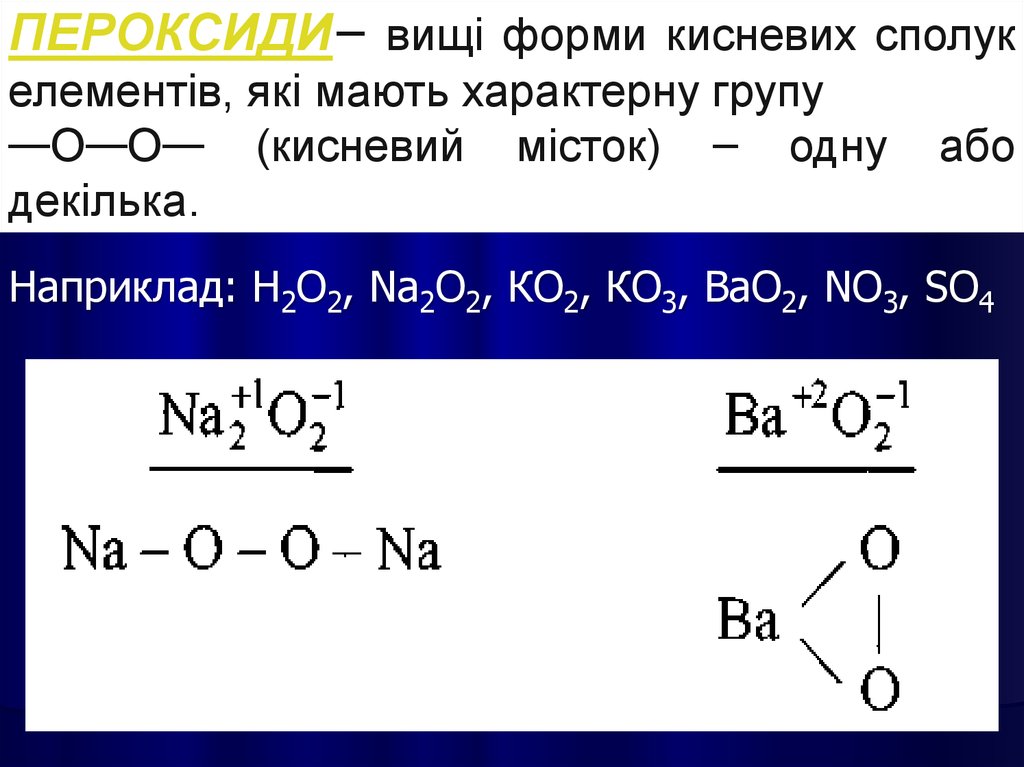
ПЕРОКСИДИ– вищі форми кисневих сполукелементів, які мають характерну групу
—О—О— (кисневий місток) – одну
декілька.
або
Наприклад: Н2О2, Nа2О2, КО2, КО3, ВаО2, NО3, SО4
14.
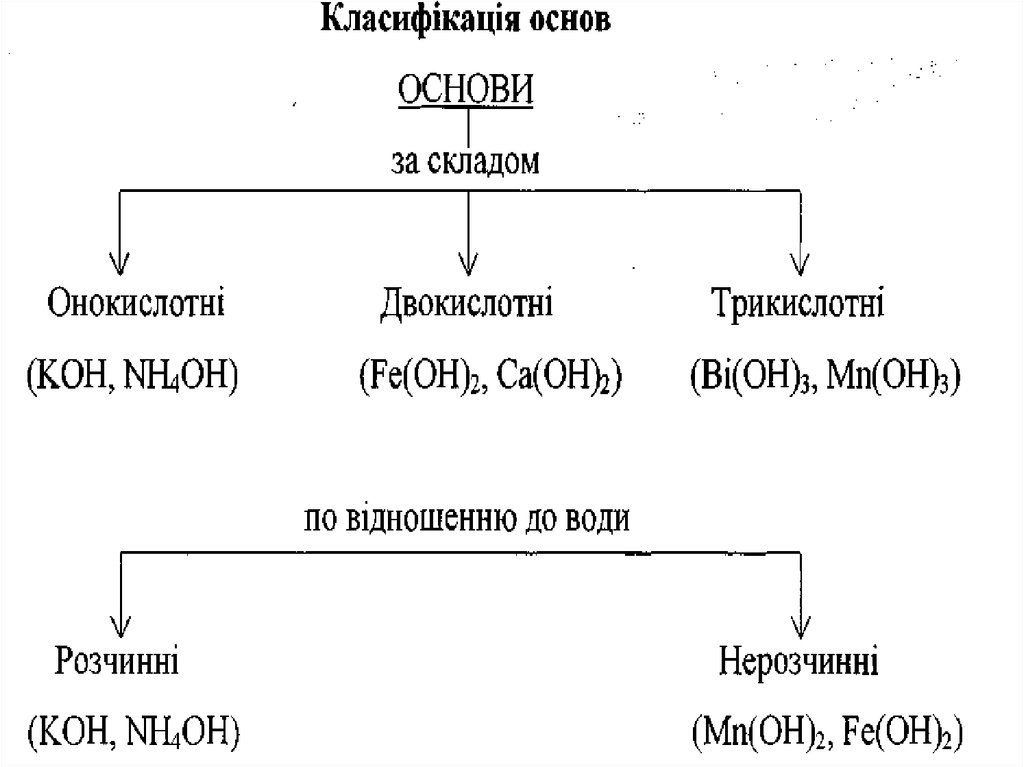
ОСНОВАМИє
сполуки
основних оксидів з водою,
які мають гідроксильні групи
—ОН.
Назви основ: після слова "гідроксид"
дається назва металу, який утворює
основу, та в дужках римськими цифрами
вказують його валентність
15.
Наприклад:16.
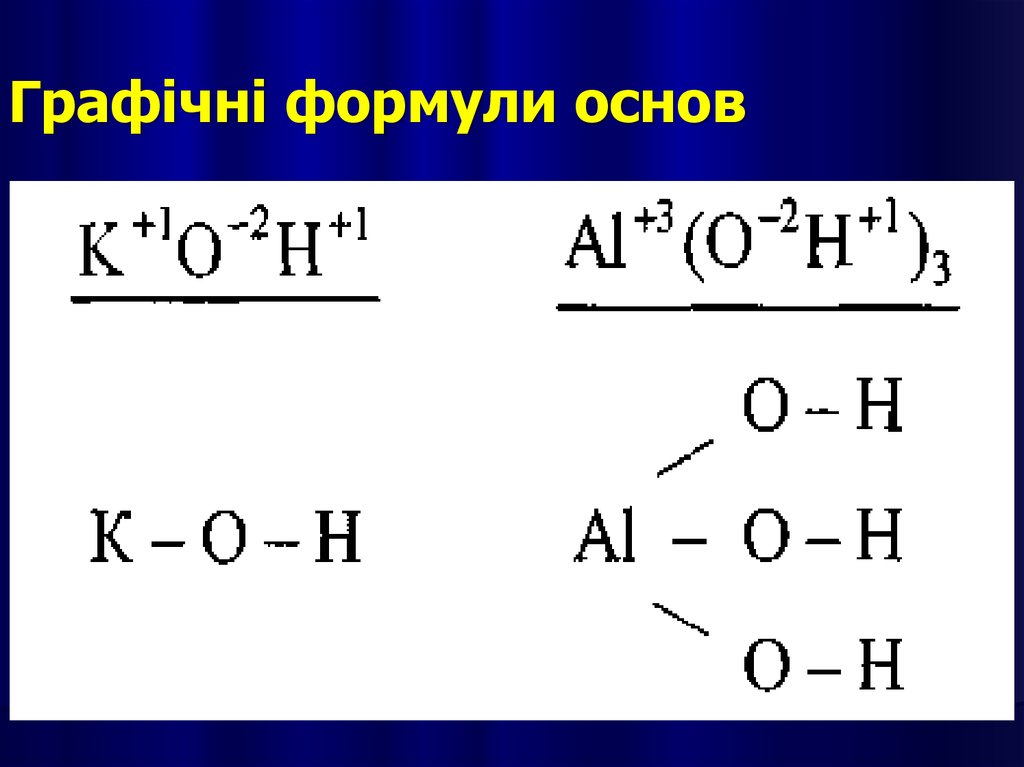
Графічні формули основ17.
18.
Основи можна добути різними способами.•Безпосереднім сполученням основних оксидів
з водою.
Na2O + H2O = 2NaOH
•Взаємодією їдких лугів, з розчинами солей.
CuSO4 + 2KOH = Cu(OH)2 ↓ + K2SO4
•Взаємодією найактивніших металів (K, Na, Ca,
Ba) з водою.
2Na + 2H2O = 2NaOH + H2 ↑
•Для технічного одержання NaOH і KOH
широко використовують спосіб електролізу
водних розчинів NaCl і KCl
19.
Хімічні властивості основ1. Взаємодія основ з кислотними оксидами.
2. Взаємодія основ з кислотами.
20.
3. Взаємодія лугів з амфотерними оксидами.4. Взаємодія лугів з амфотерними
гідроксидами.
5. Взаємодія лугів з солями.
21.
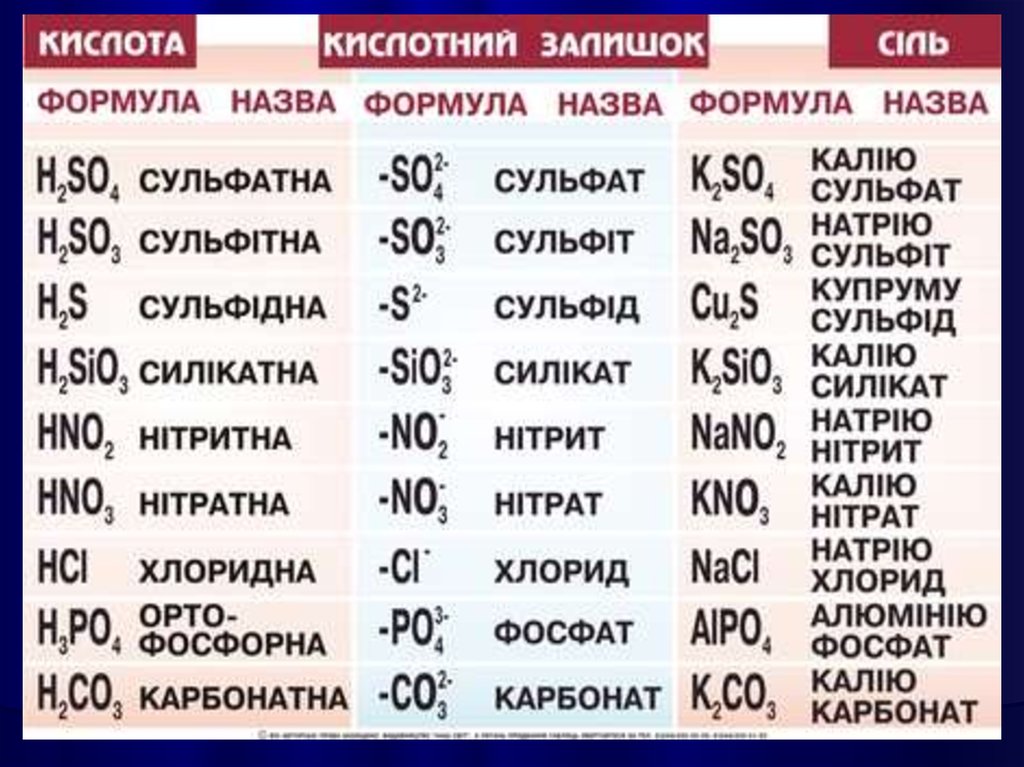
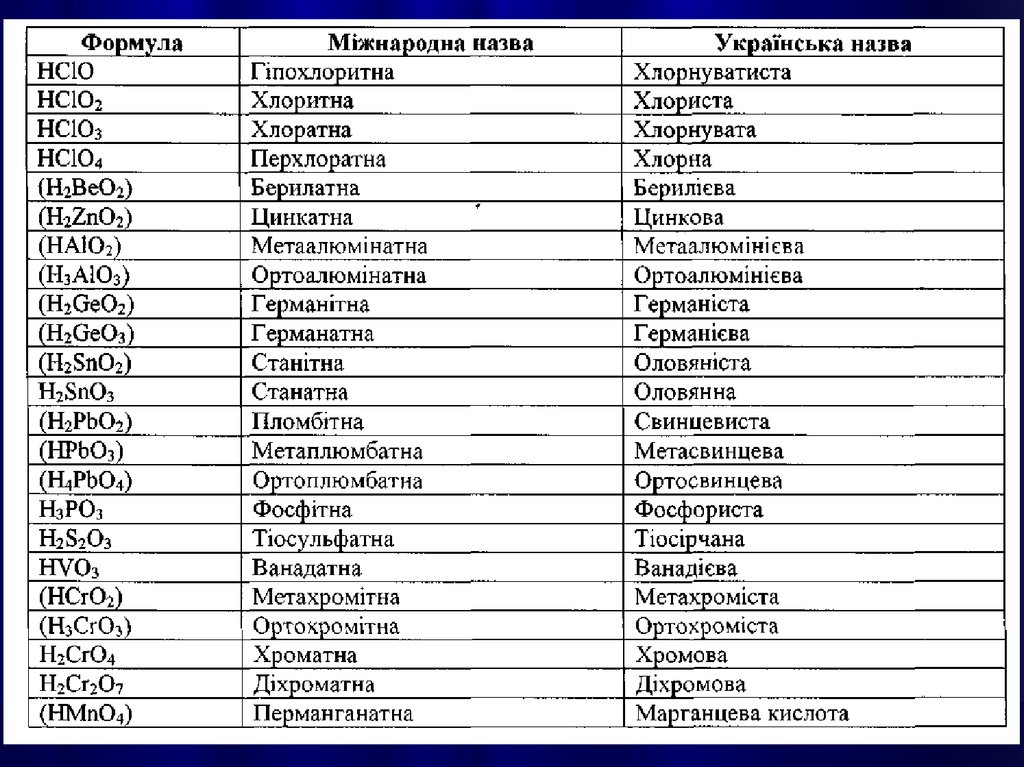
КИСЛОТАМИназивають
сполуки, які містять атоми
Гідрогену, здатні
заміщуватися на метал з
утворенням солей.
22.
23.
24.
25.
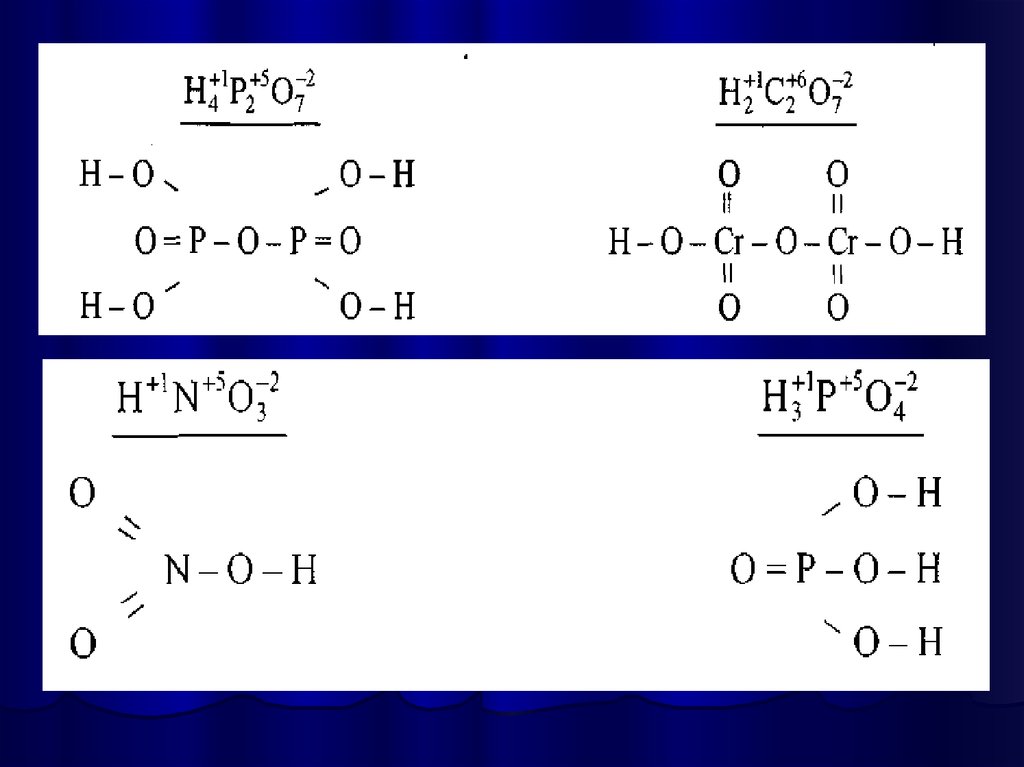
Написання графічної формули кислотипочинають з кислотоутворюючого елементу,
потім справа від нього пишуть стільки груп —
ОН, яка основність кислоти. Решту атомів
Оксигену записують зліва, з'єднуючи їх з
кислотоутворюючим атомом подвійними
зв'язками.
26.
27.
28.
Кислоти можна добувати різними способами.1. Безпосереднім сполученням ангідридів з
водою:
• SO3 + Н2О = Н2SO4
• N2O5 + Н2О = 2HNO3
2. Взаємодією кислот з солями. Цим способом
можна користуватися тоді, коли одержувана
кислота є леткою або нерозчинною.
•Н2SO4 + 2NaCl = Na2SO4 + 2HCl ↑ (при
нагріванні)
•H2SO4 + Na2SiO3 = Na2SO4 + H2SiO3 ↓
29.
3. Безкисневі кислоти можна одержувати як їхвитісненням з солей іншими кислотами, так і
безпосереднім сполученням елементів з
наступним розчиненням одержуваних кислот у
воді.
•FeS + 2HCl = FeCl2 + H2S ↑
•Н2 + Cl2 = 2HCl
30. Хімічні властивості кислот
1. Дисоціація кислот у водних розчинах.2. Взаємодія кислот з основними оксидами.
31.
3. Взаємодія кислот з основами (реакціянейтралізації).
4. Взаємодія кислот з амфотерними оксидами
та гідроксидами.
32.
5. Взаємодія кислот з солями6. Взаємодія кислот з металами.
33.
СОЛЯМИє
кристалічні
речовини, які можна рахувати
продуктами
повного
або
часткового зміщення атомів
Гідрогену в молекулах кислот
на
атоми
металів,
або
гідроксильних груп в основах
на кислотні залишки.
34.
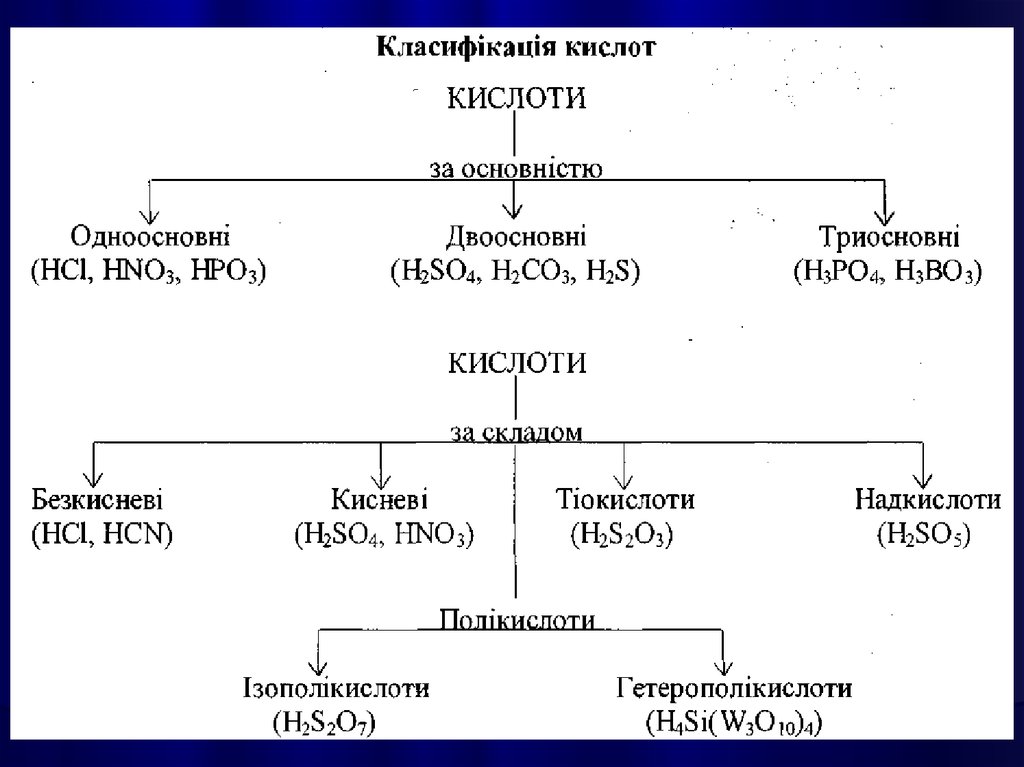
35.
Середні солі можна розглядати як продуктиповного заміщення атомів Гідрогену в молекулі
кислоти на метал, або гідроксильних груп в основах
на кислотні залишки.
Кислі солі – продукти неповного заміщення атомів
Гідрогену в кислоті на метал.
Основні солі – продукти неповного заміщення
гіроксогруп в основах на кислотні залишки.
Подвійними є солі, які утворюються при заміщенні
атомів Гідрогену в кислоти атомами різних металів,
або при заміщенні гідроксильних груп в основах
різними кислотними залишками.
Комплексні солі містять комплексний іон та іони
зовнішньої сфери.
36.
37.
Солі утворюються:1. При взаємодії кислот з основами
(реакції нейтралізації):
•2HNO3 + Ba(OH)2 = Ba(NO3)2 + 2H2O
2. При взаємодії кислот з основними
оксидами:
•2HCl + CuO = CuCl2 + H2O
3. При взаємодії кислот з амфотерними
оксидами:
•3H2SO4 + Al2O3 = Al2(SO4)3 + 3H2O
38.
4. При взаємодії кислот з солями:•3H2SO4 + Ca3(PO4)2 = 2H3PO4 + 3CaSO4
↓
5. При взаємодії кислот з металами:
•2HCl + Zn = ZnCl2 + H2 ↑
6. При взаємодії основ з кислотними
оксидами:
•2KOH + CO2 = K2CO3 + H2O
7. При взаємодії основ з солями:
•2NaOH + CuCl2 = 2NaCl + Cu(OH)2 ↓
39.
8. При взаємодії основних оксидів зкислотними:
•CaO + CO2 = CaCO3
9. При взаємодії солей:
•K2SO4 + BaCl2 = 2KCl + BaSO4 ↓
10. При взаємодії солей з металами:
•CuSO4 + Zn = ZnSO4 + Cu
11. При взаємодії металів з неметалами:
•Mg + Cl2 = MgCl2
40. Хімічні властивості солей
1. Дисоціація солей у водних розчинах.2. Гідроліз солей – взаємодія солі з водою:
41.
3. Взаємодія солей з лугами (розчиннимиосновами):
4. Взаємодія солей з кислотами:
5. Взаємодія між солями.
































 chemistry
chemistry








