Similar presentations:
Добування основних класів неорганчних сполук
1. Добування основних класів неорганчних сполук
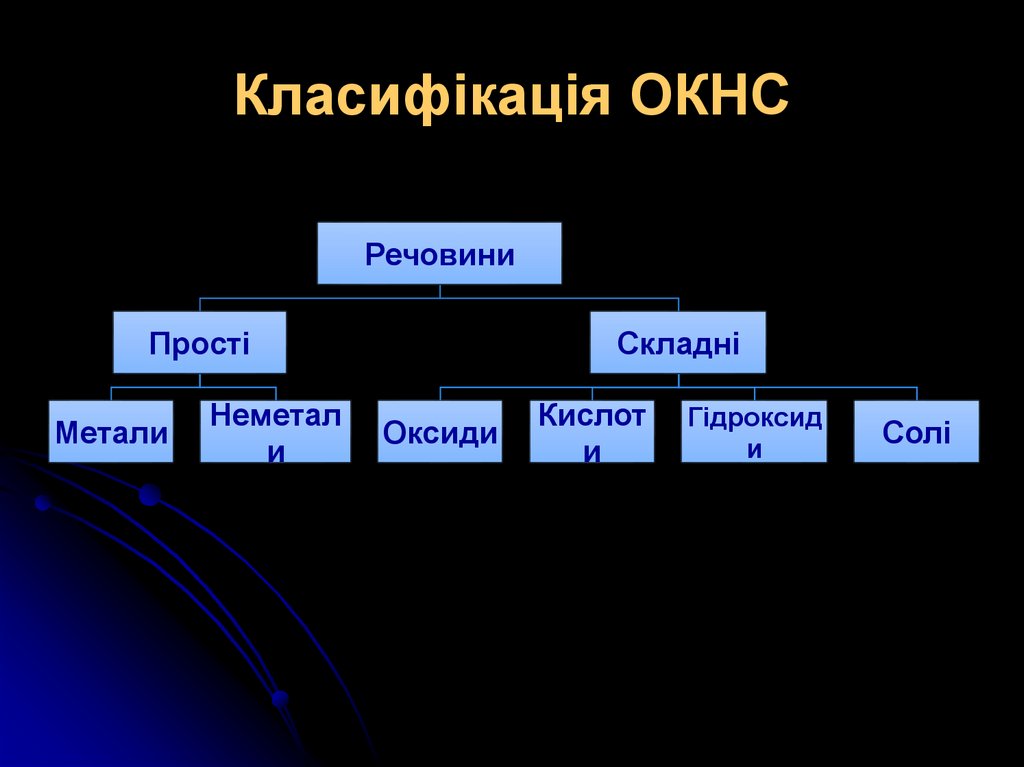
2. Класифікація ОКНС
РечовиниПрості
Метали
Неметал
и
Складні
Оксиди
Кислот
и
Гідроксид
и
Солі
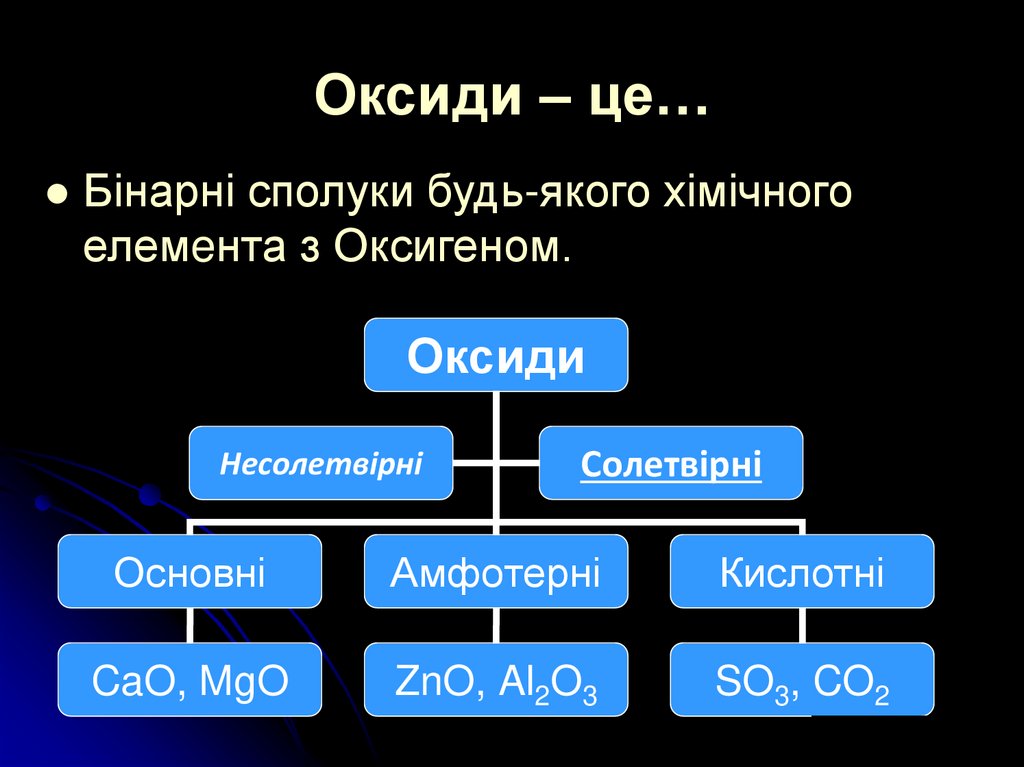
3. Оксиди – це…
Бінарні сполуки будь-якого хімічногоелемeнта з Оксигеном.
Оксиди
Несолетвірні
Солетвірні
Основні
Амфотерні
Кислотні
CaO, MgO
ZnO, Al2O3
SO3, CO2
4. Добування оксидів:
1. Реакція сполучення простої речовини зкиснем (за різних умов):
С + О2 = СО2;
4K + O2 = 2K2O.
2. Горіння складних речовин:
CH4 + 2O2 = CO2 + 2H2O.
3. Розклад при нагріванні оксигеновмісних
сполук:
CaCO3 = CaО + СО2↑;
2Сu(NO3)2 = 2CuO + 4NO2 ↑ + O2 ↑;
2Fe(OH)3 = Fe2O3 + 3H2O.
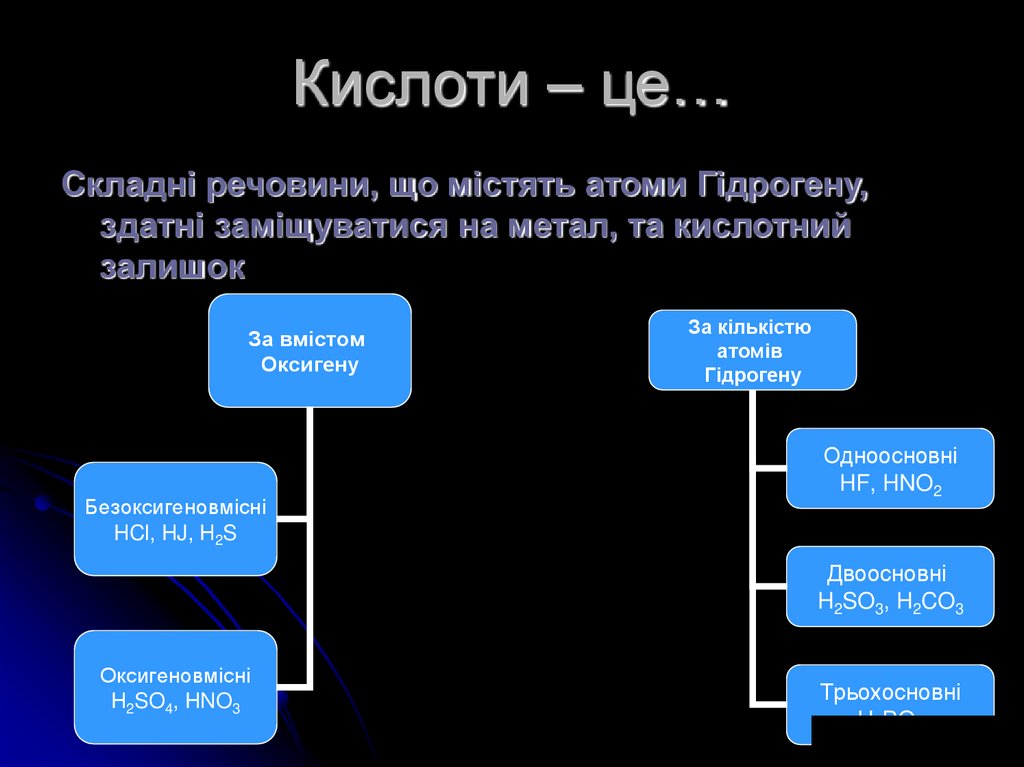
5. Кислоти – це…
Складні речовини, що містять атоми Гідрогену,здатні заміщуватися на метал, та кислотний
залишок
За вмістом
Оксигену
Безоксигеновмісні
HCl, HJ, H2S
За кількістю
атомів
Гідрогену
Одноосновні
HF, HNO2
Двоосновні
H2SO3, H2CO3
Оксигеновмісні
H2SO4, HNO3
Трьохосновні
H3PO4
6. Добування кислот:
1. При взаємодії кислотних оксидів з водою:SO3 + H2O = H2SO4;
N2O5 + H2O = 2HNO3.
2. Якщо оксиди не розчиняються у воді, то відповідні їм
кислоти добувають непрямим способом, а саме дією іншої
кислоти (найчастіше сульфатної) на відповідну сіль:
Na2SiO3 + H2SO4 = H2SiO3↓+ Na2SO4
3. Безкисневмісні кислоти добувають синтезом з водню і
неметалу з наступним розчиненням водневої сполуки у воді.
Це HCl, HBr, HJ, H2S:
H2 + Cl2 = 2HCl
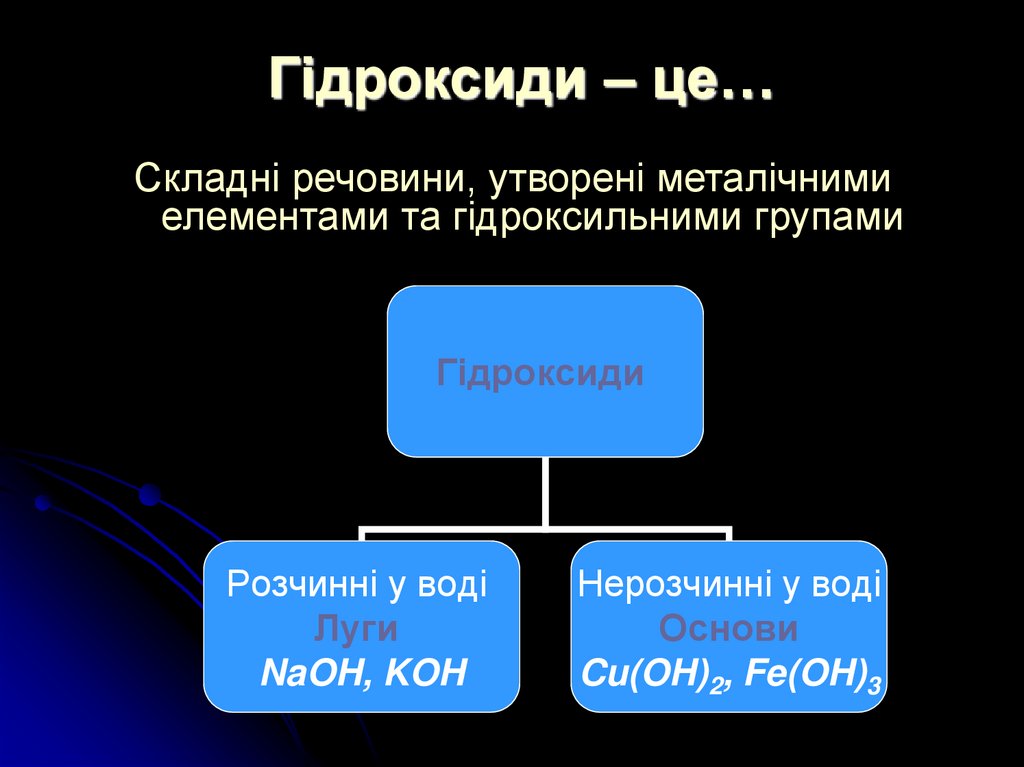
7. Гідроксиди – це…
Складні речовини, утворені металічнимиелементами та гідроксильними групами
Гідроксиди
Розчинні у воді
Луги
NaOH, KOH
Нерозчинні у воді
Основи
Cu(OH)2, Fe(OH)3
8. Добування гідроксидів:
1.При взаємодії металів або їх оксидів з водою:
2Na + 2H2O = 2NaOH + H2↑;
Na2O + H2O = 2NaOH.
2. Нерозчинні у воді основи добувають непрямим
способом, а саме: дією лугів на водні розчини
відповідних солей:
FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4;
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl.
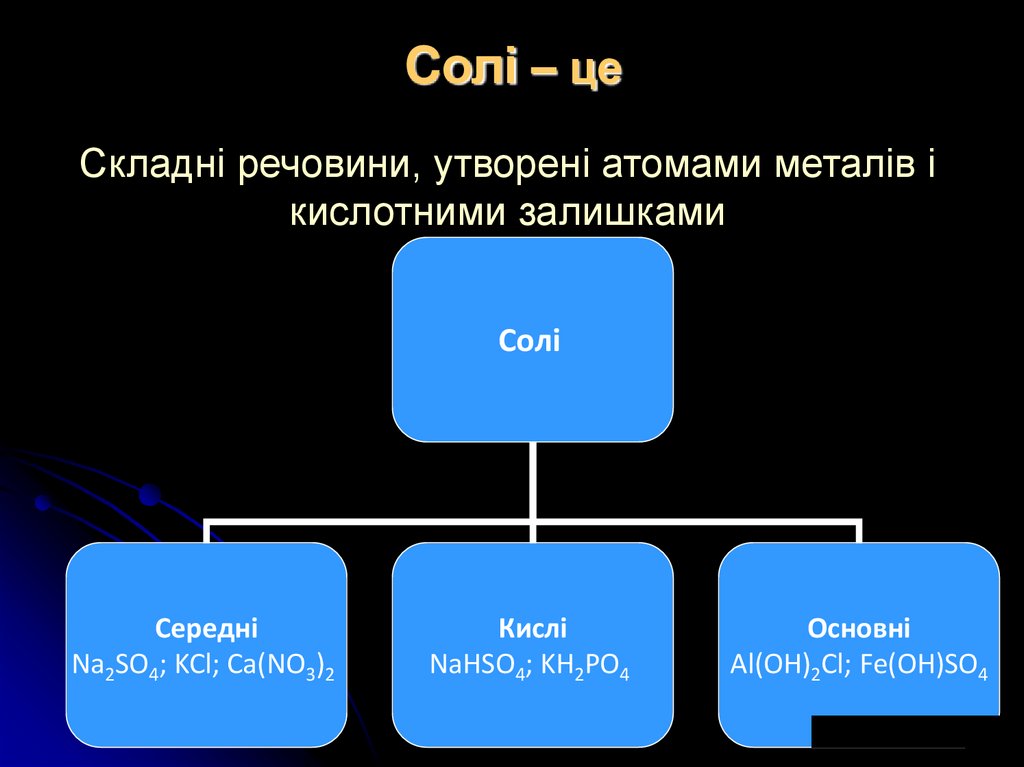
9. Cолі – це
Складні речовини, утворені атомами металів ікислотними залишками
Солі
Середні
Na2SO4; KCl; Ca(NO3)2
Кислі
NaHSO4; KH2PO4
Основні
Al(OH)2Cl; Fe(OH)SO4
10. Добування солей
1. Взаємодією кислот з основами (реакціянейтралізації) або амфотерними гідроксидами:
Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O;
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O.
2. Взаємодією кислот з основними або
амфотерними оксидами:
MgO + H2SO4 = MgSO4 + H2O;
ZnO + 2HNO3 = Zn(NO3)2 + H2O.
3. Взаємодія кислот з металами:
Zn + H2SO4 = ZnSO4 + H2↑.
4. Взаємодією кислот з іншими солями:
H2SO4 + BaCl2 = BaSO4 + 2HCl.
11. Добування солей
5. Взаємодія кислотних оксидів з основними абоамфотерними:
N2O5 + CuO = Cu(NO3)2;
SO3 + ZnO = ZnSO4.
6. Взаємодія кислотних оксидів з основними або
амфотерними гідроксидами:
P2O5 + 6NaOH = 2Na3PO4 + 3H2O;
N2O5 + Zn(OH)2 = Zn(NO3)2 + H2O.
7. Взаємодія кислотних оксидів із
солями:
CaCO3 + SiO2 = CaSiO3 + CO2↑.
12. Добування солей
8. Взаємодія сильних основ з амфотернимигідроксидами:
Ba(OH)2 + Pb(OH)4 = Ba[Pb(OH)6].
9. Взаємодія основ із солями:
FeSO4 + 2KOH = Fe(OH)2↓ + K2SO4.
10. Взаємодія солей із солями:
K3PO4 + 3CaCl2 = Ca3(PO4)2↓ + 6KCl.
11. Взаємодія солей з металами, що
мають вищу активність, ніж метали, які
входять до складу солей:
CuSO4 + Fe = Cu↓ + FeSO4.
13. Добування солей
12. Взаємодія металів з неметалами:Zn + Cl2 = ZnCl2.
13. Термічний розклад солей:
2KNO3 = 2KNO2 + O2↑;
2KClO3 = 2KCl + 3O2↑.









 chemistry
chemistry








