Similar presentations:
Физиология прокариот
1. ФИЗИОЛОГИЯ ПРОКАРИОТ
Лекция № 22. ОБМЕН ВЕЩЕСТВ И ЭНЕРГИИ У ПРОКАРИОТ
3. ОСОБЕННОСТИ МЕТАБОЛИЗМА МИКРООРГАНИЗМОВ
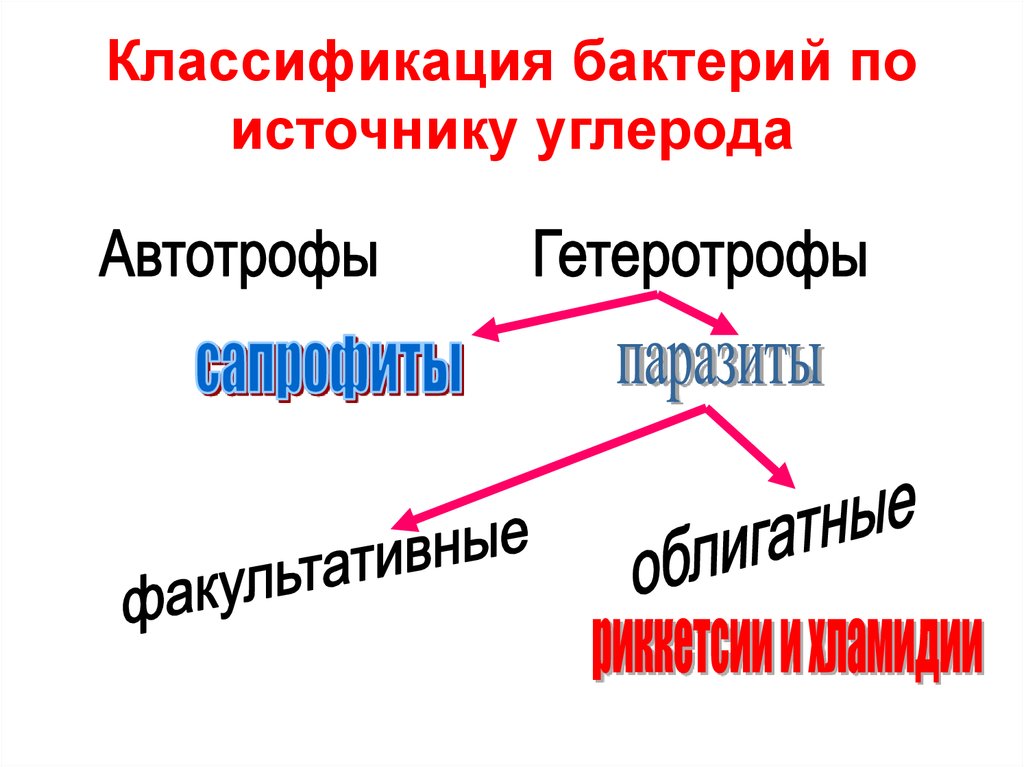
4. Классификация бактерий по источнику углерода
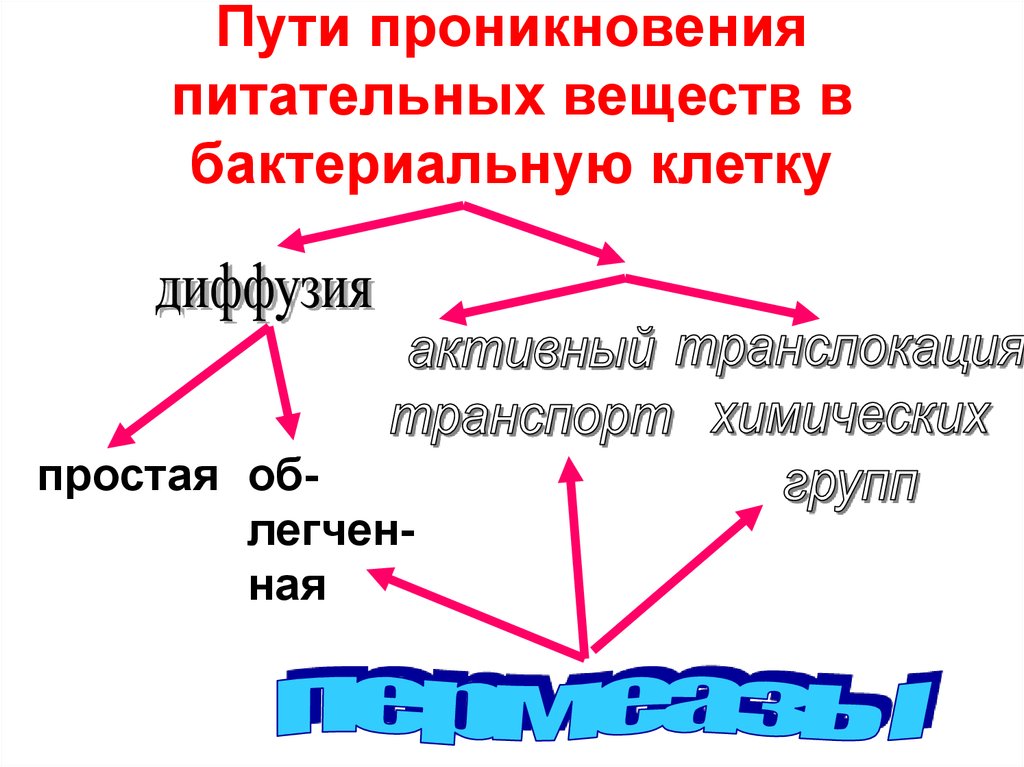
5. Пути проникновения питательных веществ в бактериальную клетку
простая облегченная6. Классификация бактерий по потребностям в факторах роста
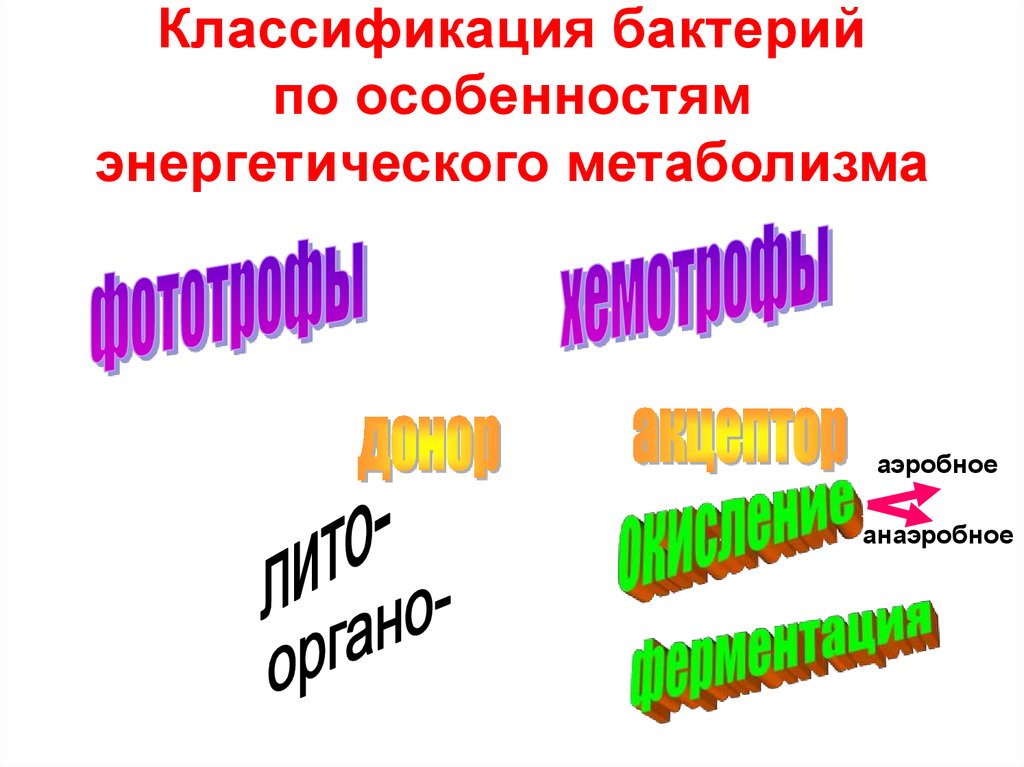
7. Классификация бактерий по особенностям энергетического метаболизма
аэробноеанаэробное
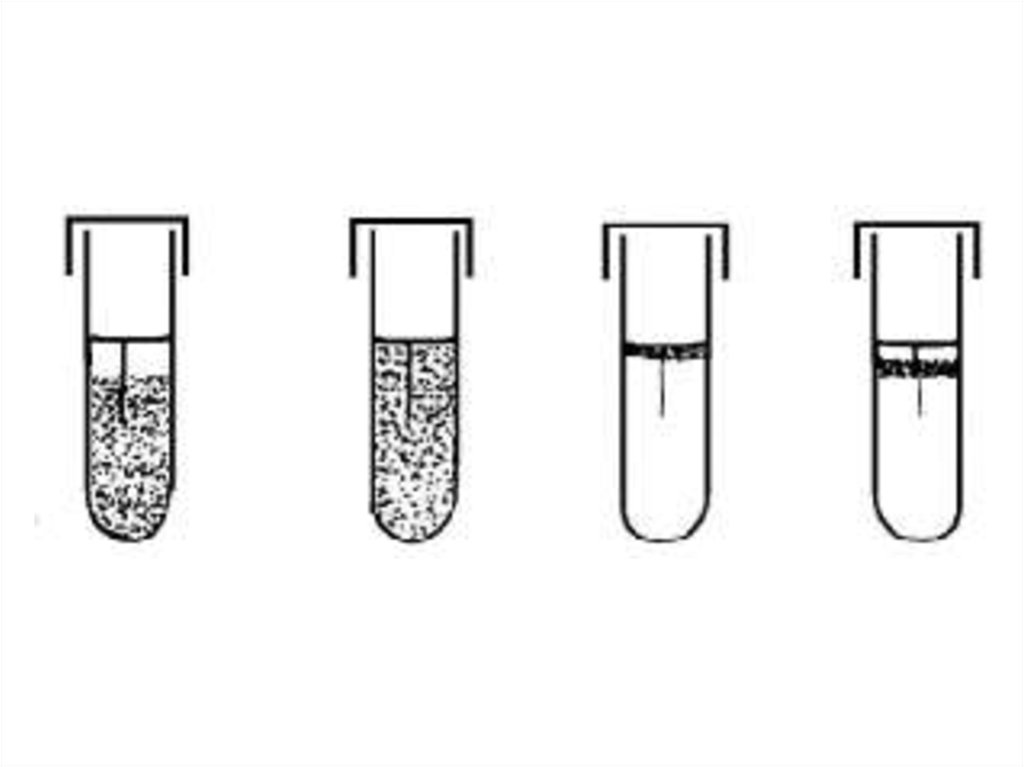
8. Классификация бактерий по отношению к кислороду воздуха
ГруппаОблигатные
аэробы
Наличие ферментов,
нейтрализующих
токсические продукты О2
Супероксид
дисмутаза
(О•→Н2О2)
Каталаза
(Н2О2 →
Н2О+ О2)
При
доступе
кислорода
воздуха
Без доступа
кислорода
воздуха
растут
не
растут
+
+
Микроаэрофилы
+
±
↓О2 –
растут
не растут
Капнофилы
+
±
↑СО2 растут
не растут
9.
АнаэробыНаличие ферментов,
нейтрализующих
токсические продукты О2
Супероксид
дисмутаза
(О•→Н2О2)
Каталаза
(Н2О2 →
Н2О+ О2)
При
доступе
кислорода
воздуха
Без доступа
кислорода
воздуха
Растут
Аэротолерантные
+
–
Не растут,
но не
погибают
Облигатные
–
–
Погибают
Растут
Факультативные
(б-во
бактерий)
+
+
Растут
Растут
10.
11. Особенности метаболизма риккетсий, хламидий, микоплазм
12. Классификация бактериальных ферментов
13. РАЗМНОЖЕНИЕ БАКТЕРИЙ И ПРИНЦИПЫ ИХ КУЛЬТИВИРОВАНИЯ
14. Способы размножения бактерий
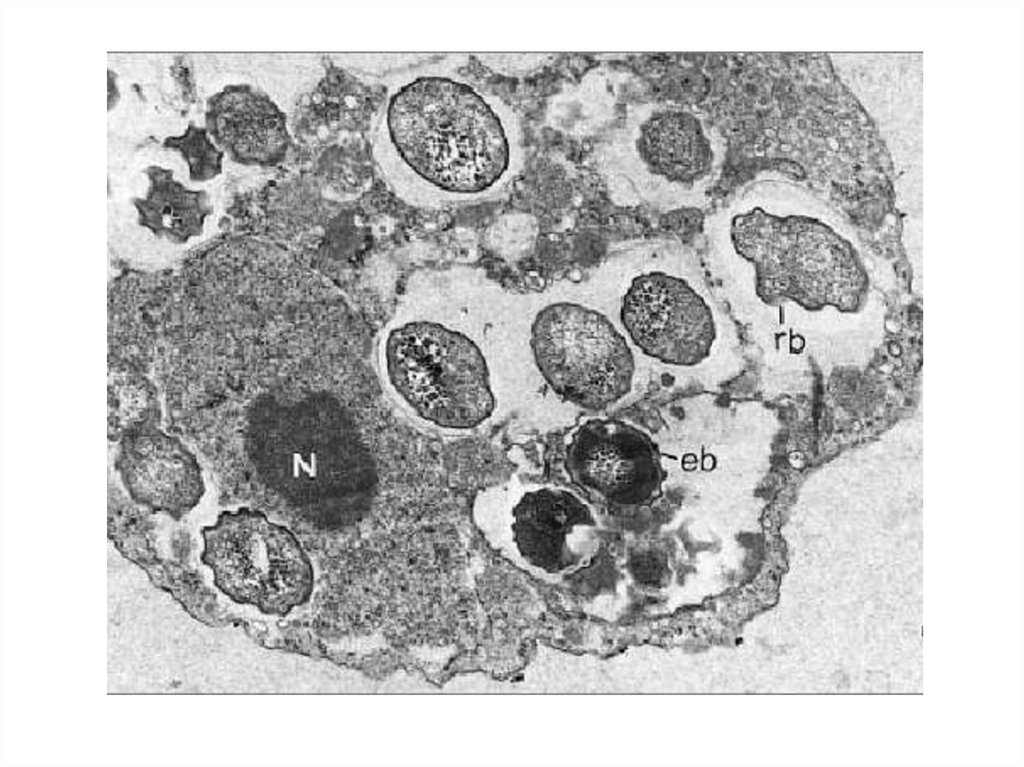
15. Цикл развития хламидий
СтадияФункция
Элементарной тельце
Инфекционная (проникновения в
клетку-хозяина путем
инвагинации места адсорбции)
Ретикулярное
(инициальное) тельце
Репродуктивная (размножение
бинарным делением →
формирование
цитоплазматического включения
– микроколонии)
Промежуточное тельце
Переходная форма от
ретикулярного тельца вновь к
элементарному тельцу
16.
17.
18. Культивирование микроорганизмов
Методкультивирования
In vivo:
•Культура клеток
•Птичий эмбрион
•Организм животного
In vitro:
•Искусственные
питательные среды
Микроорганизмы
Облигатные паразиты:
•Риккетсии
•Хламидии
•Вирусы
Почти все патогенные
бактерии
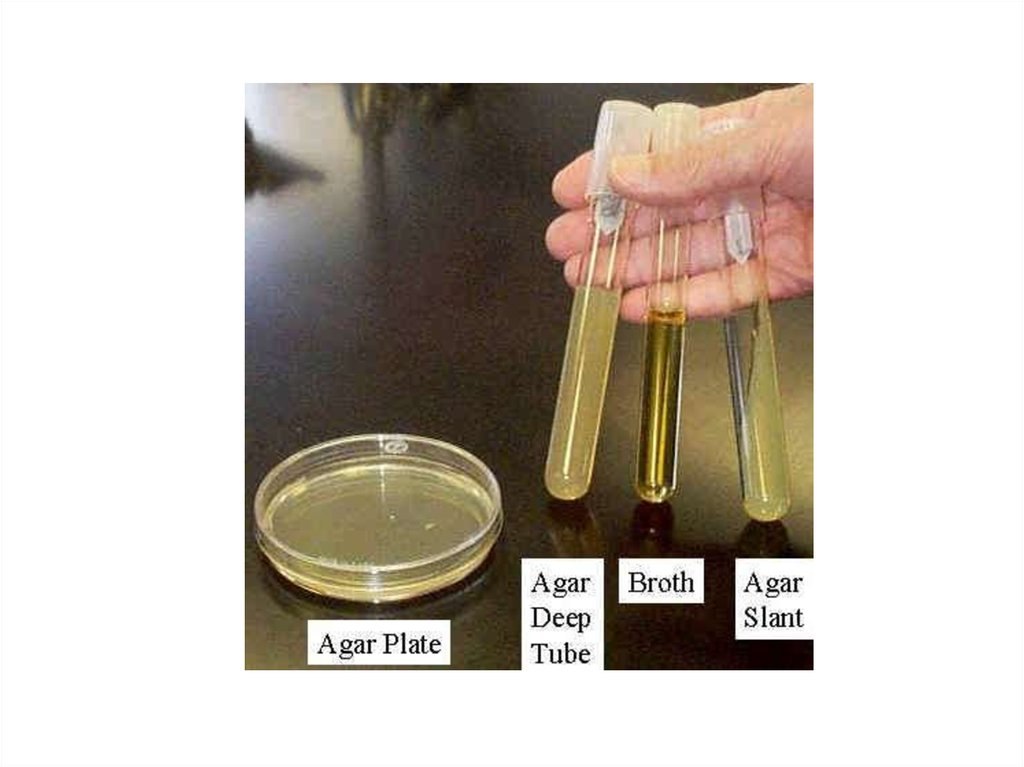
19. Классификация искусственных питательных сред
• По консистенции– Жидкие
– Полужидкие (0,5% агара)
– Плотные (1,5-2% агара, свернутые)
20. Классификация искусственных питательных сред
• По составу– Натуральные
• простые
–
–
–
–
мясо-пептонный агар и бульон (МПА и МПБ)
желатин
молоко
кусочки овощей
• сложные
простые + добавка
– Синтетические
21. Классификация искусственных питательных сред
• По назначению– Основные
• Универсальные (простые натуральные)
• Специальные (сложные натуральные)
– Элективные (селективные)
– Дифференциально-диагностические
– Консервирующие
22.
• Агар – полисахарид, добываемый из морскихводорослей определенных видов; используется для
уплотнения питательных сред в бактериологии по
такому же алгоритму, как в быту крахмал или
желатин
• Свернутые питательные среды – это плотные среды,
содержащие сыворотку крови или обогащенные
белком (яичные, например), которые уплотняются
при прогревании в процессе стерилизации
• Натуральные среды готовятся на основе отваров,
экстрактов мяса, рыбы, овощей и др. натуральных
продуктов
• Простые натуральные среды представляют собой
такие отвары или экстракты
• Сложные натуральные среды получают путем
добавления в простые натуральные среды любого
вещества (красителя, сахара, антибиотика, крови и
т.д.)
23.
• Синтетические питательные среды получают,смешивая чистые химические вещества (как
правило, соли)
• Элективные (селективные, избирательные,
обогащения) питательные среды – это среды,
содержащие вещества, используемые бактериями
определенных видов и не благоприятствующие или
даже препятствующие росту других бактерий
• Дифференциально-диагностические питательные
среды – это среды, позволяющие отличать одни виды
бактерий от других по их ферментативной активности
или культуральным свойствам
• Консервирующие питательные среды – это среды,
используемые, например, при доставке
патологического материала в бактериологическую
лабораторию – так как метаболическая активность на
них бактерий сводится практически к нулю, то
бактерии сохраняются, но не размножаются
24.
25. Требования к условиям культивирования бактерий
• Питательные потребности– простые – растут на универсальных питательных
средах
– сложные – растут на специальных питательных
средах
• Температура культивирования
– ≈ 37°С – мезофилы
– 6 – 20°С – психрофилы
– 50 – 60°С – термофилы
26. Требования к условиям культивирования бактерий
• Реакция среды (рН)– кислая – ацидофилы
– нейтральная – большинство патогенных бактерий
– щелочная – алкалифилы
• Условия аэрации
– не принимают во внимание – факультативные
анаэробы
– ↓ О2 – микроаэрофилы
– ↑ СО2 – капнофилы
– без доступа воздуха – анаэробы
– с обязательным доступом воздуха – облигатные
аэробы
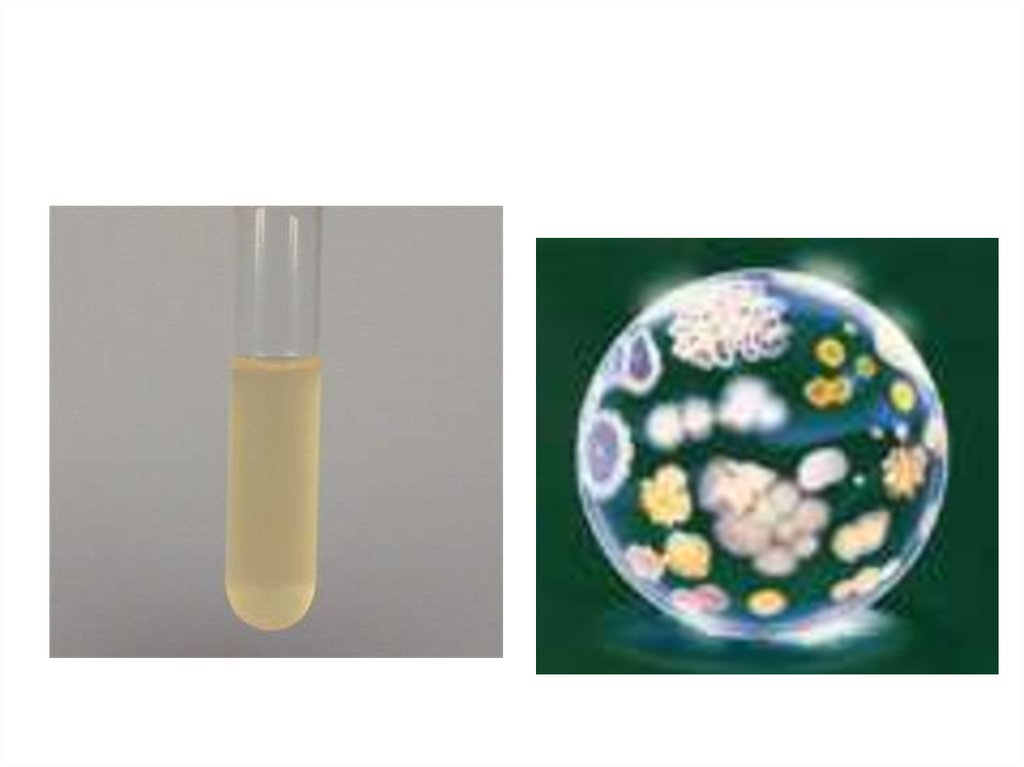
27. Характер роста бактерий на искусственных питательных средах
• Жидкие питательный среды– диффузная муть – большинство бактерий
– плёнка – «коховские бактерии»
– придонный или пристеночный рост –
стрептококки
– плёнка со спускающимися вниз
«сталактитами» – Yersinia pestis
28. Характер роста бактерий на искусственных питательных средах
• Плотные питательные среды– S-форма колоний («гладкая»)
• кокки
• Г– палочки, кроме Yersinia pestis
– R-форма колоний («шероховатая»)
• Г+ палочки
• Yersinia pestis
29.
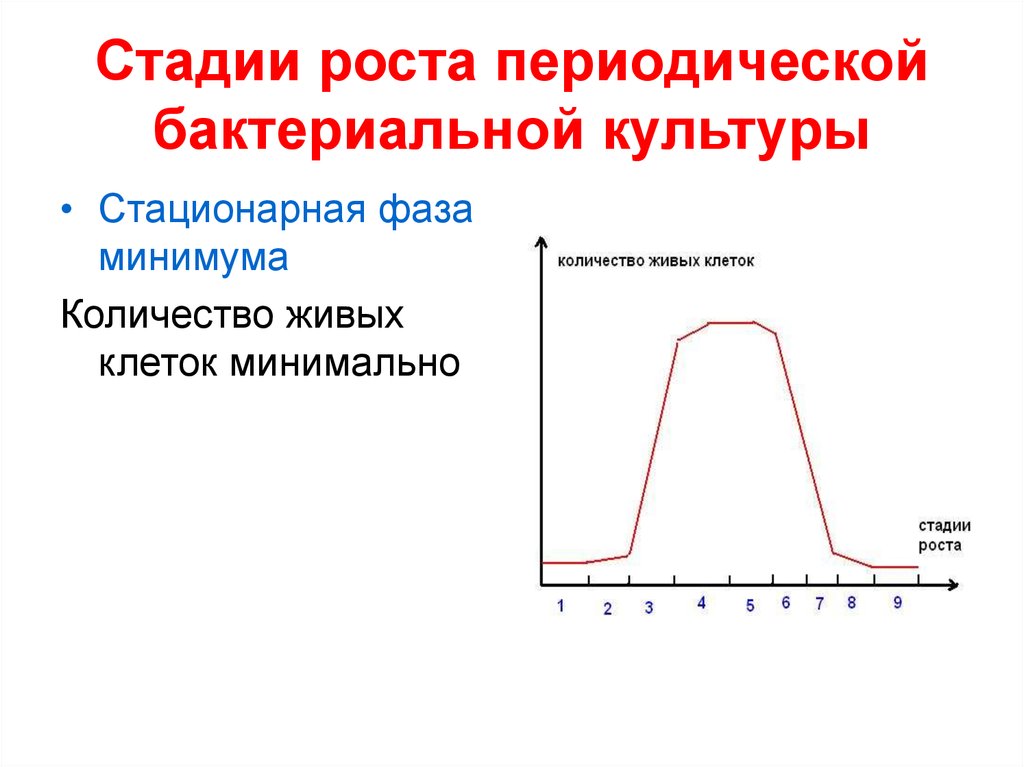
30. Стадии роста периодической бактериальной культуры
• Лаг-фазаДеления клеток не
происходит
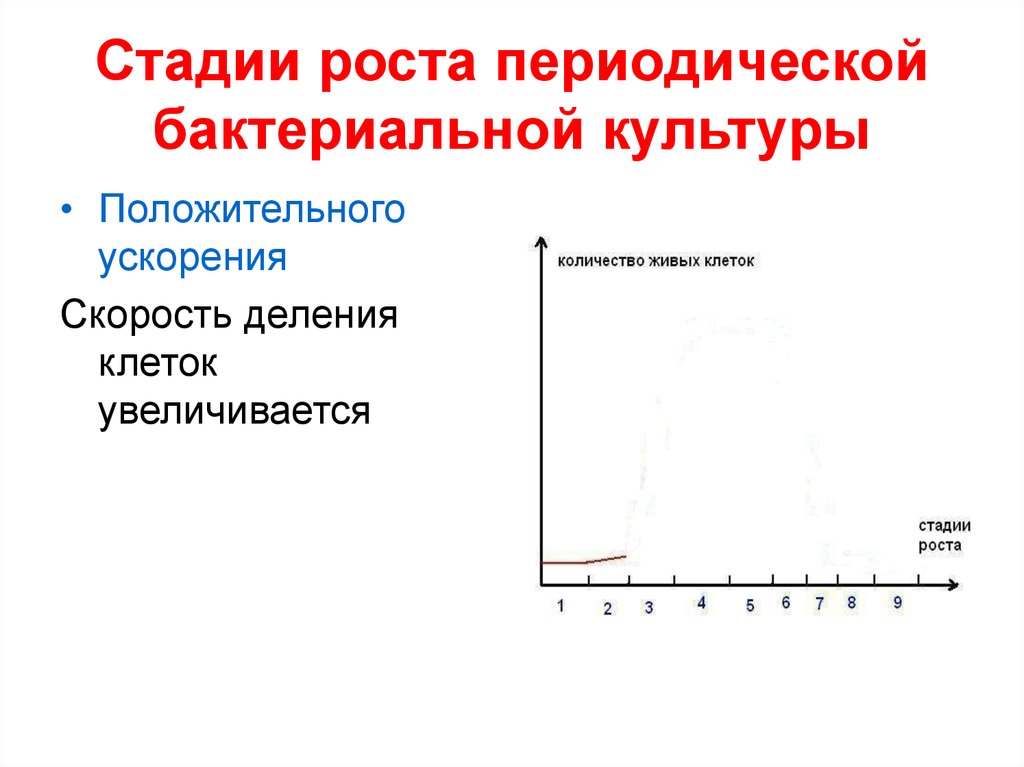
31. Стадии роста периодической бактериальной культуры
• Положительногоускорения
Скорость деления
клеток
увеличивается
32. Стадии роста периодической бактериальной культуры
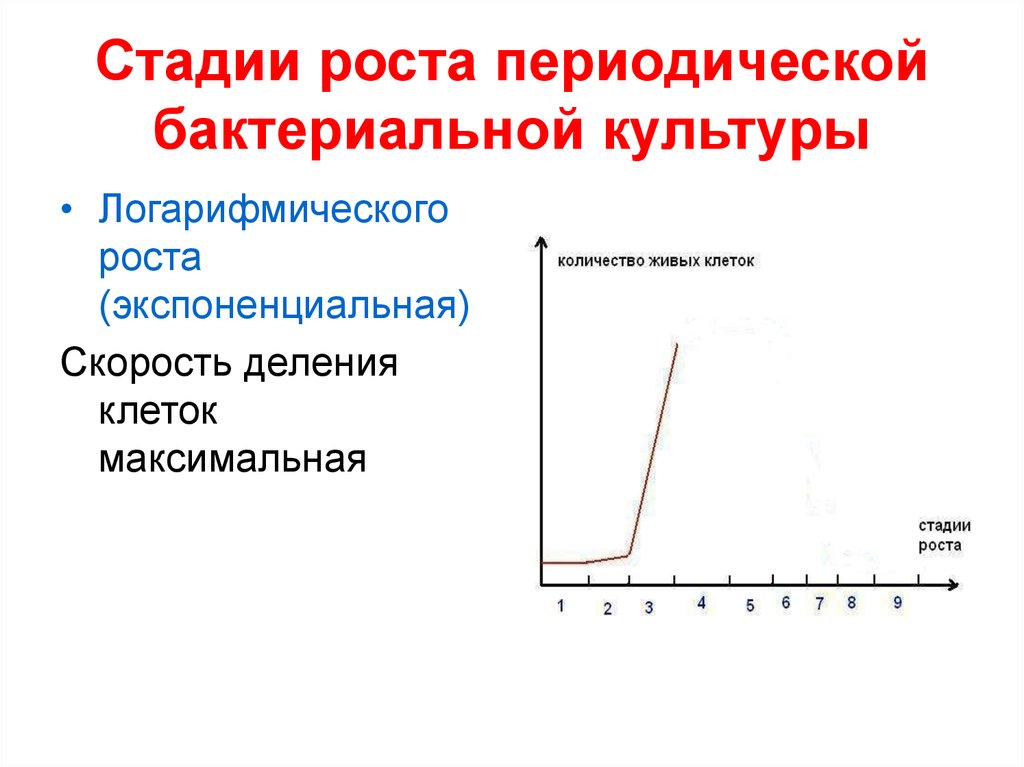
• Логарифмическогороста
(экспоненциальная)
Скорость деления
клеток
максимальная
33. Стадии роста периодической бактериальной культуры
• Отрицательногоускорения
Скорость деления
клеток снижается
34. Стадии роста периодической бактериальной культуры
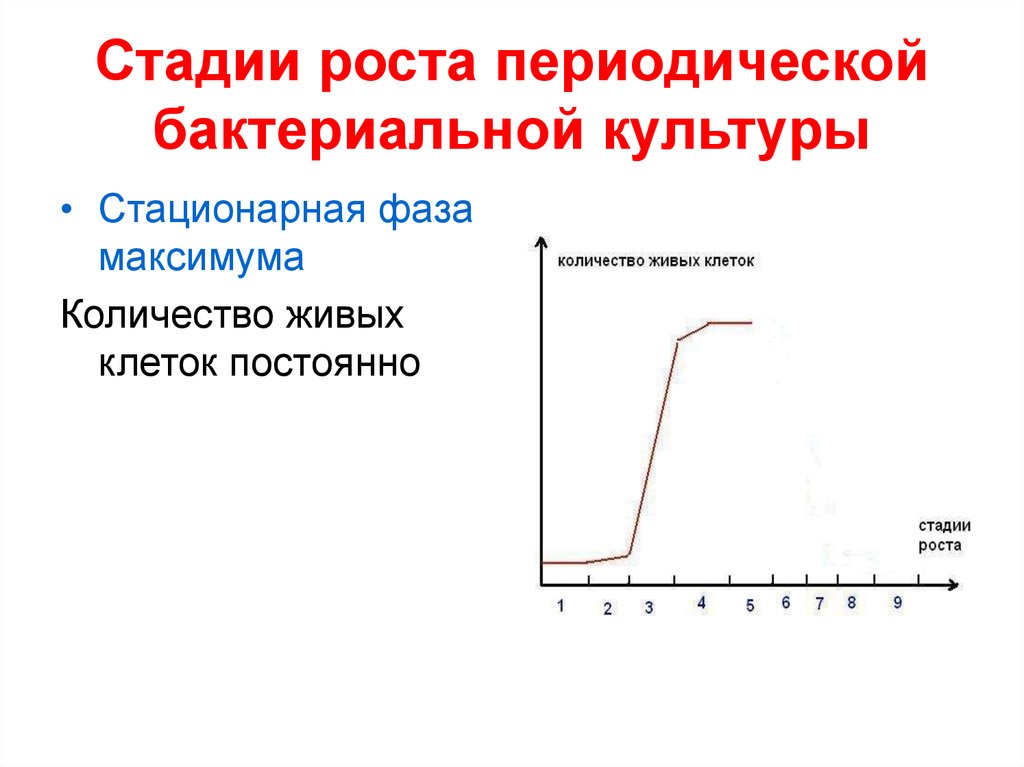
• Стационарная фазамаксимума
Количество живых
клеток постоянно
35. Стадии роста периодической бактериальной культуры
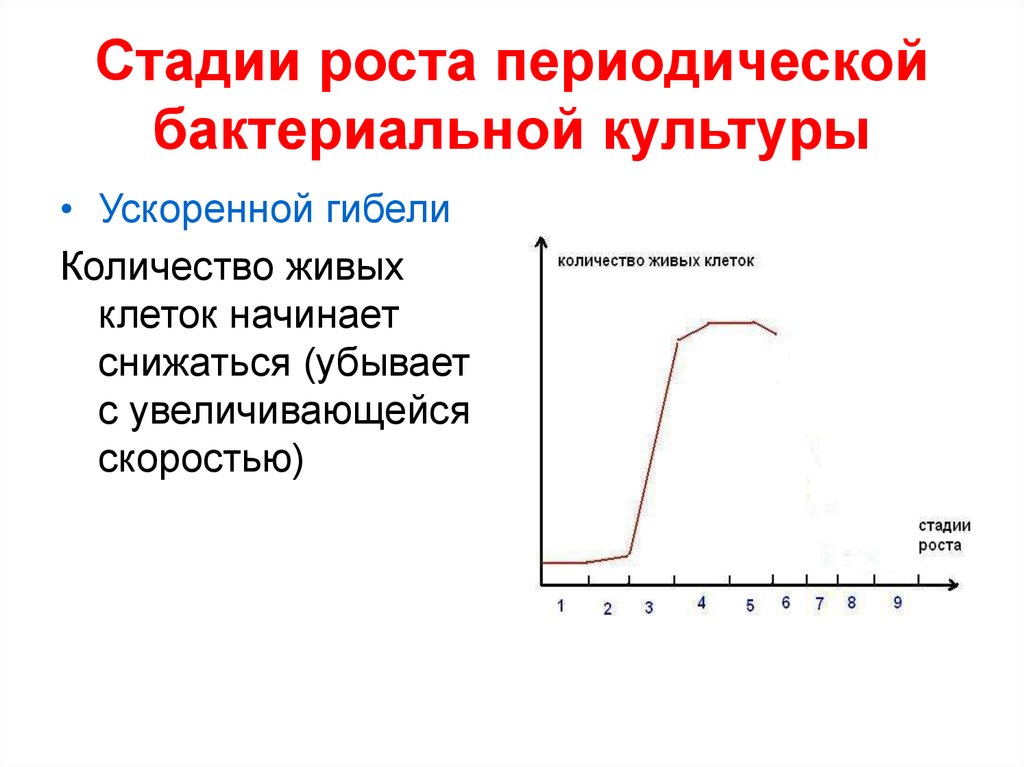
• Ускоренной гибелиКоличество живых
клеток начинает
снижаться (убывает
с увеличивающейся
скоростью)
36. Стадии роста периодической бактериальной культуры
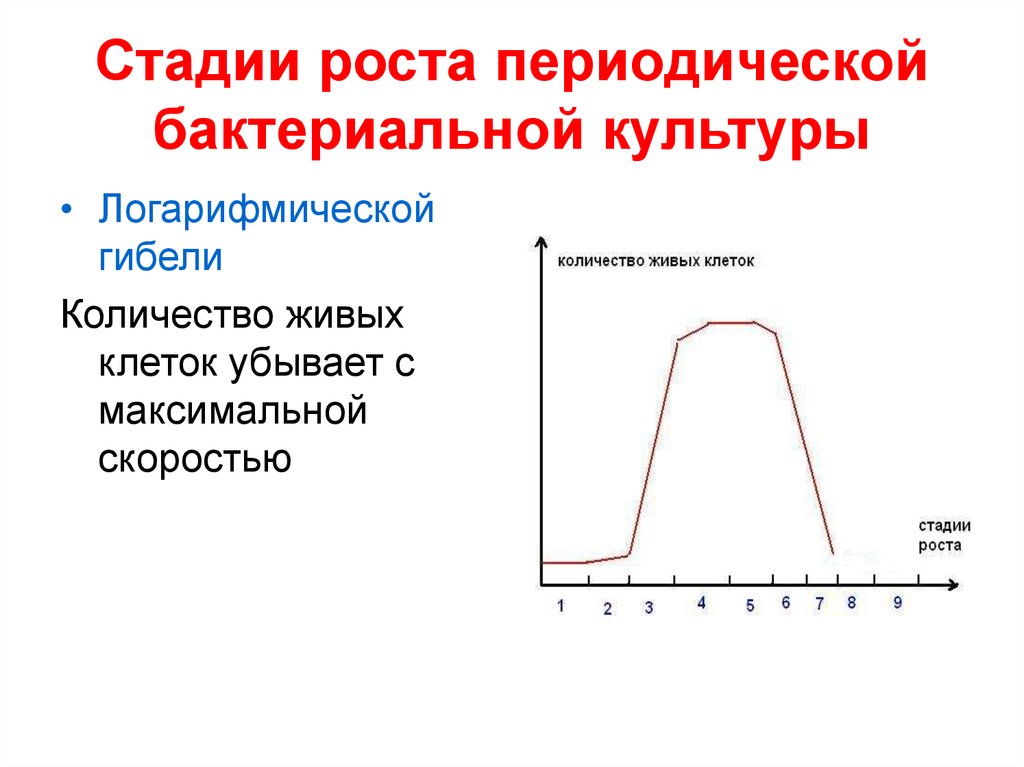
• Логарифмическойгибели
Количество живых
клеток убывает с
максимальной
скоростью
37. Стадии роста периодической бактериальной культуры
• Уменьшенияскорости гибели
Количество живых
клеток убывает с
уменьшающейся
скоростью
38. Стадии роста периодической бактериальной культуры
• Стационарная фазаминимума
Количество живых
клеток минимально
39. Методы создания анаэробных условий для культивирования бактерий
40. Физические
• культивирование в анаэростате (выкачиваетсявоздух) или аппарате Киппа (замещается инертным
газом, например азотом)
• трубки Виньяль-Вийона (смешивание с
расплавленной и охлаждённой питательной средой с
её последующим застыванием – глубинное
культивирование)
• засев уколом в высокий столбик (полужидкой среды)
• культивирование под слоем масла
• регенерация жидкой питательной среды перед
засевом (кипячение с последующим быстрым
охлаждением)
• метод Перетца (в чашку Петри заливается
охлаждённая среда, смешанная с культурой, на
поверхность – предметное стекло, сняв которое
можно легко добраться до выросшей культуры)
41. Химические
• в замкнутом объёме протекаетхимическая реакция с поглощением
кислорода
– метод Аристовского (сыпучие ингредиенты)
– метод Омелянского (жидкие ингредиенты)
• включение в питательную среду
редуцирующих веществ (связывают
растворённый в среде кислород)
– глюкоза
– тиогликолевая кислота и др.
42. Биологические
• метод Фортнера (в замкнутом объёмекультивируются анаэробы и жадный
аэроб – после прекращения роста
которого в безкислородной среде
начинают расти анаэробы)
43. Метод Китта-Тароцци
• среда Китта-Тароцци– МПБ с глюкозой
– на поверхности – масло
– на дне – кусочки печени
44. КУЛЬТУРАЛЬНЫЙ МЕТОД ИССЛЕДОВАНИЯ
45. Принципиальная схема культурального метода исследования: предварительный этап
Выделение спороносных бактерий• аэробы и факультативные анаэробы
– отсутствует
• анаэробы (строгие и аэротолерантные)
– микроскопия мазка из ПМ
– засев ПМ на среду Китта-Тароцци
• прогретого при 80 С 15 минут
• нативного
46. I этап
Получение изолированного роста (чистойкультуры)
• аэробы и факультативные анаэробы
– микроскопия мазка из ПМ
– засев ПМ на пластинчатый агар петлей (штрихом)
или шпателем (по Дригальскому) для получения
изолированного роста
• анаэробы (строгие и аэротолерантные)
– микроскопия мазка из смешанной культуры
– засев для получения изолированного роста (по
Цейсслеру или по Вейнбергу)
47.
48. II этап
Накопление чистой культуры• аэробы и факультативные анаэробы
– изучение колоний (см. практикум Павловича)
– микроскопия мазка из колонии
– РА на стекле с поливалентными сыворотками
(ориентировочная РА)
– засев колонии на скошенный МПА
• анаэробы (строгие и аэротолерантные)
– изучение колоний
– микроскопия мазка из колонии
– засев колонии на среду Китта-Тароцци
49. III этап
Окончательная идентификация чистойкультуры
• аэробы и факультативные анаэробы
– микроскопия мазка из чистой культуры
– РА на стекле с моновалентными сыворотками
(серологическая идентификация вида и серовара)
– изучение биохимических свойств
– изучение вирулентности
– определение эпидемиологических маркеров
• анаэробы (строгие и аэротолерантные)
– микроскопия мазка из чистой культуры
– изучение биохимических свойств
– выявление и идентификация экзотоксина
50. Культуральные признаки бактерий
питательные потребности
оптимальная питательная среда
температура культивирования
условия аэрации
скорость роста
характер роста на жидких и плотных
питательных средах
51. Изучение биохимических свойств бактерий (на примере энтеробактерий): I этап
• Питательные среды, методыДифференциально-диагностические среды:
– Эндо
– Левина
– Плоскирева
• Принцип действия
утилизация содержащейся в среде лактозы
сдвиг рН в кислую сторону
изменение цвета колонии
52. II этап
• Питательные среды, методыСреды накопления и первичной дифференциации:
– Рессела (глюкоза+лактоза)
– Клиглера (глюкоза+лактоза+Н2S)
– Олькеницкого (глюкоза+лактоза+Н2S+мочевина)
• Принцип действия
– утилизация глюкозы изменение цвета только
столбика
– утилизация лактозы изменение цвета и
столбика и косяка
– выработка Н2S почернение
– утилизация мочевины покраснение
53.
54. III этап: изучение сахаролитических свойств
• Питательные среды, методыСреды Гисса (в коротком ряду Гисса – с лактозой,
глюкозой, маннитом, мальтозой, сахарозой)
• Принцип действия
утилизация содержащегося в среде углевода
сдвиг рН в кислую сторону
изменение цвета среды
55. III этап: изучение протеолитических свойств
• Питательные среды, методы–
–
–
–
желатин
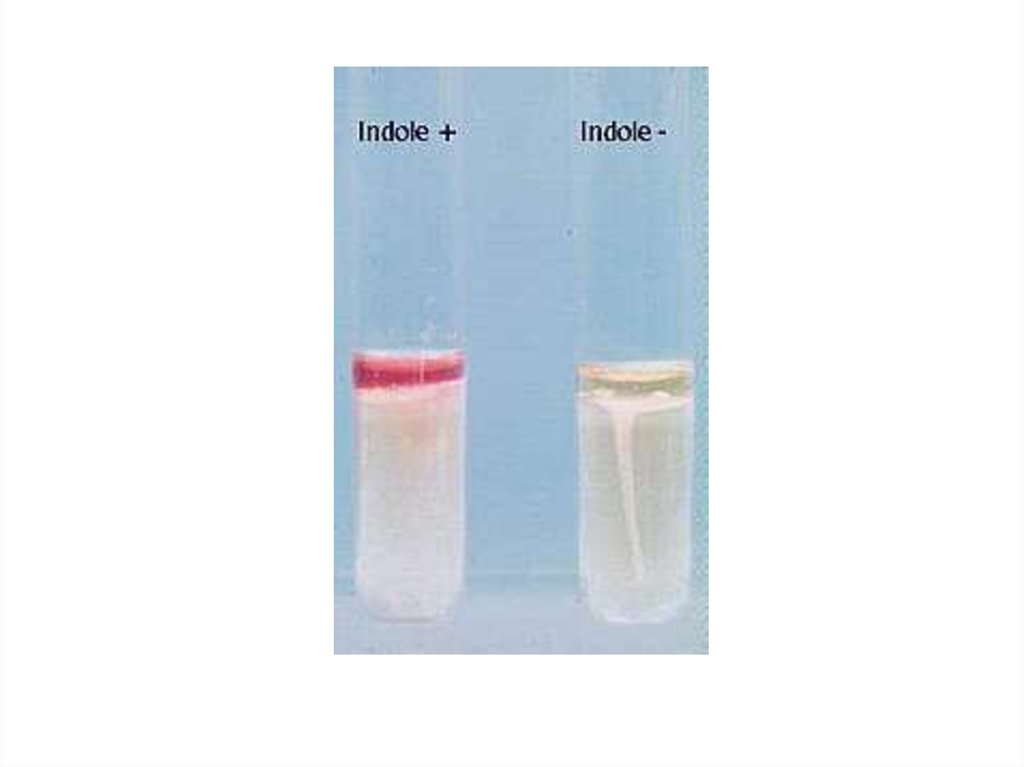
продукция индола
продукция аммиака
продукция Н2S
• Внешний эффект при положительной пробе
–
–
–
–
разжижение
покраснение индикаторной бумажки
посинение лакмусовой бумажки
см. среды Клиглера и Олькеницкого
56.
57. III этап: определение наличия отдельных ферментов
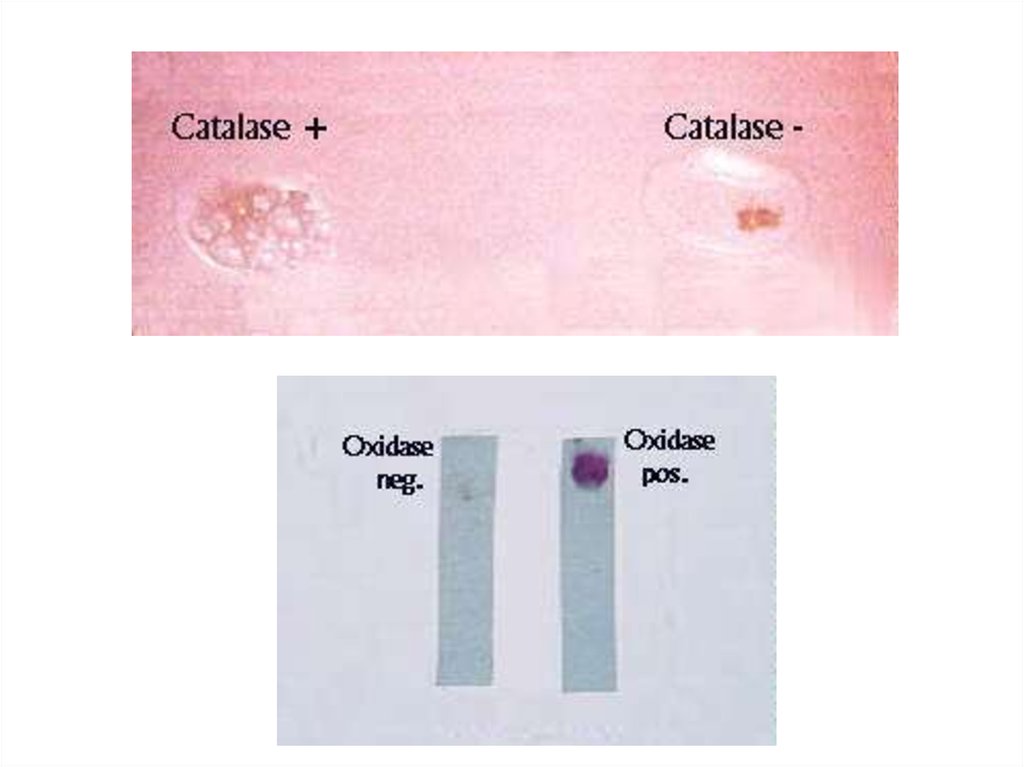
• Питательные среды, методы– каталазная активность
– оксидазная активность
• Внешний эффект при положительной
пробе
– газообразование при смешивании культуры
с перекисью водорода
– покраснение индикаторной бумажки












































 biology
biology








