Similar presentations:
Закон «Об образовании» глава II, статья 9. 6.1
1.
2.
Закон «Об образовании» глава II, статья 96.1.
Основные
профессиональные
образовательные
программы начального профессионального, среднего
профессионального
и
высшего
профессионального
образования обеспечивают реализацию федерального
государственного образовательного стандарта с учетом типа
и вида образовательного учреждения, образовательных
потребностей и запросов обучающихся и включают в себя
учебный план, рабочие программы учебных курсов,
предметов, дисциплин (модулей) и другие материалы,
обеспечивающие воспитание и качество подготовки
обучающихся,
а
также
программы
учебной
и
производственной практики, календарный учебный график
и методические материалы, обеспечивающие реализацию
соответствующей образовательной технологии.
3.
Рабочая программа учебной дисциплины - документ,являющийся частью ОПОП ОУ и предназначенный для
реализации требований ФГОС НПО/СПО
Примерные программы не сковывают творческую
инициативу преподавателей и предоставляют широкие
возможности для реализации различных подходов к
построению учебного курса при сохранении единого
образовательного пространства.
4.
5.
6.
Рабочая программа разработана на основе:1)Федерального
компонента государственного образовательного стандарта
среднего (полного) общего образования по специальности:
270802 «Строительство и эксплуатация зданий и сооружений»
2) Примерной программы учебной дисциплины Химия для профессий
начального профессионального образования и специальностей среднего
профессионального образования Габриелян Олег Саркисович, Остроумов Игорь
Геннадиевич ФГУ «ФИРО» Минобрнауки России, 2008г
3)Выписки часов из рабочего учебного плана по специальности:
270802 «Строительство и эксплуатация зданий и сооружений»
Рабочая программа составлена в соответствии с нормативными
документами для написания рабочей программы по общеобразовательным
дисциплинам:
- приказом Министра образования РФ от 30.06.1999 № 56 «Об утверждении
обязательного минимума содержания среднего (полного) общего образования»;
В соответствии с рекомендациями ГОУ ДПО УМЦ ПО от 08.07.2011г по
разработке рабочих программ учебных дисциплин по профессиям НПО и
специальностям СПО
7.
Рабочая программа учебнойдисциплины должна содержать:
титульный лист;
паспорт рабочей программы;
структуру и содержание учебной
дисциплины;
условия реализации программы
учебной дисциплины;
контроль и оценку результатов
освоения учебной дисциплины;
8.
1. Паспорт рабочей программы включает в себя:1.1 Область применения программы;
1.2 Место дисциплины в структуре ОПОП;
1.3 Цели и задачи - требования к результатам
освоения дисциплины;
1.4 Использование вариативной части ОПОП;
1.5 Рекомендуемое количество часов на освоение
программы дисциплины.
9.
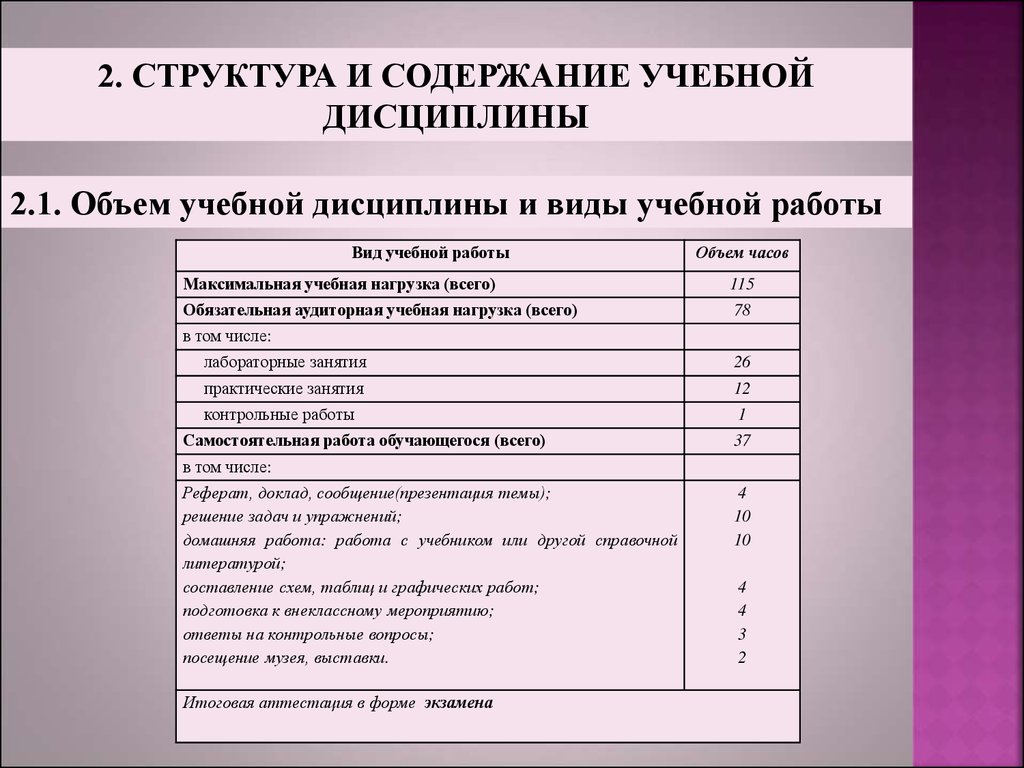
2. СТРУКТУРА И СОДЕРЖАНИЕ УЧЕБНОЙДИСЦИПЛИНЫ
2.1. Объем учебной дисциплины и виды учебной работы
Вид учебной работы
Объем часов
Максимальная учебная нагрузка (всего)
115
Обязательная аудиторная учебная нагрузка (всего)
78
в том числе:
лабораторные занятия
26
практические занятия
12
контрольные работы
1
Самостоятельная работа обучающегося (всего)
37
в том числе:
Реферат, доклад, сообщение(презентация темы);
решение задач и упражнений;
домашняя работа: работа с учебником или другой справочной
литературой;
составление схем, таблиц и графических работ;
подготовка к внеклассному мероприятию;
ответы на контрольные вопросы;
посещение музея, выставки.
Итоговая аттестация в форме экзамена
4
10
10
4
4
3
2
10.
Дидактическая единица — это «квант» содержаниядисциплины. Это может быть термин, определение,
понятие и т. п., подлежащее усвоению в процессе
изучения дисциплины.
Дидактический материал курса химии можно объединить в несколько
групп.
I г р у п п а – это теории
II г р у п п а – это законы
III г р у п п а – это химические понятия
IV г р у п п а – это методы химической науки.
V г р у п п а – это факты
VI г р у п п а – творческое наследие выдающихся ученых.
Дидактические единицы по темам
должны быть
направлены на приобретение обучающимися
умений,
знаний, и направлены на формирование общих компетенций
определенных ФГОС по учебной дисциплине.
K химическому содержанию дисциплины предъявляется ряд
дидактических требований (принципов), которые
необходимо соблюдать для успешного обучения студентов.
11.
- Принцип научности-Принцип доступности
-Принцип учета возрастных особенностей обучающихся.
- Принцип системности и систематичностии
-Принцип интегративности
-Принцип непрерывности и преемственности
-Принцип наглядности.
-Принцип сознательности и активности.
-Принцип комплексного подхода
-Принцип профильной направленности
12.
2.2 Тематический плани содержание учебной дисциплины ХИМИЯ
Наименование
разделов и тем
1
Введение
Содержание учебного материала, лабораторные и практические работы, Объём Уровень
самостоятельная работа обучающихся.
часов усвоения
2
3
4
1-2
Место и роль дисциплины в системе профессиональной 2
подготовки. Научные методы познания веществ и химических
явлений. Роль эксперимента и теории в химии. Моделирование
химических процессов.
Инструктаж по охране труда. Вводный срез знаний.
Виды самостоятельной работы студента:
1.
составление таблиц для систематизации учебного материала;
2. работа со словарями и справочниками;
3.
решение задач и упражнений по образцу (работа над ошибками
по вводному срезу знаний);
4.
презентации на тему:
«Материалы, полученные с помощью нанотехнологии» .
«Материалы используемые в строительной индустрии».
«Биотехнология и генная инженерия – технологии XXI века».
Творческая работа «Роль химии в моей профессии».
2
2
13.
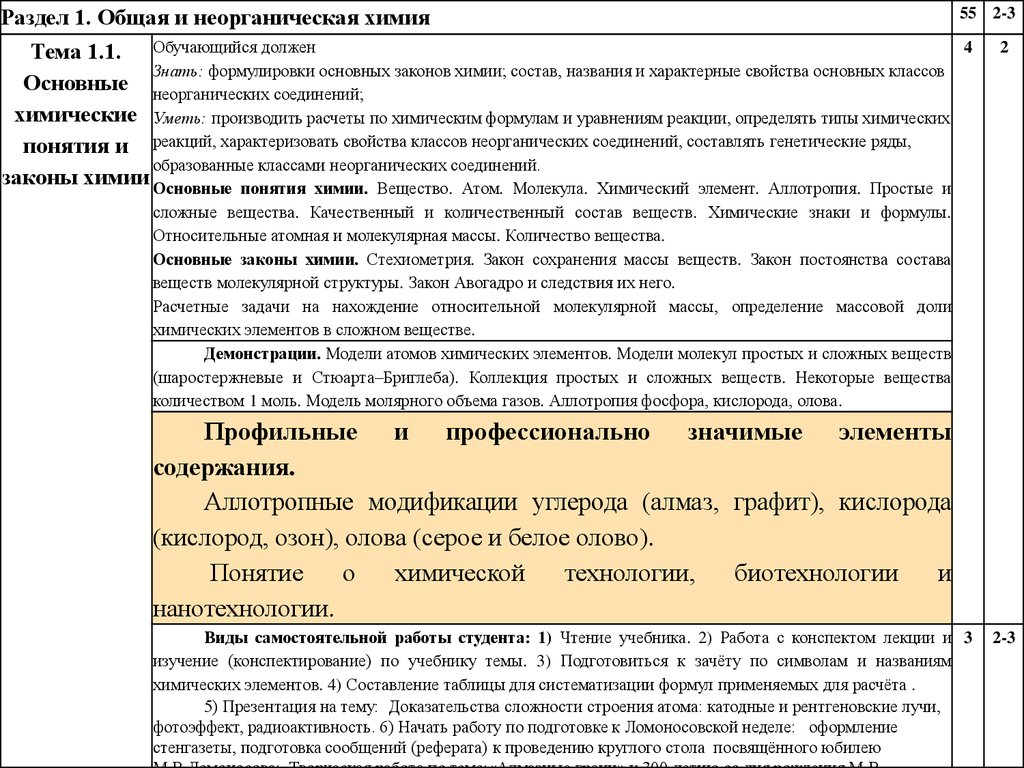
Раздел 1. Общая и неорганическая химия55 2-3
Тема 1.1. Обучающийся должен
Знать: формулировки основных законов химии; состав, названия и характерные свойства основных классов
Основные неорганических соединений;
химические Уметь: производить расчеты по химическим формулам и уравнениям реакции, определять типы химических
понятия и реакций, характеризовать свойства классов неорганических соединений, составлять генетические ряды,
образованные классами неорганических соединений.
законы химии Основные понятия химии. Вещество. Атом. Молекула. Химический элемент. Аллотропия. Простые и
4
2
сложные вещества. Качественный и количественный состав веществ. Химические знаки и формулы.
Относительные атомная и молекулярная массы. Количество вещества.
Основные законы химии. Стехиометрия. Закон сохранения массы веществ. Закон постоянства состава
веществ молекулярной структуры. Закон Авогадро и следствия их него.
Расчетные задачи на нахождение относительной молекулярной массы, определение массовой доли
химических элементов в сложном веществе.
Демонстрации. Модели атомов химических элементов. Модели молекул простых и сложных веществ
(шаростержневые и Стюарта–Бриглеба). Коллекция простых и сложных веществ. Некоторые вещества
количеством 1 моль. Модель молярного объема газов. Аллотропия фосфора, кислорода, олова.
Профильные и профессионально значимые элементы
содержания.
Аллотропные модификации углерода (алмаз, графит), кислорода
(кислород, озон), олова (серое и белое олово).
Понятие
о
химической
технологии,
биотехнологии
и
нанотехнологии.
Виды самостоятельной работы студента: 1) Чтение учебника. 2) Работа с конспектом лекции и 3
изучение (конспектирование) по учебнику темы. 3) Подготовиться к зачёту по символам и названиям
химических элементов. 4) Составление таблицы для систематизации формул применяемых для расчёта .
5) Презентация на тему: Доказательства сложности строения атома: катодные и рентгеновские лучи,
фотоэффект, радиоактивность. 6) Начать работу по подготовке к Ломоносовской неделе: оформление
стенгазеты, подготовка сообщений (реферата) к проведению круглого стола посвящённого юбилею
2-3
14.
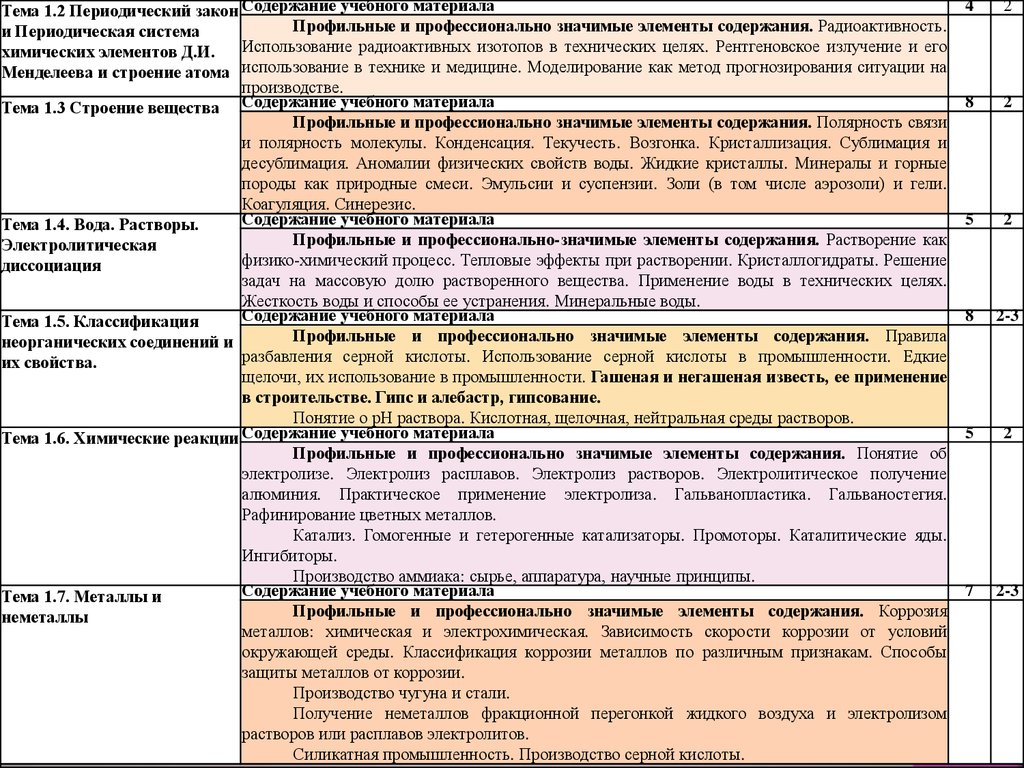
Тема 1.2 Периодический закон Содержание учебного материалаПрофильные и профессионально значимые элементы содержания. Радиоактивность.
и Периодическая система
Использование радиоактивных изотопов в технических целях. Рентгеновское излучение и его
химических элементов Д.И.
Менделеева и строение атома использование в технике и медицине. Моделирование как метод прогнозирования ситуации на
производстве.
Тема 1.3 Строение вещества Содержание учебного материала
Профильные и профессионально значимые элементы содержания. Полярность связи
и полярность молекулы. Конденсация. Текучесть. Возгонка. Кристаллизация. Сублимация и
десублимация. Аномалии физических свойств воды. Жидкие кристаллы. Минералы и горные
породы как природные смеси. Эмульсии и суспензии. Золи (в том числе аэрозоли) и гели.
Коагуляция. Синерезис.
Содержание учебного материала
Тема 1.4. Вода. Растворы.
Профильные и профессионально-значимые элементы содержания. Растворение как
Электролитическая
физико-химический
процесс. Тепловые эффекты при растворении. Кристаллогидраты. Решение
диссоциация
задач на массовую долю растворенного вещества. Применение воды в технических целях.
Жесткость воды и способы ее устранения. Минеральные воды.
Содержание учебного материала
Тема 1.5. Классификация
Профильные и профессионально значимые элементы содержания. Правила
неорганических соединений и
разбавления
серной кислоты. Использование серной кислоты в промышленности. Едкие
их свойства.
щелочи, их использование в промышленности. Гашеная и негашеная известь, ее применение
в строительстве. Гипс и алебастр, гипсование.
Понятие о рН раствора. Кислотная, щелочная, нейтральная среды растворов.
Содержание
учебного материала
Тема 1.6. Химические реакции
Профильные и профессионально значимые элементы содержания. Понятие об
электролизе. Электролиз расплавов. Электролиз растворов. Электролитическое получение
алюминия. Практическое применение электролиза. Гальванопластика. Гальваностегия.
Рафинирование цветных металлов.
Катализ. Гомогенные и гетерогенные катализаторы. Промоторы. Каталитические яды.
Ингибиторы.
Производство аммиака: сырье, аппаратура, научные принципы.
Содержание учебного материала
Тема 1.7. Металлы и
Профильные и профессионально значимые элементы содержания. Коррозия
неметаллы
металлов: химическая и электрохимическая. Зависимость скорости коррозии от условий
окружающей среды. Классификация коррозии металлов по различным признакам. Способы
защиты металлов от коррозии.
Производство чугуна и стали.
Получение неметаллов фракционной перегонкой жидкого воздуха и электролизом
растворов или расплавов электролитов.
Силикатная промышленность. Производство серной кислоты.
4
2
8
2
5
2
8
2-3
5
2
7
2-3
15.
РАЗДЕЛ 2.ОРГАНИЧЕСКАЯ ХИМИЯ
Тема 2.1. Основные понятия
органической химии и теория
строения органических
соединений
Тема 2.2. Углеводороды и их
природные источники
Тема 2.3. Кислородсодержащие
органические соединения
Содержание учебного материала
Профильные и профессионально значимые элементы содержания. Понятие
о субстрате и реагенте. Реакции окисления и восстановления органических веществ.
Сравнение классификации соединений и классификации реакций в неорганической и
органической химии.
Содержание учебного материала
Профильные и профессионально значимые элементы содержания. Правило
В.В. Марковникова. Классификация и назначение каучуков. Классификация и
назначение резин. Вулканизация каучука.
Получение ацетилена пиролизом метана и карбидным способом. Реакция
полимеризации винилхлорида. Поливинилхлорид и его применение. Тримеризация
ацетилена в бензол.
Понятие об экстракции. Восстановление нитробензола в анилин.
Гомологический ряд аренов. Толуол. Нитрование толуола. Тротил.
Основные направления промышленной переработки природного газа.
Попутный нефтяной газ, его переработка.
Процессы промышленной переработки нефти: крекинг, риформинг. Октановое
число бензинов и цетановое число дизельного топлива.
Коксохимическое производство и его продукция.
Содержание учебного материала
Профильные и профессионально значимые элементы содержания.
Метиловый спирт и его использование в качестве химического сырья. Токсичность
метанола и правила техники безопасности при работе с ним. Этиленгликоль и его
применение. Токсичность этиленгликоля и правила техники безопасности при работе с
ним.
Получение фенола из продуктов коксохимического производства и из бензола.
Поликонденсация формальдегида с фенолом в фенолоформальдегидную смолу.
Ацетальдегид. Понятие о кетонах на примере ацетона. Применение ацетона в технике и
промышленности.
Многообразие карбоновых кислот (щавелевая кислота как двухосновная,
акриловая кислота как непредельная, бензойная кислота как ароматическая).
Пленкообразующие масла. Замена жиров в технике непищевым сырьем.
Синтетические моющие средства.
Молочнокислое брожение глюкозы. Кисломолочные продукты. Силосование
кормов. Нитрование целлюлозы. Пироксилин.
34
2-3
5
2
9
2-3
8
2-3
16.
8Тема 2.4. Азотсодержащие Содержание учебного материала
органические соединения.
Профильные и профессионально значимые элементы содержания.
Полимеры.
Аминокапроновая кислота. Капрон как представитель полиамидных волокон.
Использование гидролиза белков в промышленности. Поливинилхлорид,
политетрафторэтилен (тефлон). Фенолоформальдегидные пластмассы.
Целлулоид. Промышленное производство химических волокон.
4
Тема 2.5 Обобщение
Содержание учебного материала
знаний по общей,
Профильные и профессионально значимые элементы содержания.
неоганической и
Законы и химические теории которые необходимо знать профессионалу.
органической химии
Химические реакции, их классификация и условия протекания.
Химия в жизни общества.
Химические вещества используемые в моей профессиональной деятельности;
Всего по дисциплине
78
2-3
2-3
2.4 Раздел «Условия реализации программы дисциплины» включает в себя:
требования к минимальному материально-техническому обеспечению
(Оборудование учебного кабинета: ______________________________
Технические средства обучения: ________________________________
Оборудование лаборатории и рабочих мест лаборатории____________ ).
• Информационное обеспечение обучения (содержит перечень рекомендуемых
учебных изданий, Интернет-ресурсов, дополнительной литературы).
2.5 Раздел «Контроль и оценка результатов освоения дисциплины»
определяет результаты обучения и те формы и методы, которые будут
использованы для их контроля и оценки.
3. Рецензирование рабочих программ осуществляют при их разработке или
пересмотре в новой редакции.
17.
Цель урока:•Изучить соединения кальция, их значение и
применение;
•составить представление о строительных материалах
на основе соединений кальция;
•закрепить умения и навыки по составлению
уравнений химических реакций;
•научить использовать приобретённые знания и
умения в практической деятельности и в
повседневной жизни.
18.
План урока1. Положение кальция в периодической системе химических
элементов Д.И.Менделеева
2. Строение атома, электронная формула, валентность (степени
окисления)
3. Минералы, которые содержат кальций.
4. Гипс. Алебастр. Гипсование
5. Известь
•Осуществить цепочку превращений и назвать соединения
кальция CaO→Ca(OH)2→ CaCO3
6. Обобщение и систематизация: зачем нужны знания о
соединениях кальция?
•В моей профессии;
• Для меня лично.
7. Подведение итогов.
8. Домашнее задание.
19.
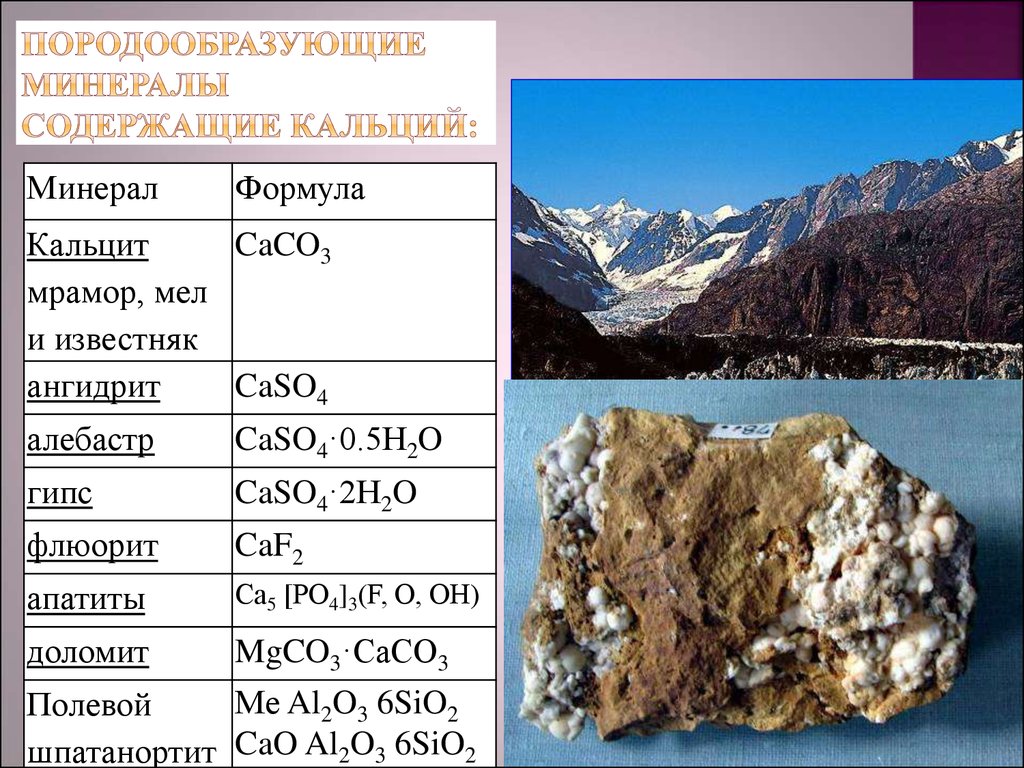
МинералФормула
Кальцит
CaCO3
мрамор, мел
и известняк
ангидрит
CaSO4
алебастр
CaSO4·0.5H2O
гипс
CaSO4·2H2O
флюорит
CaF2
апатиты
Сa5 [РO4]3(F, О, ОН)
доломит
MgCO3·CaCO3
Ме Al2O3 6SiO2
Полевой
шпатанортит CaO Al2O3 6SiO2
20.
Окраска минерала бываетбелой, розоватой,
желтовато-кремовой.
Другие названия минерала и
его разновидностей:
-шелковистый шпат,
-уральский селенит,
-гипсовый шпат,
-девичье или
марьино стекло.
21.
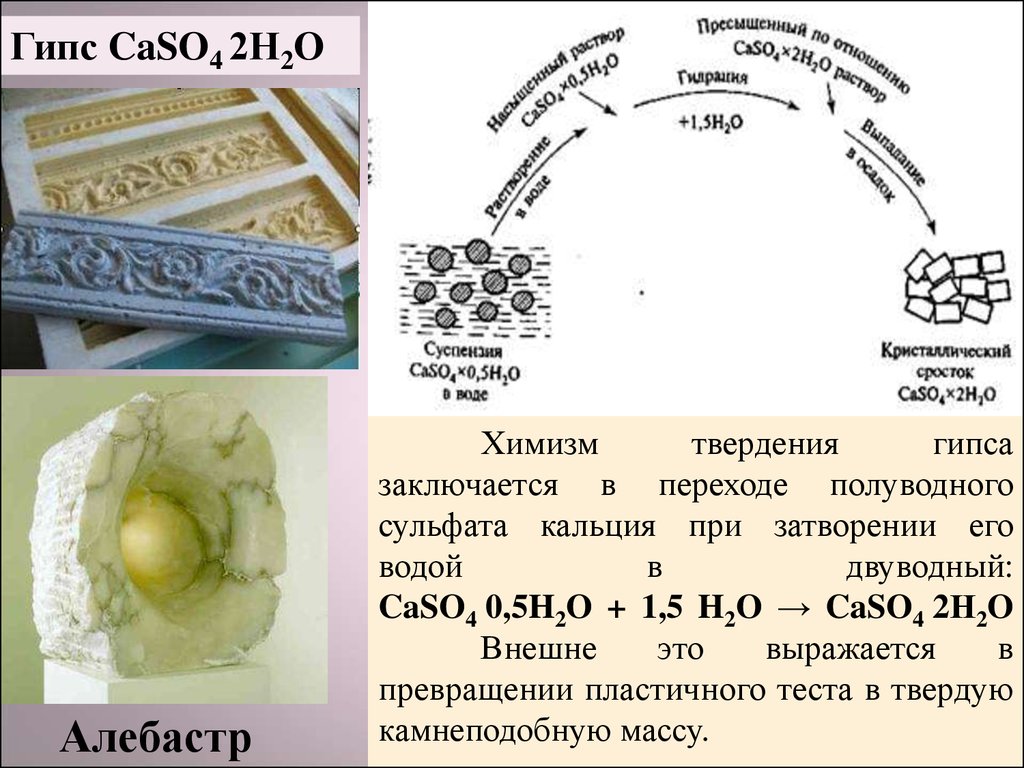
Гипс CaSO4 2Н2OАлебастр
Химизм
твердения
гипса
заключается в переходе полуводного
сульфата кальция при затворении его
водой
в
двуводный:
CaSO4 0,5H2O + 1,5 H2O → CaSO4 2Н2O
Внешне
это
выражается
в
превращении пластичного теста в твердую
камнеподобную массу.
22.
Этапы приготовления гипсовой смеси(замешивание гипса)
1. Используйте только чистую емкость. Налейте в нее необходимое
количество воды.
2. Распределите гипс по поверхности воды. Засыпьте остальной
гипс и осторожно перемешайте взвесь до равномерного состояния.
3. Не спеша, перемешивайте смесь. Для этой цели воспользуйтесь
кельмой, опуская ее до самого дна емкости.
Дайте раствору выстояться в течение нескольких минут. Когда
смесь загустеет, немедленно приступите к ее использованию.
Кстати! «Мертвый» гипс
Ни в коем случае не добавляйте ни воду, ни сухой гипс в уже
начавший схватываться раствор. В противном случае, вы рискуете
испортить смесь и получить гипс, который называют «мертвым».
Такой гипс оказывается менее прочным, а его вяжущие свойства слабее.
23.
Гипсокартон с английского языка: «drywall»- означает «сухаястена». Поэтому гипсокартон часто называют сухой гипсовой
штукатуркой.
Гипс применяют для интерьера помещений и фасадов зданий
(карнизы, гладкие профили, молдинги, фризы, розетки, углы,
колонны и пилястры, базы, капители, кронштейны и другие
декоративные элементы). Как вяжущий материал в строительном
деле, в медицине; Для получения строительного гипса,
высокопрочного гипса, гипсоцементно-пуццоланового вяжущего.
24.
МРАМОРв переводе с древнегреческого marmaros означает «блестящий камень»
— кристаллически-зернистая метаморфическая карбонатная порода,
продукт перекристаллизации известняка или доломита.
Каррарский мрамор известен ещё с
античных времён . Из белого мрамора
сделан Римский пантеон и ряд
известных скульптур времён
Возрождения, в частности, «Давид»
Микеланжело
25.
Римский КолизейОбщее количество
мрамора,
использованного для
постройки,
составляло 100 000 м3 .
Фундамент был сделан из мраморных блоков. Внутренние стены
были облицованы отполированными мраморными плитами, а
потолок окрашен штукатуркой (stucco). Другой строительный
материал включает - блоки известкового туфа, кирпичи и опус
сементикиум (бетон, сделанный из маленьких глыб известкового
туфа в миномете).
26.
ПАНТЕОН “храм всех богов” (г.Рим)При строительстве использовался известково-пуццолановый
пемзотуфобетон, кирпич. Наружные стены вестибюля частью
выложены из мраморных блоков, частью покрыты мраморной
облицовкой. Пол вымощен разноцветным мрамором; облицовка
стен ротонды выполнена также из разноцветного мрамора.
мраморный антаблемент
27.
Белая мечеть шейха Заида в Абу-Дабиимеет80 куполов в белом мраморе
28.
Храмы из известнякаМачу-Пикчу (на языкеХрам
кечуа: Мачу-Пикчу,
индуизма 7000
"Старая гора") "Потерянный Город Инков"
Парфенон
тонн
белого турецкого известняка
и итальянского мрамора
Храм Гроба Пирамиды
ГосподняЕгипта
в Иерусалиме
29.
Соборы, церкви и крепости из известнякаБелгород-Днестровская
Аккерманская крепость
церквь в Дубровицах
Софийский собор XI век
Успенский собор Московского Кремля.
30.
Замки из известнякаВиндзорский замок
42 замка Луары
31.
Известнякразличные отделочные
и декоративные изделия:
плитку - фасадную;
плитку - напольную;
- для внутренней отделки;
- фасадные карнизы;
- облицовку каминов;
- колонны;
- балюстрады;
- ступени;
- замковый камень;
- подоконники;
- резные изделия.
32.
МЕЛСтроительство получает
на основе мела
Строительную известь,
Бетоны,
Штукатурки
и строительные
растворы.
Используют
мел и в процессе кладки
стен и фундаментов,
а также для декоративнооблицовочных работ.
33.
в качестве ускорителя для схватывания цементов.для изготовления силикатного кирпича
для изготовления: товарного бетона, бетонных блоков с
трубами, бетонных изделий, изделий с применением
бетона.
CaCL2 влияет на повышение прочности бетона.
используется для обработки пылящих поверхностей
(асбест) в теплый период года при низкой влажности .
для сооружения земляного полотна, устройства дорожных
оснований, покрытий автомобильных дорог.
для предотвращения образования пыли в теплое время года
и против обледенения зимой при строительстве дорог,
летных полей.
34.
XX векШирокое использование
бетона, алюминия, стекла,
нержавеющей стали
XXIвек
Широкое использование
стекла, пластмасс,
металлических поверхностей
35.
Принцип межпредметных связей и профильную направленностьможно проследить и при решении химических задач.
А. Расчеты по формулам:
Вычисление относительной молекулярной массы вещества.
Вычисление отношения масс атомов элементов в сложном веществе.
Вычисление массовой доли элемента в веществе (в %).
Вычисление массы определенного количества вещества.
Вычисление масс и объемов газов (при н. у.).
Вычисление относительной плотности газов.
Б. Расчеты по уравнениям
Вычисление масс веществ или объемов газов по известному количеству вещества одного из
вступающих в реакцию или образующихся в результате ее веществ.
Вычисление объемных отношений газов по химическим уравнениям.
Расчет по термохимическим уравнениям количества теплоты по известному количеству и
массе одного из участвующих в реакции веществ.
Расчеты по химическим уравнениям, если одно из реагирующих веществ дано в избытке.
Определение массовой доли выхода продукта от теоретически возможного.
Вычисление массы продукта реакции по известной массе исходного вещества, содержащего
определенную массовую долю примесей.
В. Расчеты на выведение формул веществ
Нахождение молекулярной формулы газообразного вещества на основании его плотности и
массовых долей входящих в него элементов (в %).
Г. Расчеты массовой доли вещества в растворе (в %)
Расчеты по определению массовой доли растворенного вещества (в %) в растворе и массы
растворенного вещества по известной массовой доле его в растворе.
36.
Адаптируя химическое содержание к различнымпрофессиям НПО или специальностям СПО, следует
конструировать его на основе двух компонентов:
инвариантного ядра и вариативной составляющей.
Инвариантное ядро содержания включает
химический язык, основные химические понятия,
законы, теории, факты и методы исследования,
используемые в химии.
1
2
Вариативная составляющая содержания должна
отражать специфику профиля, устанавливать и
иллюстрировать взаимосвязи химического
содержания с содержанием общепрофессиональных
и спец. дисциплин. она так же может включать
биологический, физико-математический и
гуманитарный компоненты.
































 education
education law
law








