Similar presentations:
Снижение электрической прочности и электрический пробой мембран. Физикохимические основы патологии клетки
1. Снижение электрической прочности и электрический пробой мембран
Учебник БиофизикиЧАСТЬ 4. Физикохимические основы
патологии клетки
2. Электрический пробой плоских фосфолипидных мембран (БЛМ)
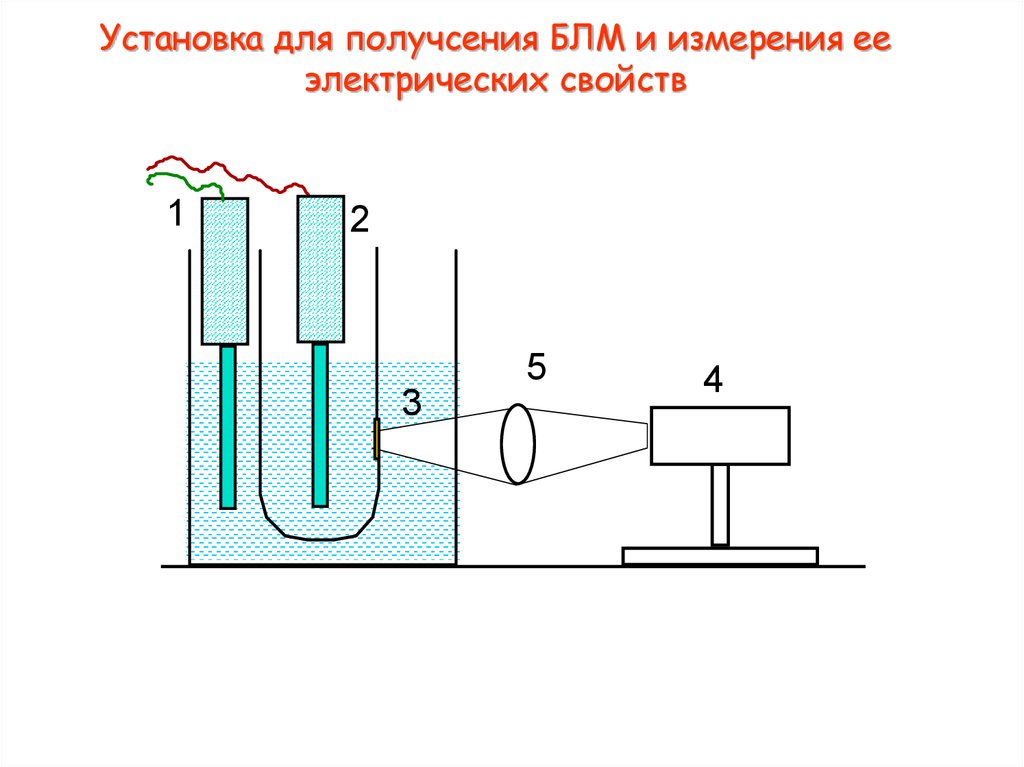
3. Приготовление БЛМ
24
3
5
1
А
Б
В
Г
4. Установка для получсения БЛМ и измерения ее электрических свойств
12
5
3
4
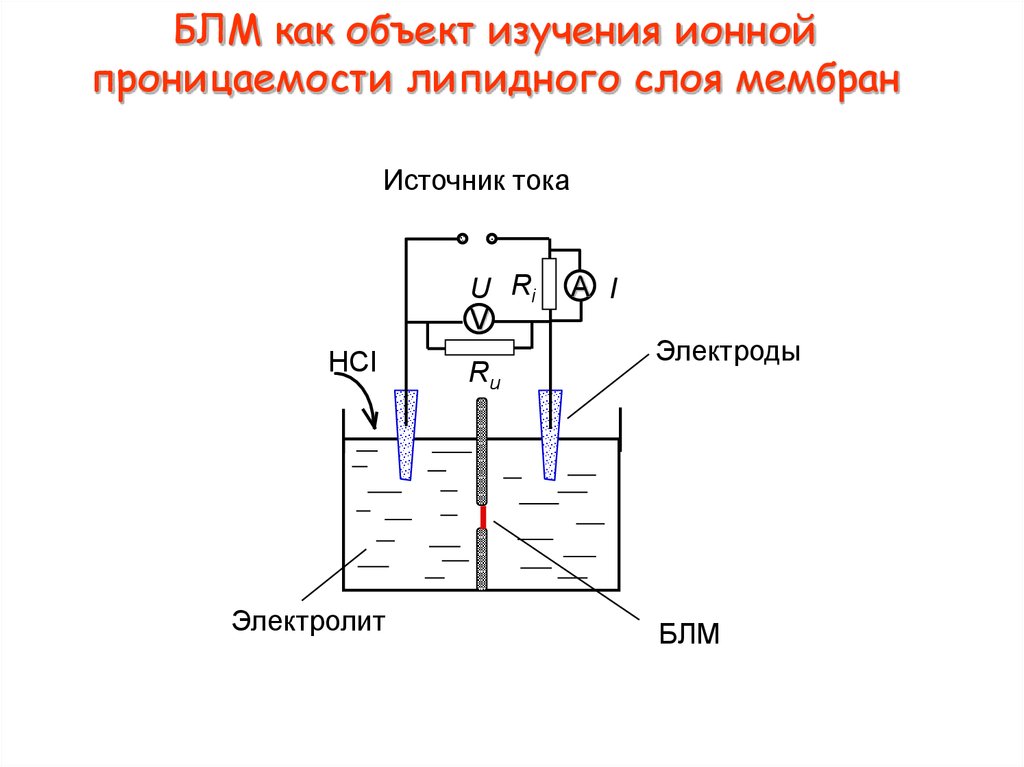
5. БЛМ как объект изучения ионной проницаемости липидного слоя мембран
Источник токаU Ri
V
HCl
Электролит
Ru
A I
Электроды
БЛМ
6. Зависимость времени жизни липидных пор от напряжения
Точки – экспериментЛинии - теория
ФЭ
ФХ
Lg t мс
6
4
2
ФХ + лизоФХ
0,2
0,4
j (V)
0,6
7. Пробой БЛМ при действии постоянного электрического поля
8. BLM as a tool to measure membrane ionic permeability
empVoltmeter
U Ri
HCl
Ru
I
Ampermeter
Electrode
emp - electro motive force.
The potential difference
applied to our system from
an external source.
U - membrane potential.
I - membrane current.
Electrolyte
Bilayer lipid membrane (BLM)
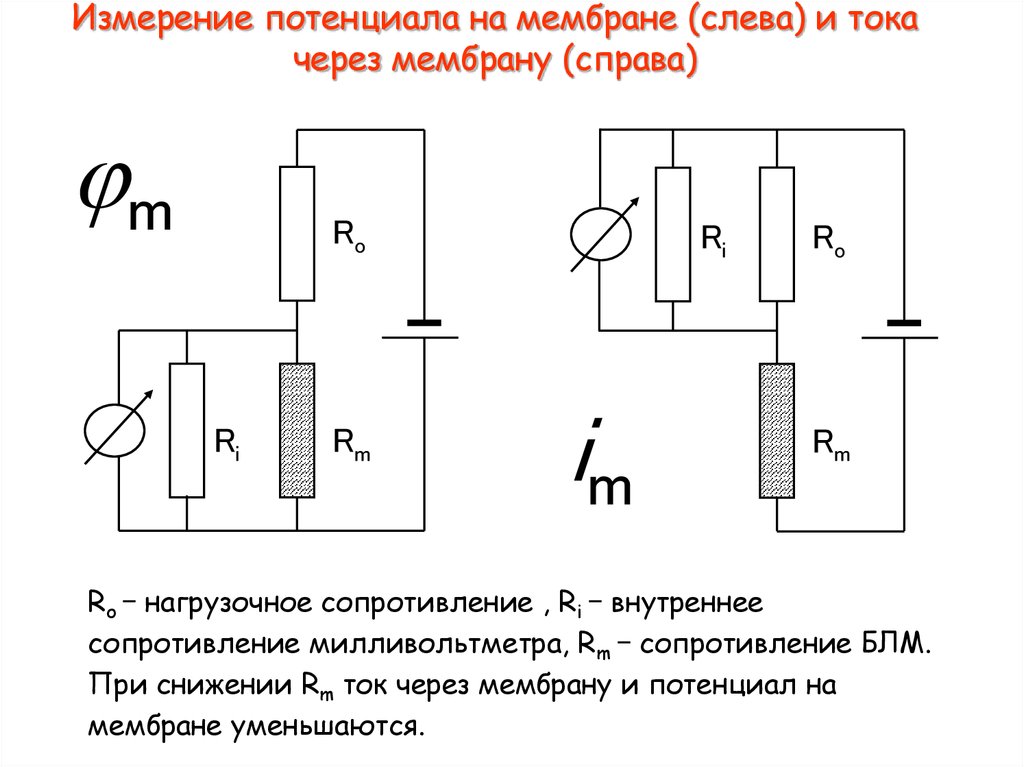
9. Измерение потенциала на мембране (слева) и тока через мембрану (справа)
jmRo
Ri
Rm
Ri
im
Ro
Rm
Ro – нагрузочное сопротивление , Ri – внутреннее
сопротивление милливольтметра, Rm – сопротивление БЛМ.
При снижении Rm ток через мембрану и потенциал на
мембране уменьшаются.
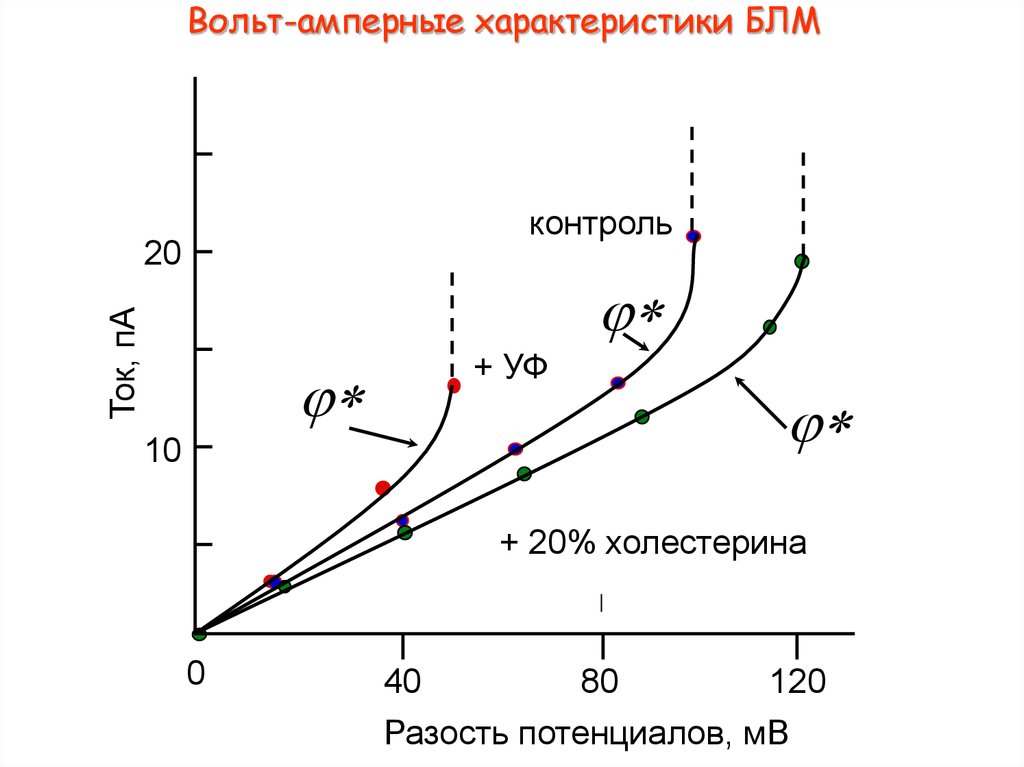
10. Вольт-амперные характеристики БЛМ
контроль20
Ток, пА
j*
j*
10
+ УФ
j*
+ 20% холестерина
0
40
80
120
Разость потенциалов, мВ
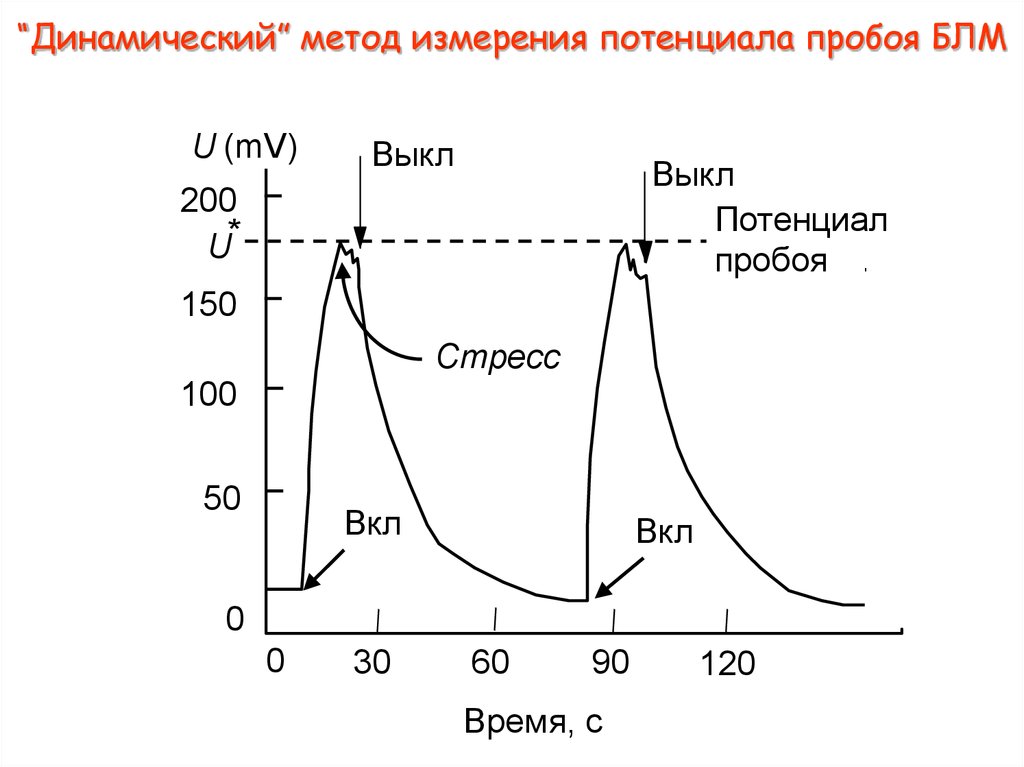
11. “Динамический” метод измерения потенциала пробоя БЛМ
U (mV)Выкл
Выкл
Потенциал
пробоя
200
U*
150
Стресс
100
50
Вкл
Вкл
0
0
30
60
90
Время, с
120
12. Электрический пробой БЛМ
Потенциал пробоя БЛМ, мВЭлектрический пробой БЛМ
U*
Фосфолипаза A2
УФ
90
пептид
СГД
P
СГД
60
30
0
10
20
0
10
20 0
10
Время, мин
20 0
10
20
13. Влияние изменения гидростатического давления на потенциал пробоя БЛМ
DPDP
100
75
50
25
0
10
20
мин
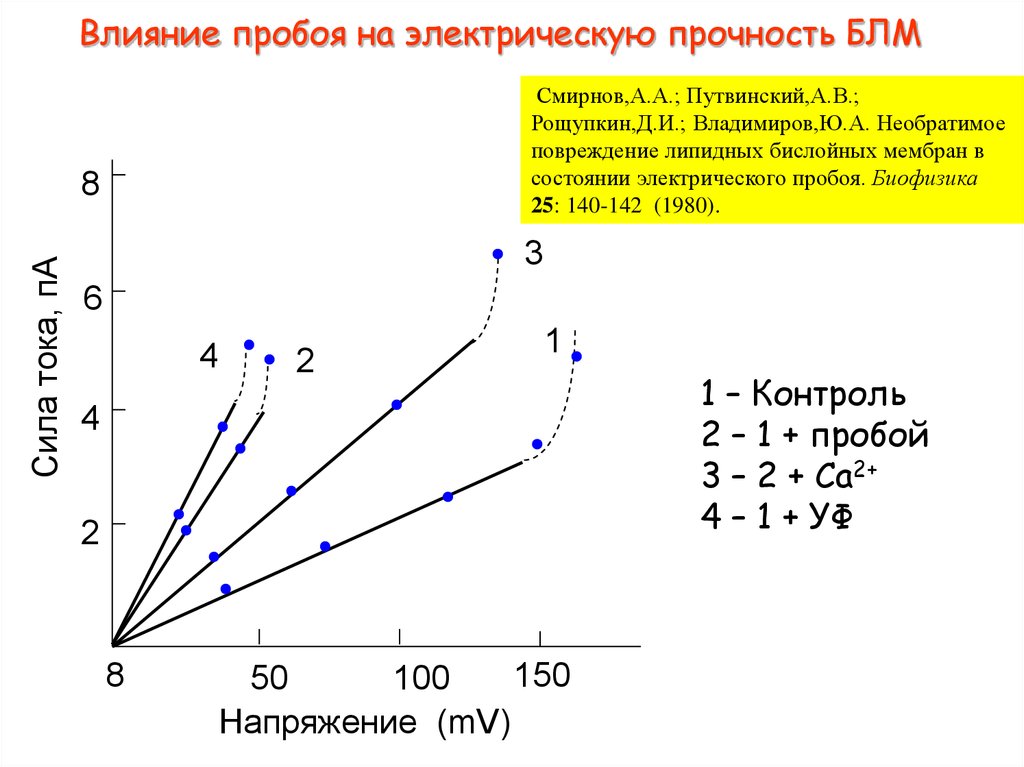
14. Влияние пробоя на электрическую прочность БЛМ
Смирнов,А.А.; Путвинский,А.В.;Рощупкин,Д.И.; Владимиров,Ю.А. Необратимое
повреждение липидных бислойных мембран в
состоянии электрического пробоя. Биофизика
25: 140-142 (1980).
Сила тока, пА
8
3
6
4
2
1
4
2
8
150
50
100
Напряжение (mV)
1 – Контроль
2 – 1 + пробой
3 – 2 + Са2+
4 – 1 + УФ
15. Пробой мембран собственным (ионным диффузионным) потенциалом
16. Концентрационный потенциал, образуемый на БЛМ в присутствии ионофора
U (mV)Потенциал Нернста
U (mV ) =
HCl
БЛМ
zF [H]2
» 60 DpH
ln
RT [H]1
Электролит
+ ионофор
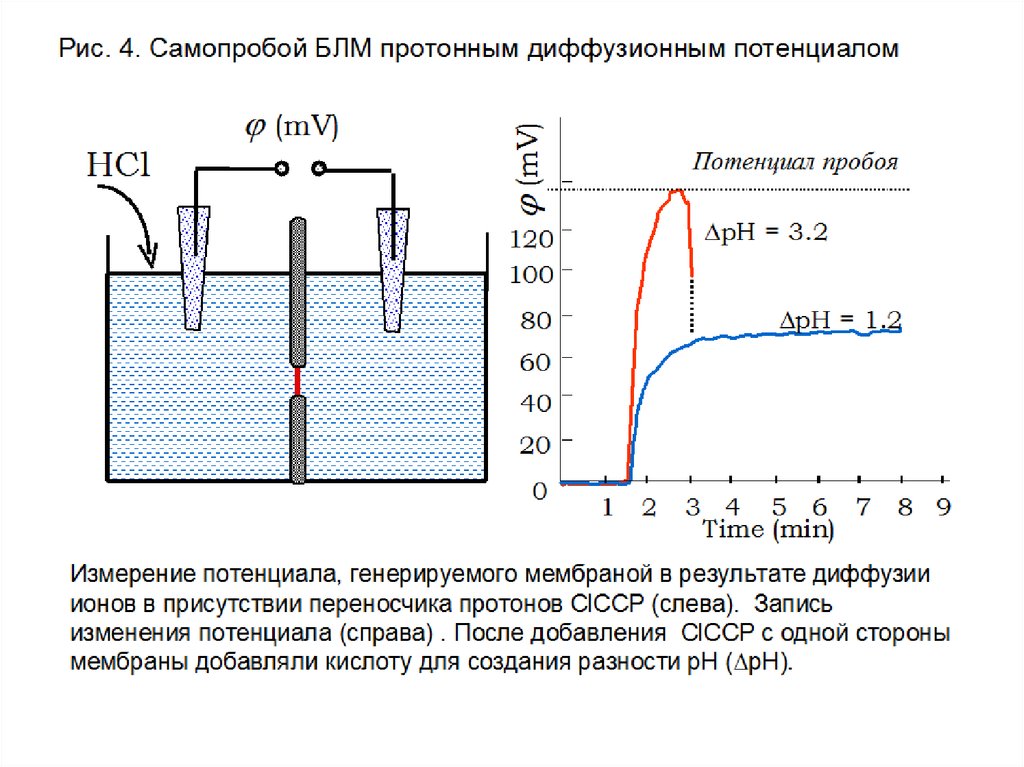
17. Самопробой БЛМ при высоком ионном диффузионном потенциале
Потенциал на мембране, мВСамопробой БЛМ при высоком ионном
диффузионном потенциале
Потенциал пробоя
DpH = 3.2
120
100
DpH = 1.2
80
Потенциал Нернста
60
40
20
0
1
2
3 4 5 6
Время, мин
7
8
9
18. Самопробойц БЛМ
19. Электрический пробой мембран собственным мембранным потенциалом
Valзамыкание
2 мин
Время
30 мВ
1 мин
ClCCP
Пробой
j*
замыкание
Пробой
Мембранный потенциал
25 мВ
j*
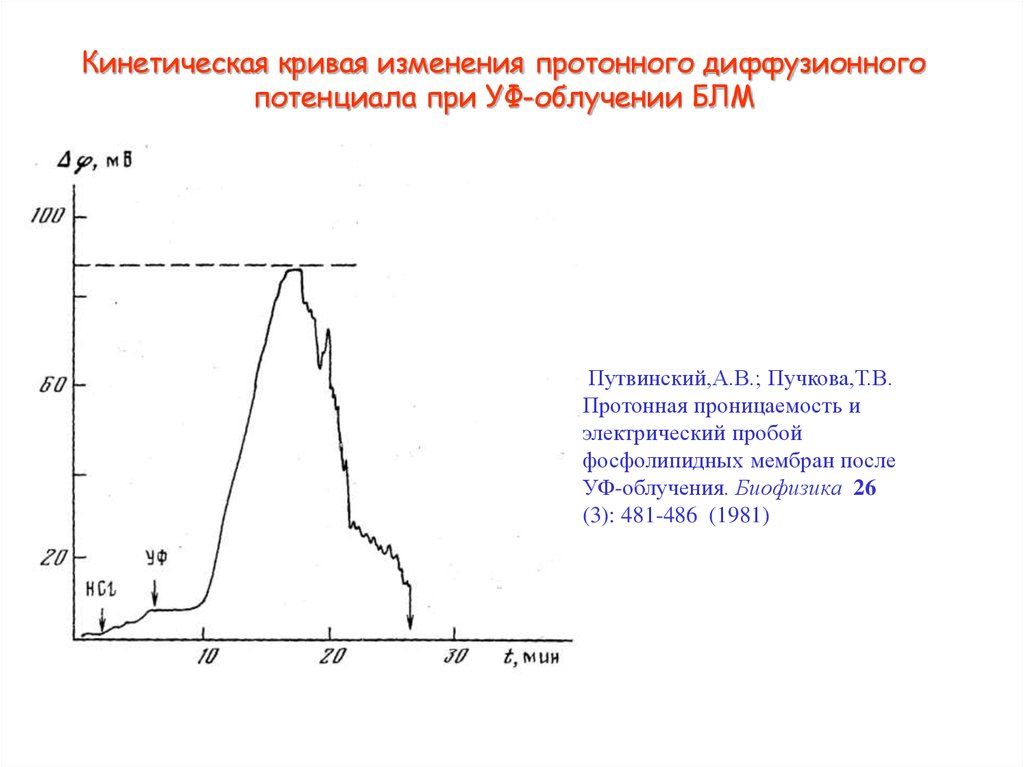
20. Кинетическая кривая изменения протонного диффузионного потенциала при УФ-облучении БЛМ
Путвинский,А.В.; Пучкова,Т.В.Протонная проницаемость и
электрический пробой
фосфолипидных мембран после
УФ-облучения. Биофизика 26
(3): 481-486 (1981)
21. Самопробой БЛМ при УФ облучении
Разность потенциалов, мВСамопробой БЛМ при УФ облучении
Потенциал
пробоя
40
30
20
УФ
10
0
HCl
2
4
6
7.5
Время, мин
8.0
22. Пробой БЛМ при УФ облучении
Рис. 1. Изменениесопротивления БЛМ (R),
приготовленных из
митохондриальных липидов
(а) и яичного лецитина (б).
Потенциал на мембранах до
облучения 28 мВ. Стрелка
показывает начало Уфоблучения
Путвинский,А.В.; Пучкова,Т.В. Протонная проницаемость и электрический
пробой фосфолипидных мембран после УФ-облучения. Биофизика 26 (3):
481-486 (1981)
23. Electrical breakdown of BLM under UV
24. Потенциал пробоя БЛМ (Uпр), приготовленных из ми-тохондриальных липидов (а) и яичного лецитина (б)
Потенциал пробоя БЛМ (Uпр), приготовленных из митохондриальных липидов (а) и яичного лецитина (б)Путвинский,А.В.; Пучкова,Т.В.
Протонная проницаемость и
электрический пробой
фосфолипидных мембран после
УФ-облучения. Биофизика 26
(3): 481-486 (1981)
25. Пробой БЛМ при разном диффузионном потенциале
26. Электрический пробой фосфолипидных везикул (липосом)
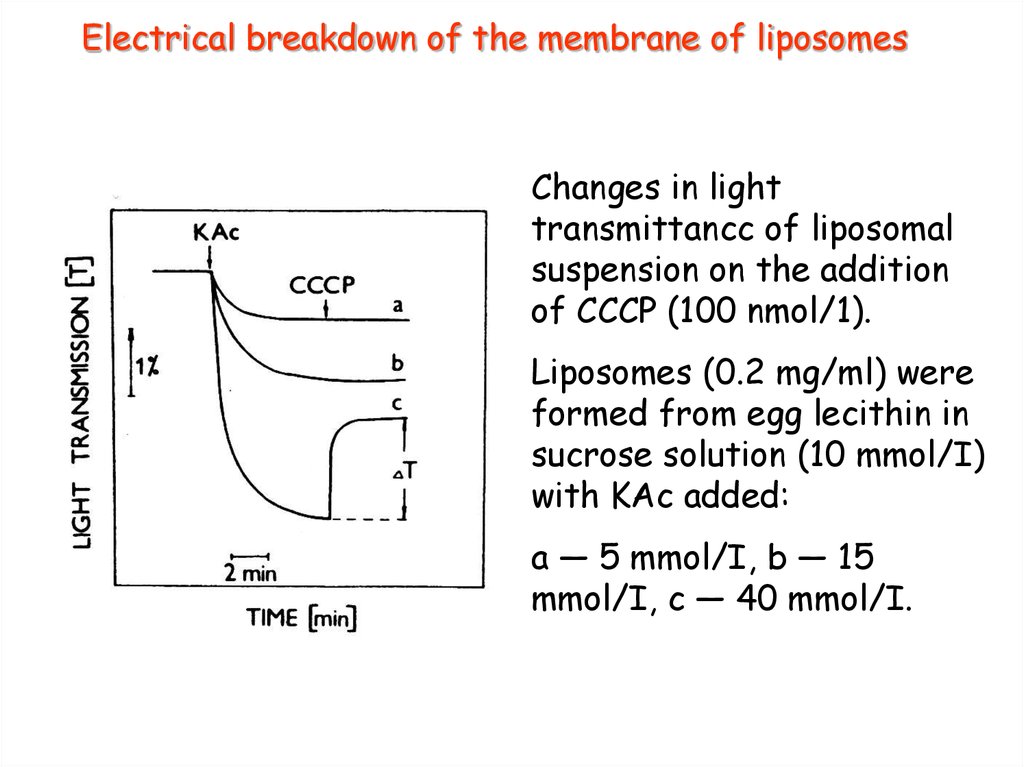
27. Electrical breakdown of the membrane of liposomes
Changes in lighttransmittancc of liposomal
suspension on the addition
of СССР (100 nmol/1).
Liposomes (0.2 mg/ml) were
formed from egg lecithin in
sucrose solution (10 mmol/I)
with KAc added:
a — 5 mmol/I, b — 15
mmol/I, с — 40 mmol/I.
28. Электрический пробой мембран липосом
ClCCPа
б
1%
Светопропускание
KAc
в
DT
2 мин
Время
29. Электрический пробой мембран липосом
Мембранный потенциал90
60 60
DT / T (отн. ед.)
-4
90
120
KAc
-2
Сжатие
0
0
Набухание
-1
KAc
-2,0
-1,5
-1,0 -1,0
-2
-1,5
Lg[KAc]o / [KAc]i
-2,0
30. Влияние холестерина на пробой в липосомах
Потенциал на мембране (мВ)0% холестерина
20% холестерина
AcOK (мМ)
31. Breakdown of membrane during continuous introduction of KAc
Time-course of lighttransmittance (T) in the
liposomal suspension (a) and
the calculated membrane
potential (b) during
continuous introduction of
concentrated potassium
acetate solution. Liposomes
(0.2 mg lipids/ml) prepared
from egg lecithin were
formed in 10 mmol/1 sucrose
solution. Final concentration
of CCCP was 0.1 mmol/l.
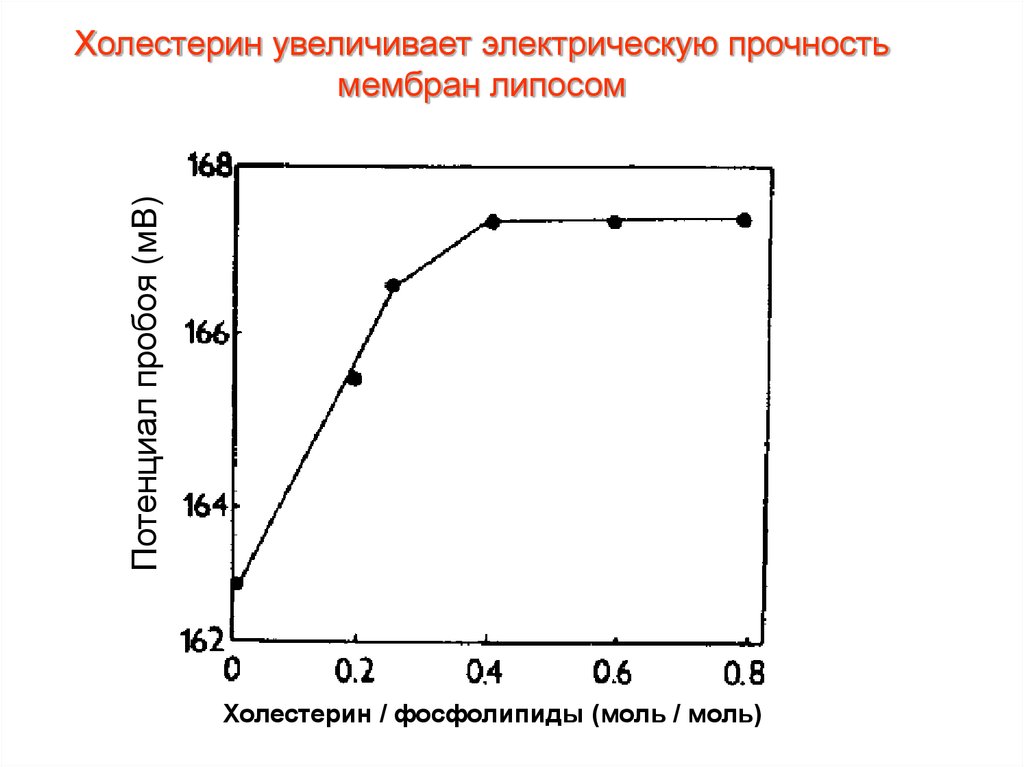
32. Холестерин увеличивает электрическую прочность мембран липосом
Потенциал пробоя (мВ)Холестерин увеличивает электрическую прочность
мембран липосом
Холестерин / фосфолипиды (моль / моль)
33. Снижение мембранного потенциала в липосомах при пероксидации липидов
Потенциал пробоя (мВ)Снижение мембранного потенциала в липосомах
при пероксидации липидов
Слева – При УФоблучении разными
дозами.
Справа – Про
добавлении
водорастворимых
продуктов
пероксидации
липидов.
Доза (Дж / см2)
Продукты ПОЛ (мл)
34. Детергенты снижают электрическую прочность мембран липосом
Потенциал пробоя (мВ)Детергенты снижают электрическую прочность
мембран липосом
Triton X-100
CTAB
SDS
Логарифм молярной концентрации детергента
35. Электрический пробой мембран эритроцитов
36. Электрический пробой мембран эритроцитов
pH5,8
pH
6,0
7
6,8
5
7,2
7,6
6,6
7,0
7,4
0
j*
6,4
6
6,2
Dj, мВ
100
80
60
40
20
4
0,3
1,5
2,4 3,2
Lg (Ci / Co)
3
2
1
20
40
60 мин
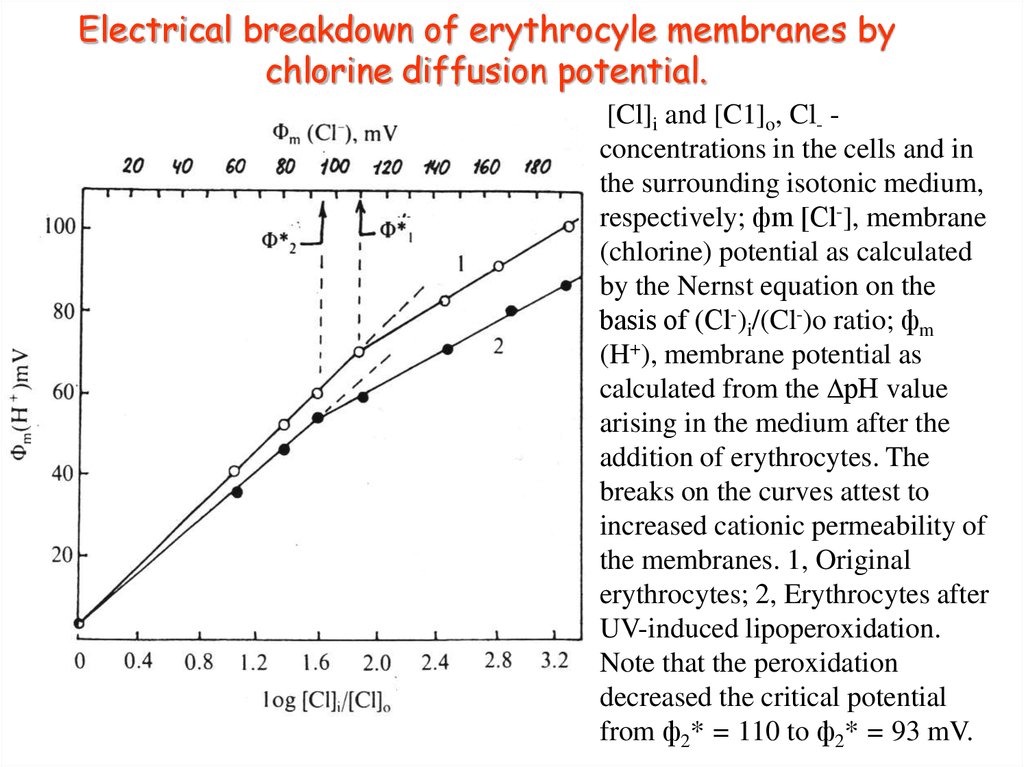
37. Electrical breakdown of erythrocyle membranes by chlorine diffusion potential.
[Cl]i and [C1]o, Cl- concentrations in the cells and inthe surrounding isotonic medium,
respectively; фm [Сl-], membrane
(chlorine) potential as calculated
by the Nernst equation on the
basis of (Сl-)i/(Cl-)o ratio; фm
(H+), membrane potential as
calculated from the DрН value
arising in the medium after the
addition of erythrocytes. The
breaks on the curves attest to
increased cationic permeability of
the membranes. 1, Original
erythrocytes; 2, Erythrocytes after
UV-induced lipoperoxidation.
Note that the peroxidation
decreased the critical potential
from ф2* = 110 to ф2* = 93 mV.
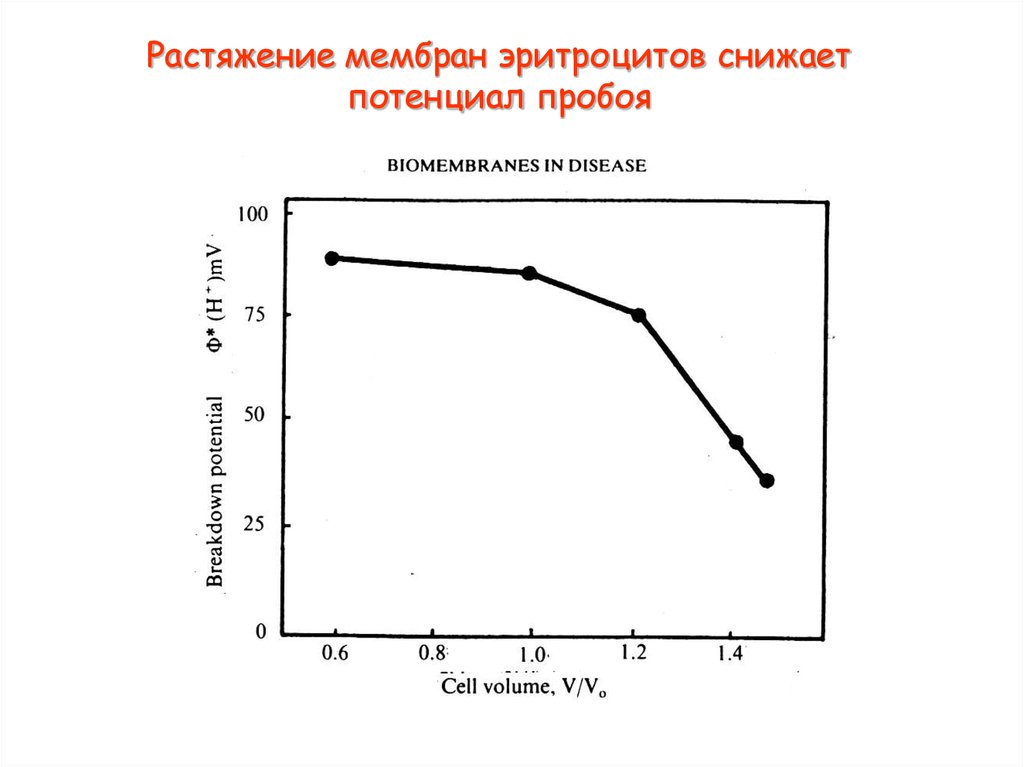
38. Растяжение мембран эритроцитов снижает потенциал пробоя
39. Release of hemoglobin from erythrocytes
40. Электрический пробой мембран митохондрий
41. Электрический пробой внутренней мембраны митохондрий
U (мВ)F (r.u.)
Субстрат
Субстрат
0
150
100
100
Ацетат
Ацетат
200
a
50
2 мин
42.
Membrane potential changes inmitochondria upon their energization,
the addition of permeant acid, and
electrical breakdown, as assessed from
variations in the fluorescence intensity
of the probe diS-C3-(5). Precalibration
of de-energized mitochondria in a KCl +
valinomycin system enabled the
variation in fluorescence to be expressed
in membrane potential units (фm, mV).
Dфs is the change in potential inside the
mitochondria after the addition of
succinate to the mitochondrial
suspension containing rotenone; фA is
the change in potential after the addition
of potassium acetate (AcOK). When the
membrane is broken down electrically,
i.e. when dфA ф*, the membrane
potential falls (b).
43. Скорость падения мембранного потенциала (tg a) при различных потенциалах на внутренней мембране
tg a2
Потенциал на мембране (мВ)
180
190
200 210
1
o
0.1
1.0
10
Концентрация соли (мМ)
Tg a (см. предыдущий
слайд) – жто скорость
падения мембранного
потенциала в результате
электрического пробоя.
Добавление KCl не создает
дополнительного
потенциала на мембране и
не приводит к пробою. При
добавлении ацетата
пробоцй наступает при
мембранном потенциале
выше 200 мВ.
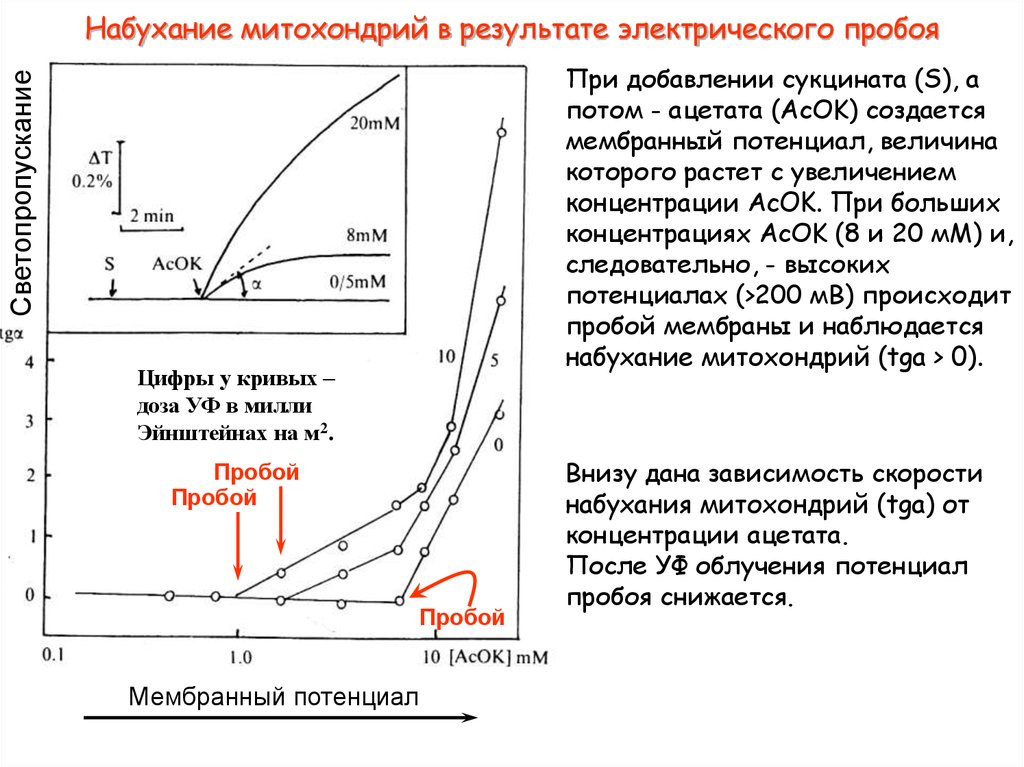
44. Набухание митохондрий в результате электрического пробоя
СветопропусканиеПри добавлении сукцината (S), а
потом - ацетата (AcOK) создается
мембранный потенциал, величина
которого растет с увеличением
концентрации AcOK. При больших
концентрациях AcOK (8 и 20 мМ) и,
следовательно, - высоких
потенциалах (>200 мВ) происходит
пробой мембраны и наблюдается
набухание митохондрий (tga > 0).
Цифры у кривых –
доза УФ в милли
Эйнштейнах на м2.
Пробой
Пробой
Пробой
Мембранный потенциал
Внизу дана зависимость скорости
набухания митохондрий (tga) от
концентрации ацетата.
После УФ облучения потенциал
пробоя снижается.
































 biology
biology physics
physics chemistry
chemistry








