Similar presentations:
Периодическая система Д.И. Менделеева и строение атома
1. Периодическая система Д.И. Менделеева и строение атома
2. Цель:
Закрепить знания о причинах изменениясвойств химических элементов на основании
положения в таблице Д.И. Менделеева;
Научиться обоснованно объяснять и сравнивать
свойства элементов, а также образованных ими
простых и сложных веществ по положению в
таблице Д.И. Менделеева;
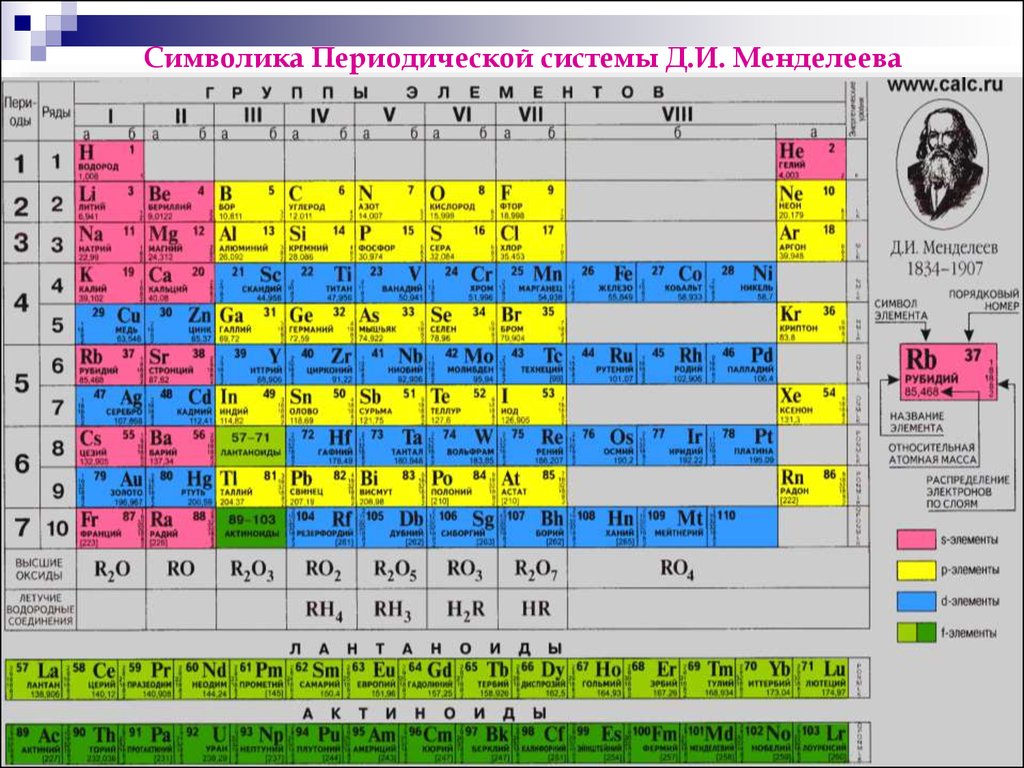
3. Символика Периодической системы Д.И. Менделеева
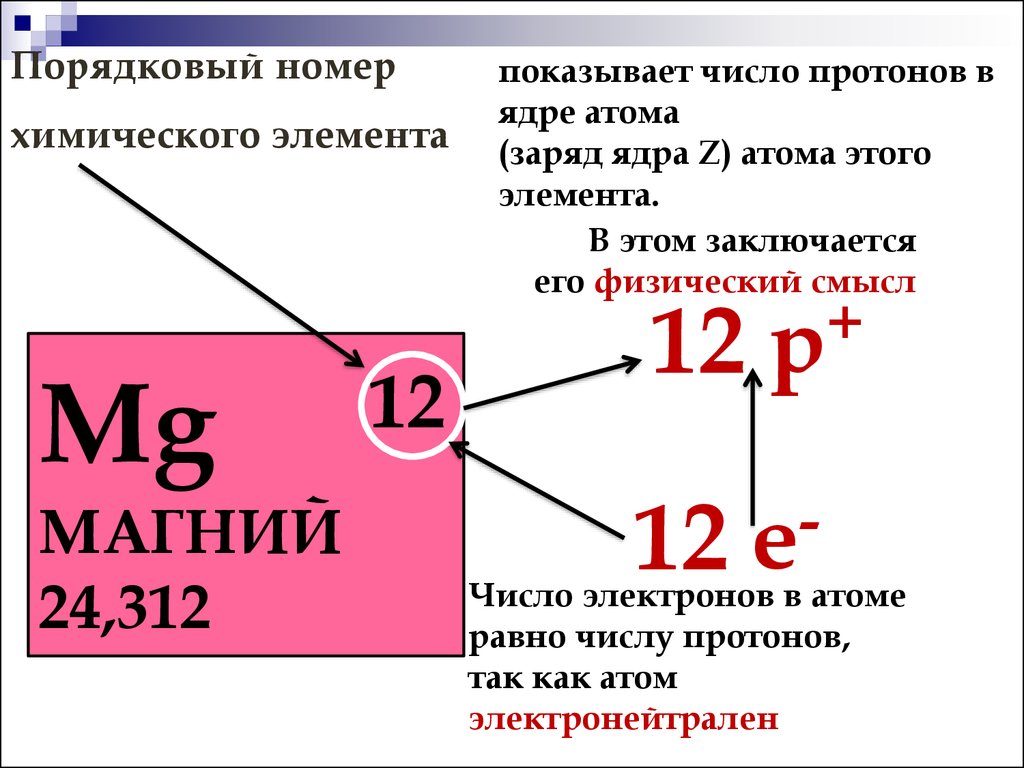
4. Порядковый номер химического элемента
MgМАГНИЙ
24,312
12
показывает число протонов в
ядре атома
(заряд ядра Z) атома этого
элемента.
В этом заключается
его физический смысл
12
+
р
12
е
Число электронов в атоме
равно числу протонов,
так как атом
электронейтрален
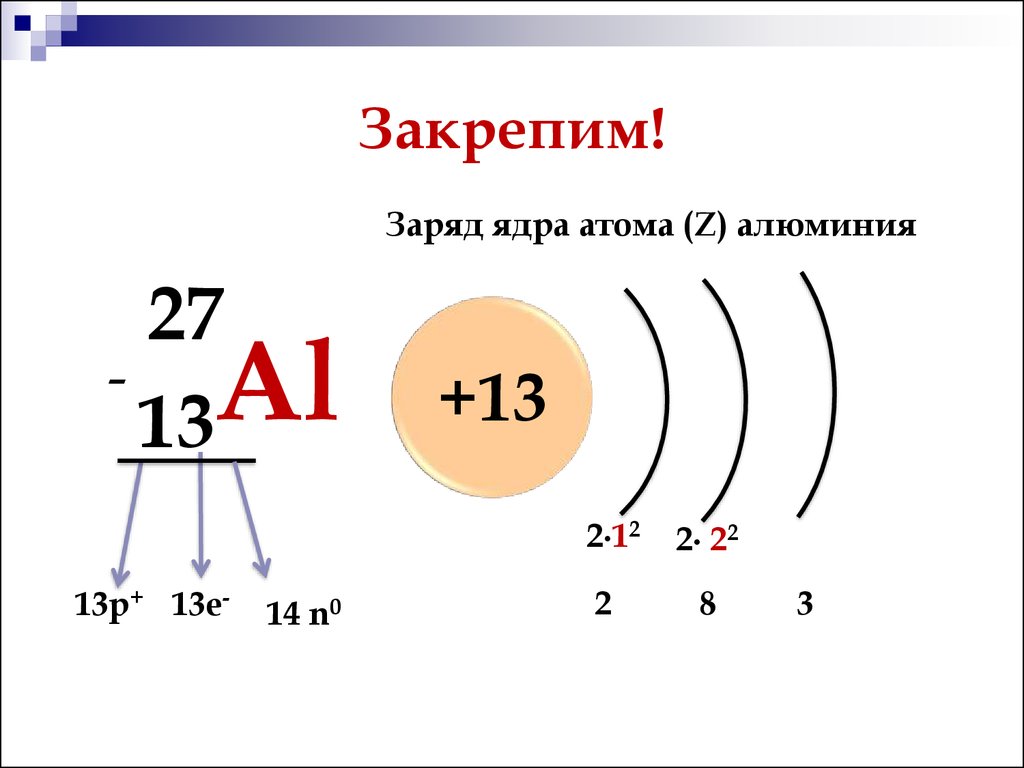
5. Закрепим!
Са20
КАЛЬЦИЙ
40,08
S
СЕРА
32,064
32
S
Z = +20
+
20 р
20 е
Z = +32
32 р+
32е-
6. Закрепим!
Zn30
Z = +30
+
30 р
30 е
35
Z = +35
35 р+
35е-
ЦИНК
65,37
Br
БРОМ
79,904
S
7. Горизонтальные строки химических элементов - периоды
малыебольшие
незавершенный
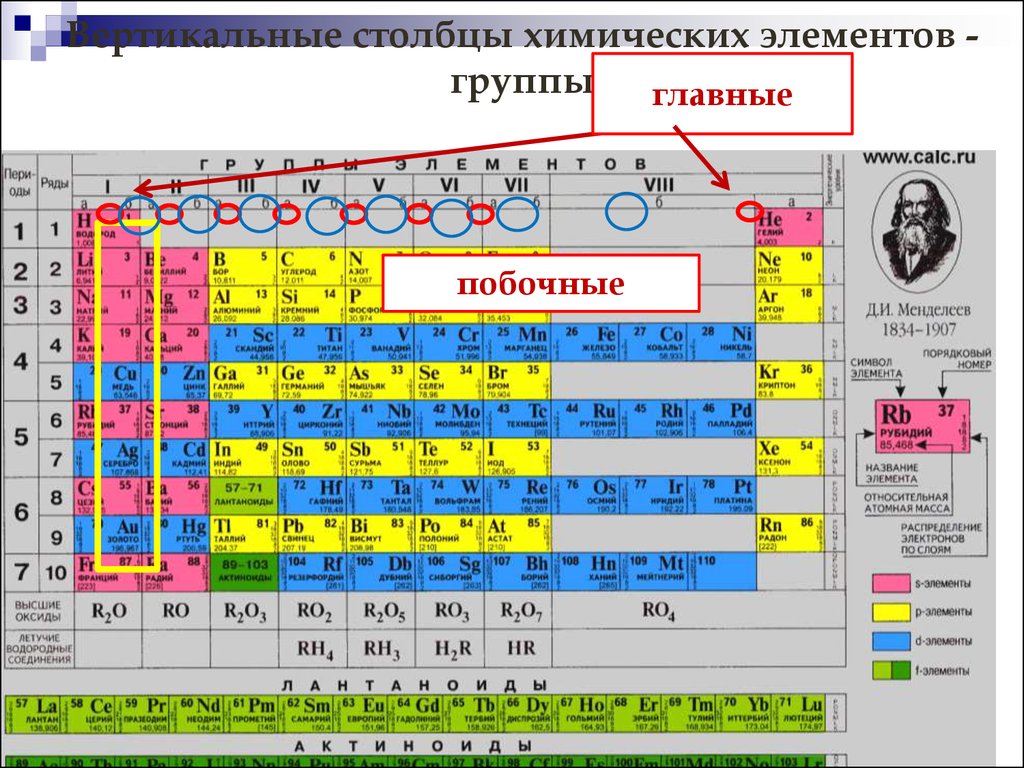
8. Вертикальные столбцы химических элементов - группы
Вертикальные столбцы химических элементов группы главныепобочные
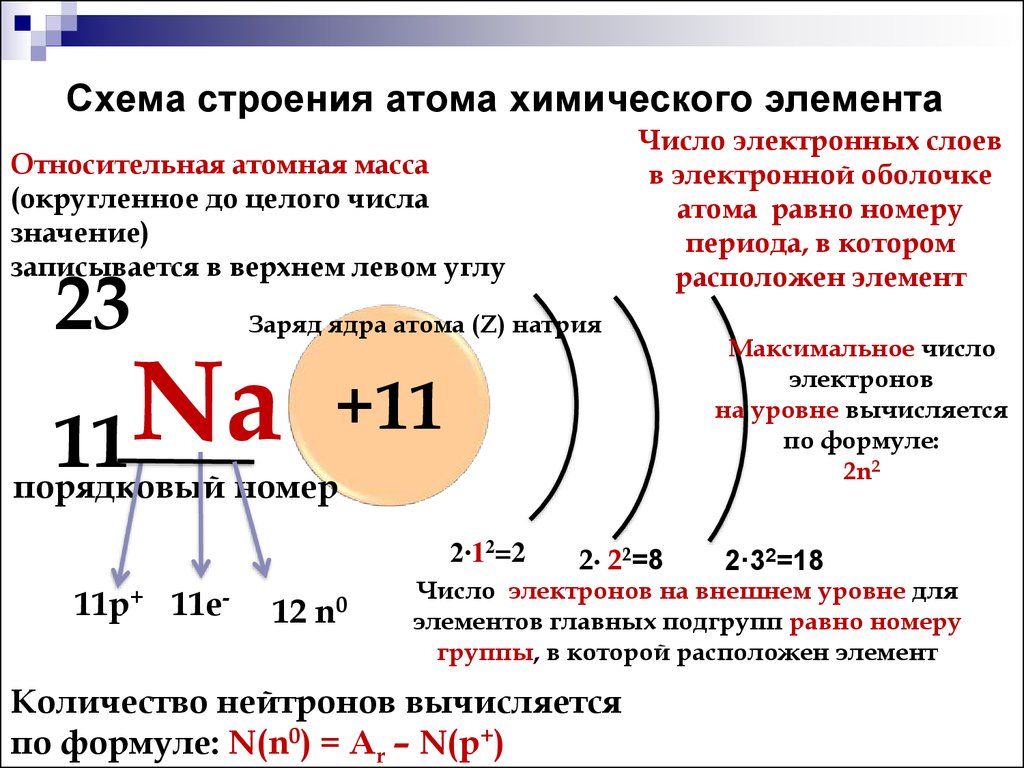
9. Схема строения атома химического элемента
Число электронных слоевв электронной оболочке
атома равно номеру
периода, в котором
расположен элемент
Относительная атомная масса
(округленное до целого числа
значение)
записывается в верхнем левом углу
23
Заряд ядра атома (Z) натрия
Na
11
+11
порядковый номер
2∙12=2
11р+ 11е-
12
n0
2∙ 22=8
Максимальное число
электронов
на уровне вычисляется
по формуле:
2n2
2·32=18
Число электронов на внешнем уровне для
элементов главных подгрупп равно номеру
группы, в которой расположен элемент
Количество нейтронов вычисляется
по формуле: N(n0) = Ar – N(p+)
10. Закрепим!
Заряд ядра атома (Z) алюминия27
Al
13
13р+ 13е-
14 n0
+13
2∙12
2∙ 22
2
8
3
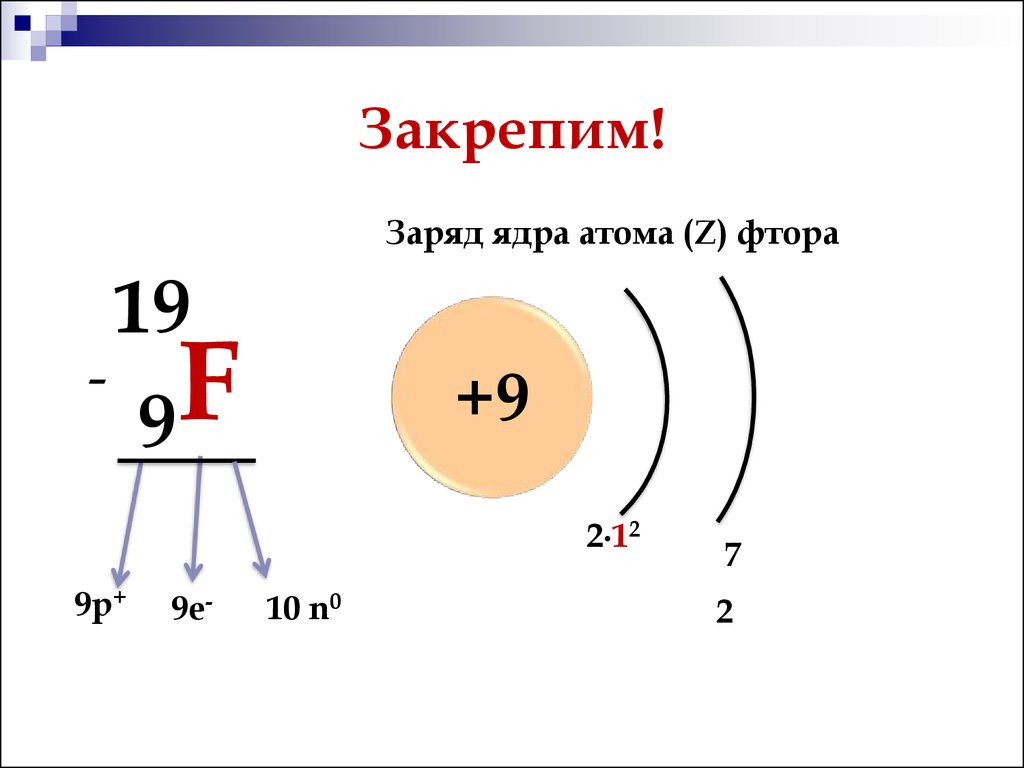
11. Закрепим!
Заряд ядра атома (Z) фтора-
19
F
9
+9
2∙12
9р+
9е-
10 n0
7
2
12. ЗАКОНОМЕРНОСТИ ИЗМЕНЕНИЯ СВОЙСТВ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
13. В пределах одного периода
1.В пределах одного периода
Возрастают:
I
II
III
Li
Be
B
+3
+4
+5
2 1
2 2
23
IV
C
+6
24
V
N
+7
VI
O
+8
25
VII
VIII
F
Ne
+9
+10
26
27
28
Заряд атомного ядра
Число электронов во внешнем слое атомов
Высшая степень окисления элементов в соединениях
Li+1 Be+2 B+3 C+4 N+5
Электроотрицательность
Окислительные свойства
Неметаллические свойства простых веществ
Кислотные свойства высших оксидов и гидроксидов
14. В пределах одного периода
2. Уменьшаются:I
Li
+3
II
Be
+4
21
Радиус
III
B
+5
22
23
IV
V
VI
VII
VIII
C
N
O
F
Ne
+6
+7
+8
+9
+10
24
25
26
27
28
атома
Металлические свойства простых веществ
Восстановительные свойства:
Li - только восстановитель,
С – и окислитель, и восстановитель,
F – только окислитель
Основные свойства высших оксидов и гидроксидов:
LiOH – основание,
Be(OH)2 – амфотерный гидроксид,
HNO3 - кислота
15. В пределах одного периода
3. Не изменяется:I
Li
+3
2 1
II
III
Be
B
+4
+5
22
23
IV
V
C
N
+6
+7
24
25
VI
VII
VIII
O
F
Ne
+8
+9
+10
26
27
28
Число электронных слоёв (энергетических уровней)
в атоме – равно номеру периода
16. Закрепим!
В периодах слева направо заряд ядра атома1)Увеличивается
2)Уменьшается
3)Не
изменяется
4)Сначала увеличивается, а затем уменьшается
17. Закрепим!
В периодах справа налево число энергетическихуровней
1)Увеличивается
2)Уменьшается
3)Не
изменяется
4)Сначала увеличивается, а затем уменьшается
18. Закрепим!
В периодахслева направо
восстановительные свойства элемента
1)Усиливаются
2)Ослабевают
3)Не
изменяются
4)Сначала ослабевают, а затем усиливаются
19. Закрепим!
Атомы химических элементовалюминия и кремния
имеют одинаковое:
1)Значение
зарядов ядер атомов;
2)Число электронов на внешнем слое;
3)Число электронных слоёв;
4)Число электронов
20. Закрепим!
Атомы химических элементовсеры и хлора
имеют различное:
1)Значение
зарядов ядер атомов;
2)Число электронов на внешнем слое;
3)Число электронных слоёв;
4)Общее число электронов
21. В пределах одной А группы
пределах одной А группы1. ВВозрастают:
IА
Заряд атомного ядра
Li +3
Число электронных слоёв в атоме
21
Радиус атома
Восстановительные свойства
Металлические свойства
Na +11
простых веществ
281
Основные свойства высших оксидов
и гидроксидов
K +19
Кислотные свойства (степень
2881
диссоциации)
бескислородных кислот неметаллов
Rb +37
2 8 18 8 1
22. В пределах одной А группы
2. Уменьшаются:VII А
F +9
27
Электроотрицательность;
Окислительные свойства;
Cl +17
287
Неметаллические свойства
простых веществ;
Br +35
2 8 18 7
I +532 8 18 18 7
Прочность (устойчивость) летучих
водородных соединений.
23. В пределах одной А группы
3. Не изменяются:II А
Be +4
22
Mg +12
Ca +20
282
2882
Sr +38
2 8 18 8 2
Число электронов во внешнем
электронном слое
Степень окисления элементов в
высших оксидах и гидроксидах (как
правило, равная номеру группы)
Be+2
Mg+2
Ca+2
Sr+2
24. Закрепим!
1)2)
3)
4)
В главных подгруппах
снизу вверх
заряд ядра атома
Увеличивается
Уменьшается
Не изменяется
Сначала увеличивается, а затем уменьшается
25. Закрепим!
В главных подгруппахснизу вверх
число электронов на внешнем уровне
1)Увеличивается
2)Уменьшается
3)Не
изменяется
4)Сначала увеличивается, а затем уменьшается
26. Закрепим!
В главных подгруппахснизу вверх
окислительные свойства элемента
1)Усиливаются
2)Ослабевают
3)Не
изменяется
4)Сначала увеличивается, а затем уменьшается
27. Закрепим!
Атомы химических элементовуглерода и кремния
имеют одинаковое:
1)Значение
зарядов ядер атомов;
2)Число электронов на внешнем слое;
3)Число электронных слоёв;
4)Общее число электронов в атоме
28. Закрепим!
Атомы химических элементовазота и фосфора
имеют различное:
1)Значение
зарядов ядер атомов;
2)Число электронов на внешнем слое;
3)Число электронных слоёв;
4)Общее число электронов






















 chemistry
chemistry








