Similar presentations:
Периодическая система Д.И. Менделеева и строение атома
1.
Обязательный минимум знанийпри подготовке к ОГЭ по химии
Периодическая система
Д.И. Менделеева
и строение атома
Автор: Кулаева Галина Николаевна,
учитель химии
МБОУ СОШ с. Троицкого
Моздокского района РСО - Алания
2.
Цель:• Повторить основные теоретические вопросы
программы 8 класса;
• Закрепить знания о причинах изменения
свойств химических элементов на основании
положения в ПСХЭ Д.И. Менделеева;
• Научить обоснованно объяснять и сравнивать
свойства элементов, а также образованных
ими простых и сложных веществ по
положению в ПСХЭ;
• Подготовить к успешной сдаче ОГЭ по химии
3.
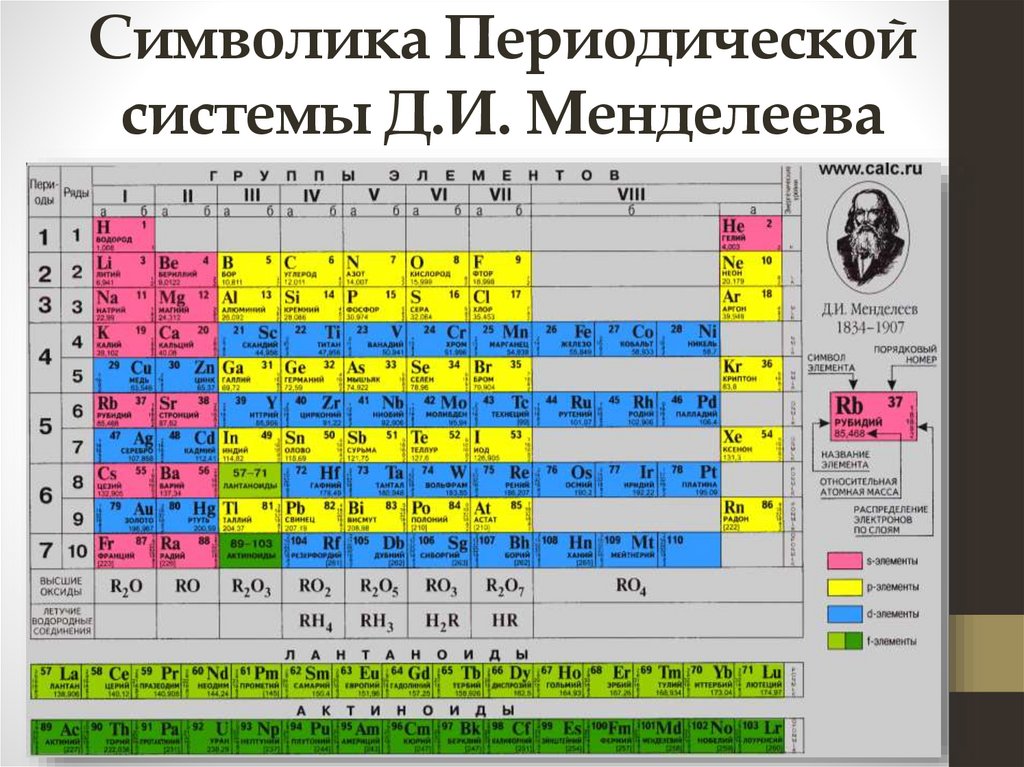
Символика Периодическойсистемы Д.И. Менделеева
4.
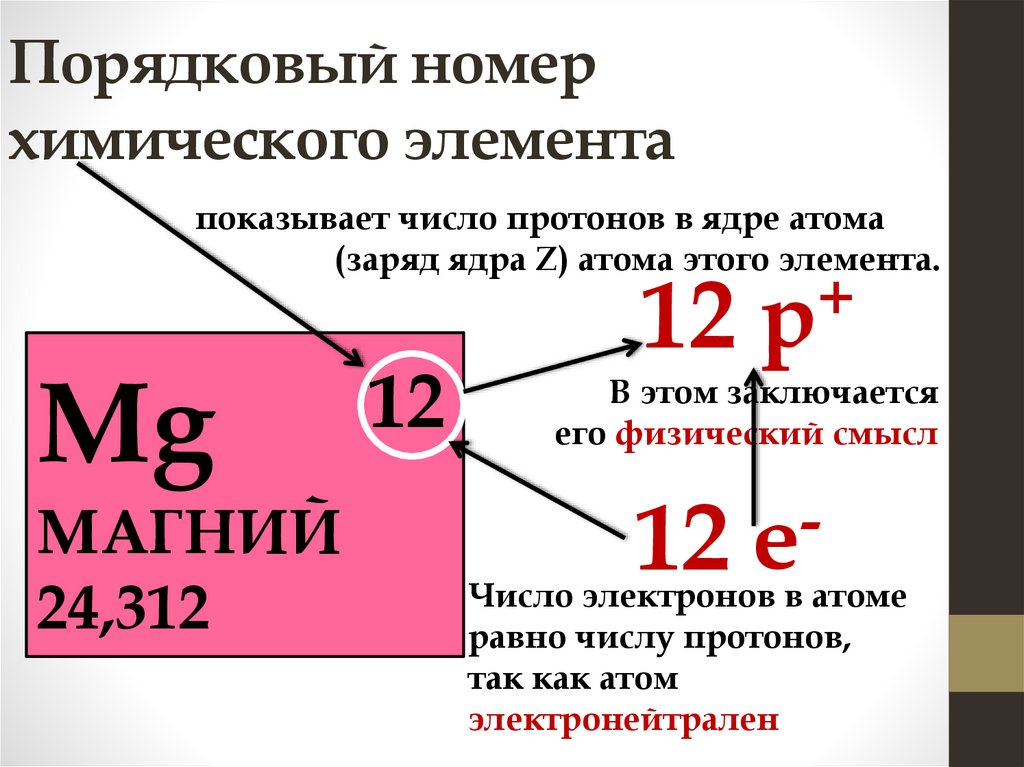
Порядковый номерхимического элемента
показывает число протонов в ядре атома
(заряд ядра Z) атома этого элемента.
Mg
МАГНИЙ
24,312
12
+
12 р
В этом заключается
его физический смысл
12 е
Число электронов в атоме
равно числу протонов,
так как атом
электронейтрален
5.
Закрепим!Са
20
КАЛЬЦИЙ
40,08
S
СЕРА
32,064
32
S
Z = +20
+
20 р
20 е
Z = +32
32 р+
32е-
6.
Закрепим!Zn
30
Z = +30
+
30 р
30 е
35
Z = +35
35 р+
35е-
ЦИНК
65,37
Br
БРОМ
79,904
S
7.
Горизонтальные строки химическихэлементов - периоды
малые
большие
незавершенный
8.
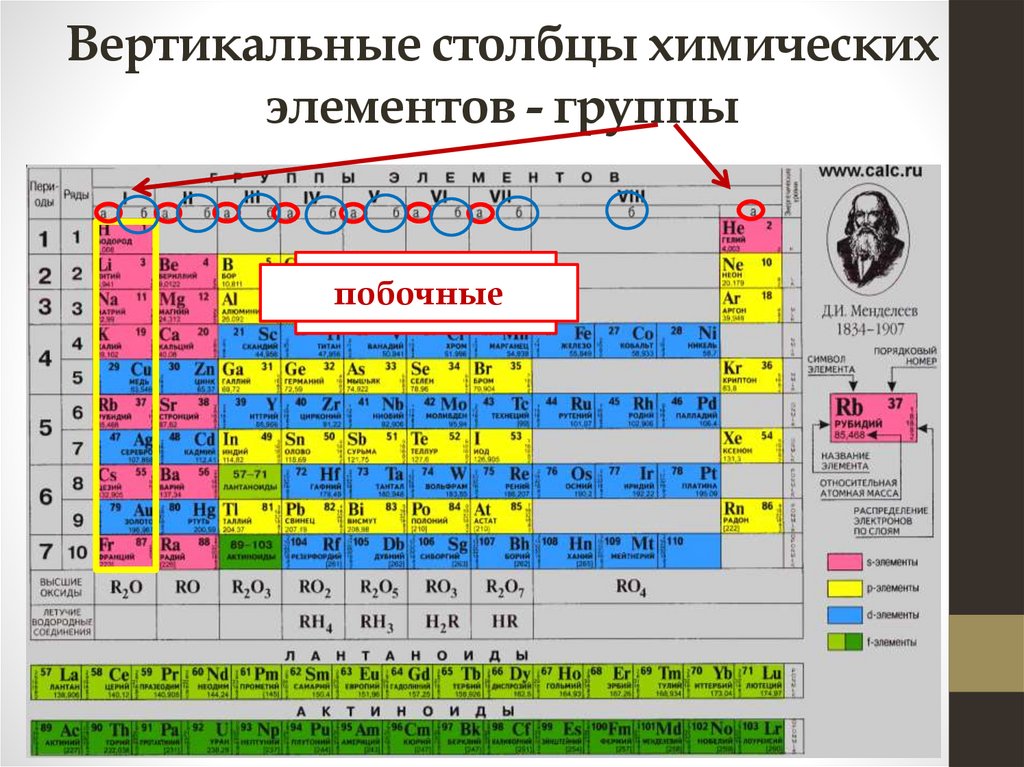
Вертикальные столбцы химическихэлементов - группы
побочные
главные
9.
Пример записи схемы строенияатома химического элемента
Число
электронных слоев
Относительная атомная
масса
электронной
оболочке атома равно
(округленное дов целого
числа значение)
периода,
в котором
записывается вномеру
верхнем
левом углу
над расположен
элемент
порядковым номером
-
23
+11
Na
11
Заряд ядра атома (Z) натрия
Натрий: порядковый номер 11
2
(записывается в нижнем левом углу
2∙1
1
2 2∙ 282
рядом с символом химического элемента)
11р+ 11е- Количество
нейтронов вычисляется
12 n0
0) = A –уровне
+) для
Число электронов
наN(n
внешнем
по формуле:
N(p
Максимальное
число
электронов
r
элементов главных
подгрупп
равно номеру
группы,
на уровне
вычисляется
по формуле:
в которой расположен 2n
элемент
2
10.
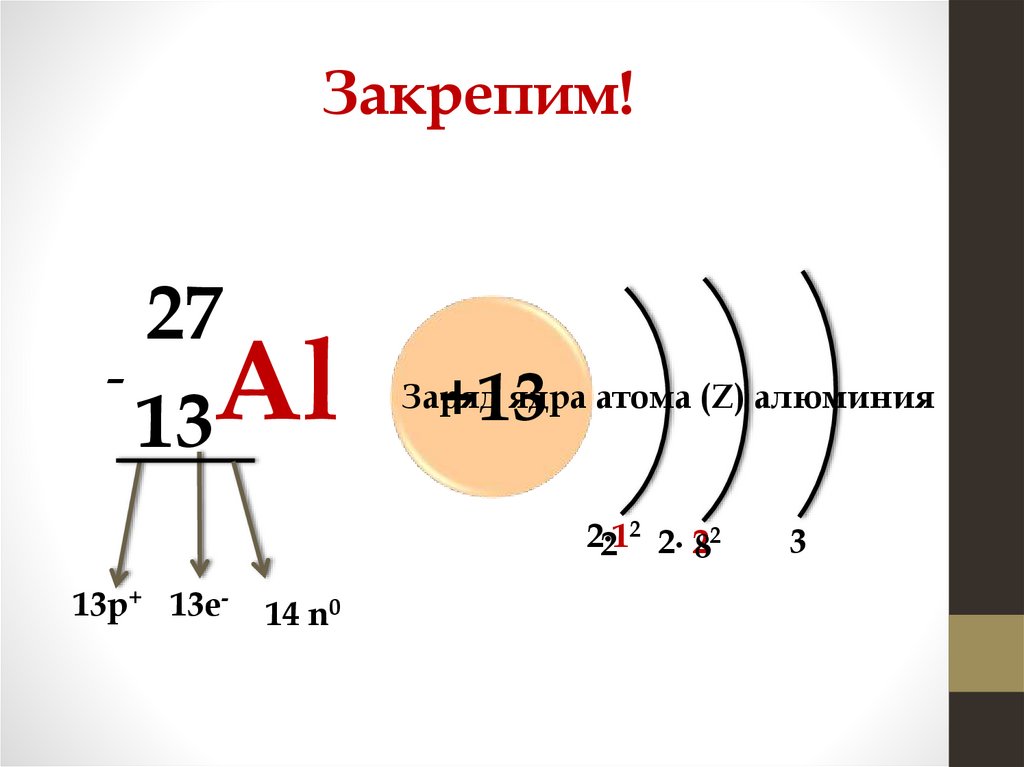
Закрепим!27
Al
13
+13
Заряд ядра атома (Z) алюминия
2
2∙1
2 2∙ 282
13р+ 13е-
14 n0
3
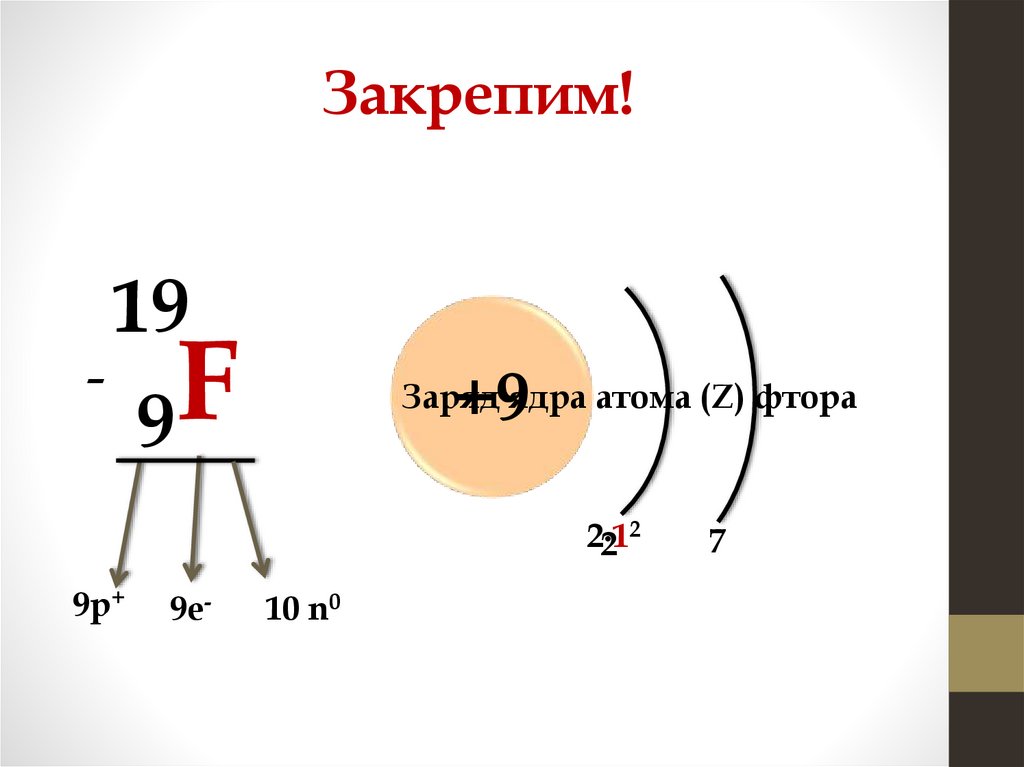
11.
Закрепим!-
19
F
9
+9
Заряд ядра атома (Z) фтора
2
2∙1
2
9р+
9е-
10 n0
7
12.
ЗАКОНОМЕРНОСТИ ИЗМЕНЕНИЯ СВОЙСТВЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
13.
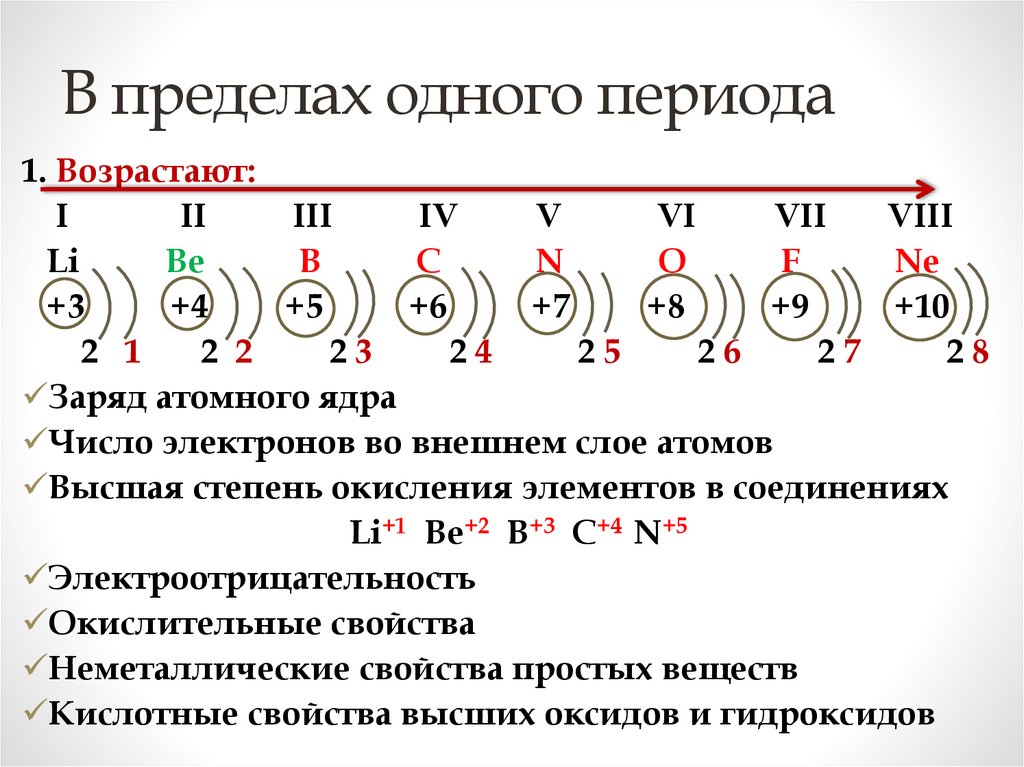
В пределах одного периода1. Возрастают:
I
II
III
IV
V
VI
VII
VIII
Li
Be
B
C
N
O
F
Ne
+3
+4
+5
+6
+7
+8
+9
+10
2 1
2 2
23
24
25
26
27
28
Заряд атомного ядра
Число электронов во внешнем слое атомов
Высшая степень окисления элементов в соединениях
Li+1 Be+2 B+3 C+4 N+5
Электроотрицательность
Окислительные свойства
Неметаллические свойства простых веществ
Кислотные свойства высших оксидов и гидроксидов
14.
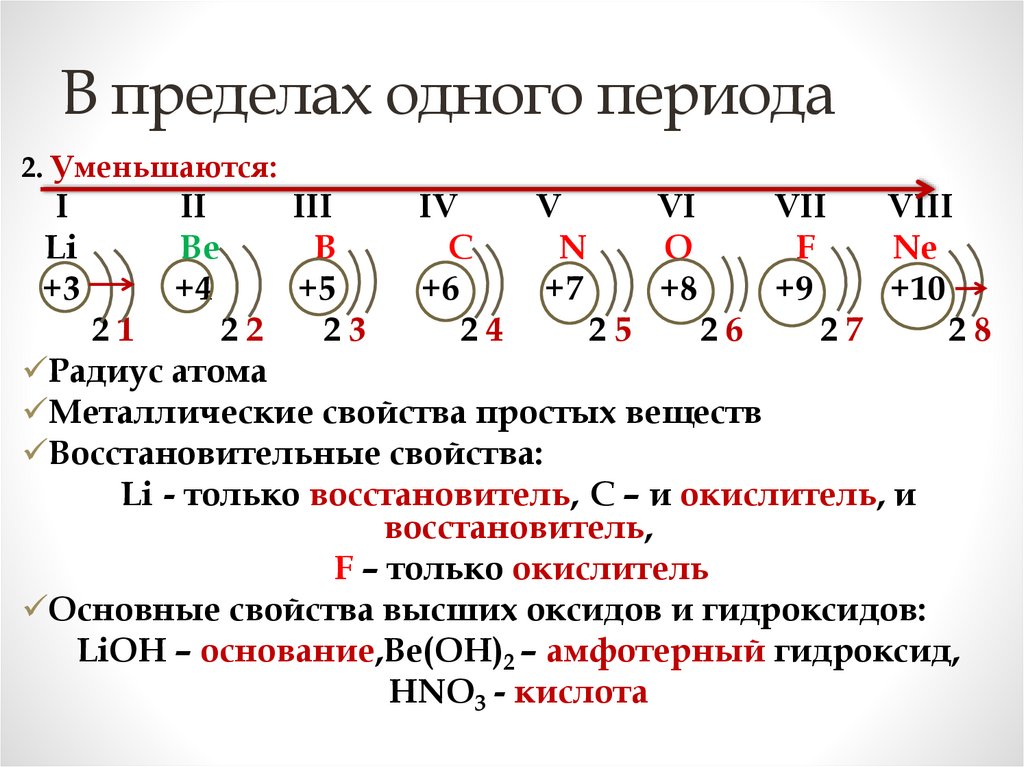
В пределах одного периода2. Уменьшаются:
I
Li
+3
II
Be
+4
III
IV
V
VI
VII
VIII
B
C
N
O
F
Ne
+5
+6
+7
+8
+9
+10
21
22
23
24
25
26
27
28
Радиус атома
Металлические свойства простых веществ
Восстановительные свойства:
Li - только восстановитель, С – и окислитель, и
восстановитель,
F – только окислитель
Основные свойства высших оксидов и гидроксидов:
LiOH – основание,Be(OH)2 – амфотерный гидроксид,
HNO3 - кислота
15.
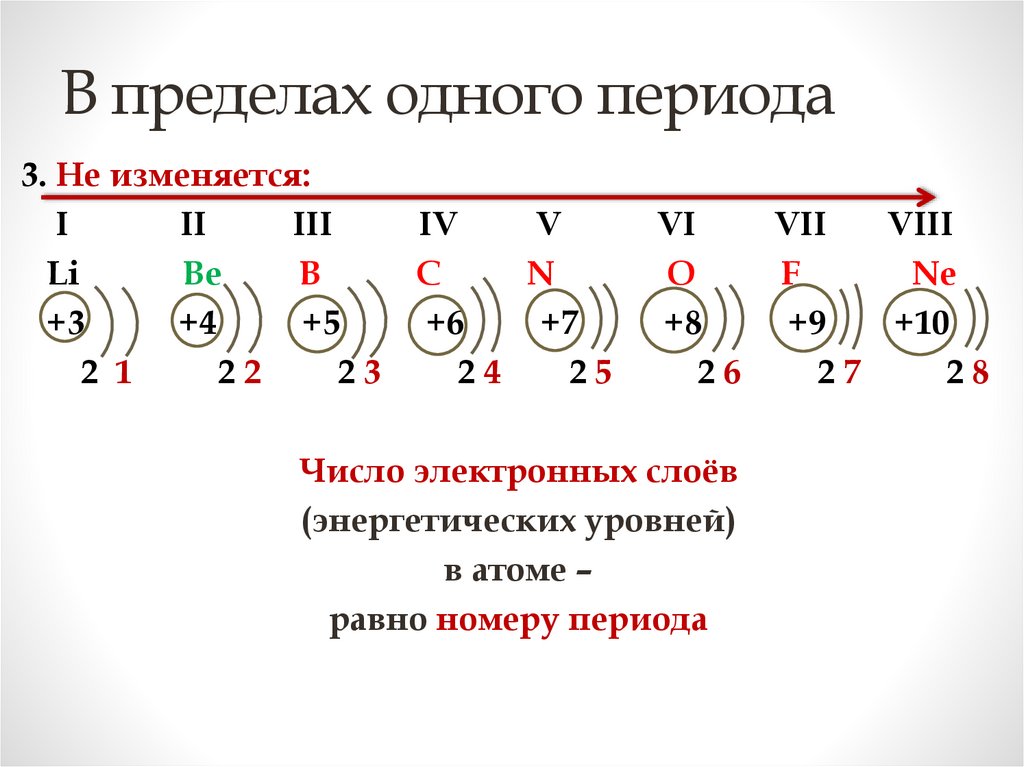
В пределах одного периода3. Не изменяется:
I
II
III
Li
Be
B
+3
+4
+5
2 1
22
23
IV
V
C
N
+6
+7
24
25
VI
VII
VIII
O
F
Ne
+8
+9
+10
26
27
28
Число электронных слоёв
(энергетических уровней)
в атоме –
равно номеру периода
16.
Закрепим!В периодах
слева направо
заряд ядра атома
1) Увеличивается
2) Уменьшается
3) Не изменяется
4) Сначала увеличивается, а затем уменьшается
17.
Закрепим!В периодах
справа налево
число энергетических уровней
1) Увеличивается
2) Уменьшается
3) Не изменяется
4) Сначала увеличивается, а затем уменьшается
18.
Закрепим!В периодах
слева направо
восстановительные свойства элемента
1) Усиливаются
2) Ослабевают
3) Не изменяются
4) Сначала ослабевают, а затем усиливаются
19.
Закрепим!Атомы химических элементов
алюминия и кремния
имеют одинаковое:
1) Значение зарядов ядер атомов;
2) Число электронов на внешнем слое;
3) Число электронных слоёв;
4) Число электронов
20.
Закрепим!Атомы химических элементов
серы и хлора
имеют различное:
1) Значение зарядов ядер атомов;
2) Число электронов на внешнем слое;
3) Число электронных слоёв;
4) Общее число электронов
21.
В пределах одной А группы1. Возрастают:
IА
• Заряд атомного ядра
Li +3
• Число электронных слоёв в атоме
• Радиус атома
21
• Восстановительные свойства
• Металлические свойства
Na +11
простых веществ
281
• Основные свойства высших оксидов
и гидроксидов
• Кислотные свойства (степень
K +19
диссоциации)
2881
бескислородных кислот неметаллов
Rb +37
2 8 18 8 1
22.
В пределах одной А группы2. Уменьшаются:
VII А
• Электроотрицательность;
F +9
27
• Окислительные свойства;
Cl +17
287
Br +35
2 8 18 7
I +53
2 8 18 18 7
• Неметаллические свойства
простых веществ;
• Прочность (устойчивость)
летучих водородных соединений.
23.
В пределах одной А группы3. Не изменяются:
II А
Be +4
22
• Число электронов во внешнем
электронном слое
Mg +12
282
Ca +20
• Степень окисления элементов в
высших оксидах и гидроксидах (как
правило, равная номеру группы)
2882
Sr +38
2 8 18 8 2
Be+2
Mg+2
Ca+2
Sr+2
24.
Закрепим!• В главных подгруппах
снизу вверх
заряд ядра атома
1) Увеличивается
2) Уменьшается
3) Не изменяется
4) Сначала увеличивается, а затем уменьшается
25.
Закрепим!В главных подгруппах
снизу вверх
число электронов на внешнем уровне
1) Увеличивается
2) Уменьшается
3) Не изменяется
4) Сначала увеличивается, а затем уменьшается
26.
Закрепим!В главных подгруппах
снизу вверх
окислительные свойства элемента
1) Усиливаются
2) Ослабевают
3) Не изменяется
4) Сначала увеличивается, а затем уменьшается
27.
Закрепим!Атомы химических элементов
углерода и кремния
имеют одинаковое:
1) Значение зарядов ядер атомов;
2) Число электронов на внешнем слое;
3) Число электронных слоёв;
4) Общее число электронов в атоме
28.
Закрепим!Атомы химических элементов
азота и фосфора
имеют различное:
1) Значение зарядов ядер атомов;
2) Число электронов на внешнем слое;
3) Число электронных слоёв;
4) Общее число электронов
29.
Домашнее задание:•§ 36, тест стр. 268-272
30.
Спасибо за активную работу!31.
Список литературы• Таблица Д.И. Менделеева
http://s00.yaplakal.com/pics/pics_original/7/7/0
/2275077.gif
• Габриелян О.С. «Химия. 9 класс», - ДРОФА, М., 2013, с. 267-268
• Савельев А.Е. Основные понятия и законы
химии. Химические реакции. 8 – 9 классы. – М.:
ДРОФА, 2008, - с. 6-48.
• Рябов М.А., Невская Е.Ю. «Тесты по химии» к
учебнику О.С. Габриеляна «Химия. 9 класс». –
М.: ЭКЗАМЕН, 2010, с. 5-7























 chemistry
chemistry