Similar presentations:
Периодический закон и периодическая система Д.И. Менделеева в свете учения о строении атома
1. Муниципальное казенное общеобразовательное учреждение: средняя общеобразовательная школа п. Кирпичный
Устюжанина СнежанаНиколаевна,
учитель химии, биологии и
экологии
Первая квалификационная
категория
30.11.2023
2017 г.
1
2. «Периодический закон и периодическая система Д. И. Менделеева в свете учения о строении атома»
Д. И. Менделеев1834 — 1907 гг.
3. ЦЕЛЬ: Сформировать представление о Периодическом законе и периодической системе химических элементов Д.И. Менделеева в свете
учения остроении атома.
Задачи:
1. Повторить, углубить и обобщить знания о строении
атома, Периодическом законе и периодической системе
химических элементов Д.И. Менделеева.
2. Познакомить с основными принципами заполнения
электронами электронных орбиталей атомов химических
элементов.
3. Закрепить навыки и умения написания схем
электронного строения атомов химических элементов,
составления электронно – графических формул
химических элементов.
4. ХОД УРОКА:
1. Организационный момент.2. Изучение нового материала
(презентация).
3. Закрепление изученного материала
(презентация и самостоятельная работа).
4. Домашнее задание.
5. Химия – это область чудес, где скрыто счастье человечества, и величайшие завоевания разума будут сделаны именно в этой области.
М. Горький30.11.2023
5
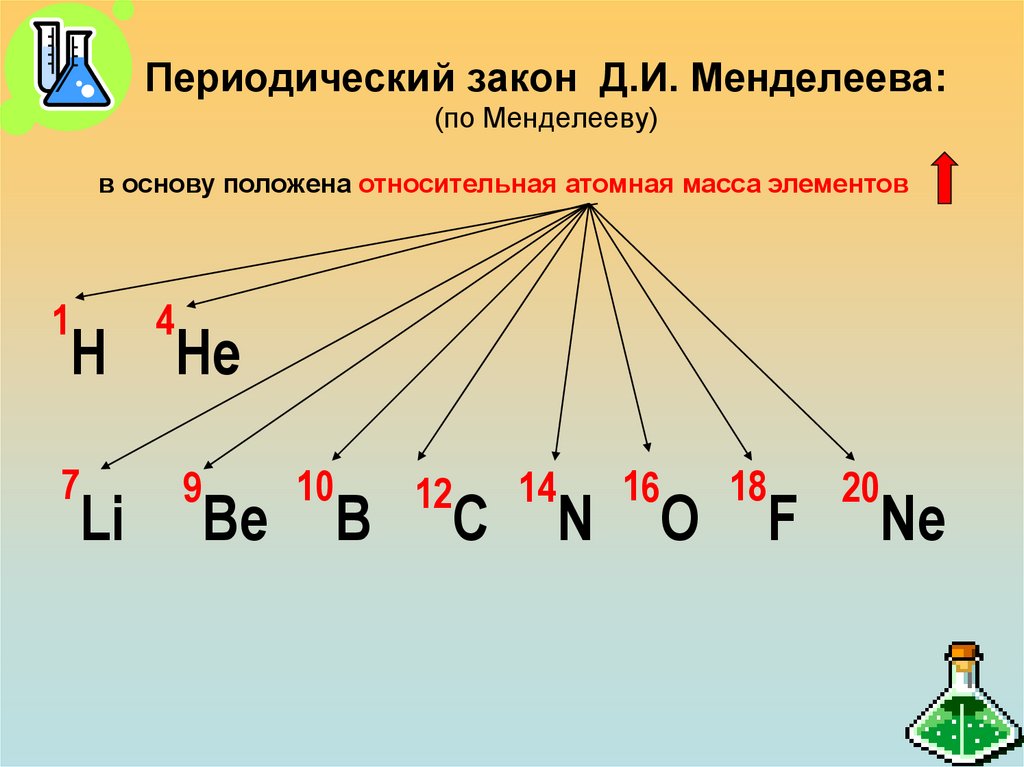
6. Периодический закон Д.И. Менделеева: (по Менделееву)
в основу положена относительная атомная масса элементов1
Н
7
Li
4
Не
9
Be
10
B
12
C
14
N
16
O
18
F
20
Ne
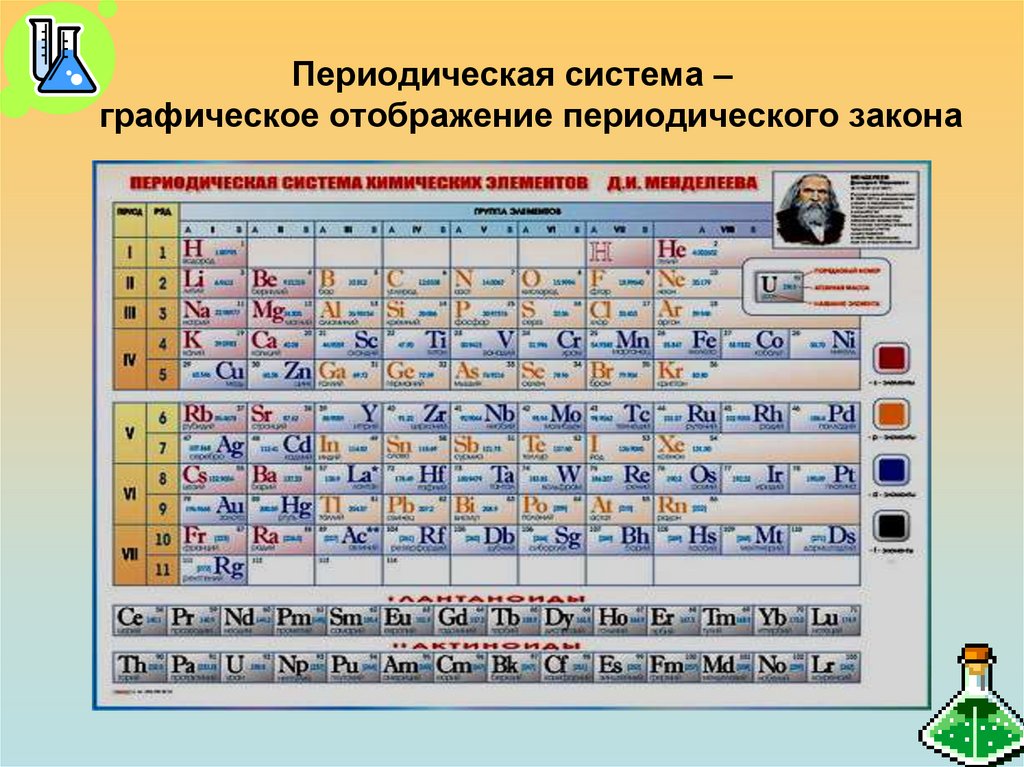
7. Периодическая система – графическое отображение периодического закона
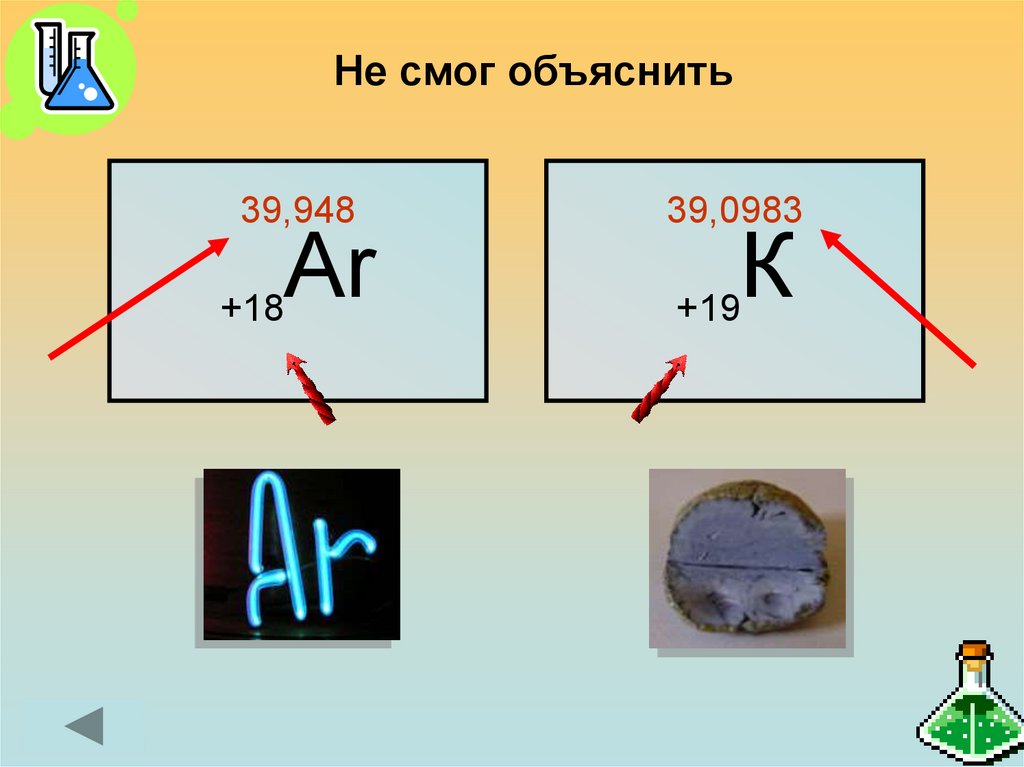
8.
Не смог объяснить39,948
Аr
+18
39,0983
К
+19
9. Строение атома
МОДЕЛЬ «ПУДИНГА»(анг.уч. Джозеф-Джон Томсон - 1904г.)
«ПЛАНЕТАРНАЯ МОДЕЛЬ»
( Э. Резерфорд – 1911г.)
10. Строение атома
Э. Резерфорд30.11.2023
В 1910 г. Эрнест Резерфорд со своими
учениками и коллегами изучал
рассеивание альфа-частиц,
проходящих через тонкую золотую
фольгу и попадавших на экран.
Доказал, что атом имеет плотное ядро.
Предложил планетарную теорию строения
атома.
10
11. Строение атома
Дж. Томсон30.11.2023
Доказал, что электроны несут на
себе отрицательный заряд,
определил массу и скорость
движения.
11
12. Строение атома
30.11.202312
13. Строение атома
Квантовыепостулаты Бора:
1.
Электрон вращается вокруг ядра по строго определенным
орбитам («разрешенные» значения Е1, Е2,...Еn)
(энергия не поглощается и не излучается)
2.
Электрон может переходит из одного «разрешенного»
энергетического состояния в другое
(энергия поглощается или излучается)
14. Атом водорода
30.11.202314
15. Структура атома
30.11.202315
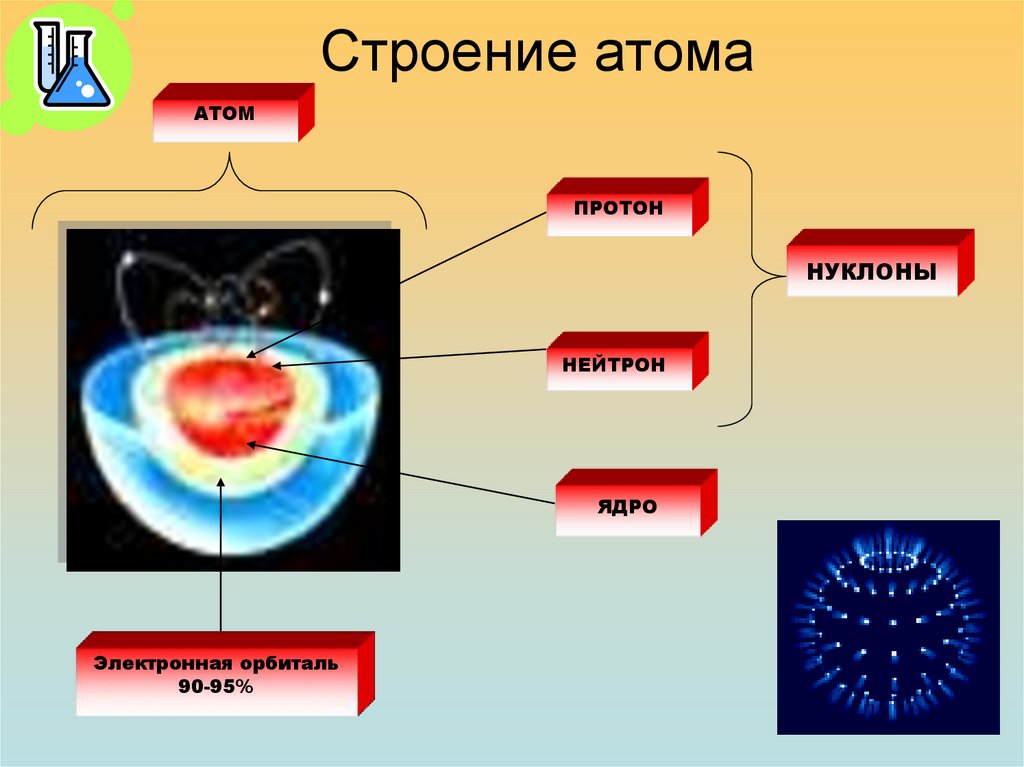
16.
Строение атомаАТОМ
ПРОТОН
НУКЛОНЫ
НЕЙТРОН
ЯДРО
Электронная орбиталь
90-95%
17. Характеристики элементарных частиц
30.11.202317
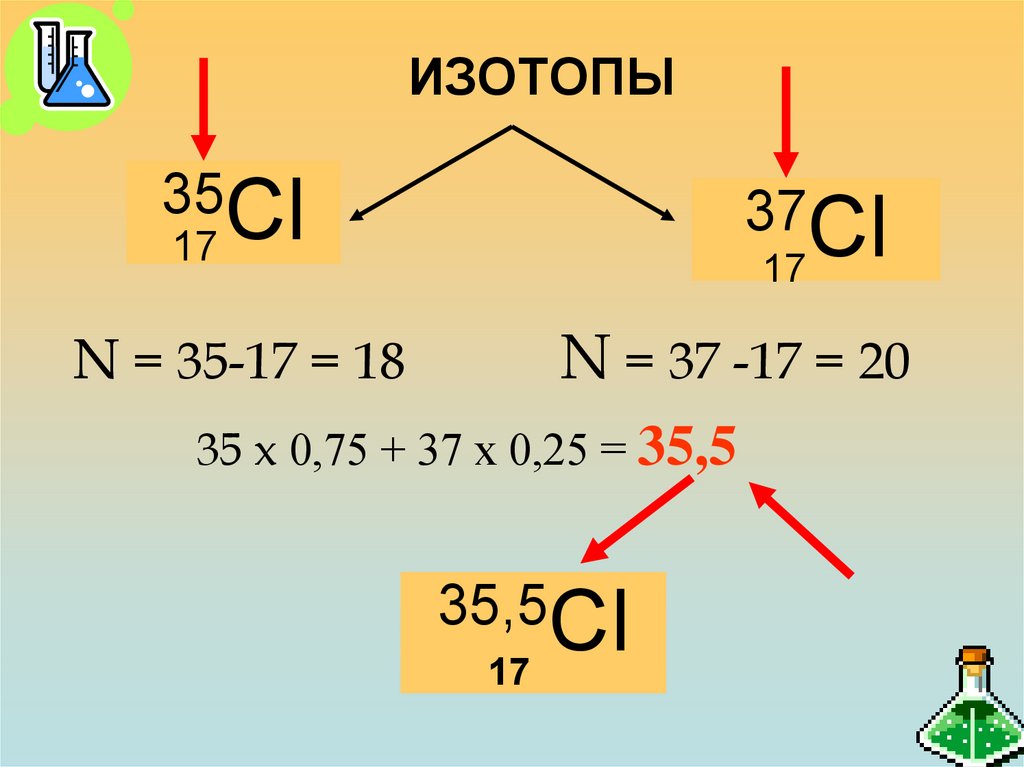
18. ИЗОТОПЫ
35Сl37Сl
17
17
N = 37 -17 = 20
N = 35-17 = 18
35 x 0,75 + 37 х 0,25 = 35,5
35,5Сl
17
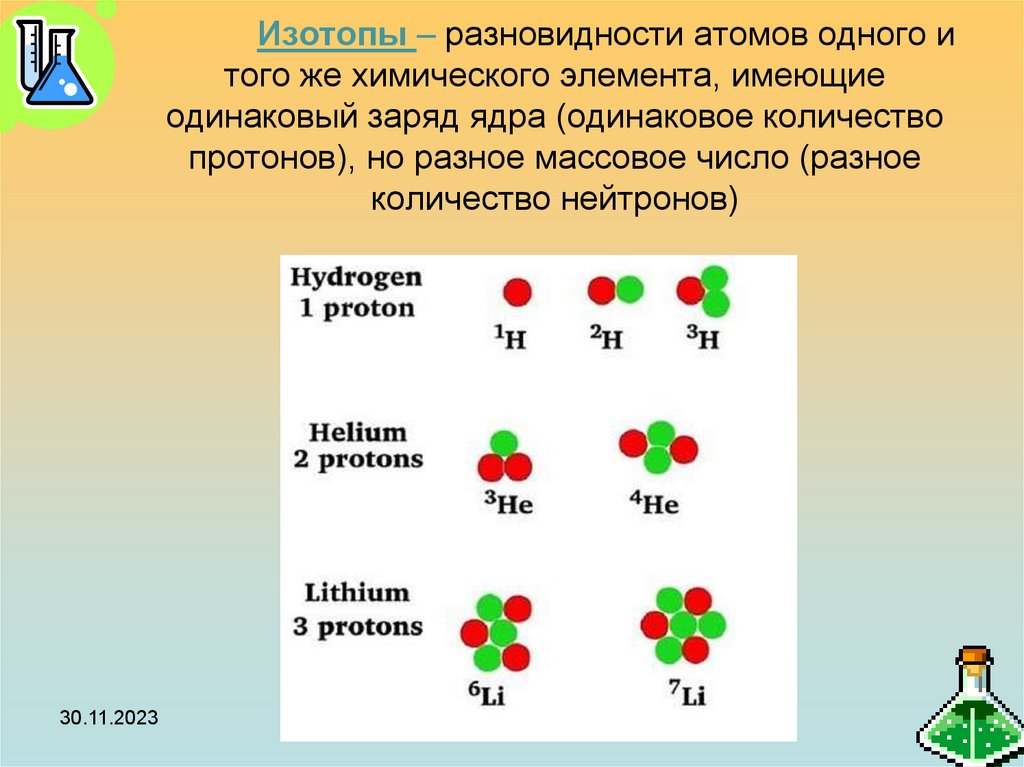
19. Изотопы – разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд ядра (одинаковое количество
протонов), но разное массовое число (разноеколичество нейтронов)
30.11.2023
19
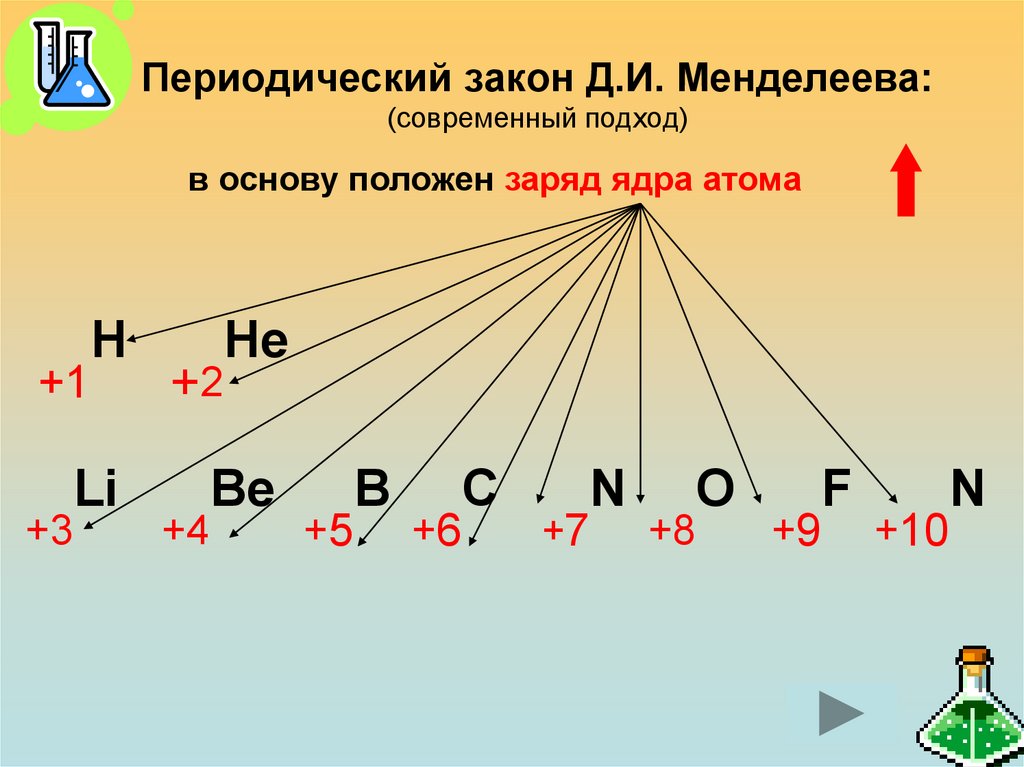
20. Периодический закон Д.И. Менделеева: (современный подход)
в основу положен заряд ядра атомаН
+1
+3
Li
+2
+4
Не
Be
B
+5
C
+6
N
+7
+8
O
F
+9
N
+10
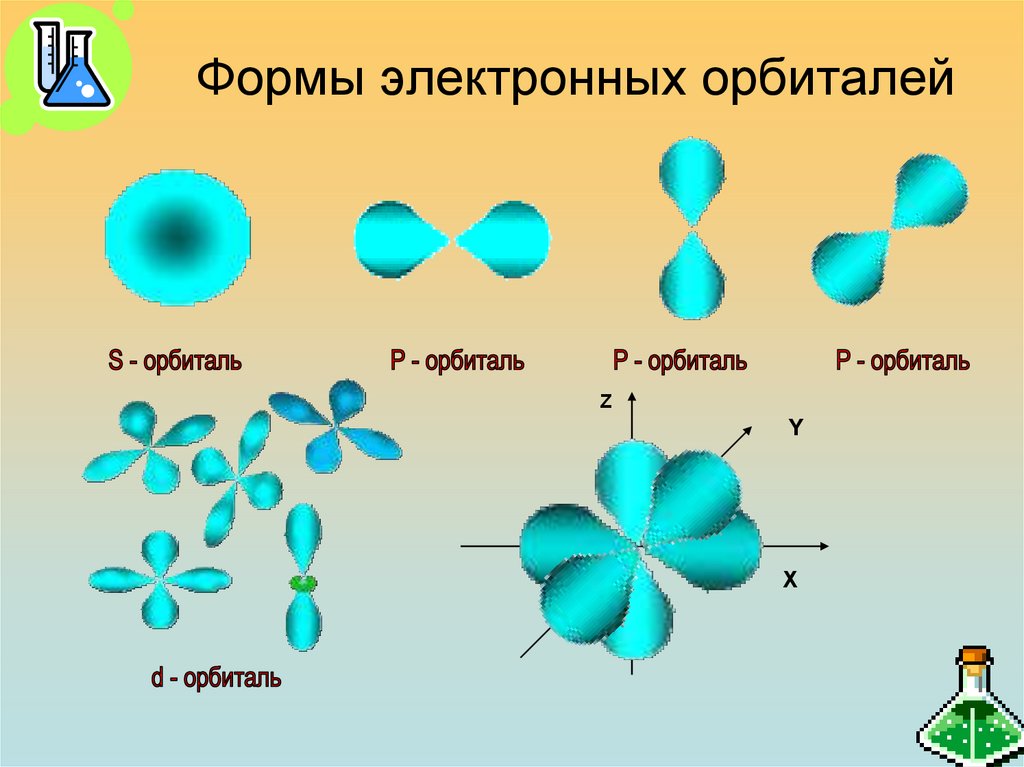
21. Формы электронных орбиталей
ZY
X
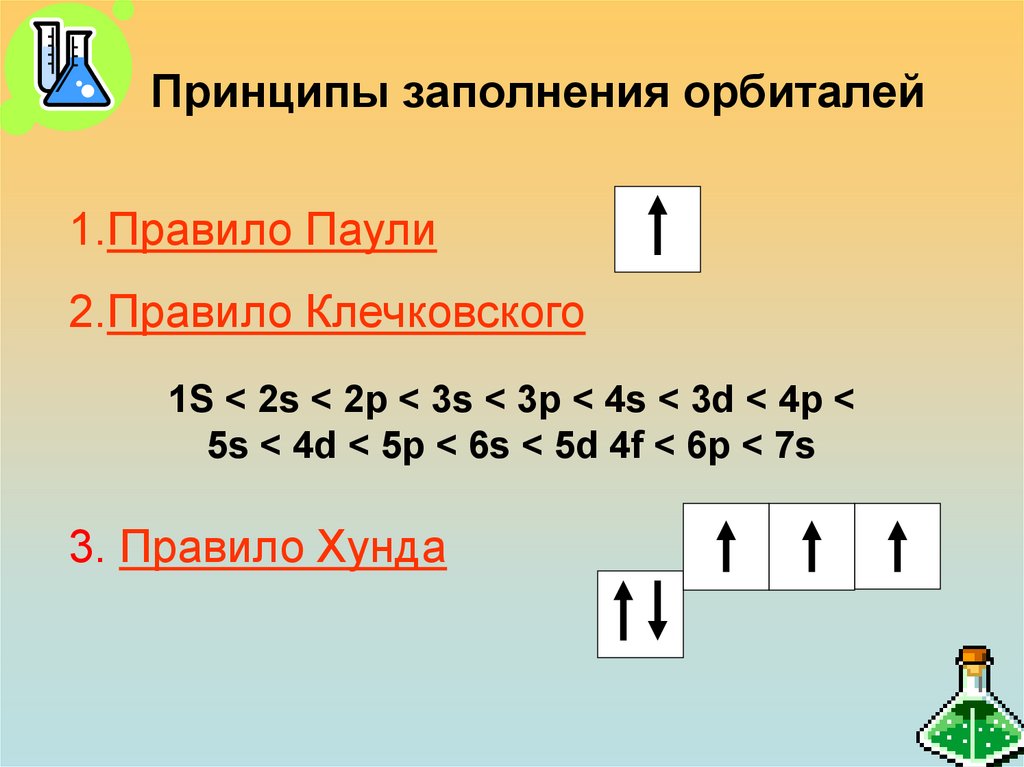
22. Принципы заполнения орбиталей
1.Правило Паули2.Правило Клечковского
1S < 2s < 2p < 3s < 3p < 4s < 3d < 4p <
5s < 4d < 5p < 6s < 5d 4f < 6p < 7s
3. Правило Хунда
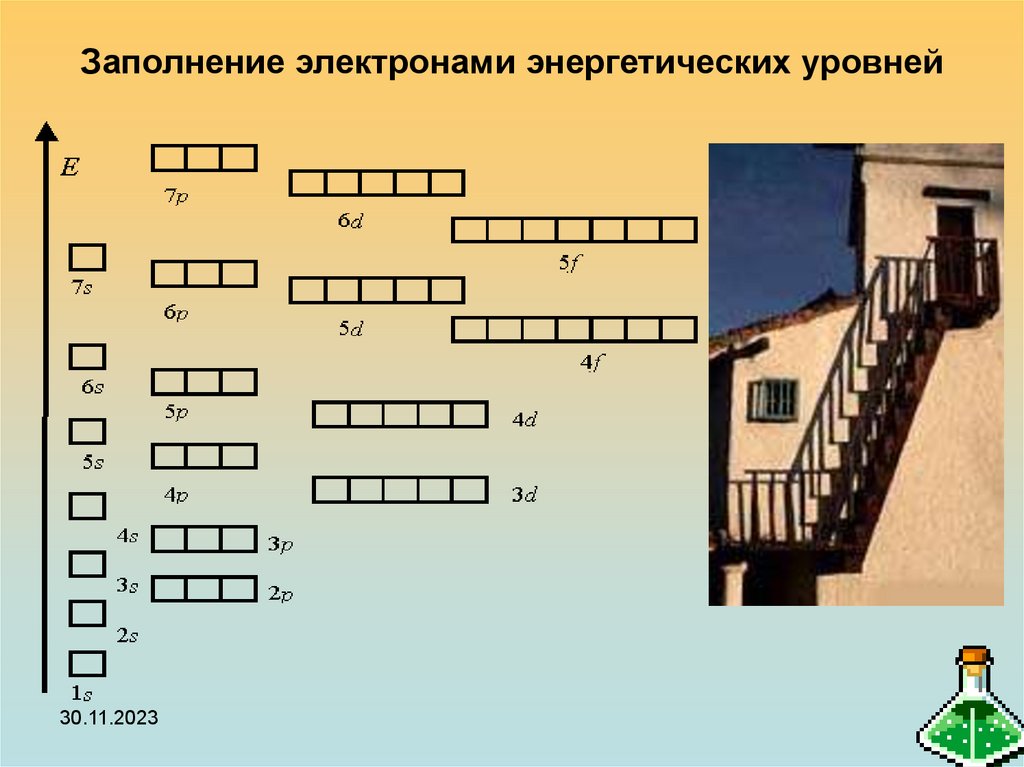
23. Заполнение электронами энергетических уровней
30.11.202323
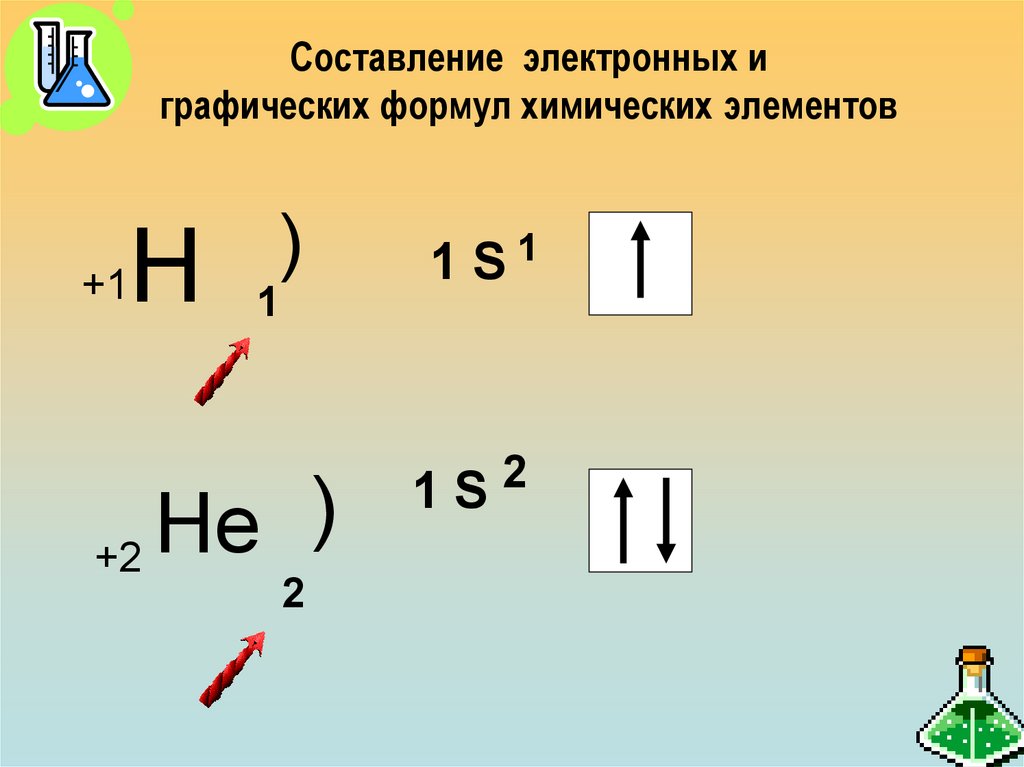
24. Составление электронных и графических формул химических элементов
Н+1
)
1
)
Нe
+2
2
1 S1
2
1S
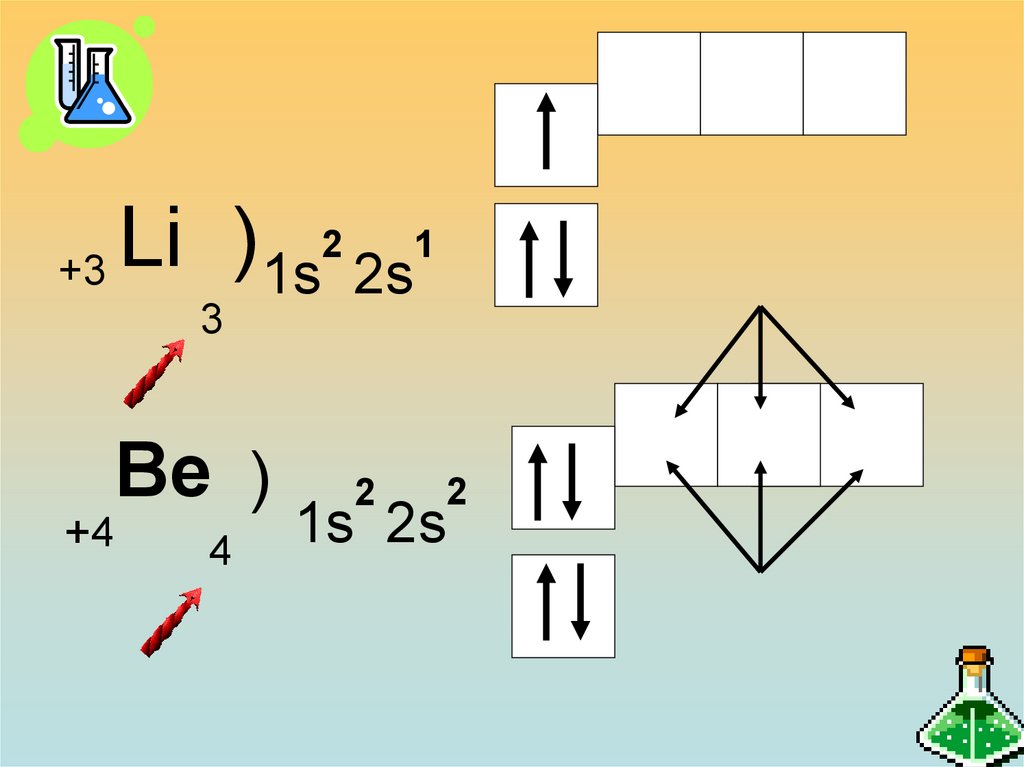
25.
21
Li
)
+3
1s 2s
3
Вe )
+4
4
2
1s 2s
2
26.
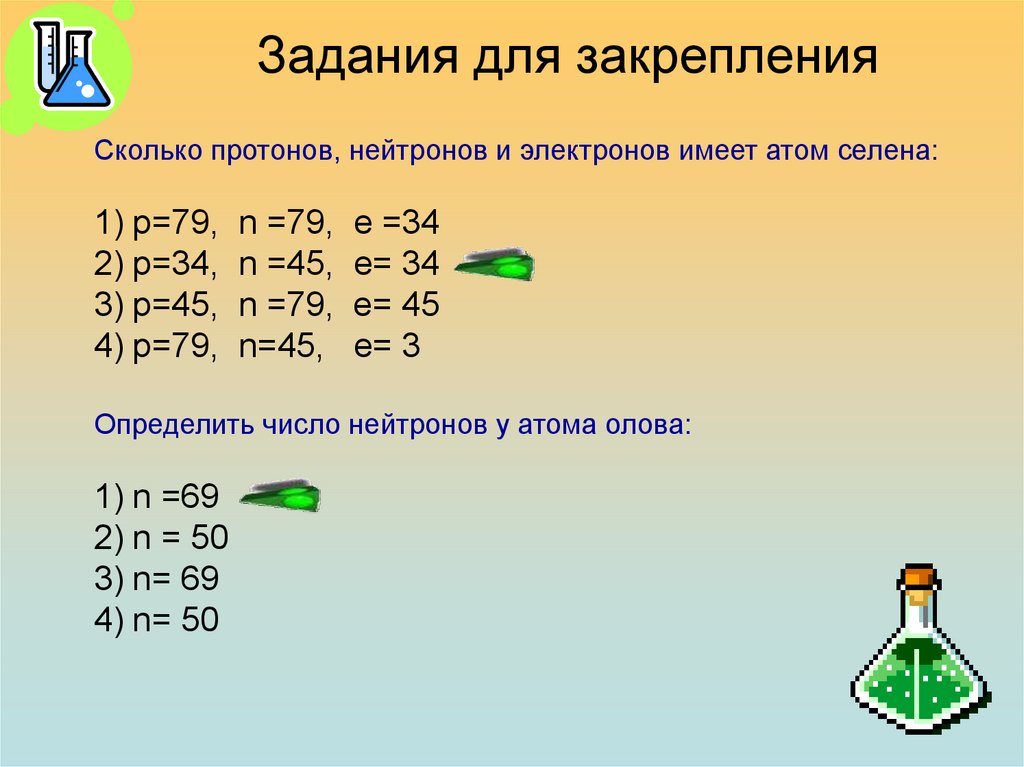
Задания для закрепленияСколько протонов, нейтронов и электронов имеет атом селена:
1) р=79,
2) р=34,
3) р=45,
4) р=79,
n =79,
n =45,
n =79,
n=45,
е =34
е= 34
е= 45
е= 3
Определить число нейтронов у атома олова:
1) n =69
2) n = 50
3) n= 69
4) n= 50
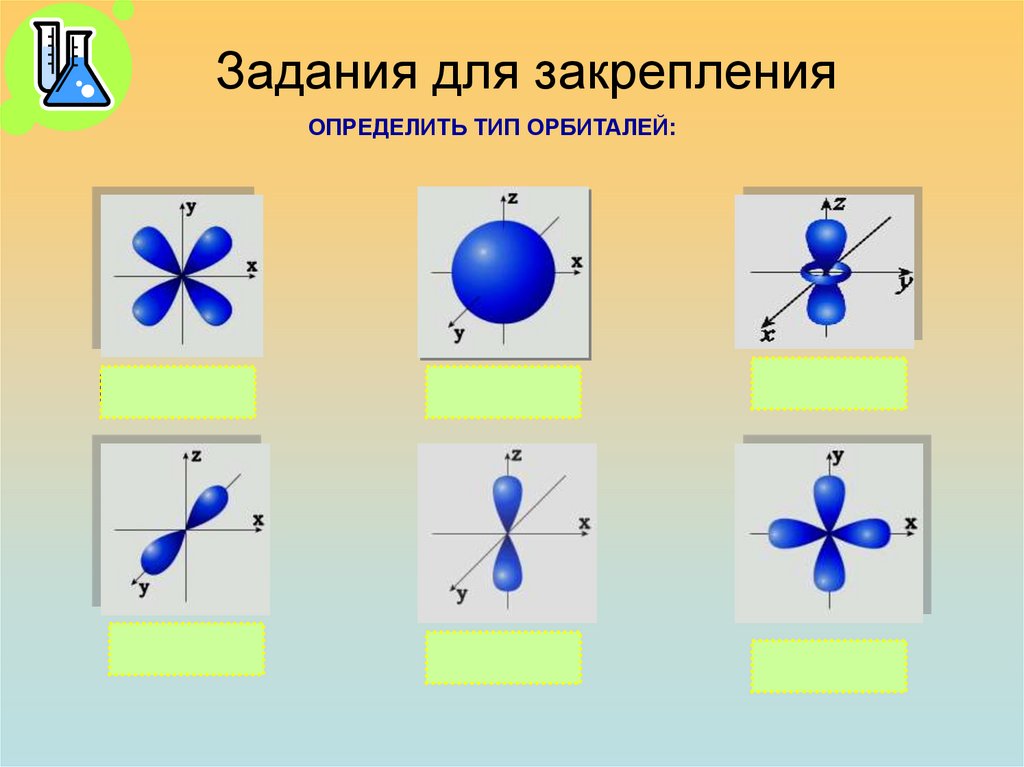
27. Задания для закрепления
ОПРЕДЕЛИТЬ ТИП ОРБИТАЛЕЙ:d yz
Py
S
Pz
d
d
28. Задания для закрепления
НЕ СУЩЕСТВУЮТ ЭЛЕКТРОННЫЕ ОРБИТАЛИ:1s 2s 3s 4s 1p
2p 3p 4p 1d 2d
3d 4d 1f 2f 3f
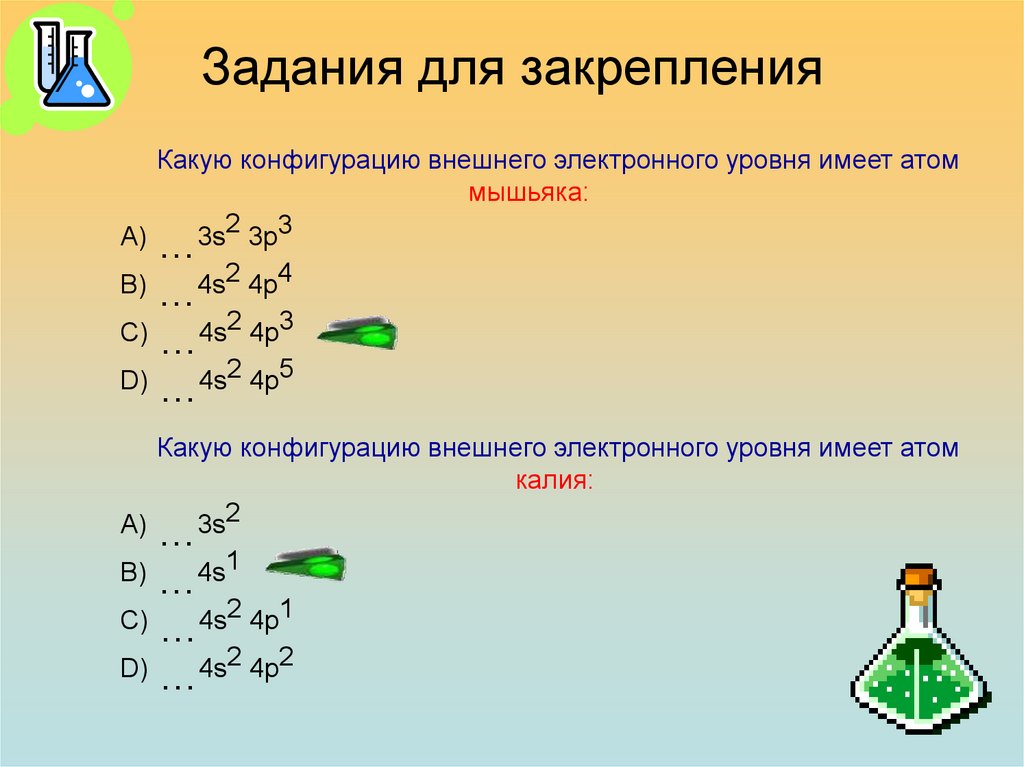
29. Задания для закрепления
Какую конфигурацию внешнего электронного уровня имеет атоммышьяка:
А) …3s2 3p3
В)
4s2 4p4
…
С) …4s2 4p3
D) …4s2 4p5
Какую конфигурацию внешнего электронного уровня имеет атом
калия:
А) …3s2
В)
4s1
…
С) …4s2 4p1
D) …4s2 4p2
30. Задания для закрепления
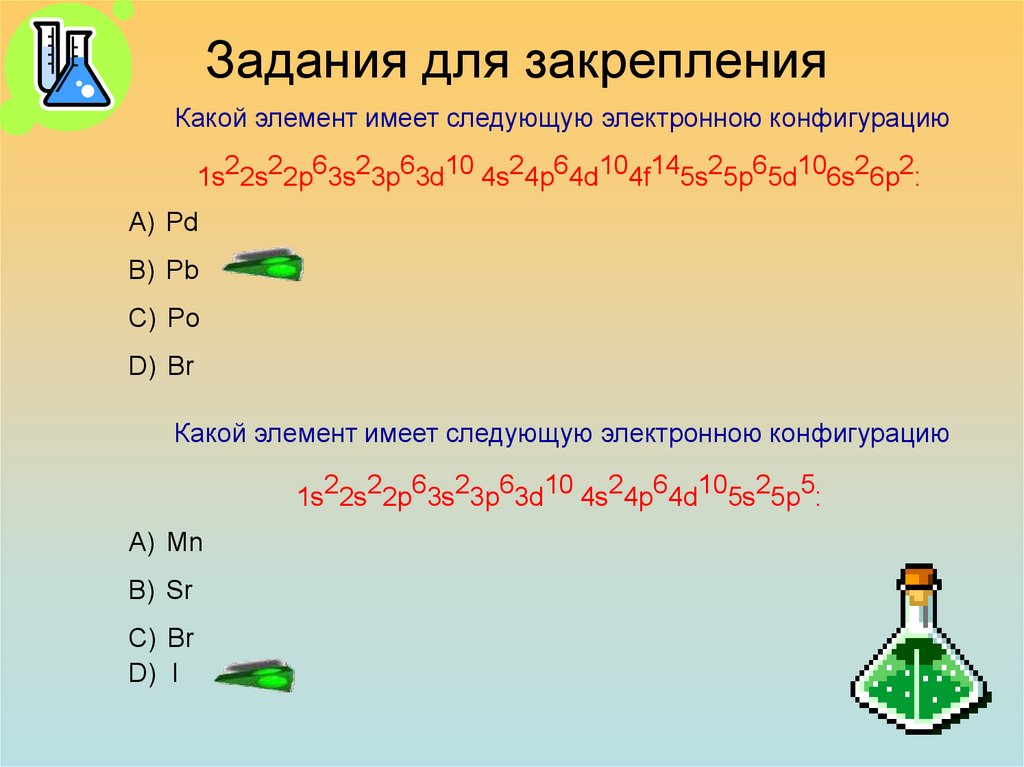
Какой элемент имеет следующую электронною конфигурацию1s22s22p63s23p63d10 4s24p64d104f145s25p65d106s26p2:
А) Pd
В) Pb
С) Po
D) Br
Какой элемент имеет следующую электронною конфигурацию
1s22s22p63s23p63d10 4s24p64d105s25p5:
А) Mn
В) Sr
С) Br
D) I
31.
Задания для закрепленияАтом какого элемента имеет 35 протонов?
А) Zn
В) Ra
С) U
D) Br
30.11.2023
31
32. Домашнее задание:
§ 1-3 упр. 3,4 с. 2330.11.2023
32
33. Используемая литература и материалы
1.О. С. Габриелян, Г.Г. Лысова. Химия 11 класс. М.: Дрофа, 2006г.
2. Майкл Льюис. Химия. Школьный курс в 100 таблицах. М. : АСТ – ПРЕСС,
1997г.
3. Г. П. Хомченко. Пособие по химии для поступающих в ВУЗы. М.: Новая
Волна, 2002г.
4. Интернет ресурсы.
30.11.2023
33
34.
30.11.202334

















 chemistry
chemistry








