Similar presentations:
Молекулярно-кинетическая теория
1.
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ1. Основные понятия и определения молекулярной
физики и термодинамики
2. Давление. Основное уравнение молекулярнокинетической теории
3. Законы идеальных газов
4. Уравнение состояния идеального газа (уравнение
Менделеева-Клапейрона)
2.
1. Основные понятия и определения молекулярнойфизики и термодинамики
Совокупность
большого
числа
частиц(атомов,
молекул), составляющих макроскопическую систему,
называется термодинамической системой.
Система может находиться в различных состояниях.
Величины, характеризующие состояние системы,
называются параметрами состояния: давление P,
температура T, объём V и так далее.
Связь между P, T, V специфична для каждого тела и
называется уравнением состояния.
3.
Равновесной,называется такая система, параметры состояния
которой одинаковы во всех точках системы и не
изменяются со временем (при неизменных внешних
условиях). При этом в равновесии находятся
отдельные, макроскопические части системы
4.
Процесс – переход из одного равновесногосостояния в другое.
Релаксация
–
возвращение
системы
в
равновесное состояние.
Время релаксации – время перехода в
равновесное состояние.
Если
равновесие
установилось,
то
система
самопроизвольно не сможет выйти из него.
Например, если опустить горячий камень в холодную
воду, то, через некоторое время наступит равновесное
состояние: температуры выровняются. Но обратный
процесс
невозможен
–
температура
камня
самопроизвольно не увеличится.
5.
Идеальный газ – это газ для которого:1) радиус взаимодействия двух молекул много
меньше среднего расстояния между ними
(молекулы взаимодействуют только при
столкновении);
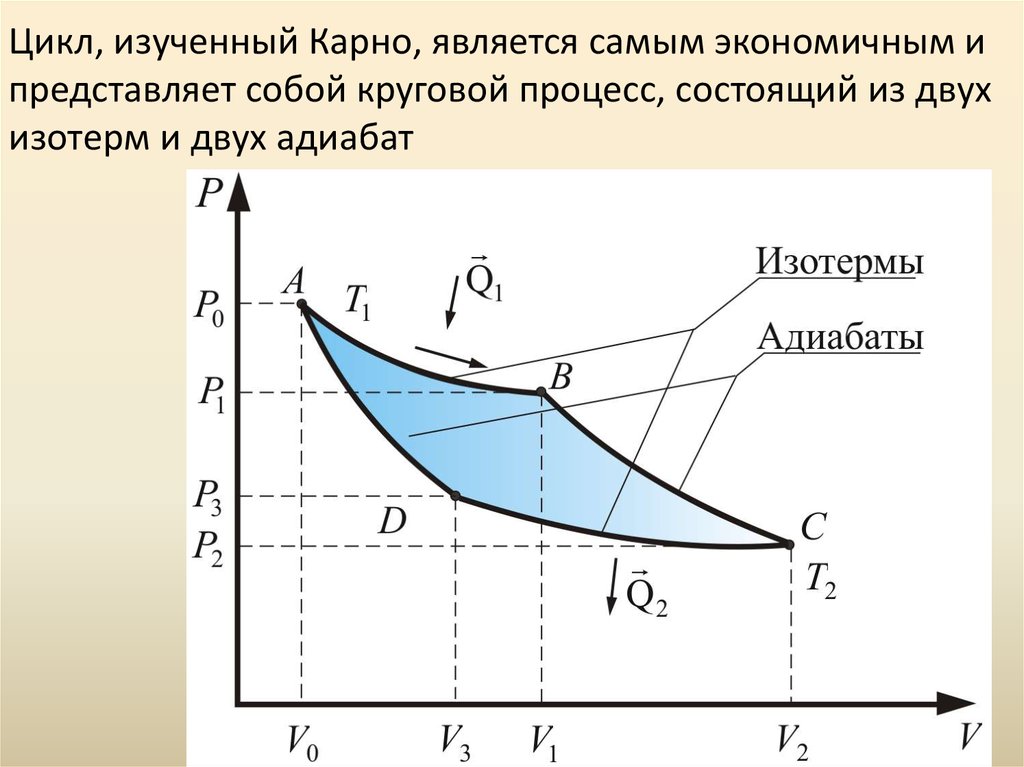
2) столкновения молекул между собой и со стенками
сосуда – абсолютно упругие (выполняются законы
сохранения энергии и импульса);
3) объем всех молекул газа много меньше объема,
занятого газом.
6.
Давление. Основное уравнение молекулярнокинетической теорииРассмотрим подробнее, что представляет собой один из
основных параметров состояния – давление P.
Ещё в XVIII веке Даниил Бернулли предположил, что
давление газа – есть следствие столкновения
газовых молекул со стенками сосуда.
Именно давление чаще всего является единственным
сигналом присутствия газа.
7.
Определим давление, как силу, действующую вединицу времени на единицу площади:
1
2
P m0 υ x
3
P dF / dS.
Молекулы имеют разные скорости, направленные в
разные стороны, то есть скорости газовых молекул –
случайная величина.
Более точно случайную величину
среднеквадратичная величина.
характеризует
8. Под скоростью необходимо понимать среднеквадратичную скорость Вектор скорости, направленный произвольно в пространстве, можно разделить
2скоростью υ x
Под
среднеквадратичную
необходимо
2
υx
понимать
скорость
Вектор скорости, направленный произвольно в
пространстве, можно разделить на три составляющих:
υ
2
2
υx
2
υy
2
υz
.
Ни одной из этих проекций нельзя отдать предпочтение
из-за хаотичного теплового движения молекул, то есть в
среднем
2
2
2
υx υ y υz
9.
Следовательно, на другие стенки будет точно такое жедавление.
Тогда можно записать в общем случае:
2
m
υ
1
2
0
2
P m0 n υ n
, P 3 n Ek
3
3
2
2
где
Ek
– средняя энергия одной молекулы.
Это основное уравнение молекулярно-кинетической
теории газов.
Давление газов определяется средней кинетической
энергией поступательного движения молекул.
10. Единицы измерения давления. По определению, поэтому размерность давления 1 Н/м2 = 1Па; 1 атм.= 9,8 Н/см2 = 98066 Па 105 Па 1 мм рт.ст. = 1 тор = 1/760 атм. = 133,
Единицы измерения давления.По определению,
F поэтому
P ,
S
размерность давления Н .
м 2
1 Н/м2 = 1Па;
1 атм.= 9,8 Н/см2 = 98066 Па 105 Па
1 мм рт.ст. = 1 тор = 1/760 атм. = 133,3 Па
1 бар = 105 Па; 1 атм. = 0,98 бар.
11.
Законы идеальных газовВ XVII – XIX веках были сформулированы опытные законы
идеальных газов
Изопроцессы идеального газа – процессы, при которых один
из параметров остаётся неизменным.
12.
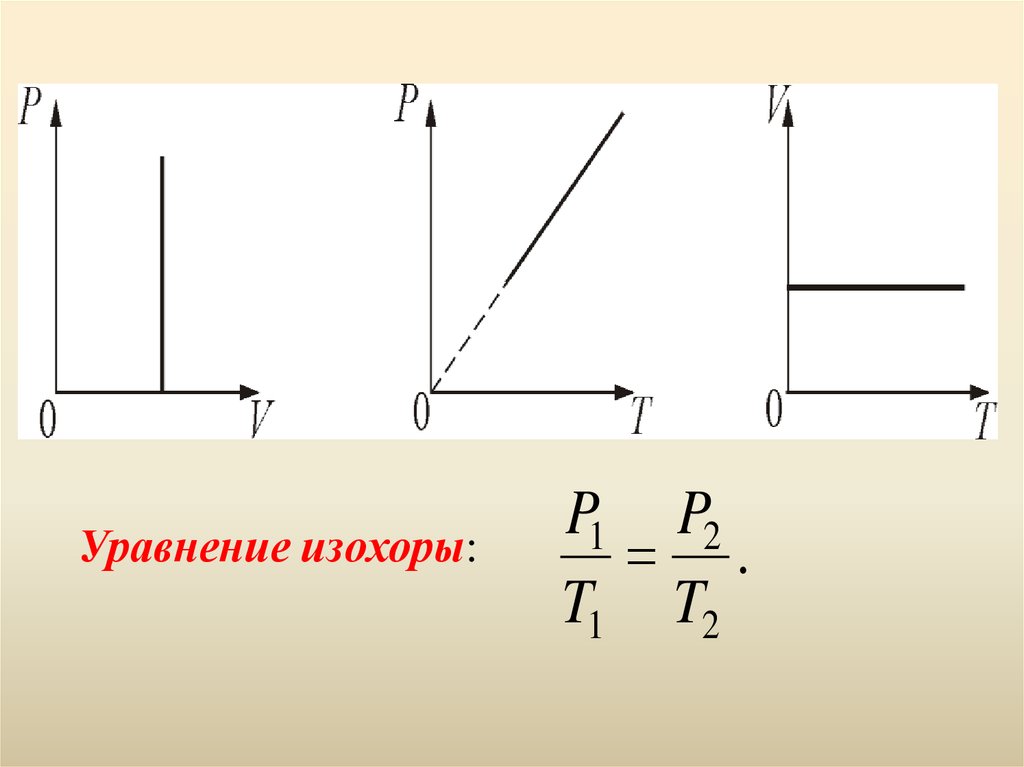
1.Изохорический процесс. V = const.Изохорическим процессом называется процесс,
протекающий при постоянном объёме V.
Поведение газа при этом изохорическом процессе
подчиняется закону Шарля: P/Т = const :
«При постоянном объёме и неизменных значениях
массы газа и его молярной массы, отношение давления
газа к его абсолютной температуре остаётся
постоянным».
13.
Уравнение изохоры:P1 P2
.
T1 T2
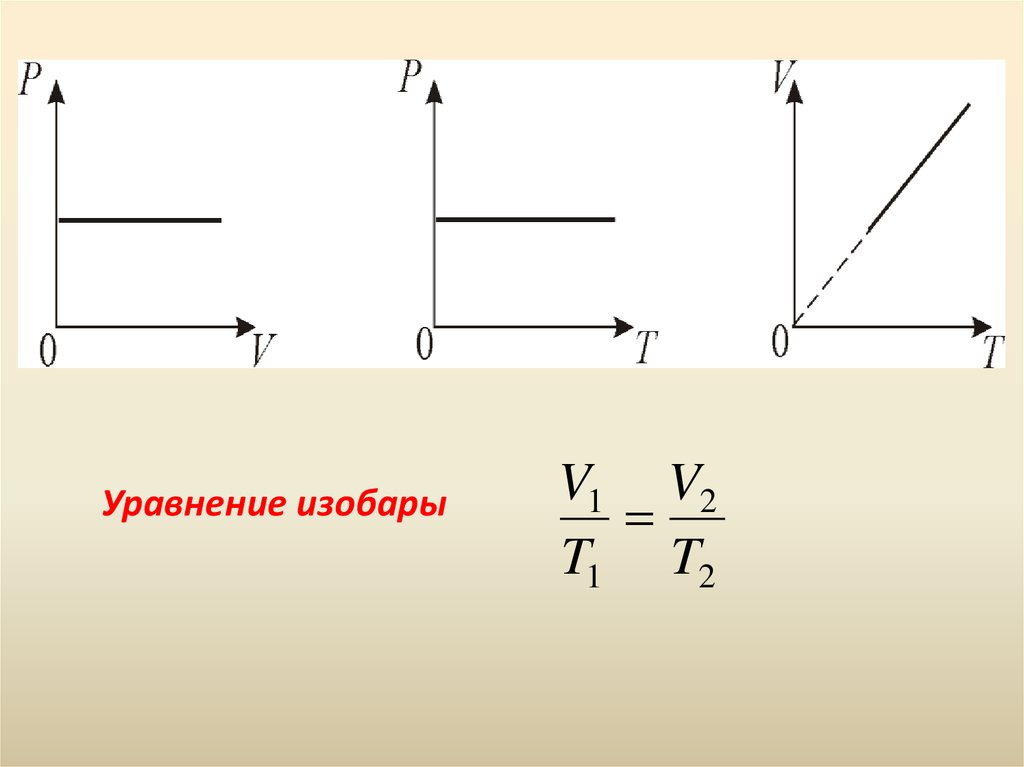
14. 2. Изобарический процесс. Р = const. Изобарическим процессом называется процесс, протекающий при постоянном давлении Р. Поведение газа при изо
2. Изобарический процесс. Р = const.Изобарическим процессом называется процесс,
протекающий при постоянном давлении Р.
Поведение газа при изобарическом процессе
подчиняется закону Гей-Люссака: V/T = const
«При постоянном давлении и неизменных значениях
массы и газа и его молярной массы, отношение
объёма газа к его абсолютной температуре остаётся
постоянным».
15.
Уравнение изобарыV1 V2
T1 T2
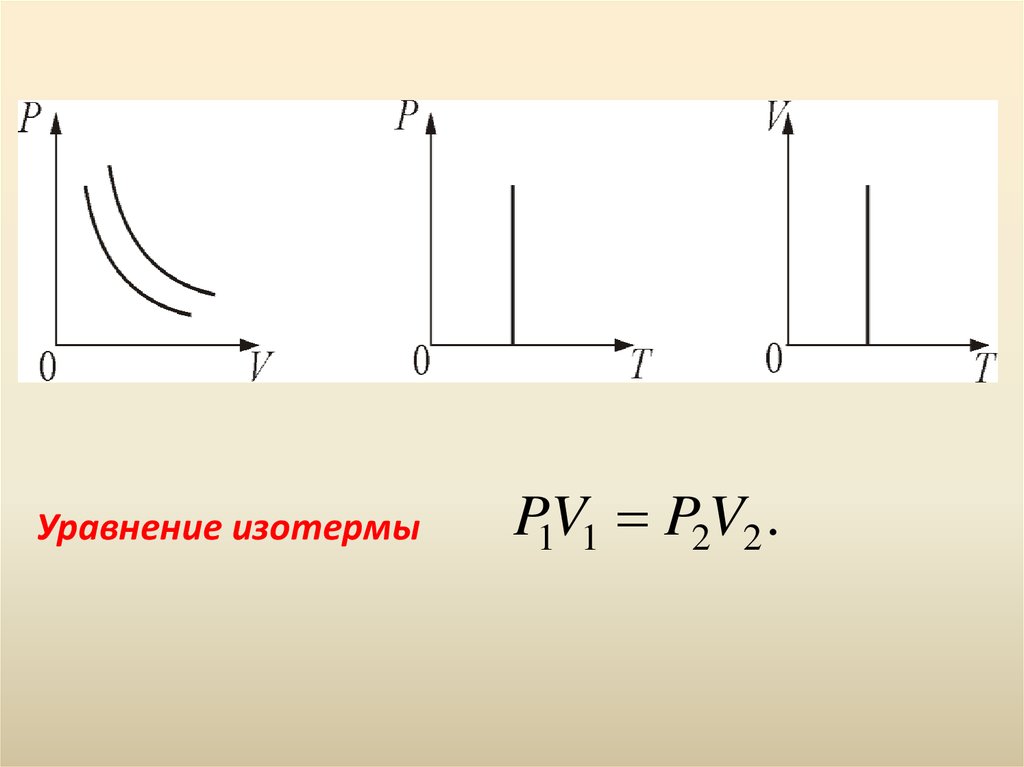
16. 3. Изотермический процесс. T = const. Изотермическим процессом называется процесс, протекающий при постоянной температуре Т. Поведение идеальн
3. Изотермический процесс. T = const.Изотермическим процессом называется процесс,
протекающий при постоянной температуре Т.
Поведение идеального газа при изотермическом
процессе подчиняется закону Бойля-Мариотта:
РV = const
«При постоянной температуре и неизменных значениях
массы газа и его молярной массы, произведение объёма
газа на его давление остаётся постоянным».
17.
Уравнение изотермыP1V1 P2V2 .
18. 4. Адиабатический процесс (изоэнтропийный). Процесс, происходящий без теплообмена с окружающей средой. 5. Политропический процесс. Процесс,
4. Адиабатический процесс (изоэнтропийный).Процесс, происходящий без теплообмена с
окружающей средой.
5. Политропический процесс.
Процесс, при котором теплоёмкость газа остаётся
постоянной.
Политропический процесс – общий случай всех
перечисленных выше процессов.
19.
Уравнениесостояния
идеального
(уравнение Менделеева-Клапейрона)
газа
Идеальным газом называют газ, молекулы которого
пренебрежимо малы, по сравнению расстояния между
ними, и не взаимодействуют друг с другом на
расстоянии.
Все газы, при нормальных условиях, близки по
свойствам к идеальному газу. Ближе всех газов к
идеальному газу – водород.
Уравнение, связывающее основные параметры
состояния идеального газа вывел великий русский
ученый
Д.И. Менделеев.
20. Менделеев объединил известные нам законы Бойля-Мариотта, Гей-Люссака и Шарля с законом Авогадро. Уравнение, связывающее все эти законы, наз
Менделеев объединил известные нам законы БойляМариотта, Гей-Люссака и Шарля с законом Авогадро.Уравнение, связывающее все эти законы, называется
уравнением Менделеева-Клапейрона:
m
PV RT
μ
Для одного моля можно записать
PVμ RT
21.
Функция распределения МаксвеллаЕщё в XIX веке Дж. Максвелл утверждал, что молекулы,
беспорядочно сталкиваясь друг с другом, как-то
«распределяются» по скоростям, причём вполне определённым
образом.
22. Молекулы движутся хаотически. Среди них есть и очень быстрые, и очень медленные. Благодаря беспорядочному движению и случайному характеру
Молекулы движутся хаотически. Среди них есть иочень быстрые, и очень медленные. Благодаря
беспорядочному движению и случайному характеру их
взаимных столкновений, молекулы определённым
образом распределяются по скоростям. Это
распределение
оказывается
однозначным
и
единственно возможным, и не только не противоречит
хаотическому движению, но именно им и
обусловлено.
23. Максвелл Джеймс Клерк (1831 – 1879) – английский физик. Работы посвящены электродинамике, молекулярной физике, общей статике, оптике, механике,
Распределение молекул идеального газа поскоростям впервые было получено знаменитым
английским ученым Дж. Максвеллом в 1860 году с
помощью методов теории вероятностей.
Максвелл Джеймс Клерк
(1831 – 1879) – английский
физик.
Работы посвящены
электродинамике, молекулярной
физике, общей статике, оптике,
механике, теории упругости.
Установил статистический закон,
описывающий распределение
молекул газа по скоростям.
24. Скорость – векторная величина. Для проекции скорости на ось х , имеем
12
dnx
1 m
f (υ x )
e
ndυx
2kT
dnx
f (υ x )
ndυx
mυ 2x
2 kT
A1e
mυ2x
A1e 2 kT ,
mυ 2x
2 kT
,
25. закон Максвелла – распределение молекул по абсолютным значениям скоростей: где – доля всех частиц единичного объёма, скорости которых ле
закон Максвелла – распределение молекулпо абсолютным значениям скоростей:
dn 4 m
n
π 2kT
3/ 2
mυ 2
2
2
kT
e
υ dυ,
dn
где n – доля всех частиц единичного
объёма, скорости которых лежат в интервале
от υ до υ dυ.
26.
Здесь f ( ) – функция распределения молекул поскоростям, - интервал значений скоростей.,
Физический смысл f(υ) в том, что это отношение
числа молекул, скорости которых лежат в
определенном интервале скоростей, к общему числу
молекул в единичном интервале скоростей:
dn
dP
f ( )
nd d
27. При получаем плотность вероятности, или функцию распределения молекул по скоростям: Эта функция обозначает долю молекул единичного объём
При dυ 1получаем
плотность вероятности, или функцию
распределения молекул по скоростям:
3
mυ 2
2 2 kT 2
e
υ.
dn
4 m
f ( υ)
ndυ
π 2kT
Эта функция обозначает долю молекул
единичного объёма газа, абсолютные скорости
которых заключены в единичном интервале
скоростей, включающем данную скорость.
28.
Обозначим3
2
4 m
A
,
π 2кT
тогда получим:
f ( υ)
mυ 2
2
2
kT
Ae
υ.
29.
Выводы:f ( υ)
mυ 2
Ae 2kT υ2 .
- Вид распределения молекул газа по скоростям, для
каждого газа зависит от массы m и температуры Т газа и
не зависит от давления P и объёма V газа.
- В показателе степени стоит отношение, кинетической
энергии, соответствующей данной скорости υ к средней
энергии теплового движения молекул при данной
2
m
υ
температуре:
2kT
Значит распределение Максвелла характеризует
распределение молекул по значениям кинетической
энергии (показывает, какова вероятность при данной
температуре иметь такое значение кинетической энергии).
30.
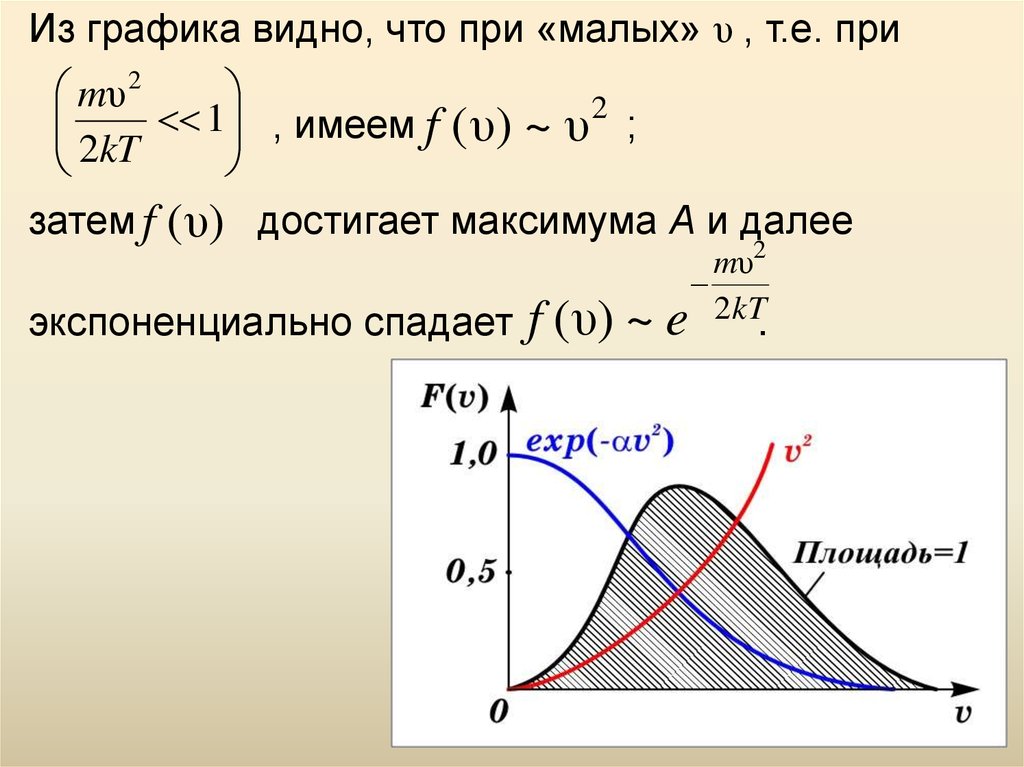
Из графика видно, что при «малых» υ , т.е. приmυ 2
1 , имеем f
2kT
( υ) ~ υ 2 ;
затем f ( υ) достигает максимума А и далее
экспоненциально спадает
f (υ) ~
mυ2
e 2kT
.
31.
Величина скорости, на которую приходитсямаксимум зависимости f ( υ) называют
наиболее вероятной скоростью.
Величину этой скорости найдем из условия
равенства нулю производной df ( υ)
υ вер
2kT
m
dυ
0
- наиболее вероятная скорость
одной молекулы.
Для одного моля газа:
2RT
υвер
μ
32.
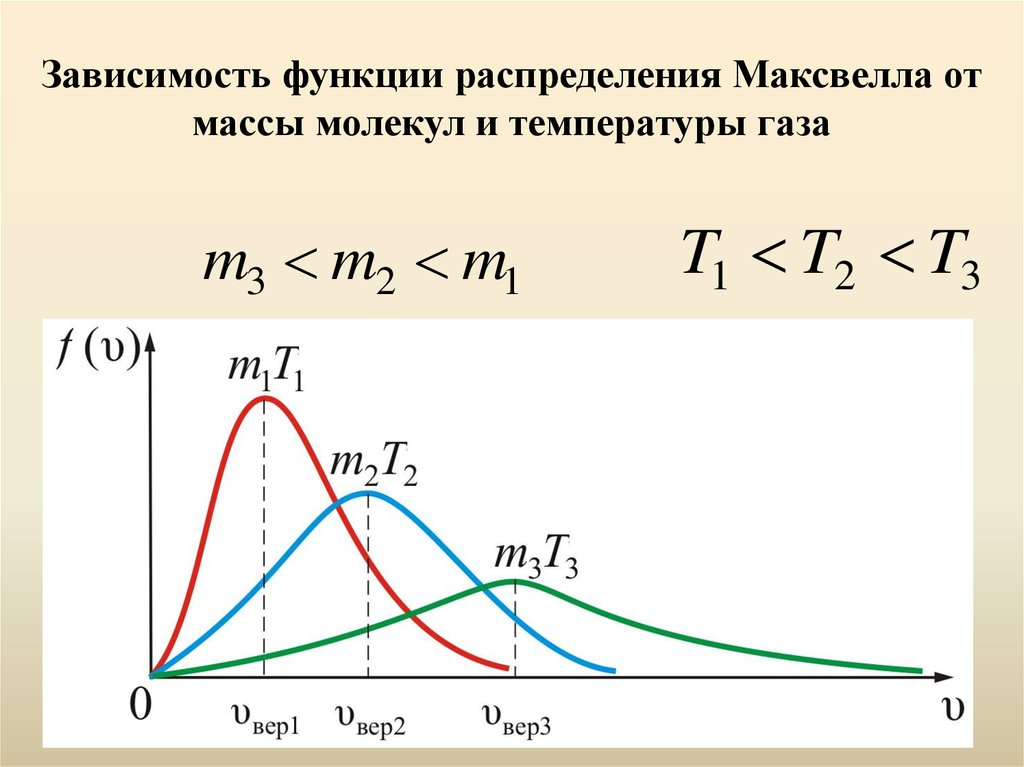
Зависимость функции распределения Максвелла отмассы молекул и температуры газа
m3 m2 m1
T1 T2 T3
33.
Площадь под кривой величина постоянная,f ( υ) const 1
равная единице (
), поэтому
важно знать как будет изменяться положение
максимума
кривой:
m
f ( υвер ) ~
,
T
υвер
T
~
.
m
Максвелловский
закон
распределения
по
скоростям
и
все
вытекающие
следствия
справедливы только для газа в равновесной
системе. Закон статистический и выполняется тем
лучше, чем больше число молекул.
34.
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ1. Внутренняя энергия. Работа и теплота
2.Теплоёмкость идеального газа. Уравнение Майера
3. Теплоёмкости одноатомных и многоатомных
газов
4. Закон о равномерном распределении энергии по
степеням свободы
5. Применение первого начала термодинамики к
изопроцессам идеальных газов
35.
1. Внутренняя энергия. Работа и теплотаНаряду с механической энергией любое тело (или
система) обладает внутренней энергией.
Она складывается из
-теплового хаотического движения молекул,
-потенциальной
расположения,
энергии
их
взаимного
- кинетической и потенциальной энергии
электронов в атомах, нуклонов в ядрах и др
36.
В термодинамических процессах изменяетсятолько кинетическая энергия движущихся
молекул (тепловой энергии недостаточно,
чтобы изменить строение атома, а тем более
ядра).
Следовательно, фактически под внутренней
энергией в термодинамике подразумевают
энергию теплового хаотического движения
молекул.
37.
Внутренняя энергия U одного моля идеальногогаза равна:
i
U RT
2
Таким образом, внутренняя энергия зависит
только от температуры.
Внутренняя энергия U является функцией
состояния системы
38.
Понятно, что в общем случае термодинамическаясистема может обладать как внутренней, так и
механической энергией и разные системы могут
обмениваться этими видами энергии.
Обмен механической энергией характеризуется
совершённой работой А, а обмен внутренней
энергией – количеством переданного тепла Q.
39.
Количество теплоты, сообщаемой телу, идёт наувеличение внутренней энергии и на
совершение телом работы:
Q ΔU A
– это первое начало термодинамики или
закон сохранения энергии в термодинамике.
40.
2. Теплоёмкость идеального газаТеплоёмкость тела характеризуется количеством
теплоты, необходимой для нагревания этого тела на
один градус
dQ
C
dT
.
Размерность теплоемкости: [C] = Дж/К.
Теплоёмкость – величина неопределённая, поэтому
пользуются понятиями удельной и молярной
теплоёмкости.
41. Удельная теплоёмкость Суд – количество теплоты, необходимое для нагревания единицы массы вещества на 1 градус [Cуд] = Дж/К. Молярная теплоем
Удельная теплоёмкость Суд –количество теплоты, необходимое для
нагревания единицы массы вещества на 1
градус
[Cуд] = Дж/К.
Молярная теплоемкость Сμ количество
теплоты, необходимое для нагревания
1 моля газа на 1 градус
[Cμ] = Дж/(моль К).
Cμ Cуд μ
42. Теплоёмкость термодинамической системы зависит от того, как изменяется состояние системы при нагревании. Если газ нагревать при постоянн
Теплоёмкость термодинамической системы зависит оттого, как изменяется состояние системы при нагревании.
Если газ нагревать при постоянном объёме, то всё
подводимое тепло идёт на нагревание газа, то есть
изменение его внутренней энергии.
Теплоёмкость при
постоянном объёме СV
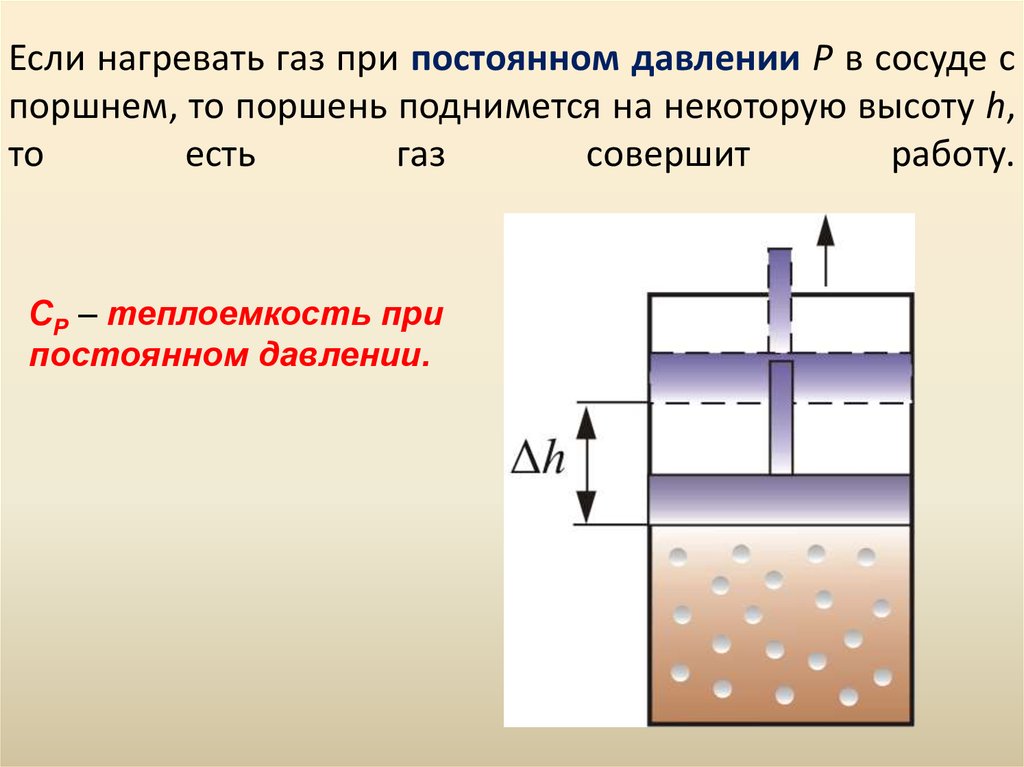
43. Если нагревать газ при постоянном давлении Р в сосуде с поршнем, то поршень поднимется на некоторую высоту h, то есть газ совершит работу.
СР – теплоемкость припостоянном давлении.
44. Следовательно, проводимое тепло затрачивается и на нагревание и на совершение работы. Отсюда ясно, что Итак, проводимое тепло и теплоёмкос
Следовательно, проводимое тепло затрачивается и нанагревание и на совершение работы. Отсюда ясно, что
CP CV .
Итак, проводимое тепло и теплоёмкость зависят от того,
каким путём осуществляется передача тепла.
Следовательно Q и С не являются функциями состояния.
Величины СР и СV оказываются связанными простыми
соотношениями.
45. Это уравнение Майера для одного моля газа. Из него следует, что физический смысл универсальной газовой постоянной в том, что R – численно ра
CP CV R.Это уравнение Майера для одного моля
газа. Из него следует, что физический смысл
универсальной газовой постоянной в том, что
R – численно равна работе, совершаемой
одним молем газа при нагревании на один
градус при изобарическом процессе.
Используя это соотношение, Роберт Майер
в 1842 г. вычислил механический эквивалент
теплоты: 1 кал = 4,19 Дж.
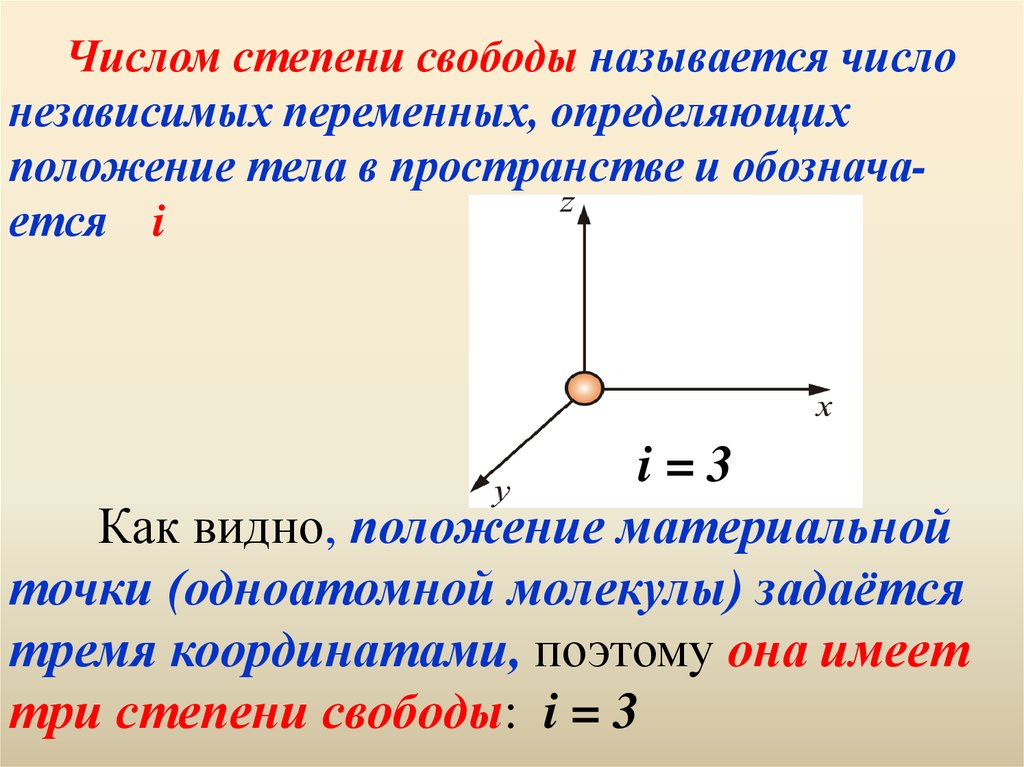
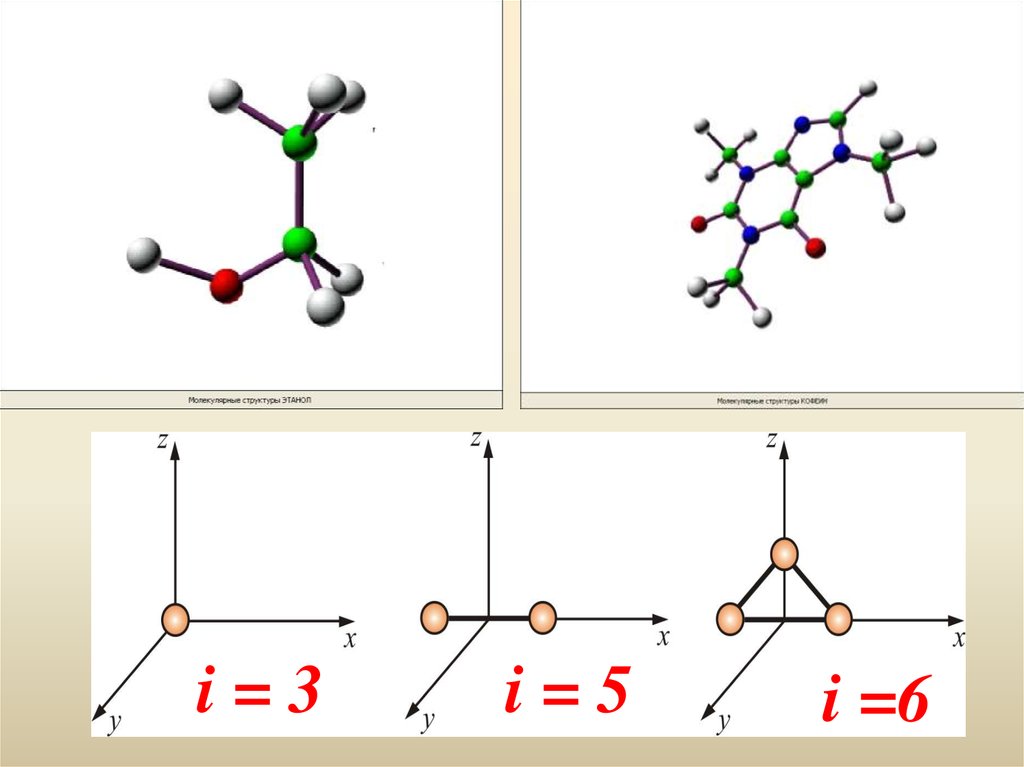
46. Числом степени свободы называется число независимых переменных, определяющих положение тела в пространстве и обознача-ется i i = 3 Как видно
Числом степени свободы называется числонезависимых переменных, определяющих
положение тела в пространстве и обозначается i
i=3
Как видно, положение материальной
точки (одноатомной молекулы) задаётся
тремя координатами, поэтому она имеет
три степени свободы: i = 3
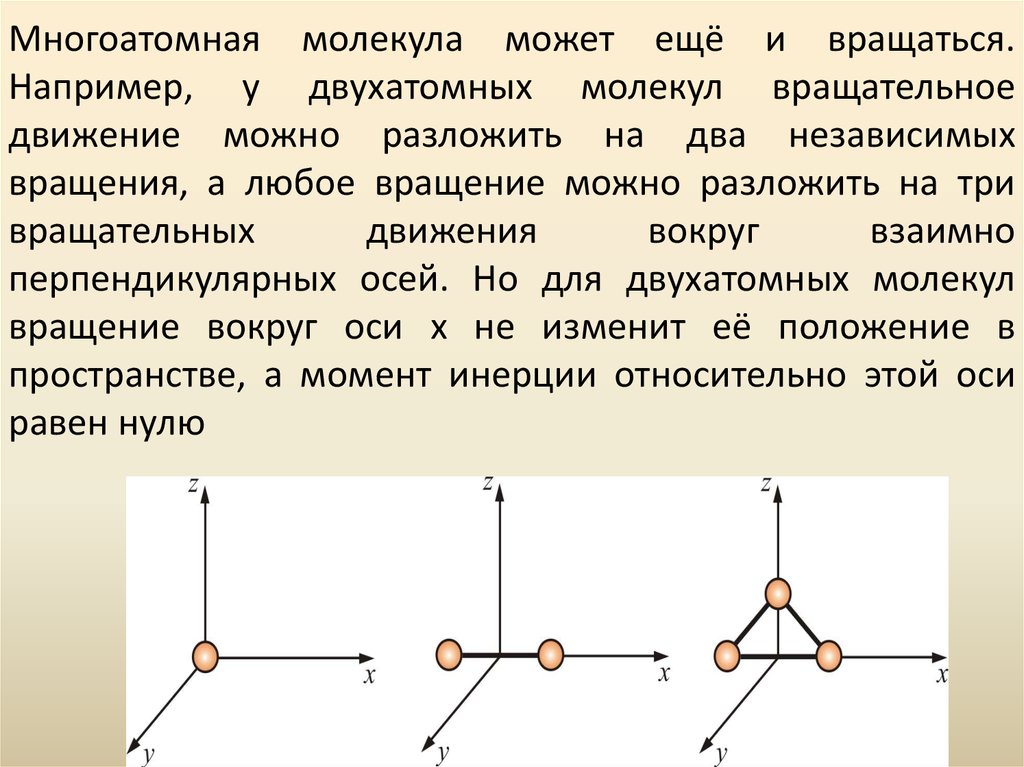
47. Многоатомная молекула может ещё и вращаться. Например, у двухатомных молекул вращательное движение можно разложить на два независимых вра
Многоатомная молекула может ещё и вращаться.Например, у двухатомных молекул вращательное
движение можно разложить на два независимых
вращения, а любое вращение можно разложить на три
вращательных
движения
вокруг
взаимно
перпендикулярных осей. Но для двухатомных молекул
вращение вокруг оси x не изменит её положение в
пространстве, а момент инерции относительно этой оси
равен нулю
48.
i=3i=5
i =6
49. Для i степеней свободы i = iп + iвр + iкол для одноатомной молекулы i = 3, для двухатомной молекулы i = 5 для трёхатомной молекулы i = 6
4. Закон о равномерном распределенииэнергии по степеням свободы
Больцман доказал, что, средняя энергия,
приходящаяся на одну степень свободы равна 1
kT .
2
1
E
2
kT .
Для i степеней свободы i = iп + iвр + iкол
i
E kT
2
для одноатомной молекулы i = 3,
3
E kT ,
2
для двухатомной молекулы i = 5
5
E kT ,
2
6
E kT .
2
для трёхатомной молекулы i = 6
50. Для молярной теплоемкости Для удельной теплоемкости
Для молярной теплоемкостиi
CV R
2
i 2
CP
R
2
Для удельной теплоемкости
i R
CV
2
i 2 R
CP
.
2
51.
Если за цикл совершается положительная работаA PdV 0
(цикл протекает по часовой стрелке),
то он называется прямым
Если за цикл совершается отрицательная работа
A PdV 0
(цикл протекает против часовой стрелки),
то он называется обратным
52. В результате кругового процесса система возвращается в исходное состояние Термический коэффициент полезного действия для кругового проц
В результате кругового процесса система возвращается висходное состояние
Термический коэффициент полезного действия для
кругового процесса
A Q1 Q2
Q2
η
Q1
Q1
1
Q1
Q1 – количество теплоты, полученное системой;
Q2 – количество теплоты, отданное системой
Аполез Q1 Q2 ,
.
53.
Круговые обратимые и необратимые процессыКруговым процессом, или циклом, называется такой
процесс, в результате которого термодинамическое
тело возвращается в исходное состояние.
1-2 расширение газа А>0
2-1 сжатие газа A<0
Работа, совершаемая за
цикл, определяется
площадью, охватываемой
кривой
54.
Все термодинамические процессы делят на двегруппы: обратимые и необратимые.
Процесс называют обратимым, если он
протекает таким образом, что после окончания
процесса он может быть проведен в обратном
направлении через все те же промежуточные
состояния, что и прямой процесс.
Процесс называется необратимым, если он
протекает так, что после его окончания систему
нельзя вернуть в начальное состояние через
прежние промежуточные состояния
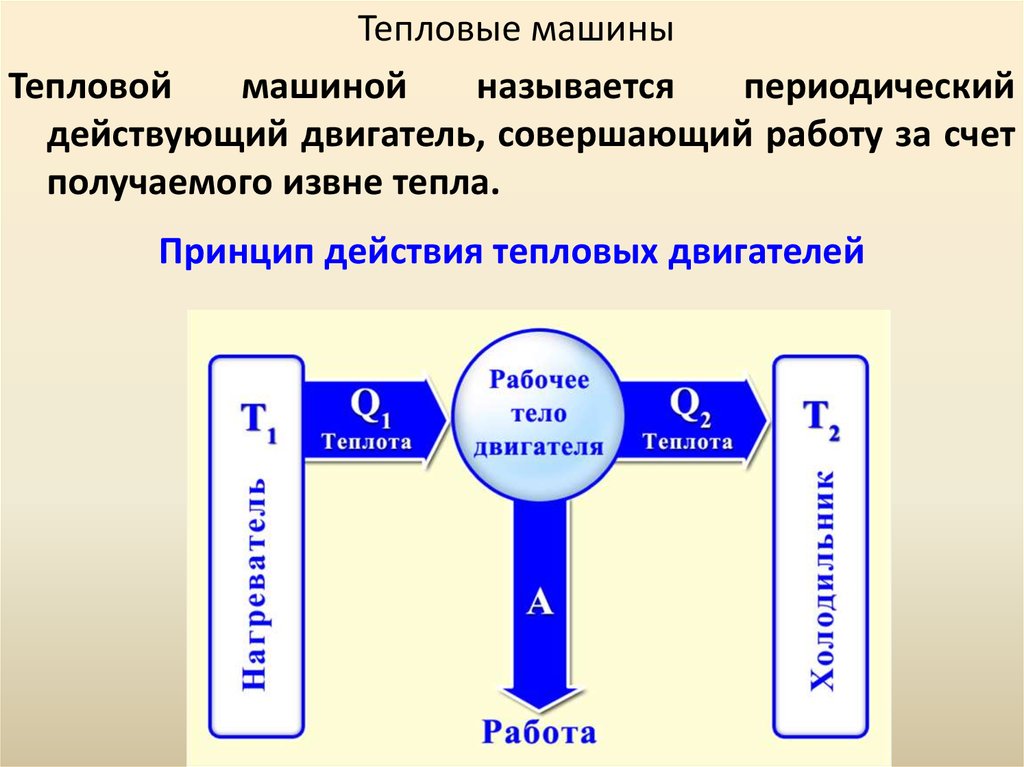
55. Принцип действия тепловых двигателей
Тепловые машиныТепловой
машиной
называется
периодический
действующий двигатель, совершающий работу за счет
получаемого извне тепла.
Принцип действия тепловых двигателей
56. КПД тепловых двигателей
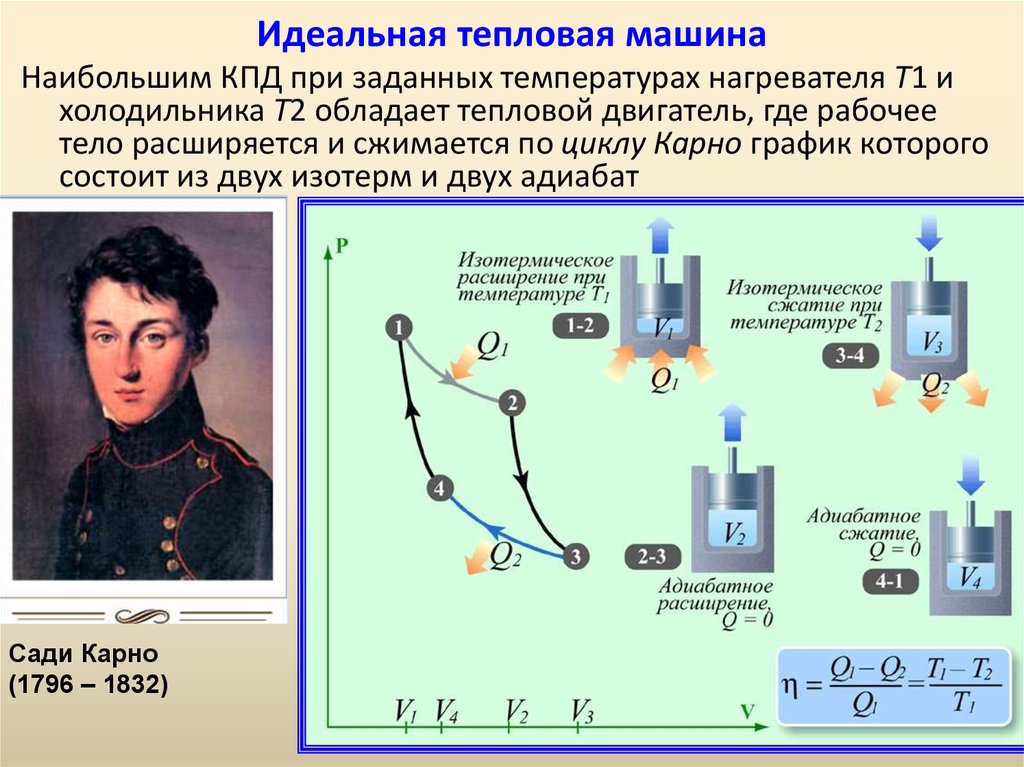
57. Идеальная тепловая машина
Наибольшим КПД при заданных температурах нагревателя T1 ихолодильника T2 обладает тепловой двигатель, где рабочее
тело расширяется и сжимается по циклу Карно график которого
состоит из двух изотерм и двух адиабат
Сади Карно
(1796 – 1832)
58.
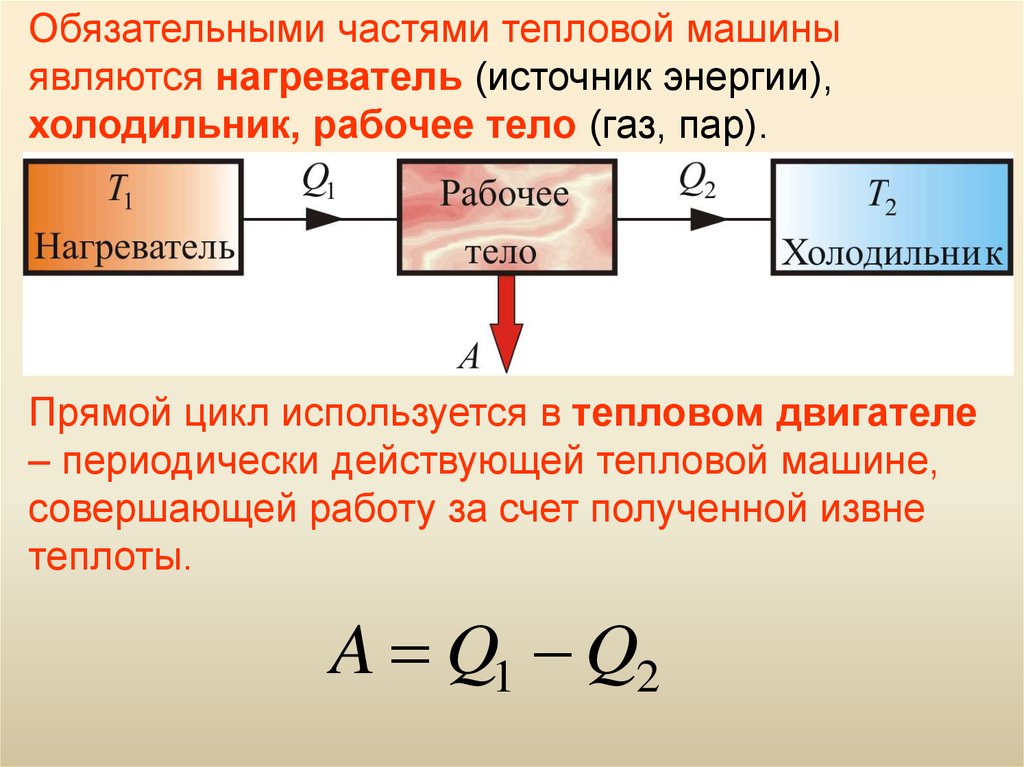
Обязательными частями тепловой машиныявляются нагреватель (источник энергии),
холодильник, рабочее тело (газ, пар).
Прямой цикл используется в тепловом двигателе
– периодически действующей тепловой машине,
совершающей работу за счет полученной извне
теплоты.
A Q1 Q2
59. Цикл, изученный Карно, является самым экономичным и представляет собой круговой процесс, состоящий из двух изотерм и двух адиабат
60. полезная работа КПД η равен:
полезная работаA Q1 Q2 .
КПД η равен:
A Q1 Q2
Q2
T2
η
1
1 .
Q1
Q1
Q1
T1
61.
Второе начало термодинамики1.
Невозможен
процесс,
единственным
результатом которого является превращение всей
теплоты,
полученной
от
нагревателя
в
эквивалентную
ей
работу
(формулировка
Кельвина)
2. Невозможен вечный двигатель второго рода
(формулировка Томпсона-Планка).
3.
Невозможен
процесс,
единственным
результатом которого является передача энергии
от холодного тела к горячему (формулировка
Клаузиуса).
62.
Третье начало термодинамикиНедостатки первого и второго начал термодинамики
в том, что они не позволяют определить значение
энтропии при абсолютном нуле Т = 0º К.
На
основании
обобщения
экспериментальных
исследований
свойств
различных
веществ
при
сверхнизких температурах был установлен закон,
устранивший указанный недостаток. Сформулировал его в
1906 г. Нернст и называется он третьим началом
термодинамики, или теоремой Нернста.
63.
СогласноНернсту,
изменение
энтропии
S
стремится
к
нулю
при
любых
обратимых
изотермических процессах, совершаемых между
двумя равновесными состояниями при температурах,
приближающихся к абсолютному нулю
( S → 0 при Т → 0).
Энтропия любой равновесной системы при
абсолютном нуле температуры может быть равна
нулю.
64.
Третье начало термодинамики иногда формулируютследующим образом:
При абсолютном нуле температуры любые изменения
термодинамической системы происходят без изменения
энтропии:
ΔST 0 0, ST 0 const
ST 0 0.
Следствием третьего начала является то что,
невозможно охладить тело до абсолютного нуля
(принцип
недостижимости
абсолютного
нуля
температуры).
Иначе был бы возможен вечный двигатель II рода



































![Удельная теплоёмкость Суд – количество теплоты, необходимое для нагревания единицы массы вещества на 1 градус [Cуд] = Дж/К. Молярная теплоем Удельная теплоёмкость Суд – количество теплоты, необходимое для нагревания единицы массы вещества на 1 градус [Cуд] = Дж/К. Молярная теплоем](https://cf.ppt-online.org/files/slide/y/YTQkum9M1GhldxO7eiA5IUntSEvNqgoLjCaby2/slide-40.jpg)















 physics
physics








