Similar presentations:
Клинические исследования и регистрация лекарственных препаратов в России
1. Клинические исследования и регистрация лекарственных препаратов в России
2. Закон «Об обращении лекарственных средств»
Вступил в силу 01 сентября 2010 г.До
Схема регистрации в
целом
соответствовала
международному
подходу
После
Создана уникальная
система регистрации,
не имеющая
аналогов в мире
3. Система регистрации в России
Особенность:Клинические исследования
включены в процесс
регистрации, назначаются и
проводятся после подачи заявки
на регистрацию и формирования
регистрационного досье
4. Система регистрации в России
Доклинические исследованияФормирование рег. досье,
подача заявки на регистрацию
Проведение клинических
исследований
Продолжение процесса
регистрации
5. Возможность проведения различных типов клинических исследований в России
Регистрационные - назначаются ипроводятся в рамках процесса
регистрации;
Международные многоцентровые
клинические исследования (ММКИ) и
пострегистрационные КИ проводятся независимо по
самостоятельной процедуре
6. Система регистрации в России – требование о проведении локальных исследований
Результаты ММКИ не признаются (заисключением случаев, когда в них
участвовали российские центры);
Производители вынуждены проводить
повторные исследования в участием
представителей «российской
популяции»;
Норма относится не только к
оригинальным препаратам, но и к
дженерикам
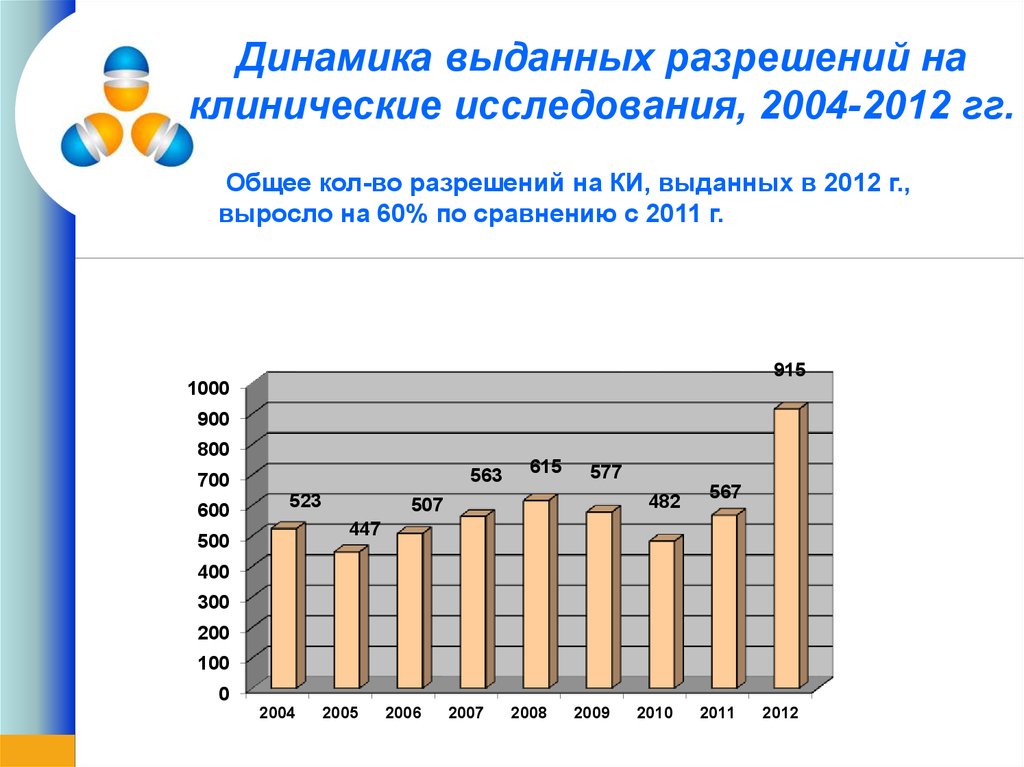
7. Динамика выданных разрешений на клинические исследования, 2004-2012 гг.
Общее кол-во разрешений на КИ, выданных в 2012 г.,выросло на 60% по сравнению с 2011 г.
915
1000
900
800
700
600
563
523
615
577
482
507
567
447
500
400
300
200
100
0
2004
2005
2006
2007
2008
2009
2010
2011
2012
Асс оциация организаций по к линическим исследованиям (AOKИ)
8. Динамика выданных разрешений на клинические исследования, 2004-2012 гг.
1000900
165
800
700
212
600
101
500
144
88
65
400
85
63
68
45
67
68
112
77
80
123
32
63
107
35
62
370
369
2011
2012
77
300
369
279
200
133
364
324
348
30
246
252
Локальные КИ
(российские спонсоры)
Биоэквивалентность
(российские спонсоры)
Биоэквивалентность
(иностранные спонсоры)
Локальные КИ (иностранные
спонсоры)
ММКИ
100
0
2004
2005
2006
2007
2008
2009
2010
Асс оциация организаций по к линическим исследованиям (AOKИ)
9.
Структура рынка КИ по видам,2004-2011
ММКИ
13,3%
19,8%
Локальные КИ
(иностранные спонсоры)
Биоэквивалентность (иностранные
спонсоры)
1,8%
5,6%
59,6%
Локальные КИ
(российские спонсоры)
Биоэквивалентность (российские
спонсоры)
Асс оциация организаций по к линическим исследованиям (AOKИ)
10. Структура рынка КИ по видам, 2012 г.
ММКИ23%
40%
Локальные КИ (иностранные
спонсоры)
Биоэквивалентность (иностранные спонсоры)
18%
12%
7%
Локальные КИ (российские
спонсоры)
Биоэквивалентность (российские спонсоры)
Асс оциация организаций по к линическим исследованиям (AOKИ)
11. Структура сектора локальных КИ иностранных спонсоров, 2012 г.
дженерикибиоаналоги
оригинальные*
6,5%
4 3,2%
2
9
3,2%
2
14,5%
иные**
45
72,6%
пострегистрационные
* включая биологические, а также новые формы,
показания и комбинации уже зарегистрированных
препаратов;
** препараты растительного происхождения, комбинации
хорошо изученных веществ и пр.
Асс оциация организаций по к линическим исследованиям (AOKИ)
12. Структура сектора локальных КИ российских спонсоров, 2012 г.
дженерикибиоаналоги
оригинальные*
7,3%
22
иные**
12
13,3%
49
29,7%
67
40,6%
15
9,1%
пострегистрационные
* включая биологические, а также новые формы, показания
и комбинации уже зарегистрированных препаратов;
** препараты растительного происхождения, гомеопатия,
комбинации хорошо изученных веществ и пр.
Асс оциация организаций по к линическим исследованиям (AOKИ)
13. Закон «Об обращении лекарственных средств», часть 3 статьи 5
«В Российской Федерации в соответствии смеждународными договорами Российской
Федерации и (или) на основе принципа
взаимности признаются результаты
клинических исследований лекарственных
препаратов для медицинского применения,
проведенных за пределами территории
Российской Федерации.»
Асс оциация организаций по к линическим исследованиям (AOKИ)












 medicine
medicine








