Similar presentations:
Этические проблемы клинических исследований лекарственных средств
1. Этические проблемы клинических исследований лекарственных средств
Выполнили:Васильев А.А.
Ермолаев Н.Т.
ЛД 102-1
2. Итак, что же такое клиническое исследование лекарственного средства?
Итак, что же такое клиническое исследованиелекарственного средства?
Это системное изучение лекарственного препарата посредством применения
его у человека (пациента или здорового добровольца) с целью оценки его
безопасности и/или эффективности, а также выявления и/или подтверждения
его клинических, фармакологических, фармакодинамических свойств, оценки
всасывания, распределения, метаболизма, выведения и/или взаимодействия
с другими лекарственными средствами.
2/16
3. Вступление
Проведение клинических исследований принципиальноновых и ранее не применявшихся лекарственных
препаратов сопряжено с рядом вопросов этического
характера. Научная ценность результатов, получаемых в ходе
клинических исследований, не должна противопоставляться
соблюдению этических норм.
3/16
4. В настоящее время в Российской Федерации правовой основой для проведения клинических исследований являются:
• Хельсинкская декларация Всемирной ассоциации врачей(2001 г.);
• Конституция РФ;
• Основы законодательства РФ об охране здоровья граждан от
22 июля 1993 г. №5487-1 (с изменениями от 18 июля 2011 г.);
• Федеральный закон от 22 июня 1998 г. №86 «О лекарственных
средствах» (с изменениями от 2 января 2000 г.; 30 декабря 2001
г.), п. 7 ст. 40;
• ОСТ 42-511-99 «Правила проведения качественных
клинических испытаний в РФ» (утв. Минздравсоцразвития РФ от
29 декабря 1998 г.).
4/16
5. Основные этические и правовые принципы клинических исследований, сформулированные в Хельсинкской декларации Всемирной
ассоциации врачей,принятой на 18-й Генеральной ассамблее Всемирной ассоциации врачей
(Хельсинки, Финляндия, 1964 г.), декларируют, что:
• обязанность исследователя – защита жизни, здоровья, неприкосновенности частной жизни и достоинства испытуемых;
• план и способ выполнения исследования должны быть четко сформулированы в протоколе;
• протокол должен быть одобрен независимым этическим комитетом (ЭК);
• исследователь обязан предоставлять в ЭК текущую информацию, особенно о любых неблагоприятных явлениях;
• исследование должно проводиться только квалифицированными лицами;
• обязательна оценка возможного риска и ожидаемой пользы от проведения исследования;
• ожидаемая польза должна превалировать над возможным риском;
• конфиденциальность участия испытуемого в исследовании;
• если испытуемые недееспособны, согласие на их участие в исследовании должны дать их законные представители.
Кроме того, в 1966 г. была принята международная Конвенция гражданских и политических прав, ст. 7 которой гласит,
что «Никто не должен подвергаться пытке, жестокости, негуманному или неполноценному лечению, а также наказанию.
В частности, никто не может подвергаться медицинским или научным экспериментам без свободно принятого согласия».
5/16
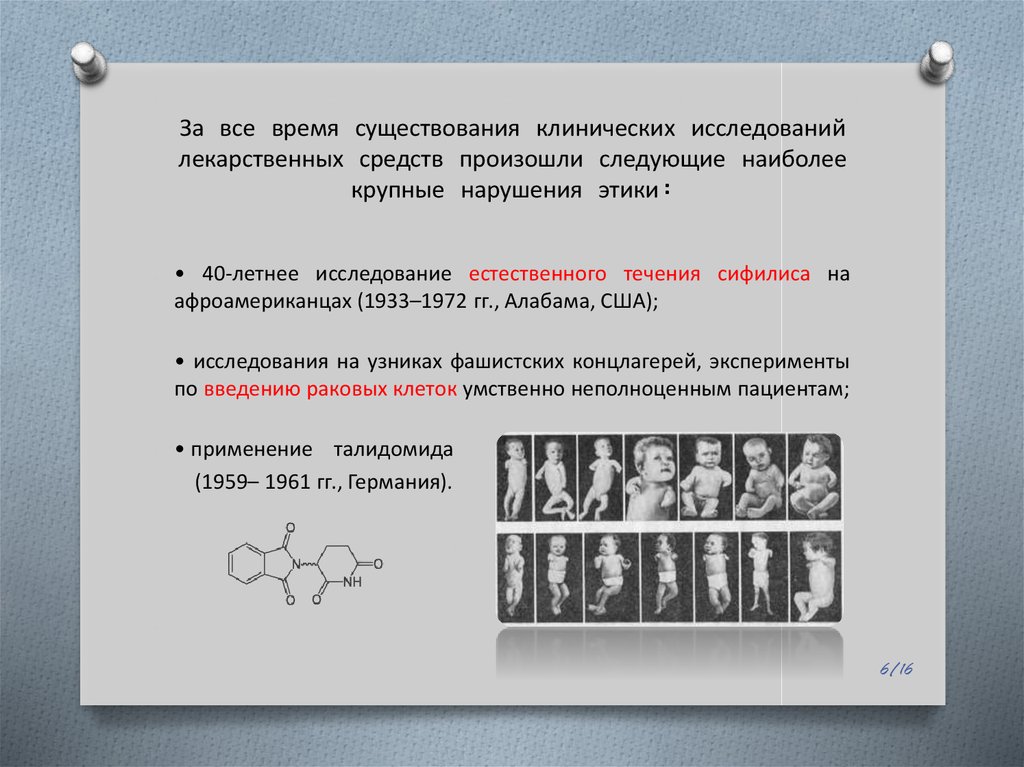
6. За все время существования клинических исследований лекарственных средств произошли следующие наиболее крупные нарушения этики:
• 40-летнее исследование естественного течения сифилиса наафроамериканцах (1933–1972 гг., Алабама, США);
• исследования на узниках фашистских концлагерей, эксперименты
по введению раковых клеток умственно неполноценным пациентам;
• применение талидомида
(1959– 1961 гг., Германия).
6/16
7. Существуют три вида Этических Комитетов*:
• локальный – действует на базе учреждения, в котором проходятклинические исследования, и осуществляет наблюдение за ходом
работ;
• региональный – действует в рамках региона;
• национальный (центральный) – действует на территории всей
страны.
* За соблюдением этических норм при клинических исследованиях
следят ЭК – независимые органы, основанные на добровольном
членстве. Они создаются на базе медицинских учреждений или других
национальных, региональных, местных представительных органов.
7/16
8.
Основными целями работы ЭК является защита прав и интересоввовлеченных в исследование испытуемых и исследователей, обеспечение
этической и нравственно правовой оценки материалов клинического
исследования. Для выполнения указанных целей ЭК решает следующие
задачи:
• независимо и объективно оценивает безопасность и неприкосновенность
прав испытуемых на стадиях планирования и проведения исследования;
• оценивает соответствие исследования гуманистическим и этическим
нормам, целесообразность проведения каждого исследования;
• оценивает соответствие исследователей, технических средств, протокола
(программы) проведения исследования, подбора субъектов исследования
правилам проведения качественных клинических исследований;
• осуществляет наблюдение за выполнением стандартов качества
проведения клинических исследований для обеспечения достоверности и
полноты данных.
8/16
9. Оценка риска
Существуют следующие потенциальные риски для здоровья, которыерассматриваются и проверяются ЭК:
- физический и психологический ущерб;
- вторжение в личную жизнь;
- нарушение конфиденциальности;
- социальные и экономические травмы.
Физический ущерб здоровью при проведении клинических исследований
могут нанести также и активные медицинские процедуры или побочное
действие ЛС (как правило должно быть минимальным).
9/16
10. Вторжение в личную жизнь является отдельным видом риска, возникающим при скрытом наблюдении за участниками исследования. Для
оценки его этичности рассматриваются следующие аспекты:• является ли нарушение частной жизни приемлемым с точки
зрения представлений испытуемых?
• является ли исследуемый вопрос таким важным, чтобы вторжение
было оправданным?
• может ли исследование быть изменено таким образом, чтобы его
можно было проводить без вторжения в личную жизнь субъектов?
10/16
11. Оценка ожидаемой пользы
Положительный эффект исследования может включать в себя прямуюпользу для участников исследований и получение более широких
сведений о заболеваниях и методах лечения, полезных для общества в
целом. Одни испытуемые могут полагать, что хирургическое
вмешательство – это благо, поскольку они избегают хронического
заболевания и его длительного лечения, другие же могут относиться к
нему как к значительному риску, полагая, наоборот, что длительное
лечение – это незначительный риск, в
то
время
как
они
избегают
необходимости
хирургического
вмешательства. Пожилой человек
может счесть, что потеря волос или
небольшой
шрам
–
это
незначительный риск, в то время как
подросток может быть этим серьезно
озабочен.
11/16
12. Согласие пациента на участие в исследовании
Добровольноеинформированное
согласие гарантирует, что будущие
испытуемые
понимают
характер
исследования и могут со знанием дела и
добровольно принять решение о своем
участии или неучастии. Эта гарантия
защищает
и
испытуемого,
к
самостоятельности которого проявляется
уважение, и исследователя, который в
противном
случае
вступает
в
противоречие с законом. Документальная
форма
информированного
согласия
обычно
предполагает
применение
заполненного
бланка
о
согласии,
содержащего всю информацию, которую
предусмотрено раскрыть, и подпись
испытуемого.
12/16
13. Включение женщин в исследование
Включение женщинв исследование
Клинические исследования с участием женщин, которые на момент
проведения исследования беременны или могут забеременеть, должны
находиться под особым контролем ЭК. Столь пристальное внимание к этой
проблеме объясняется присутствием третьей стороны (плода), который
фактически принимает участие в исследовании, но не может дать на это
согласие и поэтому нуждается в максимальной защите от возможного
нанесения вреда его здоровью. При этом беременная женщина может быть
субъектом исследования, только если его цель отвечает потребностям
здоровья матери и плода, а риск для их здоровья минимален.
13/16
14. Клинические исследования с участием детей
Клинические исследованияс участием детей
Согласно существующей в РФ практике клинические исследования ЛС на
детях, за редким исключением, когда препараты предназначены для
применения в педиатрии, проводятся по завершении клинических
исследований на эффективность и безопасность ЛС у взрослых. Известно, что
эффект различных ЛС у детей может кардинально отличаться от такового у
взрослых. Фармакокинетика многих ЛС изменяется в зависимости от возраста
пациента, а их желательные и побочные эффекты могут быть разными у детей
и взрослых.
Например, фенобарбитал оказывает седативный эффект у взрослых, при этом
у детей он может вызывать возбуждение.
14/16
15. Прежде чем приступить к исследованию с привлечением детей, исследователям и ЭК необходимо ответить на следующие вопросы:
• обосновано ли клиническое исследование, важны липредполагаемые результаты и будут ли в результате получены
ответы на поставленные вопросы?
• не являются ли достаточными результаты исследований,
полученные на взрослых?
• допустимы ли риск и нагрузки, которым будут подвергнуты
субъекты исследования?
• не нарушаются ли права субъектов исследования при получении
согласия?
15/16
16.
При проведении клинических исследований на детях запрещается убеждатьродителей и ребенка принять решение об участии в исследовании с помощью
финансовых или иных материальных механизмов. Не следует привлекать к
участию в исследованиях детей, содержащихся в домах для сирот,
исправительных учреждениях, а также необходимо резко ограничить участие
детей из неблагополучных семей (родители-алкоголики, наркоманы,
безработные, неоднократно судимые). При этом согласно Хельсинкской
декларации согласие ребенка должно быть получено в дополнение к
разрешению его родителей.
16/16














 medicine
medicine








