Similar presentations:
Химия 7 13C22491
1. Химические реакции
2.
Химическая реакция —процесс, в течение которого
одни вещества превращаются в
другие.
Физическое явление —
изменение свойств физических
тел.
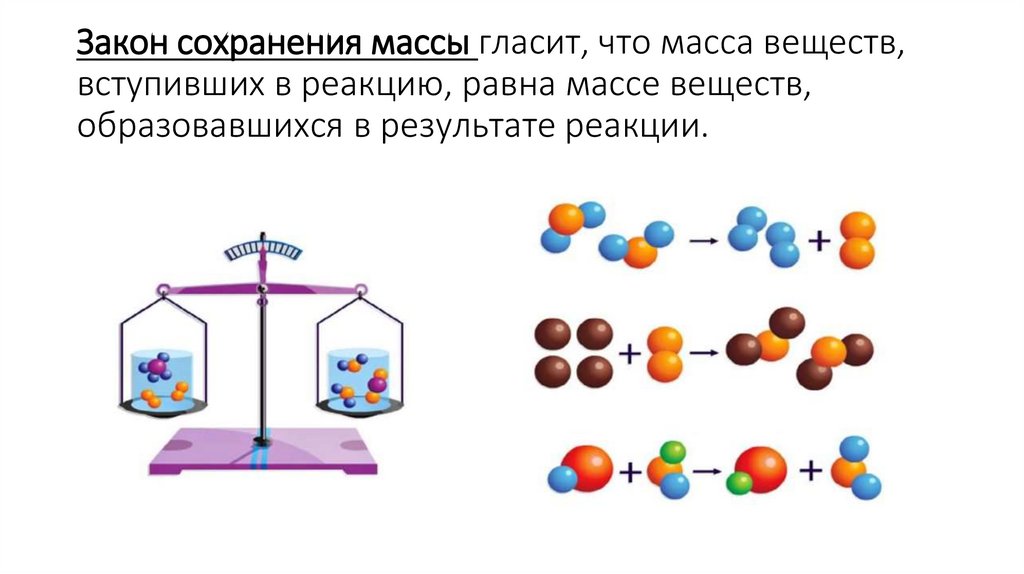
3. Закон сохранения массы гласит, что масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате
реакции.4.
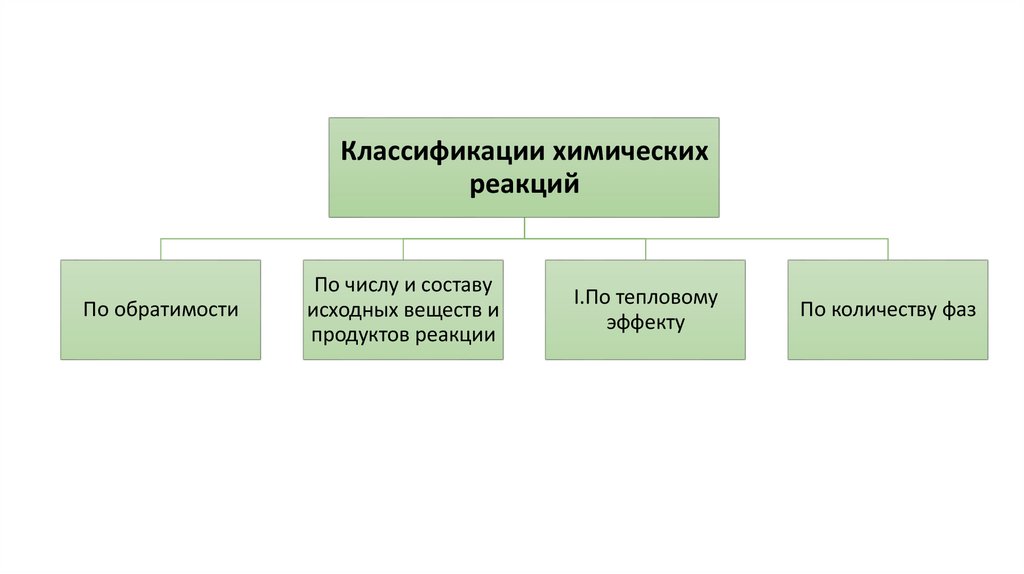
Классификации химическихреакций
По обратимости
По числу и составу
исходных веществ и
продуктов реакции
I.По тепловому
эффекту
По количеству фаз
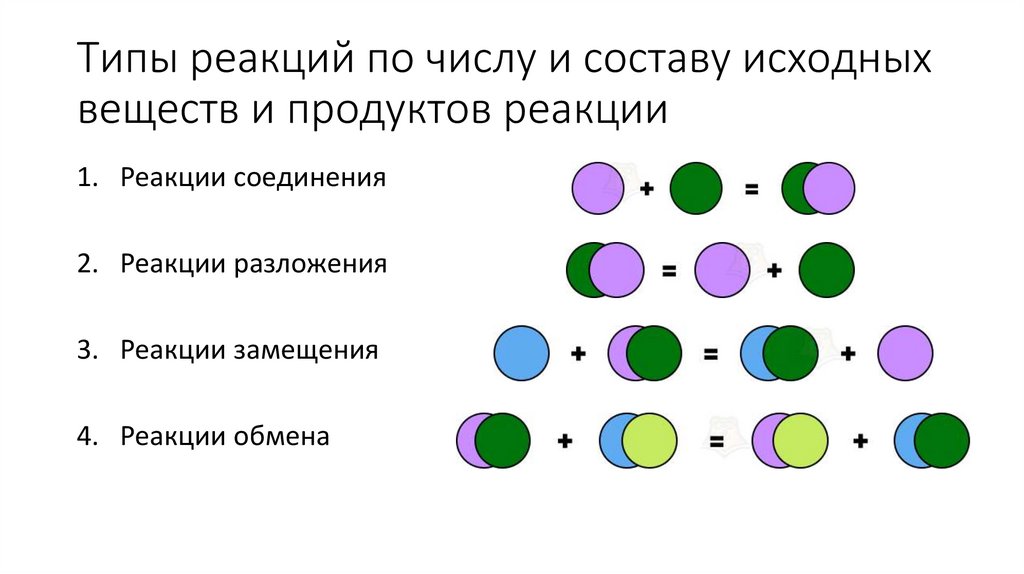
5. Типы реакций по числу и составу исходных веществ и продуктов реакции
1. Реакции соединения2. Реакции разложения
3. Реакции замещения
4. Реакции обмена
6. Типы реакций по обратимости
1) Обратимые реакции2) Необратимые реакции
Реакции протекают в двух
направлениях: прямом и
обратном. То есть из реагентов
мы можем получить продукты, а
из продуктов — реагенты.
Реакции протекают только в
одном направлении — прямом.
То есть из реагентов мы можем
получить продукты, а из
продуктов реагенты мы
получить не сможем.
Если в продуктах есть слабый электролит, осадок, газ или
выделяется очень много тепла, то чаще всего в таких
случаях реакция будет необратима.
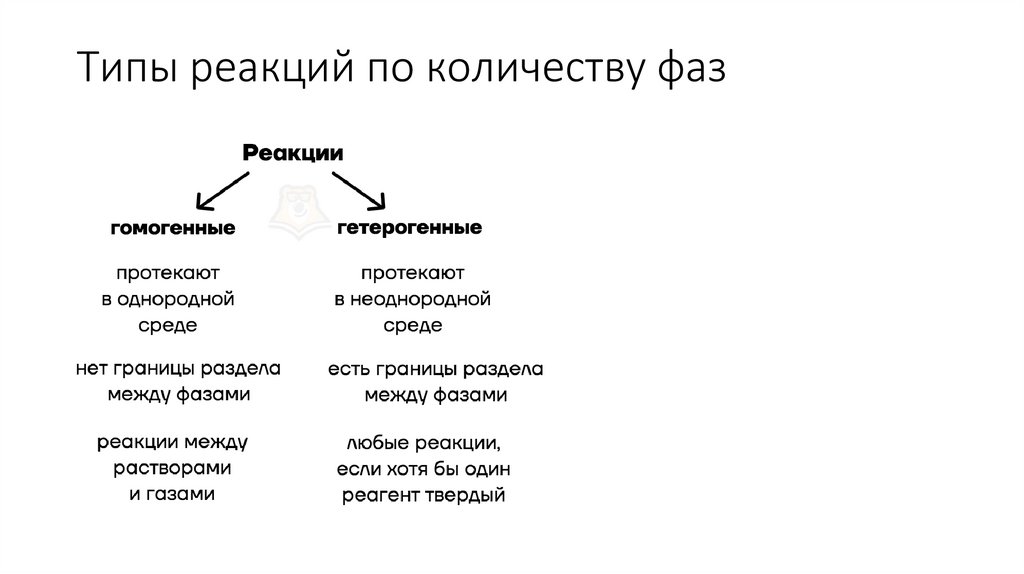
7. Типы реакций по количеству фаз
8. Типы реакций по тепловому эффекту
9. Задание для закрепления
Охарактеризуйте химические реакции по известным вам признакам:1) CuSO4 + Zn = ZnSO4 + Cu+ Q;
2) BaO + H2O = Ba(OH)2 + Q;
3) N2 + O2 =2NO+Q;
4) 2CuOH = Cu2O+ H2O-Q;
5) H2SO4 + 2KOH = K2SO4+ 2H2O+ Q;
6) H2 + S= H2S+ Q;
7) N2 + 3H2 = 2NH3 + Q;
8) 2Li + 2H2O = 2LiOH + H2 + Q.
10. При составлении уравнений используются коэффициенты и индексы.
Коэффициентчисло молекул, изображается цифрой перед молекулярной
формулой вещества
Индекс
число атомов элемента в одной молекуле вещества, которое
записывается справа внизу от символа элемента.
11. Важно помнить!
• Коэффициент 1 , как и индекс 1 в формуле вещества, не пишется.• Есть простые вещества — двухатомные молекулы. Если они не в
составе соединений, то пишутся с индексом 2 — N2, O2, H2
• В уравнении реакции не следует ставить кратные коэффициенты.
Если все коэффициенты кратно увеличены, их нужно сократить.
Например, в записи уравнения все коэффициенты можно и нужно
сократить, разделить на 2:
4Н2 О = 4Н2 + 2












 chemistry
chemistry








