Similar presentations:
Типы химических реакций, их классификация
1.
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РОССИЙСКОЙ ФЕДЕРАЦИИфедеральное государственное бюджетное учреждение высшего образования
«Санкт-Петербургский государственный аграрный университет»
___________________________________________________________________
Царскосельский аграрно-технологический колледж
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ,
ИХ КЛАССИФИКАЦИЯ
АВТОР: К.Х.Н. ЧУМАЧЕНКО Е.В.
2.
Цель занятия:сформировать представление о химических
реакциях.
Задачи:
Образовательная: изучить классификацию
химических реакций.
Развивающая: развивать умение работать с
первоисточником и дополнительной информацией:
выделять главное и составлять опорный конспект;
развивать память, логическое мышление, внимание.
Воспитательная: воспитывать аккуратность,
трудолюбие, патриотические, эстетические и
нравственные качества.
3.
Химическая реакция – этопроцесс превращения исходных веществ
(реагентов) в конечные вещества
(продукты)
Признаками протекания химических
реакций являются:
изменение цвета,
выделение газа,
выпадение осадка,
появление запаха,
выделение или поглощение энергии.
4.
Химические реакции записывают спомощью схем или уравнений, которые
содержат формулы исходных веществ и
продуктов реакций. Уравнения реакций
отличаются от схем наличием
коэффициентов, с помощью которых
уравнивают число атомов каждого
элемента в исходных веществах (левая
часть уравнения) и продуктах (правая
часть уравнения). Коэффициенты
позволяют отразить закон сохранения
массы.
BaCl2 + H2SO4 = BaSO4 ↓+ 2HCl
5.
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХРЕАКЦИЙ
Химические реакции можно классифицировать по
различным признакам, например:
по числу и составу исходных веществ и продуктов
реакции;
по агрегатному состоянию;
по тепловому эффекту;
по изменению степени окисления;
по наличию или отсутствию катализатора;
по признаку обратимости.
Существуют и другие признаки сравнения, по
которым можно классифицировать химические реакции.
6.
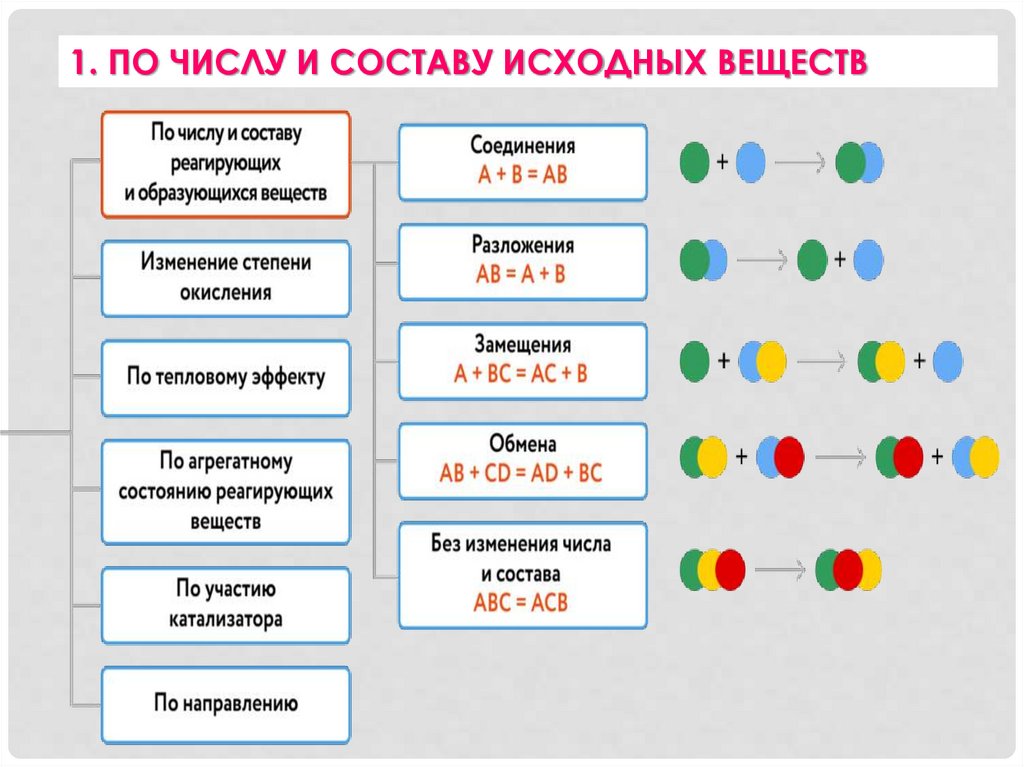
1. ПО ЧИСЛУ И СОСТАВУ ИСХОДНЫХ ВЕЩЕСТВ7.
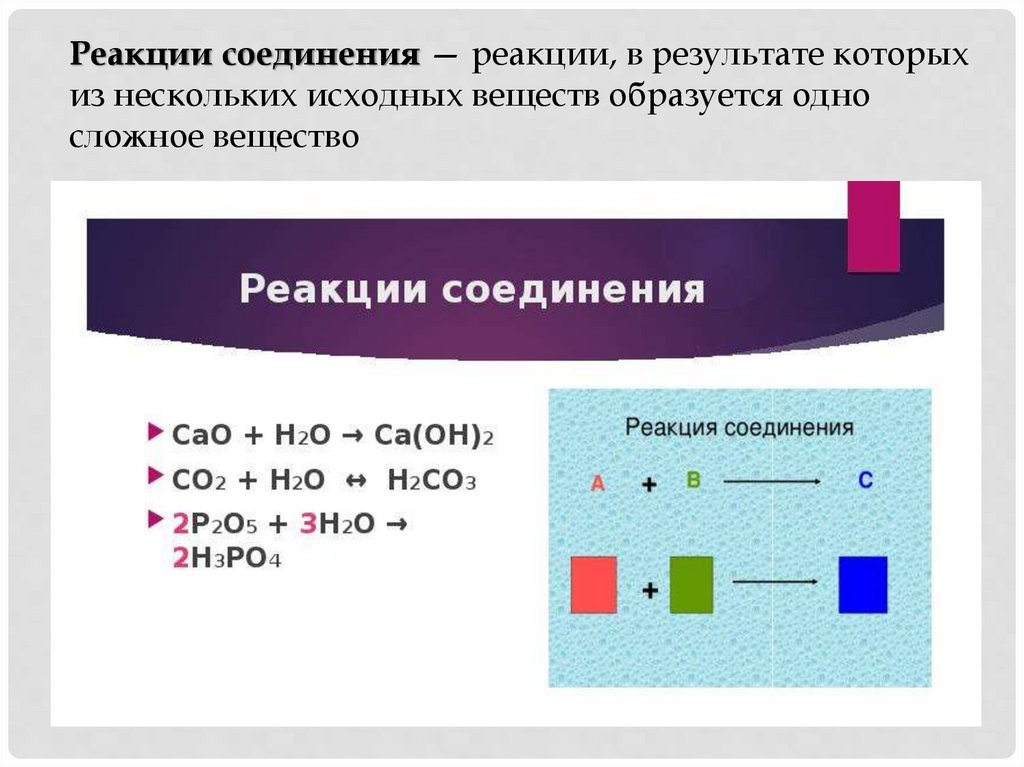
Реакции соединения — реакции, в результате которыхиз нескольких исходных веществ образуется одно
сложное вещество
8.
Реакции разложения — реакции, в результатекоторых из одного сложного вещества
образуются два и несколько новых веществ
9.
Реакции замещения — реакции между простым исложным веществами, протекающие с образованием двух
новых веществ — простого и сложного. В реакциях
замещения атомы простого вещества замещают атомы
одного из химических элементов в сложном веществе
10.
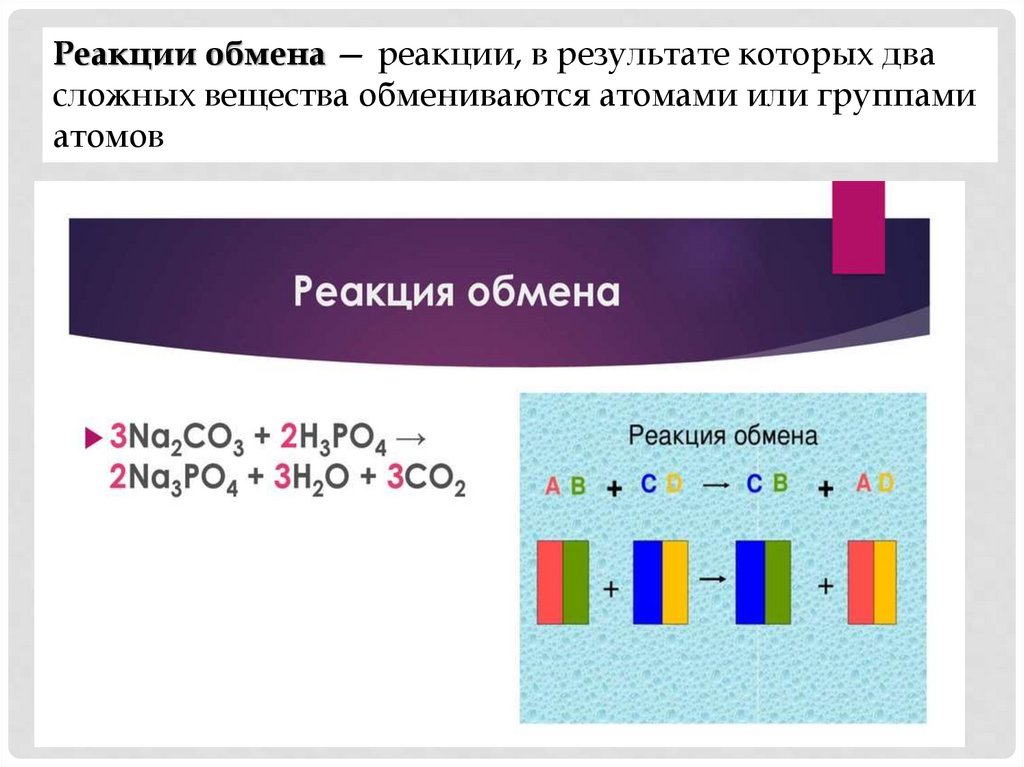
Реакции обмена — реакции, в результате которых двасложных вещества обмениваются атомами или группами
атомов
11.
2. От агрегатного состояния:В зависимости от агрегатного состояния, в котором
находятся реагирующие вещества (жидкое, твёрдое,
газообразное), различают гомогенные и гетерогенные
реакции. Агрегатное состояние вещества обычно
обозначается буквами русского алфавита нижним
индексом в скобках: (г) — газ, (ж) — жидкость, (т) —
твёрдое.
ГОМОГЕННЫЕ РЕАКЦИИ
Это реакции, протекающие в одной фазе
HCl (р-р) + NaOH (р-р)= NaCl + H2O
H2(г ) + Cl2(г ) = 2HCl↑
12.
ГЕТЕРОГЕННЫЕ РЕАКЦИИЭто реакции, протекающие на границе раздела
фаз
Граница раздела фаз присутствует в системе,
образованной, например, жидкостью и твёрдым
телом (металл и кислота), твёрдым телом и
газом, двумя несмешивающимися жидкостями
(масло и вода).
Примерами гетерогенных реакций являются:
Zn(тв) + H2SO4 (разб. р-р) = ZnSO4 + H2↑
C(тв) + O2(г) = CO2↑
13.
3. По тепловому эффекту:По тепловому эффекту различают
экзотермические и эндотермические реакции.
Экзотермические реакции
реакции, протекающие с выделением тепла (+Q)
Самые типичные экзотермические реакции —
это реакции горения:
CH4 + O2 = CO2↑ + H2O +Q
Эндотермические реакции
реакции, протекающие с поглощением тепла (-Q)
CaCO3 = CaO + CO2↑ –Q
14.
Если в уравнении указан тепловой эффект реакции, т.е. количество выделяемой или поглощаемой в результате
реакции теплоты, то такое уравнение
называется термохимическим.
В термохимических уравнениях обязательно указывают
агрегатные состояния веществ (жидкое, твёрдое или
газообразное), так как разные агрегатные состояния
одного и того же вещества имеют разную внутреннюю
энергию. Коэффициенты в термохимическом уравнении
равны количеству веществ (в молях), вступивших в
реакцию.
Например, термохимическое уравнение
2H2(г) + O2(г) = 2H2O(г) + 484 кДж
15.
При протекании химической реакции возможныдва варианта перераспределения энергии.
1) Если E реагентов > E продуктов, то
благодаря "выигрышу" в энергии атомы соединяются и
образуют молекулы. Исходя из закона сохранения
энергии, в результате такой реакции избыточная
энергия выделяется в окружающую среду, чаще всего в
виде тепла или света.
2) Если E реагентов < E продуктов, то в этом случае
для протекания реакции необходима дополнительная
энергия, которая может быть получена извне в виде
дополнительного нагревания, УФ-облучения или в
других формах.
16.
4. По изменению степени окисленияатомов химических элементов:
Окислительно-восстановительные реакции – это
реакции, в которых изменяются степени окисления
некоторых элементов.
Окисление - это процесс потери электронов,
сопровождающийся увеличением степени окисления.
Восстановление – это процесс присоединения
электронов, сопровождающийся уменьшением степени
окисления.
Окислитель – это элемент, принимающий электроны.
Восстановитель - это элемент, отдающий электроны.
Feo + CuSO4 = FeSO4 + Cuo
17.
5. По наличию или отсутствиюкатализатора:
По наличию или отсутствию катализатора различают
каталитические и некаталитические реакции.
Катализатор – это вещество, участвующее в реакции и
изменяющее её скорость, но остающееся неизменным
после того, как химическая реакция закончилась.
Существуют также вещества, которые замедляют
реакцию. Такие вещества называются ингибиторами.
Ингибиторы используются в быту и в промышленности
для подавления протекания нежелательных процессов,
например старения полимеров, окисления топлива и
смазочных масел, пищевых жиров и др.
18.
6. По признаку обратимости:По признаку обратимости различают обратимые и
необратимые реакции.
Обратимые реакции – это реакции, одновременно
протекающие в двух противоположных направлениях.
Необратимые реакции протекают только в одном
направлении.
При записи обратимых реакций вместо знака равенства
используют противоположно направленные стрелки.
Обратимые реакции очень распространены в химии. К
ним относятся диссоциация воды и слабых кислот,
реакции водорода с йодом и азотом, окисление оксида
серы (IV) до оксида серы (VI) кислородом и многие
другие:
H2 + I2 ↔2HI
Следует отметить, что единой классификации химических
реакций не существует.
19.
Окислительно-восстановительные реакции– это реакции, протекающие с изменением
степени окисления атомов, входящих в состав
реагирующих веществ.
Степень окисления – это условный заряд
атома, вычисленный исходя из предположения,
что вещество состоит из ионов (ион –
заряженная частица).
Степень
окисления
любого
простого
вещества равна нулю. Например: Al0 , H20, S0. В
сложных
веществах
некоторые
элементы
проявляют постоянную степень окисления.
20.
Степень окисления + 1: у щелочных металлов (металлыглавной подгруппы первой группы Li, Na, K, Rb, Cs, Fr), а
также Ag. Например: K2O, Na2O, Rb2O, Li2O, Ag2O.
У водорода (Н) в большинстве соединений степень
окисления равна +1: Н+12О, H+1Br.
Исключение составляют гидриды металлов – соединения
металлов с водородом
LiH-1, CaH-12. В этих соединениях степень окисления
водорода -1.
Степень окисления +2: у элементов главной подгруппы
второй группы Be, Mg, Ca, Sr, Ba. Например: Ba+2O,
Ca+2O, Mg+2Cl2.
Степень окисления +3: у элементов третьей группы Al, B.
Например: Al+32O3, H3B+3O3.
Степень окисления -1: всегда у фтора F. Например: НF-1.
21.
Степень окисления -2: в сложных веществаху кислорода О. Исключение составляют
перекиси (или пероксиды) в которых степень
окисления кислорода -1. Например: Н2О-12.
Остальные элементы относятся к элементам
с переменной валентностью. Их степень
окисления может меняться.
В сложных веществах, состоящих из трех и
более элементов, степень окисления элементов
с переменной валентностью может
определяться через Х.
22.
Типы окислительно-восстановительных реакцийВнутримолекулярные
Реакции идут с изменением
степени окисления разных
атомов в одной молекуле
NaN+5O-23→NaN+3O2 + O02
Межмолекулярные
Реакции идут с изменением
степени окисления атомов в
молекулах разных веществ
H2S-2 + H2S+4O3→S0 + H2O
23.
Составление уравнений окислительновосстановительных реакций(метод электронного баланса).
1. Записать схему химической реакции
2.Определить элементы, атомы которых изменяют свои
степени окисления в ходе реакции.
3. Определить окислитель (степень окисления понижается) и
восстановитель (степень окисления повышается).
4. Составить уравнение электронного баланса.
5. Уравнять число электронов, отданных восстановителем, и
число электронов присоединенных окислителем.
6. Определить коэффициенты при восстановителе и
окислителе.
7. Записать окончательное уравнение ОВР.
24.
ЗНАЧЕНИЕ ОВРОкислительно-восстановительные реакции широко
распространены в природе и являются основой
жизнедеятельности живых организмов, поскольку
сними связаны обмен веществ, процессы дыхания,
брожения, гниения, фотосинтеза в зеленых растениях.
Широкое применение ОВР получили в технике,
например в процессах коррозии металлов, горения
различных топлив, металлургических,
электролитических и других процессах.
Наиболее эффективно ОВР используют в
электролизе. Этим способом получают многие
металлы (щелочные, щелочноземельные, алюминий), а
также такие неметаллы, как водород, кислород, хлор.
25.
РЕШИТЬ УРАВНЕНИЯ ОВР1.Mg + HNO3(p)→Mg(NO3)2 + N2↑ + H2O
2. KI- + FeCl3 →I2 + FeCl2 +KCl
3. K2Cr2O7 + K2SO3 + H2SO4 = Cr2(SO4)3 + K2SO4 +H2O
4. KNO2 + KMnO4 + H2O = MnO2 + KNO3 + KOH
5.Na2Cr2O7 + HBr = CrBr3 + Br2 + NaBr + H2O
6. Pt + HNO3 + HCl = PtCl4 + NO + H2O
7. P + HNO3 = H3PO4 + NO2 + H2O






















 chemistry
chemistry








