Similar presentations:
https___school.mos.ru_ej_attachments_files_222_699_278_original_%D0%90%D0%B7%D0%BE%D1%82%D0%BD%D0%B0%D1%8F%20%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D0%B0%20%D0%B8%20%D0%BD%D0%B8%D1%82%D1%80%D0%B0%D1%82%D1%8B
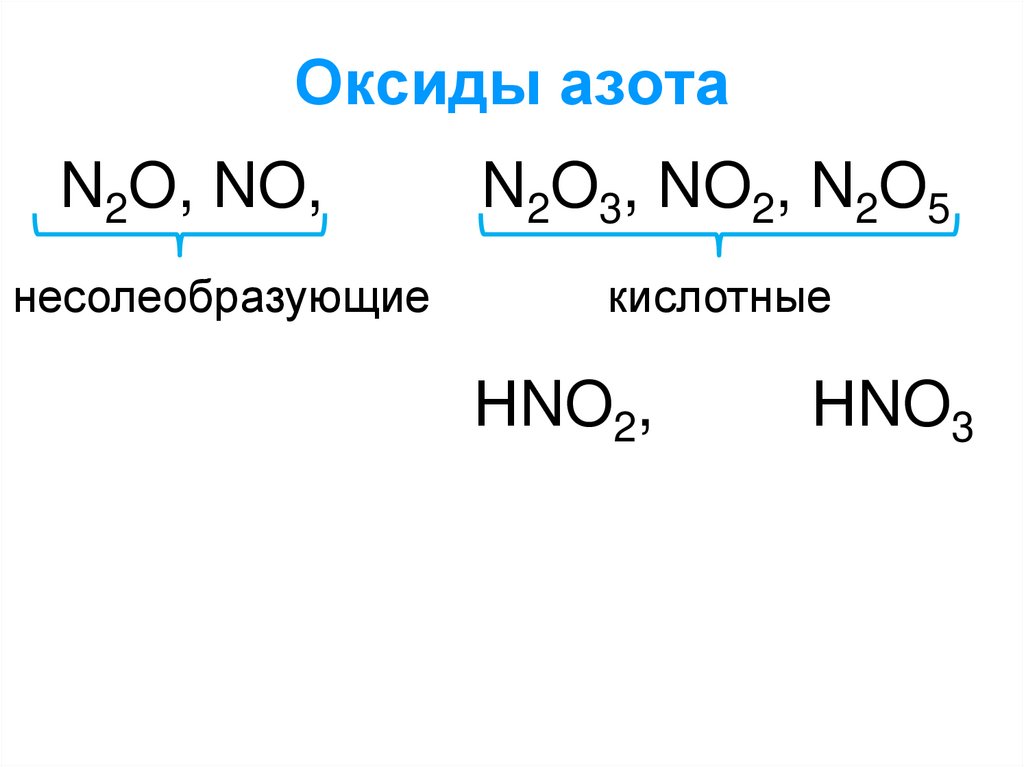
1. Оксиды азота
N2O, NO,N2O3, NO2, N2O5
несолеобразующие
кислотные
НNO2,
НNO3
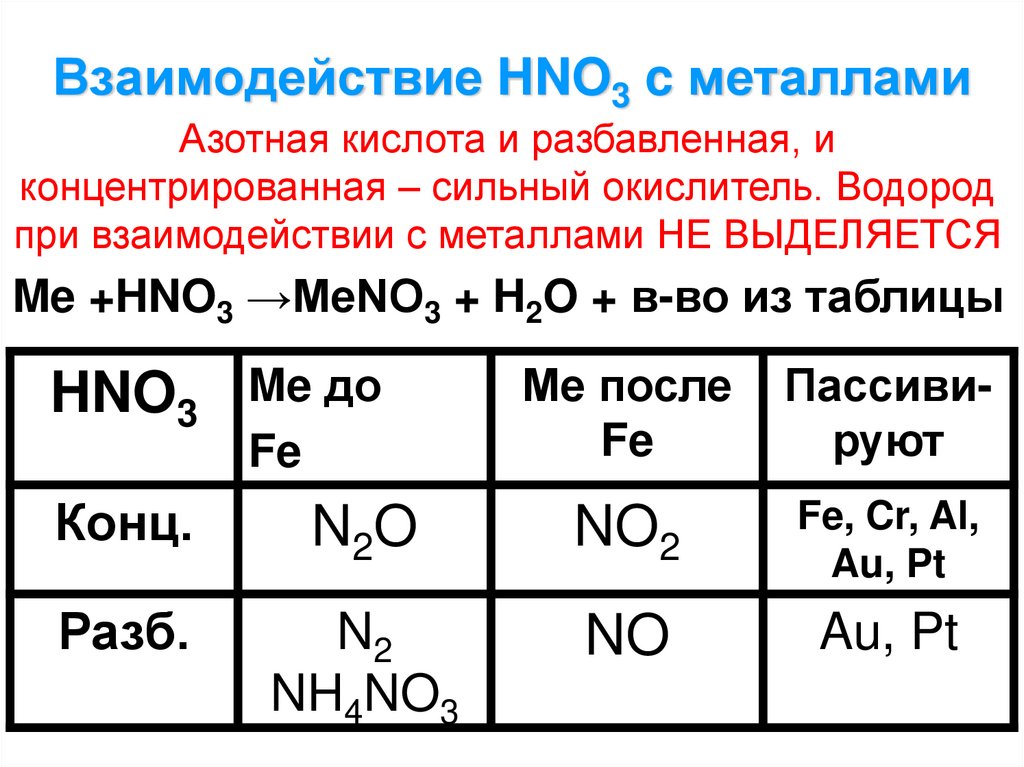
2. Взаимодействие HNO3 c металлами
Азотная кислота и разбавленная, иконцентрированная – сильный окислитель. Водород
при взаимодействии с металлами НЕ ВЫДЕЛЯЕТСЯ
Me +HNO3 →MeNO3 + H2O + в-во из таблицы
HNO3 Me до
Fe
Ме после
Fe
Пассивируют
Конц.
N2O
NO2
Fe, Cr, Al,
Au, Pt
Разб.
N2
NH4NO3
NO
Au, Pt
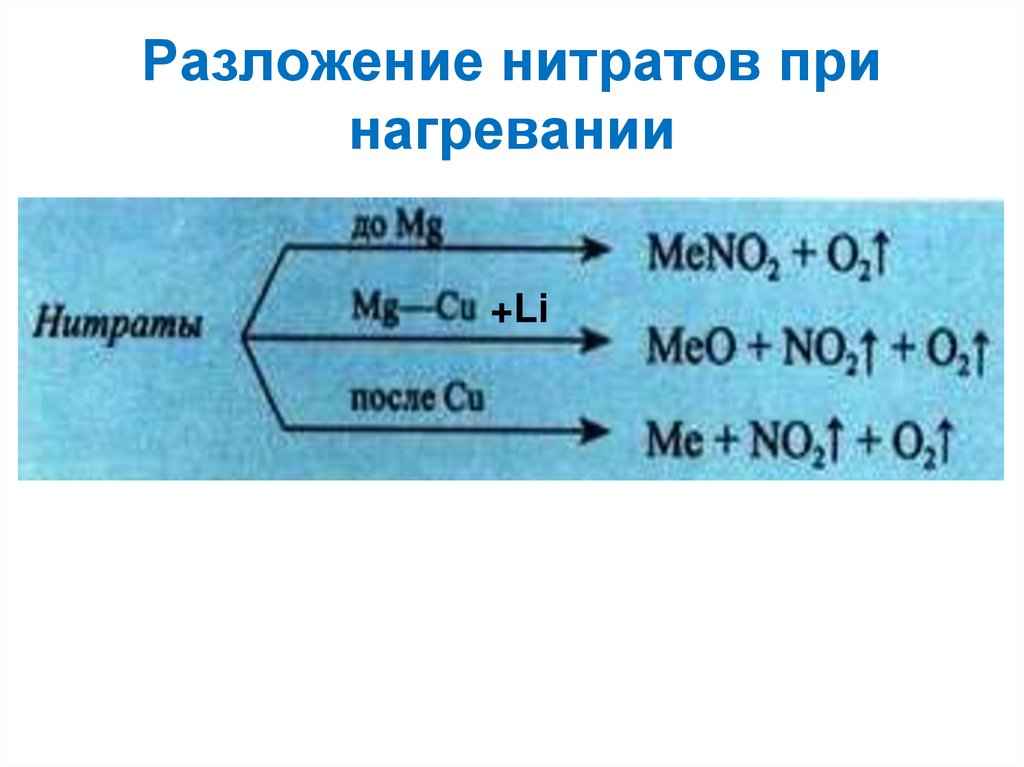
3. Разложение нитратов при нагревании
+Li4. Закончите уравнения возможных реакций:
1. HNO3+ NH32. HNO3+ Na2CO3
3. HNO3+ Al2O3
4. HNO3+ NaCl
5. NH4Cl (t◦) →
6. NO2+ KOH
7. HNO3+ Cu(OH)2
8. HNO3(Р)+Na
9. NH3 + O2
10. HNO3(K)+Na
1. AgNO3+ CaCl2
2. KNO3(t◦) →
3. NH4NO3 + Ca(OH)2
4. Zn(NO3)2(t◦) →
5. NH4NO3+ Ca(OH)2
6. Fe(NO3)3+ KOH
7. N2O3+ Ba(OH)2
8. Zn(NO3)2+Al
9. Zn(NO3)2 + HCl
10. (NH4)2SO4 + BaCl2
5. Индикаторы в растворах:
1. Азотной и азотистой к-т: лакмус - ?красный
2. Аммиака: лакмус -? фенолфталеин - ?
синий, малиновый


 chemistry
chemistry








