Similar presentations:
3 Л Фазалық тепе-теңдік ТД-сы [Автосохраненный]
1. Қарағанды медицина университеті Фармация мектебі Фазалық тепе-теңдіктер термодинамикасы. Гиббстің фазалар ережесі. Дәрілік
заттардыңбіркомпонентті және бинарлы жүйелері
жағдайының диаграммасы
2.
Фармацевтикалық химияда маңызды факторзаттардың тазалығы болып табылады.
Заттарды тазарту үшін сублимация,
экстракция, дистилляция және т.б. сияқты
әдістер қолданылады.
Бұл әдістерде заттардың фазалық ауысуы
жүзеге асырылады. Фазалық ауысулардың
заңдылықтарын қарастырамыз.
3.
Фазалық күйАдамның сезім мүшелеріне әртүрлі заттар әсер
етуіне сәйкес оларды газ тәрізді, сұйық және
қатты деп бөлуге болады.
Бұл топтардың әрқайсысы заттың белгілі бір
фазалық күйін көрсетеді.
Фаза дегеніміз заттардың термодинамикалық
тепе-теңдік күйі - фазалық күй.
4.
Фазалық ауысуларЗаттың бір фазалық күйден екінші фазаға ауысуы фазалық ауысу қасиеттердің күрт өзгеруімен қатар жүреді.
Фазалық ауысулар 2 типке бөлінеді.
I типтегі фазалық ауысуларға - булану, сублимация және
балқу жатады, олар жылуды шығарумен немесе сіңірумен
және фаза көлемінің өзгеруімен бірге жүреді.
2 типтегі фазалық ауысулар бұл қасиеттерге ие емес.
Мысалы, темірдің ферромагниттік күйден парамагниттік
күйге ауысуы: α Fe → β Fe металдың 769 0С
температурада кристалдық құрылымын өзгертпей және
масса көлемін сақтауы; металдың жоғары өткізгіш күйге
көшуі; сұйық гелийдің артық сұйықтық күйіне ауысуы.
5.
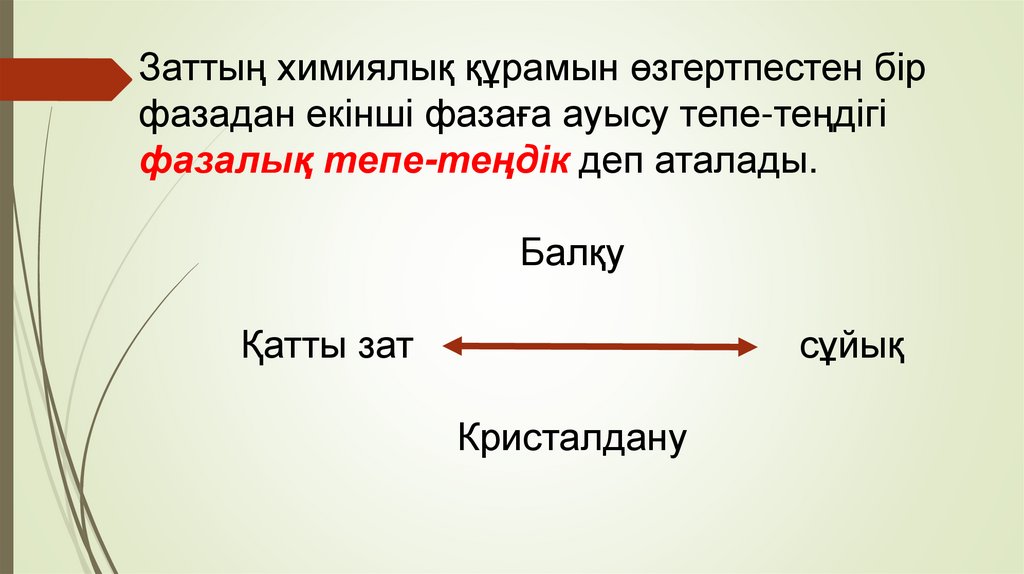
Заттың химиялық құрамын өзгертпестен бірфазадан екінші фазаға ауысу тепе-теңдігі
фазалық тепе-теңдік деп аталады.
Балқу
Қатты зат
сұйық
Кристалдану
6.
Заттың бір немесе басқа фазалық күйдеболуы температура мен қысымға байланысты.
Температураның
жоғарылауы
әрдайым
кристалды → сұйық → газды күйіне
ауысуына және жүйеде ретсіздік (бұзылу)
дәрежесінің жоғарылауына әкеледі.
Қысымның жоғарылауы затқа кері әсер етеді.
7.
8.
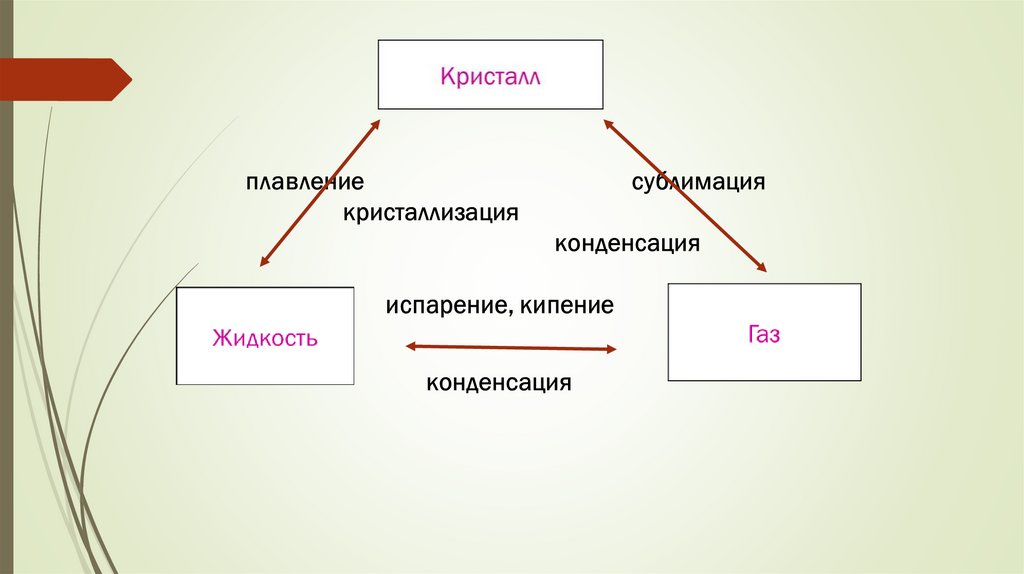
Газдың сұйық немесе кристалды күйге ауысуыконденсация деп аталады.
Кейде газдың сұйықтыққа ауысу процесі сұйылту,
ал кристалға десублимация деп аталады.
Заттың сұйық немесе кристалдық күйден газ
тәрізді күйге ауысуы булану деп аталады.
9.
Бу - тепе-теңдік жағдайындағы заттың газтәрізді күйі.
Булану дегеніміз - сұйық немесе кристалл
бетінде болатын булану процесі.
Егер бу сұйықтықтың бетінен ғана емес,
сонымен бірге оның булануы кезінде пайда
болса, онда қайнау пайда болады.
10.
Заттың кристаллдан газға ауысуы сублимациядеп аталады.
Сұйықтың кристаллға ауысуы - бұл
кристалдану немесе қатаю.
Төмен температурада жүретін қатаю процесі
мұздату деп аталады.
Кері процесс балқу деп аталады.
11.
Фазалық ауысулар жылудың бөлінуіменнемесе сіңуімен және энтропияның айтарлықтай
өзгеруімен жүреді.
Егер заттың фазалық ауысуы температураның
жоғарылауымен (сублимация, балқу, булану)
жүрсе, онда ол жылуды сіңірумен қатар жүреді
және энтропияның ΔS> 0 жоғарылауымен
сипатталады. ΔH> 0.
12.
Егер ауысу температураның төмендеуіменжүрсе (конденсация, сұйылту, қатаю), онда ол
жылудың бөлінуімен бірге жүреді және ΔH <0
сипатталады.
Осы ауысу кезінде энтропия төмендейді, ΔS <0.
13.
Заттың атауын H және S өзгерту таңбасыменкөрсету әдеттегідей ΔHisp, ΔSpl.
Бір заттың кристалдық күйі қасиеттері мен
құрылымында әр түрлі болуы мүмкін, содан кейін
олар бұл зат әртүрлі модификацияларда болады
деп айтады.
Бірнеше кристалды модификациялардың болу
құбылысы полиморфизм деп аталады, ал бір
модификациядан екіншісіне ауысу полиморфты
қайта құру деп аталады.
14.
Заттың бір фазадан екінші фазаға ауысумүмкіндігі физика мен химияның жалпы
заңдылықтарының бірі - Гиббс фазалық
ережесімен анықталады.
Гиббс фазалық ережесі тепе-теңдікке
қолданылады және фазалық тепе-теңдікке
қосыла ТД II заңының көрінісі болып табылады.
15.
Гиббс фазалық ережесіС=К–Ф+п
c - жүйенің еркіндік немесе өзгермелілік
дәрежелерінің саны - бұл оның фазалық құрамын
өзгертпестен бір уақытта өзгеруге болатын жүйенің
күйінің параметрлері саны.
K - жүйенің тәуелсіз компоненттерінің саны;
Ф - жүйенің берілген нүктесіндегі фазалар саны;
n - жүйені сипаттайтын күй параметрлерінің саны.
16.
ТД жүйе бірнеше фазадан және бірнешекомпоненттерден тұруы мүмкін.
Компонент - жүйенің ажырамас бөлігі болып
табылатын жеке химиялық зат, одан бөлінуі мүмкін
және дербес өмір сүре алады.
К – жүйедегі тәуелсіз компоненттер (заттар) саны.
NаСІ сулы ерітіндісі
К = 2 (су, NаСІ).
Газдар қоспасы Н2, Не, Аг К = 3 (әсерлесулер жоқ).
Газдар қоспасы НІ, Н2, І2 К = 2 (мүмкін реакция:
Н2 + І2 = 2НІ, тек 2 тәуелсіз компоненттер).
17.
Фазалық ережені қолдана отырып,зерттелген жүйенің термодинамикалық мүмкін
немесе мүмкін еместігін болжауға болады.
Әдетте n = 2, T және p = const
C=К-Ф+2
18.
Жүйелер классификациясыКомпоненттер саны бойынша:
Бір, екі, үш компонентті.
Фазалар саны бойынша:
Бір, екі, үш фазалы.
Бостандық дәрежелерінің саны бойынша:
1. C = 0 - инвариантты,
2. C = 1 - моновариантты,
3. C = 2 - бивариантты.
19.
Жүйелер қасиеттерінің зат мөлшерінетәуелділігі сипаты бойынша оларды 2 түрге
бөлуге болады:
1) экстенсивті қасиеттер - бұл денелер
қосылғанда жинақталатын қасиеттер
(ұзындығы, көлемі, массасы, жылу
сыйымдылығы);
2) қарқынды қасиеттер - бұл жүйенің
массасына тәуелсіз қасиеттер (T, P).
20.
Жүйенің фазалық құрамын көрсететін диаграммаларфазалық диаграммалар немесе күй диаграммалары
(көлемдік және жазық) деп аталады.
Фазалық талдаудың принциптері:
1) Үздіксіздік принципі: жүйенің күйінің параметрлерінің
үнемі өзгеруімен - фазаның құрамындағы жүйенің қасиеттері
де бірқалыпты және үздіксіз өзгереді.
2) Геометриялық сәйкестік принципі: жүйе күйінің
диаграммасында жүйенің әр фазалық күйі өзінің
геометриялық кескініне ие (жазықтық, сызық, нүкте).
21.
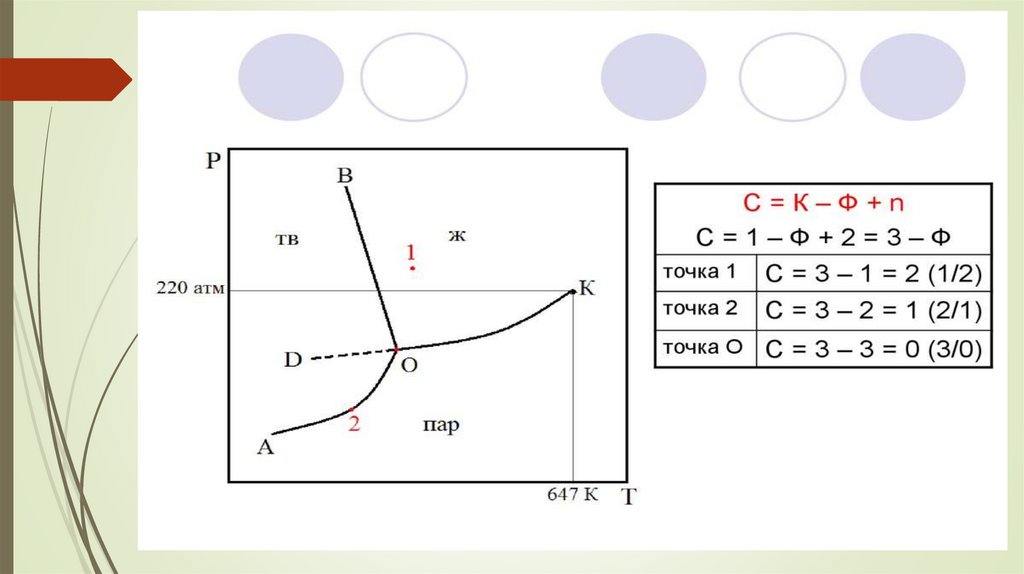
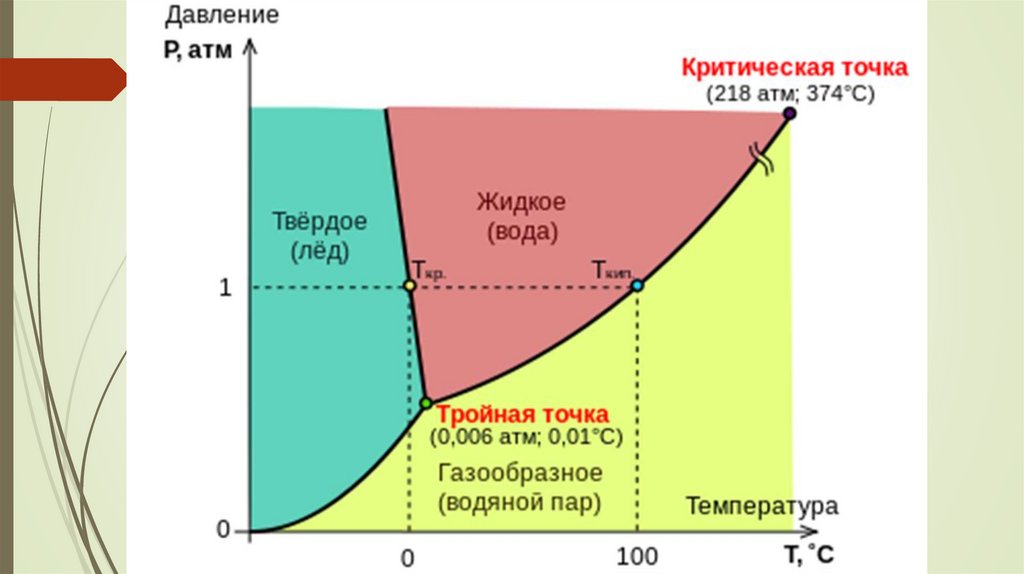
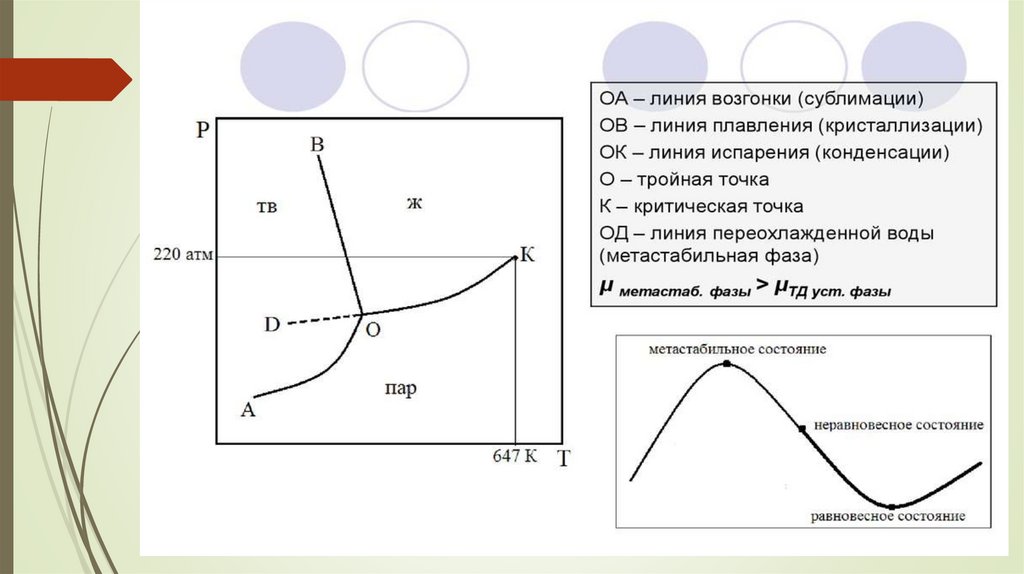
Судың күй диаграммасыЖазықтықтар фазалар: мұз (М), сұйық (С), бу (Б) болуын
көрсетеді. Жазықтықтардың қиылысу сызықтары тепе – теңдік
күйді сипаттайды: С↔М (АО қисығы); М ↔ Б (СО қисығы); С
↔ Б (ВО қисығы). Күй диаграммасындағы нүкте (фигуративтік
нүкте) жүйенің сол күйдегісін сипаттайтын параметрлер мәні.
Жазықтың кез – келген шегінде фазалар санын өзгертпей – ақ
Т және Р мәндерін өзгертуге болады. Себебі еркіндік дәрежесі
с = 1 – 1 + 2 = 2 (жүйе бивариантты).
Кез–келген қисыққа түсірілген нүктеде жүйе моновариантты с = 1. с =
1 – 2 + 2 = 1. Температураны немесе қысымды ғана өзгертуге болады.
Диаграммадағы О нүктесінде жүйе үш фазалы, (М, С, Б)
с= 1 – 3 + 2 = 0 (жүйе инвариантты)
О нүктесін судың үштік нүктесі дейді. Параметрлердің біреуінің өзгеруі
тепе – теңдікті бұзып, бір немесе екі фазаның жоғалуына әкеледі.
22.
23.
24.
25.
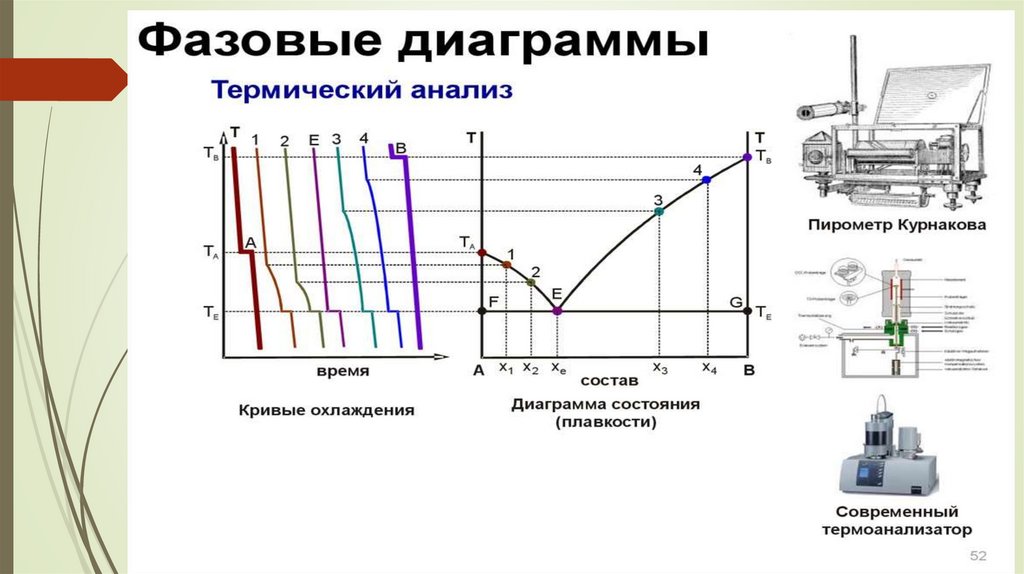
Термиялық талдаузерттелетін жүйенің кристалдану немесе
балқу температурасының оның құрамына
тәуелділігін зерттейтін физика-химиялық
талдау бөлімі.
Термиялық талдау деректері термиялық
диаграмма ретінде жасалады.
26.
Екі компоненті жүйенің күй диаграммасыЕкі компонентті жүйе үшін қысым тұрақты болғанда, Гиббстің фазалар ережесі келесі теңдеуме
анықталады:
с=2–ф+1=3–ф
(4.9)
Бұл кезде тепе – теңдіктегі фазалар саны үштен ф = 3 (с = 0), ал еркіндік дәрежесі екіден арты
болмайды с = 2 (ф = 1).
Қатты фазалы екікомпоненті жүйенің күй диаграммасын балқу диаграммасы (термиялық талдау
дейді.
Балқу диаграммасы жүйе күйінің қоспалардың балқу температурасы мен құрамынан тәуелділігі
көрсетеді.
Термиялық талдау температураның уақыт бойынша өзгеру сипаттамасы бойынша жүйені
салқындау кезіндегі өзгерісі туралы қортынды айтады. Салқындау қисықтары бойынша е
компоненті жүйенің күй диаграммасын тұрғызады.
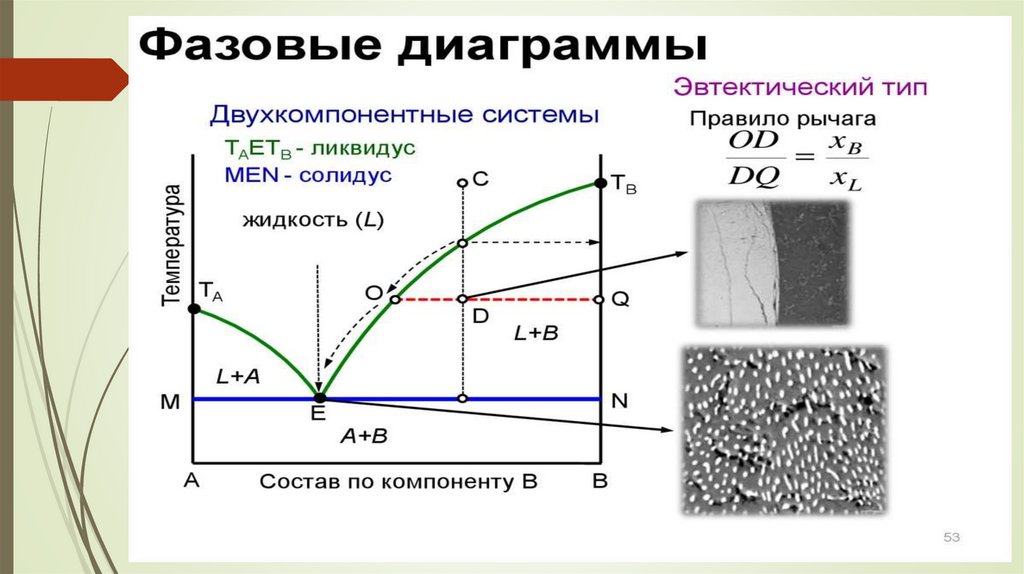
Негізгі күй диаграмма түрлеріне: эвтетикалық диаграмма,
конгруэнтті және инконгруэнт
балқитын химиялық қосылыстар, қатты және сұйық фазада ерігіштігі шектелген және шектелмеге
жатады.
27.
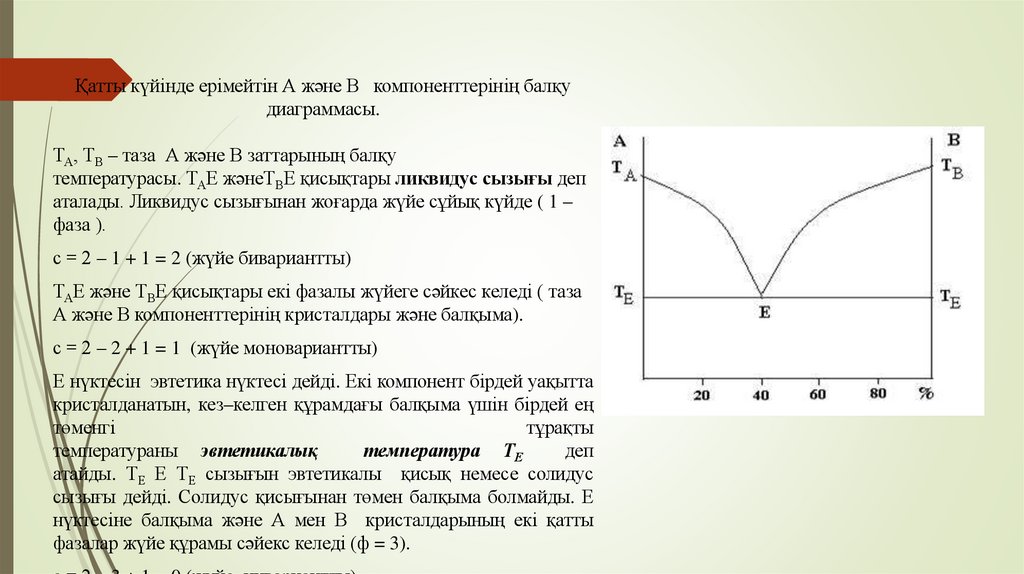
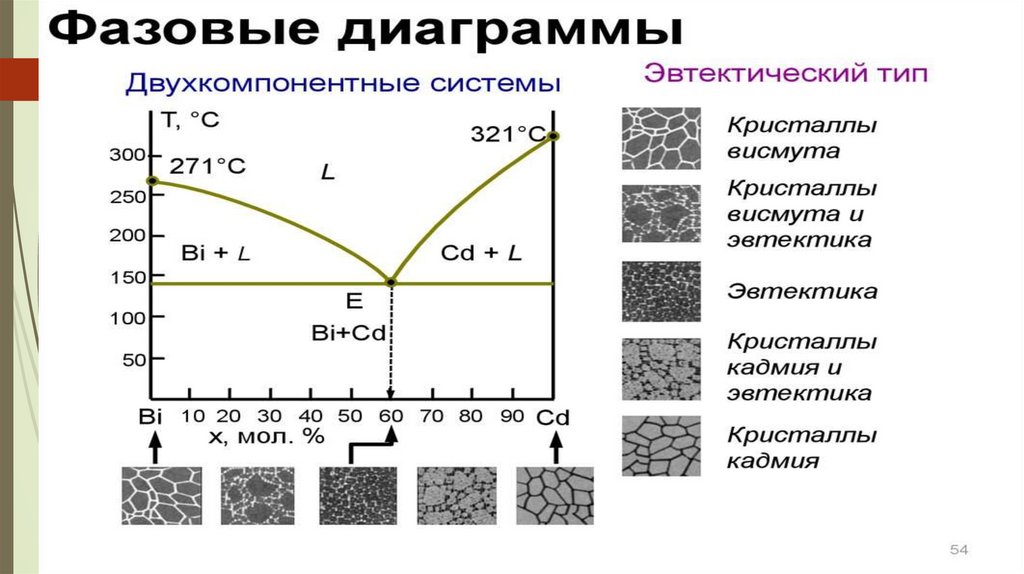
Қатты күйінде ерімейтін А және В компоненттерінің балқудиаграммасы.
ТА, ТВ – таза А және В заттарының балқу
температурасы. ТАЕ жәнеТВЕ қисықтары ликвидус сызығы деп
аталады. Ликвидус сызығынан жоғарда жүйе сұйық күйде ( 1 –
фаза ).
с = 2 – 1 + 1 = 2 (жүйе бивариантты)
ТАЕ және ТВЕ қисықтары екі фазалы жүйеге сәйкес келеді ( таза
А және В компоненттерінің кристалдары және балқыма).
с = 2 – 2 + 1 = 1 (жүйе моновариантты)
Е нүктесін эвтетика нүктесі дейді. Екі компонент бірдей уақытта
кристалданатын, кез–келген құрамдағы балқыма үшін бірдей ең
төменгі
тұрақты
температураны эвтетикалық
температура ТЕ
деп
атайды. ТЕ Е ТЕ сызығын эвтетикалы қисық немесе солидус
сызығы дейді. Солидус қисығынан төмен балқыма болмайды. Е
нүктесіне балқыма және А мен В кристалдарының екі қатты
фазалар жүйе құрамы сәйекс келеді (ф = 3).
28.
29.
30.
31.
32.
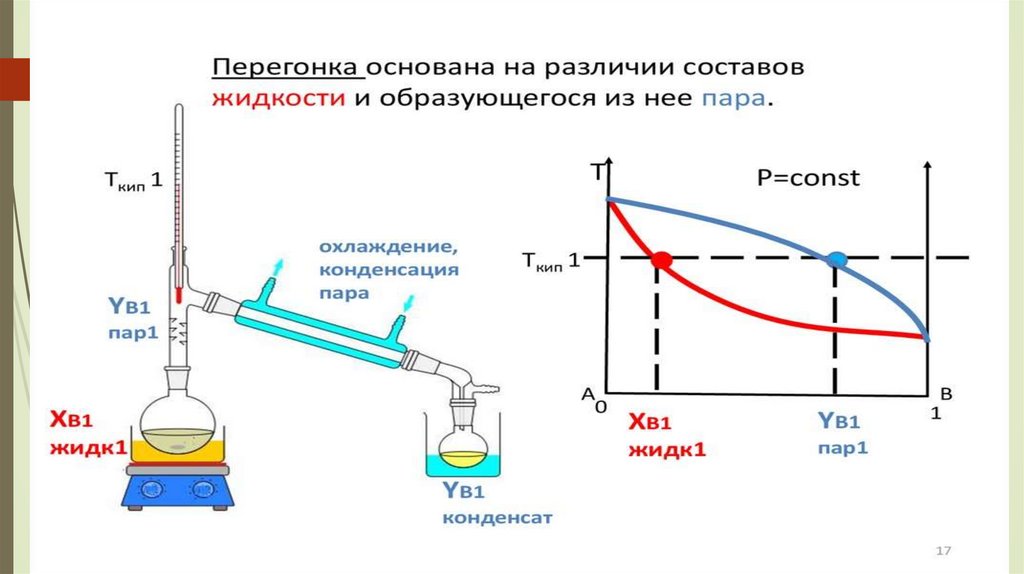
Дистилляция (айдау)• сұйықтықты буландыру арқылы сұйық ұшпа
қоспалардан бөлу процесі, кейін булар
салқындатылып және конденсацияланады.
• айдау кезінде қоспалардың бөлінуі қоспадағы
заттардың қайнау температураларының
айырмашылығына байланысты пайда болады.
• Бу - қайнау температурасы төмен ұшпа
компонентпен байытылған;
Кубтағы қалдық қайнау температурасы жоғары
ауыр қайнау компонентімен байытылған.
33.
Қарапайым дистилляция - сұйық қоспаның бірбөлігін буландыру арқылы, пайда болған буларды
шығарумен және тоңазытқышта конденсациялаумен шектеледі.
Алынған конденсат - дистиллят, буланбайтын
сұйықтық - төменгі (кубтық) қалдық.
Дистиллят әрқашанда ұшпа компонентпен
байытылған, қалдық аз ұшпалы (жоғары
қайнайтын) компоненттер.
Іс жүзінде, егер A және B Tқайнау
температурасы 80 °C-тан жоғары болса, бөлу
тиімді болып табылады.
34.
35.
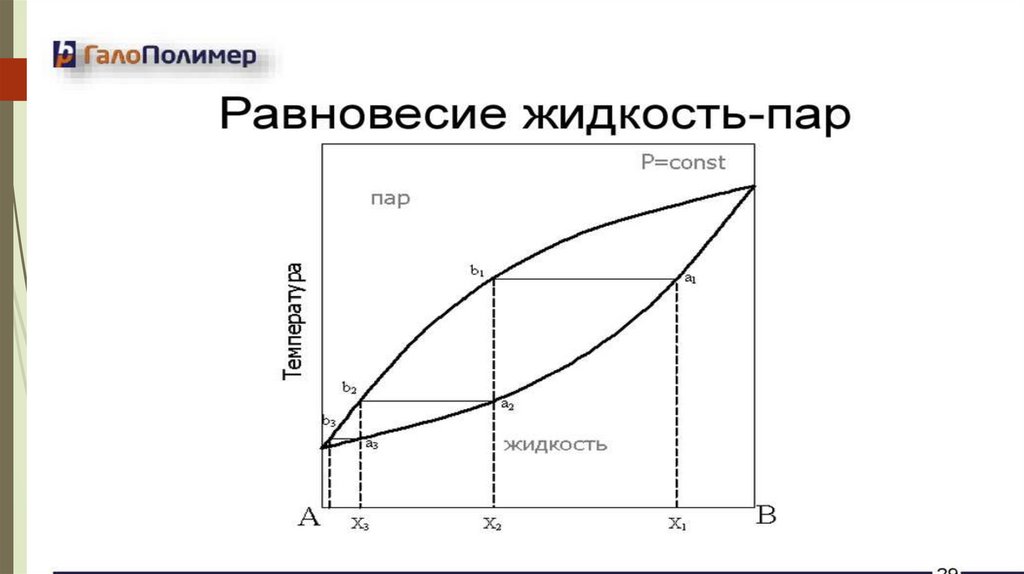
Коноваловтың бірінші заңыБетіндегі бу қысымы атмосфералық қысымға
тең болғанда сұйықтықтар қайнайды.
Таза сұйықтық тұрақты температурада
қайнайды.
Тепе-теңдік бинарлық жүйедегі бу сұйықтықпен
салыстырғанда аз қайнайтын компонентпен
байытылған.
36.
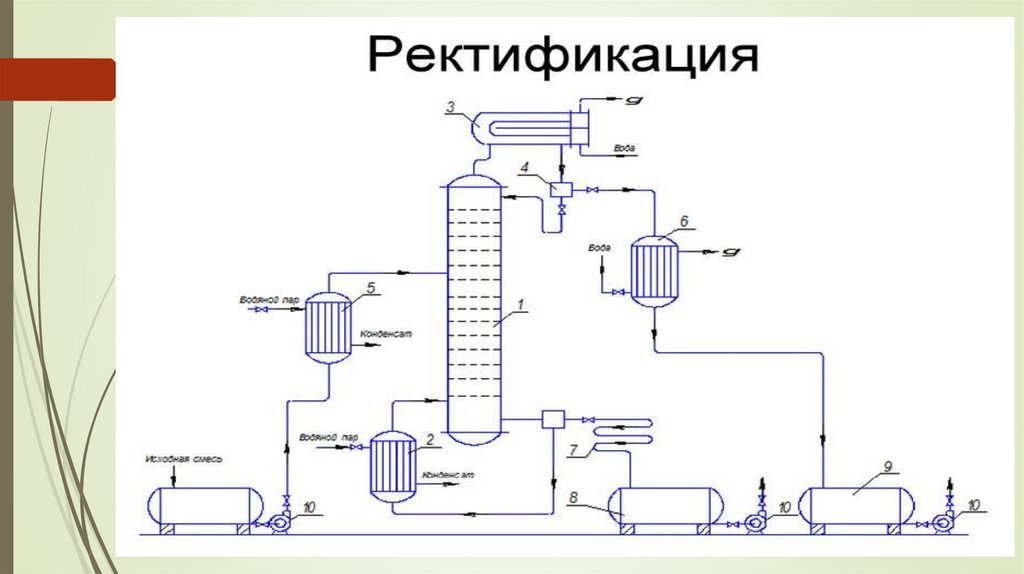
Фракциялық дистилляция - бірнешефракцияларға бөлінуі (ұшпа компоненттің
мазмұнына сәйкес).
Айырмашылық - қалыптасқан булардың ішінара
конденсациясы және оларды дистилляция
ыдысына қайтару болып табылады.
Аз ұшпа компоненттің булары конденсацияланып,
дистилляция колбасына оралады, ал одан да ұшпа
өнімнің тазартылған булары қабылдағышқа
жиналады.
37.
38.
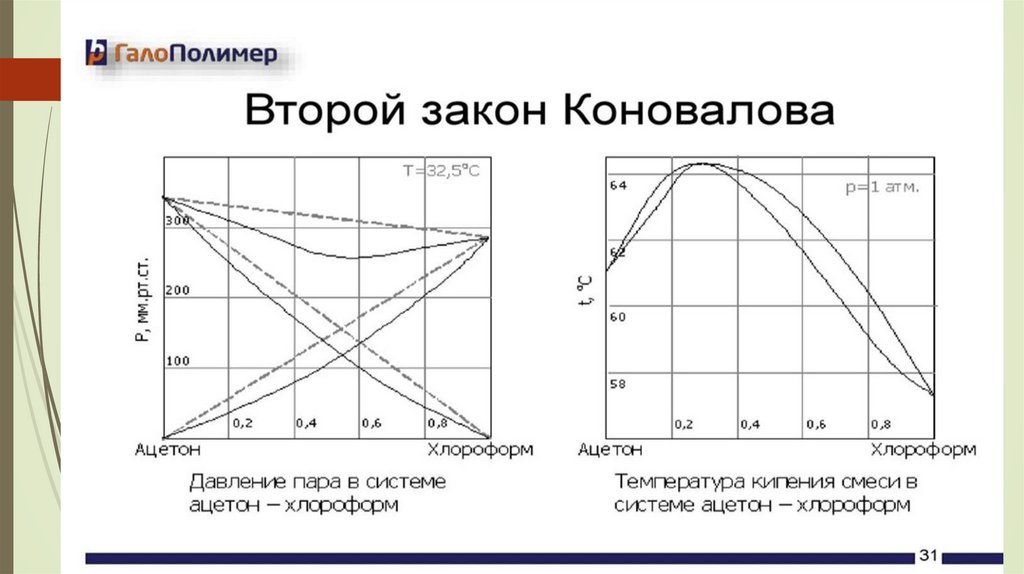
Коноваловтың екінші заңыҚайнау диаграммасындағы экстремум
ерітінді мен қаныққан будың тепе-теңдігіне
сәйкес келеді, онда екі фазаның да құрамы
бірдей.
Буы мен сұйық құрамы сәйкес келетін
ерітінділер азеотропты деп аталады.


























 medicine
medicine








