Similar presentations:
Лекція_7_Обмін_нуклеотидів_Молекулярна_біологія
1.
ЛНМУ імені Данила ГалицькогоКафедра біологічної хімії
Лекція для студентів 2-го курсу медичного факультету
Особливості метаболізму нуклеотидів в нормі
та при патології. Загальна характеристика
матричних синтезів та їх регуляція.
Молекулярні механізми мутацій
Лекторка: д.б.н., проф. Ірина Степанівна Фоменко
Контактна інформація:
Кафедра біологічної хімії: (032)2757602
лекторка: іryna.fomenko.lviv@gmail.com
2. Нуклеїнові кислоти
Нуклеїнові кислоти (НК) – складні високомолекулярні біополімери,мономерами яких є нуклеотиди. Функції НК – збереження та
генетичної інформації.
НК характеризуються унікальними структурними та
функціональними властивостями і являють собою складні
біополімери клітин, які містять велику кількість мономерних
одиниць – нуклеотидів, тому НК називають полінуклеотидами.
3.
НуклеотидиNucleotides
Нуклеотиди є мономерами ДНК та РНК.
Нуклеотиди беруть участь у майже всіх біохімічних процесах
безпосередньо чи опосередковано. Вони є структурними
компонентами нуклеїнових кислот (ДНК, РНК), коензимів та беруть
участь у регуляції метаболічних реакцій.
Нуклеотиди складаються з трьох
основних компонентів:
1. Азотиста основа (пуринового чи
піримідинового ряду)
2. Пентоза (рибоза або
дезоксирибоза).
3. Залишки фосфорної кислоти (13).
Дві основні пуринові основи, присутні в нуклеотидах, - аденін (A) та
гуанін (G), а також три основні піримідини - тимін (T), цитозин (C) і
урацил (U).
4.
Азотисті основиПуринові основи – це похідні пурину, який містить піримідидинове кільце,
з'єднане з імідазольним. Пурини, присутні в нуклеотидах - аденін та гуанін.
NH2
6
1
7
N
5
N
O
N
N
N
N
8
2
N
4
N9
H
3
N
N
H
N
H
N
NH2
Аденін (6-амінопурин) Гуанін (2-аміно 6-гідроксипупин)
Пурин
Піримідинові основи - це похідні піримідину: цитозин, урацил та тимін.
NH2
5
3N
N
6
2
N
1
Піримідин
O
O
CH3
N
N
N
O
O
4
N
O
N
Урацил (2, 4- Тимін (2, 4-дигідроксиЦитозин (2-Гідрокси4-амінопіримідин) дигідроксипіпимідин) 5-метилпіримідин)
У пуринових азотистих основах атоми вуглецю (C) та азоту (N) пуринового
кільця нумеруються в напрямку проти годинникової стрілки. У піримідинових
нуклеотидах атоми C та N нумеруються за годинниковою стрілкою.
5.
Мінорні азотисті основиКрім основних азотистих основ, у невеликій кількості зустрічаються рідкісні,
так звані, мінорні основи: 5-метил- і 5-гідроксиметилцитозин, 5карбоксиурацил, 4-тіоурацил, диметиламіноаденін, 1-метилгуанін
NH2
CH2ОН
N
O
H3C
NH2
N
N
Гідроксиметилцитозин
CH3
N
O
N
N
N
N
5'-метилцитозин
N
CH3
N
H C
3 N
N
H
H2N
Диметиладенін
Деякі фармакологічно активні пуринові основи
виявлені в рослинах. Наприклад, кофеїн в каві,
теофілін в чаї та теобромін в какао. Кофеїн і
теофілін виступають як збудники центральної
нервової системи, вони інгібують
фосфодіестеразу. Кофеїн має властивості
антиоксиданта. Деякі інгалятори містять теофілін,
який використовується при астмі.
O
N
N
N
H
1-метилгуанін
6.
ПентозиУ нуклеотидах зустрічаються два типи пентоз: рибоза і
дезоксирибоза. Якщо пентоза у нуклеотиді є дезоксирибозою, то
його назва - дезоксирибонуклеотид, якщо це рибоза, то нуклеотид є
рибонуклеотидом.
5'
OHCH2
4
5'
O
OH
'
1
3'
2'
OH OH
'
OHCH2
OH
O
4'
1'
3'
2'
OH H
Позначка «штрих» після цифри використовується для того, щоб
розрізняти атоми у пентоз від позиції азотистої основи.
7.
НуклеозидиНуклеозид складається з двох
компонентів: азотистої основи (пурину або
піримідину) та пентози У випадку пуринових
нуклеозидів, пентоза приєднується до N-9
положення пуринового кільця. У піримідинових
нуклеозидах пентоза приєднується до N-1
піримідинового кільця. Тип зв'язку між
азотистою основою та цукром називається Nглікозидним.
Нуклеозиди отримують назву від
назви відповідних основ.
Наприклад, аденін, з'єднаний з
рибозою, називається аденозином.
Велика літера A використовується
для позначення нуклеозиду, який
містить аденін. Якщо основа
з'єднана з дезоксирибозою, то
нуклеозид отримує назву
дезоксинуклеотид і позначається
літерою "d".
Азотиста основа
Аденін
Аденін
Гуанін
Гуанін
Гіпоксантин
Ксантин
Цитозин
Цитозин
Тимін
Тимін
Урацил
Оротова кислота
NH2
N
N
O
N
N
N
O
CH3
N
N-Глікозидний зв'язок
OHCH2 O
OH
OHCH2 O
OH
Аденозин
Нуклеозид
Аденозин
Дезоксиаденозин
Гуанозин
Дезоксигуанозин
Інозин
Ксантозин
Цитидин
Дезоксицитидин
Тимідин
Деоксидимідин
Уридин
Ородитидин
OH H
Дезокситимідин
Абревіатура
A
dA
G
dG
I
X
C
dC
T
dT
U
O
8.
НуклеотидиO
Нуклеотиди є
фосфорильованими
нуклеозидами, тому
вони складаються з трьох
компонентів: азотистої
основи, цукру та
фосфату. Зазвичай одна
або дві гідроксильні групи
пентози фосфорилуються
через ефірний зв'язок.
Name
Adenosine monophosphate
Deoxy adenosine monophosphate
Guanosine monophosphate
Deoxyguanosine monophosphate
Cytidine monophosphate
Deoxy cytidine monophosphate
Deoxy thymidine monophosphate
Uridine monophosphate
Inosine monophosphate
Orotidine monophospahate
N
N
O
O
O
NH2
NH2
N
OH
O
N
O
OH–P–O–P–O–P–O–CH2 O
OH
N
OH
O
OH
OH
OH
OH
ГМФ
dЦМФ
ГДФ
dЦДФ
ГТФ
dЦТФ
Alternate name
Adenylic acid
Deoxyadenylic acid
Guanylic acid
Deoxy guanylic acid
Cytidylic acid
Deoxy cytidylic acid
Deoxy thymidylic acid
Uridylic acid
Inosinic acid
Orotidylic acid
N
OH–P–O–P–O–P–O–CH2 O
OH
OH
O
Abbreviation
AMP
dAMP
GMP
dGMP
CMP
dCMP
dTMP
UMP
IMP
OMP
H
9.
Ди-, олігонуклеотиди, вільні нуклеотидиДинуклеотиди складаються з двох нуклеотидів, з'єднаних за допомогою
фосфодіефірного зв'язку між 3'-ОН першого нуклеотиду та 5'-ОН другого. Два
коферменти, які є динуклеотидами НAД+ та ФAД, є найбільш поширеними.
Олігонуклеотиди складаються з менше ніж десяти нуклеотидів, але більше ніж
двох. Нуклеотиди з'єднані фосфодіестерним зв'язком.
NH2
Вільні нуклеотиди. В клітинах міститься
безліч вільних нуклеотидів, які беруть
участь у біологічних процесах. Найбільш
поширеним серед них є АТФ, що слугує
енергетичною валютою клітин. У ссавців
його концентрація становить приблизно 1
мМ/л.
- 50 кДж/моль
N
N
- 12 кДж/моль
N
N
О
О
СН2 О Р О Р О Р ОН
ОН
НО
О
ОН
ОН
ОН
Аденозитрифосфат (АТФ)
Інші макроергічні сполуки - ГТФ та ГДФ беруть участь у енергозалежних реакціях.
ГТФ також потрібен для біосинтезу білків. УДФ є носієм активованих цукрів та
аміноглюкоз, необхідних для синтезу глікогену, глікопротеїнів, гангліозидів тощо.
УДФ-глюкуронат служить донором глюкуроніду в реакціях кон'югації. СДФ-холін
виконує роль донора холіну в біосинтезі фосфоліпідів.
Регуляторну функцію виконують циклічні нуклеотиди – цАМФ і цГМФ. Вони є
вторинними посередниками дії гормонів.
10.
Травлення нуклеїнових к-тНі самі нуклеотиди, ні вихідні пуринові та піримідинові основи, що надходять в
організм людини з їжею, не включаються ні в нуклеїнові кислоти тканин людини,
ні в пуринові або піримідинові коферменти.
Нуклеїнові к-ти мають харчову цінність
головним чином через пентози, які вони
Нуклеїнові кислоти ДНК та РНК
містять. У тонкій кишці панкреатичні
ДНКаза, РНКаза
H2O
нуклеази (ДНКаза та РНКаза) розщеплюють
Нуклеотиди
нуклеїнові к-ти на нуклеотиди, які
H2O
дефосфорилюються лужною фосфатазою
Фосфатаза
до нуклеозидів; що всмоктуються за
Фн
допомогою натрій-залежного активного
Нуклеозиди
транспорту
Нуклеозиди
Фосфорилаза
Пентозофосфати
Азотисті
основи
Сечова кислота
CO2+H2O
Екскреція Реутилізація
Після всмоктування нуклеозиди
транспортуються до печінки, де
розщеплюються до вільних основ і
рибози або дезоксирибози-1-фосфату.
Рибоза-1-фосфат та дезоксирибоза-1фосфат, які вивільнюються з нуклеозидів,
спочатку перетворюються в відповідні 5фосфати за допомогою
фосфопентомутази.
11.
Біосинтез нуклеотидівІснують два шляхи біосинтезу нуклеотидів: синтез de novo та
реутилізація (додатковий шлях). Синтез de novo забезпечує утворення
80 – 90 % пулу нуклеотидів. Найбільш інтенсивно синтез нуклеотидів
відбувається у печінці
12.
Біосинтез пуринових нуклеотидів de novoОсновне місце синтезу пуринових нуклеотидів в організмі ссавців - печінка. З
неї вільні основи або нуклеозиди попадають у інші тканини:
• Еритроцити і поліморфноядерні лейкоцити не здатні синтезувати 5фосфорибозиламін
• Лімфоцити здатні синтезувати невеликі кількості пуринів de novo
• В клітинах мозку ссавців містяться надзвичайно малі кількості ФРПФамідотрансферази
СO2 Гліцин
Аспартат
N1
N10-Форміл
ТГФК
С
2
Субстратами біосинтезу пуринів є:
• рибозо-5-фосфат – продукт
пентозо-фосфатного шляху;
5
С
6
• амінокислоти (гліцин, аспартат,
С 7N
5
10
глутамін);
N ,N 8 С
метеніл-ТГФК • СО2;
3
С 9
N 4 N
• похідні тетрагідрофолієвої
кислоти (ТГФК): форміл-ТГФК
та метеніл-ТГФК.
Глутамін
Першим етапом синтезу пуринових нуклеотидів de novo є синтез ІМФ
13. Purine Synthesis
Реакціїсинтезу ІМФ (1)
Purine
Synthesis
1. Синтез ІМФ розпочинається з
рибозо-5-фосфату, який є продуктом
ПФШ і на який переноситься
пірофосфатна група АТФ за участі
ФРПФ-синтетази
2. Утворений 5-фосфорибозил-1-пірофосфат (ФРПФ)
взаємодіє з глутаміном, донором NН2-групи, внаслідок
чого
під
впливом
ФРПФ-амідотрансферази
утворюється β-5-фосфорибозиламін, причому в
процесі реакції відбувається зміна його конфігурації (з αна β-). Ця реакція стає ключовою в синтезі пуринів і
інгібується за принципом зворотного зв’язку пуриновими
нуклеотидами, які утворюються з фосфорибозиламіну
3. На наступній стадії до вільної NН2-групи β-5фосфорибозиламіну приєднується молекула гліцину з
утворенням гліцинамідрибонуклеотиду, фермент
фосфорибозилгліцинамідсинтетаза.
14.
Реакції синтезу ІМФ (2)4. Далі ланцюг подовжується за рахунок приєднання
формільної групи з N5, N10-метеніл-ТГФК з утворенням Nформілгліцинамідрибонуклеотиду, фермент
гліцинамідрибонуклеотидтрансформілаза.
5. На формільну групу останнього
переноситься амідна група глутаміну і
синтезується Nформілгліцинамідинрибонуклеотид,
фермент N-формілгліцинамідрибонуклеотидамідолігаза.
6. Відбувається замикання п’ятичленного
імідазольного кільце з утворенням 5аміноімідазолрибонуклеотид, фермент
амідоімідазолрибонуклеотидсинтетаза
.
15.
Реакції синтезу ІМФ (3)7. 5-аміноімідазолрибонуклеотид здатний
акцептувати СО2 з утворенням
рибонуклеотиду 5-аміноімідазол-4карбоксинуклеотиду, фермент
аміноімідазолрибонуклеотидкарбоксилаза.
8. Карбоксильна група цього продукту
взаємодіє з NН2 - групою аспарагінової
кислоти з утворенням 5-аміноімідазол-4-Nсукцинілкарбоксіамідрибонуклеотиду. Ця
реакція
здійснюється
під
впливом
специфічної
аміноімідазолсукцинокарбоксамідрибонуклеотидсинтетази.
9. Вуглецевий скелет аспарагінової кислоти
відокремлюється у вигляді фумарової кислоти
й
утворюється
5-аміноімідазол-4карбоксамідрибонуклеотид,
тобто
із
аспарагінової кислоти в 1-е положення
пуринового
ядра
за
участі
фермента
аденілсукцинази входить атом азоту.
16.
Реакції синтезу ІМФ (4)10. Останній вуглецевий атом пуринового кільця
вмонтовується у вигляді формільного залишка,
який приєднується до 5 - NН2-групи з утворенням
5-формілімідоімідазол-4-карбоксіамідрибонуклеотиду,
фермент
аміноімідазолкарбоксамідрибонуклеотидтрансформілаза.
11. Відбувається замикання другого
кільця, яке супроводжується
відщепленням води У результаті за участі
фермента інозинікази утворюється
перший пуриновий нуклеотид –
інозинова кислота (ІМФ), яка є
попередником пуринових нуклеотидів, в
основному, АМФ чи ГМФ у складі
нуклеїнових кислот.
17.
ON
HN
Aspartate
GTP
N
Mg2+ Adenylosuccinate
synthetase
GDP + Pi
NAD+
Н2О
N
Inosine Ribose-5-phosphate
monophospate
IMP(ІМP)
dehydrogenase
O
H OOC-CH-CH2-COOH
NH
N
N
N
O
N
Ribose-5-phosphate
Adenylosuccinate
Adenylosuccinate
lyase
Fumarate
N
HN
N
N
NADН + Н+
Ribose-5-phosphate
XMP
АТP
Glutamine
GMP-synthetase
Mg2+
Glutamate
АМP + PPi
О
NH2
N
N
N
N
Ribose-5-phosphate
Adenosine monophosphate (AMP)
N
N
Н2N
N
N
Ribose-5-phosphate
Guanosine monophosphate (GMP)
18.
Реакції синтезу ІМФ overviewO
P
H2C
P
O
O H2C
O
АМP
АТP
OH
PRPPsynthase
HO OH
Ribose-5-phosphate
Glutamine+H2O
O P O
HO OH
Phosphorybosyl
pyrophosphate
P
Glutamate
PPi
P
H2C O NH2
O
PRPP-glutamyl
amidotranspherase
HO OH
5-Phosphorybosilamine
Glycine
+АTP
Glycinamide ribosyl
phosphate synthase
АDP + Pi
АDP + Pi
O Glutamate
NH
C
CH2
HN
АТP + Н2О
Glutamine
Rib
NH
C
C H2
H
C
NH
THF
O
NH2
CH2
H
C
NH Rib P
Formyltransferase
O
NH Rib P
O
Glycinamide ribosyl 5-phosphate
Formylglycinamide ribosyl 5(GAR)
phosphate
C
Synthase
P
Н2О +
N10-Formyl THF
Formylglycinamidine ribosyl5-phosphate
АTP+ Н2О
Synthase
СО2
N
HC
Н+
HOOC
C
CH
H2N
C
CH2-COOH
Aspartate
АТP
АDP + Pi
Rib
N
АDP
Mg
N
CH
P
Carboxylase
H2N
5-Aminoimidazole ribosyl-5phosphate
C
N
Rib
CH-NH
COOH
2+
Synthase
O
C
C
H2N
N
CH
C
N Rib
5-Aminoimidazole
4-succinyl carboxamide
ribosyl 5-phosphate
P
5-Aminoimidazole carboxylate
ribosyl 5-phosphate
P
Adenosuccinate lyase
O
O
HN
C
Н 2О
C
N
H2N
CH
HC
C
N
Cyclohydrolase
N
Ryb
Inosine monophosphate
(ІМP)
P
O
C
C
C
H C
HN
N
CH
N
Rib P
5-Formaminoimidazole 4-carboxamide
ribosyl 5-phosphate
К+
Fumarate
O
N10-formyl-THF
THF
H2N
C
Fromyltransferase
C
CH
C
H2N
N
N
Rib
P
5-Aminoimidazole 4-carboxamide
ribosyl 5-phosphate
19.
Шлях реутилізаціїВільні пуринові нуклеотиди
утворюються з нуклеїнових кислот
(особливо РНК) за умов норми.
Енергетично вигідно
використовувати їх у процесі,
відомому як "шлях реутилізації".
Аденінфосфорибозилтрансфераза каталізує
утворення АМФ з аденіну,
використовуючи ФРПП.
Концентрації гуаніну та
гіпоксантину в крові вищі
порівняно з аденіном. Вільний
гуанін і гіпоксантин відновлюються
за допомогою ферменту
гіпоксантингуанінфосфорибозилтрансферази. Цей
фермент перетворює гіпоксантин і
гуанін в ІМФ і ГМФ відповідно,
використовуючи ФРПП як донор
рибози-5-фосфату.
NH2
NH2
N
N
N
H
Аденін
N
Аденінфосфорибозил
трансфераза
ФРПП
N
N
N
H
Гуанін
Гіпоксантин гуанін
фосфорибозил трансфераза
ФРПП
ФФн
N
NH2 N
ГМФ
N
Рибозо 5-Ф
O
N
N
Рибозо 5-Ф
N
O
N
AMФ
O
N
NH2 N
N
ФФн
O
N
N
N
H
Гіпоксантин
Гіпоксантин гуанін
фосфорибозил трансфераза
ФРПП
ФФн
N
N
NH2 N
ІМФ
N
Рибозо 5-Ф
6-Меркаптопурин, що є антагоністом гіпоксантину
використовується як протипухлинний препарат
20.
Синтез АТФ та ГТФ з АМФ та ГМФНуклеозидкінази – ферменти необхідні для утворення нуклеозидтрифосфатів –
ATФ та ГТФ
Нуклеотидмонофосфат
(AMФ, ГМФ)
ATФ
НМФ кіназа
AДФ
Нуклеотиддифосфат
(AДФ, ГДФ)
ATФ
• ГМФ спочатку перетворюється на ГДФ за
участю АТФ-залежної
нуклеозидмонофосфаткінази, що також
може діяти на дГМФ. Далі фосфорилювання
ГДФ іншою нуклеозиддифосфаткіназою
формує ГТФ.
• Для утворення АТФ також може
використовуватись аденілаткіназа:
АМФ + АТФ
Аденілаткіназа
2 АДФ
НДФ кіназа
AДФ
Нуклеотидтрифосфат
(ATФ, ГТФ)
Перетворення AДФ на ATФ також відбувається у
дихальному ланцюгу мітохондрій шляхом
окисного фосфорилування.
Нуклеозиддифосфаткінази важливі та широко поширені ферменти. Вони
можуть діяти як на пуринові, так і на піримідинові нуклеозиддифосфати, а також
на деоксинуклеозиддифосфати.
21.
Регуляція синтезу пуринових нуклеотидівРибозо 5-фосфат + АТФ
ФРППсинтетаза
Регуляція біосинтезу пуринових нуклеотидів
відбувається на різних рівнях:
IMФ
ФРПП
Фосфорибозил
амідотрансфераза
-
-
-
5-Фосфорибозиламін
+
-
Аденілосукцинат
AMФ
XMФ
+
ГМФ
IMФ
a)
AMФ
ГМФ
AДФ
ГДФ
ATФ
AДФ
ГДФ
ATФ
ГТФ
b)
ГТФ
1. ФРПП-синтетаза та фосфорибозиламідотрансфераза є алостеричними
ферментами. AMФ та ГМФ (а також AДФ та ГДФ) виконують роль інгібіторів для
ФРПП-синтетази. IMФ, ГМФ та AMФ виступають як алостеричні інгібітори, а
ФРПП як активатор фосфорибозиламідотрансферази (а).
2. AMФ інгібує аденілосукцинатсинтазу, а ГМФ - дегідрогеназу IMФ (b). Крім
того, для перетворення аденілосукцинату в AMФ потрібен ГТФ, а для утворення
ГМФ – ATФ, що зменшує синтез одного пуринового нуклеотиду при дефіциті
іншого нуклеотиду.
22.
Біосинтез піримідинових нуклеотидів de novoУ відмінність від синтезу пуринових нуклеотидів, де гетероциклічне кільце
будується на рибозо-5-фосфаті, у біосинтезі піримідинових нуклеотидів спершу
формується гетероциклічне кільце з аспартату та карбамоїлфосфату, а рибозо5-фосфат приєднується пізніше.
Ферменти синтезу піримідинових нуклеотидів de novo розташовані в цитозолі
більшості клітин, але найбільш активні з них є в печінці. Лише 10 – 20 % від
загальної їх кількості піримідинових нуклеотидів утворюється завдяки шляхам
реутилізації із азотистих основ чи нуклеозидів.
С
Глутамін
N3
СO2
2
С
4
1
N
С
5
6
С
Аспартат
Синтез піримідинових
нуклеотидів відбувається із
взаємодії СО2, NН3 і
аспартату
В шляху синтезу піримідинових нуклеотидів de novo у прокаріотів кожну реакцію
каталізує окремий фермент, тоді як у еукаріотів цей процес характеризується
більш складною організацією: Перші три реакції каталізує один
багатофункціональний фермент, четверту реакцію - унікальний фермент, а реакції
5 та 6 виконує інший багатофункціональний фермент.
23.
Біосинтез піримідинових нуклеотидів de novoCarbamoyl Phosphate Synthetase II
1. Біосинтез піримідинових нуклеотидів розпочинається з синтезу
карбамоїлфосфату. Для цього глутамін передає свою амідну групу на
CO2 за участю ATФ, у реакції, що каталізує цитозольний фермент карбамоїлфосфатсинтетаза II (CPS II).
CPS II є регуляторним ферментом, що активується ATФ та ФРПП і
інгібується УТФ.
Карбамоїлфосфатсинтетаза I (CPS I) – мітохондріальним ферментом, який
синтезує карбамоїлфосфат з аміаку та CO2 для циклу сечовини.
24.
Біосинтез піримідинових нуклеотидів de novoCarbamoyl Phosphate Synthetase II
СО2
2 АДФ + Фн
2 АTP
C O
Mg2+
Карбамоїлфосфат
синтетаза II
Глутамін
COOH
CH2
NH2
Глутамат
O
+
CH-COOH
P
H2N
Карбамоїлфосфат
O
Н2О
NН2
CH2
C
CH-COOH
N
H
Дигідрооротаза
HN
O
N
H
CH-COOH
НАДН + Н+
Дигідрооротат дегідрогеназа
O
O
ФРПП
CH
CH-COOH
N
H
Оротова к-та
O
НAД+
CH2
Дигідрооротат
N-Карбамоїласпартат
HN
Аспартаттранскарамоїлаза
Аспартат
COOH
O
Фн
ФФн
Оротат
фосфорибозил
трансфераза
CH
HN
O
O
N
CH-COOH
Риб- P
Оротидин монофосфат
(ОМФ)
СО2
ОМФдекарбоксилаза
CH
HN
O
N
CH
Риб- P
Уридин монофосфат
(УМФ)
2. Карбамоїлфосфат реагує з аспартатом, з утворенням N-карбамоїласпарагінової
кислоти. Реакцію каталізує аспартаттранскарбамоїлаза.
3. Утворення дигідрооротової кислоти під дією дигідрооротази.
4. Дегідрування дигідрооротової к-ти з утворенням оротової кислоти. У цій реакції бере
участь специфічний НАД-вмісний фермент дигідрооротатдегідрогеназа.
5. Оротова кислота під впливом УМФ-синтази реагує з ФРПФ, що виступає донором
рибозо-фосфату, з утворенням оротидин-5’-фосфату (ОМФ).
6. Декарбоксилювання ОМФ з утворенням піримідинового нуклеотиду - УМФ.
25.
Синтез ЦТФ з УМФПеретворення УМФ на УДФ і УТФ здійснюється, як і в пуринових нуклеотидів,
шляхом фосфотрансферазних реакцій:
1. Нуклеозидмонофосфаткіназа (НМФ-кіназа) каталізує реакцію утворення УДФ:
УМФ + АТФ → УДФ + АДФ,
2. Нуклеозиддифосфаткіназа (НДФ-кіназа) – утворення УТФ:
УДФ + АТФ → УТФ + АДФ.
Уридинмонофосфат (УМФ)
ATФ
Кіназа
Фермент ЦТФ-синтетаза
каталізує АТФ-залежне
заміщення кетогрупи
урацилу на амідну групу
глутаміну з утворенням
цитидин-5’-трифосфату
(ЦТФ)
AДФ
Тіоредоксин
Тіоредоксин (2SH)
УДФ
ATФ
AДФ
(-S-S-)
Рибонуклеотид
редуктаза
N5, N10
Метилен
ТГФК
ДГФК
dУМФ
Тимідилат
синтаза
dTMФ
Кіназа
УТФ
Глутамін +
ATФ + H2O
ЦТФ
синтетаза
Глутамат +
AДФ + Фн
ЦТФ
26.
Регуляція синтезу піримідинівКарбамоїлфосфатсинтетаза-II, аспартат
транскарамоїлаза та
ЦТФ-синтетаза є
регуляторними ферментами
біосинтезу піримідинових
нуклеотидів. ЦТФ є
алостеричним інгібітором
всіх трьох ферментів.
Пуринові нуклеотиди ATФ та
ГТФ сприяють біосинтезу
піримідинових нуклеотидів,
активуючи відповідно
аспартаттранскарбамоїлазу та ЦТФсинтетазу.
Глутамін (-NH2) + CO2
АТФ
ФРПП
+
-
Аспартат
Карбамоїлфосфат
Карбамоїласпартат
-
Оротова кислота
ФРПП
ОМФ
УMФ
УTФ
ЦTФ
dТТФ
27.
Порушення синтезу піримідинівОротатацидурія – спадкове порушення біосинтезу піримідинових азотистих
основ. Молекулярною причиною захворювання є спадковий дефіцит ферментів
оротатфосфорибозилтрансферази
(І
тип)
та/або
оротидин-5фосфатдекарбокислази (ІІ тип), необхідних для утворення УМФ:
Захворювання
характеризується
накопиченням та
виділенням із сечею
оротової кислоти. У сечі
виявляють оранжеву
кристалурію.
У дітей хворих на оротатацидурію спостерігається затримка росту, фізичного та
психічного розвитку, мегалобластична анемія.
Для лікування оротатацидурії використовують уридин або цитидин в дозах 0,5 - 1
г за добу. За допомогою нуклеотидкінази уридин і цитидин перетворюються на
УТФ і ЦТФ в обхід порушеної реакції. УТФ і ЦТФ інгібують регуляторні ферменти і
знижують виведення оротату у складі сечі.
Вторинна оротова ацидурія (синдром Рейє) виникає при пошкодженні
мітохондрій печінки. У результаті порушується утилізація карбамоїлфосфату, він
включається в цикл синтезу оротової кислоти.
28.
Біосинтез дезоксирибонуклеотидівУтворення дезоксирибонуклеотидів відбувається шляхом відновлення
рибонуклеотидів за участю рибонуклеотидредуктазного комплексу
Компонентами рибонуклеотидредуктазного комплексу є:
рибонуклеотидредуктаза, білковий кофактор тіоредоксин,
тіоредоксинрндуктаза і НАДФН+Н+. Безпосереднім відновником
рибонуклеотидів є тиоредоксин, сульфгідрильні групи якого окиснюються в ході
реакції
Активність
рибонуклеотидредуктази
регулюється
алостерично. dАТФ
інгібує відновлення всіх
рибонуклеотидів
Інгібітором рибонуклеотидредуктази, що каталізує утворення
дезоксирибонуклеотидів, є гідроксисечовина. Зниження синтезу
дезоксирибонуклеотидів уповільнює реплікацію і поділ клітин пухлини
29.
Синтез тимідилових нуклеотидівСинтез dТМФ з dУМФ каталізує тимідилатсинтаза, коферментом якої є
метилен-ТГФК
Метилен-ТГФК є донором
метильної групи при біосинтезі
dТМФ. Таким чином, метилен-ТГФК
виконує роль не лише кофермента
трансферазної реакції, а також і
відновлюючого агента. У процесі
перенесення метильної групи на
dУМФ метилен-ТГФК окиснюється
до ДГФК. Швидкість синтезу dТМФ
залежить від швидкості відновлення
ДГФК до ТГФК під дією
дигідрофолатредуктази
Кількість ферментів рибонуклеотидредуктази і тимідилатсинтази регулюється
на генетичному рівні за механізмом індукції і залежить від швидкості синтезу
ДНК. Максимальна активність рибонуклеотидредуктази і тимідилатсинтази
спостерігається під час реплікації ДНК
30.
Ферменти біосинтезу нуклеотидів як мішені діїпротипухлинних препаратів
Ферменти біосинтезу нуклеотидів є
мішенями дії протипухлинних
препаратів. Для біосинтезу ДНК
необхідні дезоксирибонуклеозидтрифосфати. За рахунок інгібування
ферментів біосинтезу нуклеотидів
можна уповільнити процеси поділу
клітин і росту пухлини
Гідроксисечовина - інгібітор
рибонуклеотидредуктази, що
каталізує утворення
дезоксирибонуклеотидів.
В медицині і наукових дослідженнях використовують структурні аналоги
пуринів і піримідинів, що мають два механізми дії:
• Інгібують ферменти синтезу нуклеотидів;
• Вбудовуються в РНК або ДНК і порушують комплементарну
взаємодію азотистих основ і синтез полінуклеотидних ланцюгів
31.
Аналоги пуринів як протипухлинніпрепарати
Аналоги пуринів – 6-меркаптоптурин і тіогуанін - застосовують при
лікуванні різних видів лейкозів
В організмі людини вони перетворюються на рибонуклеотиди та
інгібують синтез пуринів двома шляхами:
• за рахунок інгібування ФРПФ-амідотрансферази за принципом
зворотного негативного зв’язку;
• за рахунок інгібування перетворення ІМФ на ГМФ та АМФ.
32.
Аналоги піримідинів як протипухлинніпрепарати
До аналогів піримідинів належать 5-фторурацил, метотрексат і аміноптерин
5-Фторурацил перетворюється на рибо- і дезоксирибонуклеотиди. 33 В якості
аналога
2’-dУМФ
5-фторурацил
інгібує
тимідилатсинтазу
та
піримідинмонофосфаткіназу, що каталізує перетворення УМФ на УДФ. Крім того,
відомо, що 5-фторурацил порушує процесинг мРНК
5-Фторурацил
застосовують при лікуванні
пухлин шлунку, прямої
кишки, молочної залози
Метотрексат і аміноптерин
застосовують для
лікування різних форм
раку
Метотрексат і аміноптерин є аналогами фолату, вони інгібують
дигідрофолатредуктазу і знижують синтез пуринових нуклеотидів та dТМФ
Метотрексат і аміноптерин називають антифолатами
33.
Катаболізм пуринів (схема)В організмі людини кінцевим продуктом катаболізму пуринів є сечова
кислота. Метаболічний шлях утворення сечової кислоти дослідив
український вчений І. Я. Горбачевський. Він вперше здійснив хімічний
синтез сечової кислоти та відкрив ксантиноксидазу – фермент
катаболізму пуринів
34.
Катаболізм пуринів (реакції)- відщеплення фосфатної групи з
утворенням нуклеозидів аденозину та
гуанозину за участі фермента –
5’нуклеозидази;
- дезамінування нуклеозидів за участі
ферментів
аденозиндезамінази
та
гуаніндезамінази відповідно;
- відщеплення від нуклеозидів залишка
D-рибози (фермент нуклеозидаза) або
пентозофосфату
(фермент
фосфорилаза);
- катаболізм гіпоксантину (з АМФ) або
ксантину (з ГМФ) з утворенням сечової
кислоти. Окиснення гіпоксантину до
ксантину
з
подальшим
його
перетворенням на сечову кислоту
каталізується
ферментом
ксантиноксидазою.
У деяких живих організмів присутні ферменти, що
каталізують окиснення сечової кислоти до сечовини
та гліоксилевої кислоти, яка в подальшому
розщеплюється до СО2 і Н2О
35.
Сечова кислота та гіперурикеміяГоловним ферментом катаболізму пуринів є ксантиноксидаза, що каталізує
окиснення гіпоксантину до ксантину з подальшим утворенням сечової
кислоти. В реакціях, каталізованих ксантиноксидазою, електрони переносяться
від субстрату безпосередньо на О2 з утворенням Н2О2.
Ксантиооксидаза – аеробна оксидоредуктаза, простетична група якої містить
ФАД, іони заліза (Fe3+) та молібдену. Подібно до інших оксидоредуктаз, вона
окислює пурини молекулярним киснем з утворенням пероксиду водню. У
значній кількості цей фермент міститься лише в печінці та кишці.
За добу в організмі людини утворюється 0,5 - 1 г сечової кислоти. Щоденно у
складі сечі виводиться 0,4 – 0,6 г сечової кислоти. В нормі концентрація сечової
кислоти в плазмі крові становить становить 0,15 – 0,42 ммоль/л. Підвищений
вміст сечової кислоти у крові – гіперурикемія.
Сечова кислота має низьку розчинність у воді. При гіперурикемії вміст сечової
кислоти в крові перевищує рівень її розчинності, внаслідок чого відбувається
кристалізація натрієвих солей сечової кислоти (уратів) в тканинах
організму. Урати накопичуються переважно у дрібних суглобах кистей і стоп, а
також у нирках. Це призводить до розвитку запального процесу – подагри
36.
Подагра (загальна х-ка)Подагра є найхарактернішим порушенням
пуринового обміну. При подагрі в суглобах,
хрящах іноді в шкірі, м’язах та нирках
відкладаються кристали уратів (солей сечової
к-ти), що спричиняють запалення. Підвищення
вмісту сечової кислоти в крові при подагрі є
наслідком її посиленого утворення або
порушення виведення з організму
Подагра уражає чоловіків у 20 разів частіше,
ніж жінок. Подагра часто супроводжує
гіпертонічну хворобу та атеросклероз
Інша назва подагри - «хвороба геніїв». Хворими на подагру були: Ахілл,
Олександр Македонський, Колумб, Стендаль, Ньютон, Дарвін, Мікеланджело,
Рубенс, та ін. Взаємозв’язок між подагрою і досягненнями геніїв пояснюється
тим, що за хімічною будовою сечова кислота подібна до кофеїну і теоброміну –
стимуляторів діяльності мозку людини. Таким чином, гіперурикемія активізує
роботу мозку
37.
Подагра (первинна та вторинна)Причини первинної подагри пов'язані з порушеннями наступних ферментів:
• ФРПП-синтетаза не підлягає звичайним алостеричним механізмам контролю, і це
може призвести до збільшення утворення ФРПП та збільшеного синтезу пуринів. Цей
стан є зв'язаним з Х-хромосомою та рецесивним.
• ФРПП-глутаміламідотрансфераза втрачає чутливість до регулювання
нуклеотидами. Це призводить до підвищеного синтезу пуринів.
• Дефіцит гіпоксантингуанінфосфорибозилтрансферази (фермент реутилізації)
призводить до зменшення використання пуринів (гіпоксантину та гуаніну), що
призводить до накопичення та ФРПП.
• Дефіцит глюкозо-6-фосфатази - це глікогеноз, відомий як хвороба Гірке. Глюкозо6-фосфат не може бути перетворений на глюкозу через відсутність глюкозо-6фосфатази. Це призводить до збільшеного використання глюкозо-6-фосфату шляхом
пентозофосфатного шляху, що призводить до збільшення рівня ФРПП.
• Глутатіон-редуктаза - це фермент, що залежить від НАДФН, що генерується
пентозофосфатним шляхом. Порушення у роботі цього ферменту призводить до
збільшеного виробництва рибозо-5-фосфату і збільшеного рівня ФРПП.
Вторинна подагра виникає через різні захворювання, які викликають збільшене
утворення або зменшену виділення сечової кислоти:
• Збільшене утворення нуклеїнових кислот спостерігається в швидко ростучих
злоякісних тканинах.
• Збільшений розпад нуклеїнових кислот спостерігається при псоріазі та травмах
• Зменшене виділення сечової кислоти може бути викликаний нирковою
недостатністю.
38.
Алопуринол – інгібітор ксантиноксидазиЗа даними науковців, поширеність подагри становить від 0,06 до 3 % дорослого
населення; поширеність гіперурикемії — від 2 до 20 %. Для лікування подагри
застосовують алопуринол – синтетичний ізомер гіпоксантину
У клітинах алопуринол петертворюється на алоксантин – конкурентий інгібітор
ксантиноксидази. Інгібування ксантиноксидази призводить до накопичення
ксантину і гіпоксантину, які краще розчиняються у воді, ніж сечова кислота, і
тому легко екскретуються з організму. Таким чином, алопуринол зменшує
утворення сечової кислоти в організмі.
39.
https://www.youtube.com/watch?v=cojfrtAqI1c&t=1s40.
Синдром Леша-НіханаСиндром Леша-Ніхана – спадкова форма гіперурикемії. Крім симпотомів,
властивих подагрі, синдром Леша-Ніхана виявляється тяжкими
нервовопсихічними порушеннями.
Майкл Леш та Уільям Ніхан вперше описали дану патологію у 1964 р. Синдром
Леша-Ніхана належить до Х-рецесивних спадкових порушень, тому хворіють
переважно хлопчики. Частота захворювання становить 1:300 000.
Молекулярною причиною синдрому Леша-Ніхана є спадковий дефіцит
гіпоксантингуанінфосфорибозилтрансферази
41.
Катаболізм піримідинів (схема)Кінцевими продуктами катаболізму піримідинів є NH3, СО2 і βамінокислоти. В подальшому аміак утилізується в орнітиновому циклі,
перетворюючись на сечовину
42.
Катаболізм піримідинів (реакції)Першою реакцією катаболізму
піримідинових азотистих основ є
дезамінування. Фермент
цитозиндезаміназа каталізує
перетворення цитозину на урацил. Під
дією дигідроурацилдегідрогенази
урацил відновлюється до
дигідроурацилу. Коферментом в даній
реакції є НАДФН+Н+ . Наступні
перетворення здійснюється шляхом
гідролізу. Дигідроурацил гідролізується
до N-карбамоїлпропіонової кислоти
(уреїдопропіонату), що в подальшому
розпадається на β-аланін, СО2 і NH3,
абр використовується для синтезу
карнозину, ансерину, КоАSH
Процес катаболізму тиміну є подібним.
Тимін відновлюється до дигідротиміну,
що в подальшому гідролізується до Nкарбамоїлізобутирату
(уреїдоізобутирату). Останній
розпадається на β-аміноізобутират, СО2
і NH3.
43.
Центральна догма молекулярноїбіології
Генетична інформація, що міститься в ДНК, копіюється та
передається до дочірніх клітин через реплікацію ДНК.
Транскрипція (синтез РНК) – перший етап експресії
генетичної інформації. Далі код, що міститься в
нуклеотидній послідовності молекул РНК, транслюється
(синтез білків), завершуючи експресію генів. Потік
генетичної інформації від ДНК до РНК, а відтак до білків,
відомий як центральна догма молекулярної біології.
Реплікація
DNA
Транскрипція
РНК
Трансляція
Реплікація
ДНК
Транскрипція
БІЛОК
Зворотня
транскрипція
РНК
Трансляція
БІЛОК
Одним відомим винятком з центральної догми
є ретровіруси. Ці віруси, що кодуються РНК, їх
геромна РНК конвертується назад у ДНК за
допомогою вірусного ферменту, відомого як
зворотна транскриптаза. Здатність
зворотно перетворювати РНК в ДНК - це
метод, який використовується в лабораторії,
наприклад в RT-PCR,
44.
Первинна структурануклеїнових кислот
5'-Кінець
O
H3C
N
OH
N
5'
Послідовність нуклеотидів у
полінуклеотиді відома як первинна
структура нуклеїнової кислоти.
Первинна структура надає
індивідуальність полінуклеотидного
ланцюга.
Тимін
O
O=P–O–CH2 O
OH
1'
4'
3'
2'
NH2
H
N
O
N
5'
Аденін
N
N
O=P–O–CH2 O
OH
4'
3'
2'
NH2
H
Цитозин
N
O
O
N
5'
O=P–O–CH2 O
OH
1'
4'
3'
2'
O
H
N
Фосфодіефірний зв'язок
O
N
5'
O=P–O–CH2 O
OH
3'-Кінець
4'
1'
3'
2'
HO H
N
N
NH2
Гуанін
Ланцюг полінуклеотиду має
напрямок – від 5' до 3'. Кожен
ланцюг полінуклеотиду має
два кінці. 5'-кінець з фосфатом
показано зліва, а 3'-кінець з
вільним гідроксилом показано
справа.
45.
Вторинна структура ДНКВісь симетрії
Полінуклеотидний
ланцюг
5'
Кінець
3' Кінець
–A=T–
–G C
–A=T
Мала
боріздка
Пари нуклеотидів
перпендикулярні
до осі симетрії
Модель подвійної спіралі ДНК, запропонованої в
1953 році Дж. Уотсоном та Ф. Кріком, не тільки
описує структуру ДНК, але й показує механізм
подвоєння – реплікацію ДНК – рівний розподіл
між дочірніми клітинами генетичного матеріалу,
що має важливе біологічне значення у процесі
збереження і передачі генетичної інформації.
–A=T–
–G C
–A=T–
Велика
боріздка
–G C–
–A=T
–G C–
У подвійній спіралі ланцюги з'єднані
антипаралельно, тобто один ланцюг
простягається в напрямку від 5' до 3', тоді як
інший ланцюг (комплементарний) направлений
від 3' до 5'. Кожен ланцюг ДНК має гідрофільний
фосфатно-дезоксирибозний каркас на зовнішній
стороні молекули, тоді як гідрофобні основи
знаходяться в середині. Два полінуклеотидні
ланцюги не ідентичні, але комплементарні один
до одного.
46.
Розалінд ФранклінФотографія 51 рентгенограма волокон
натрієвої солі тимусної
ДНК в B-формі
Рентґенівські можливості, які відкрила
Розалінда Франклін, надихнули
Вотсона і Кріка до усвідомлення того,
що ДНК має форму подвійної спіралі.
47.
Вторинна структура ДНКфосфатнодезоксирибоз
5' ний каркас
Пари основ
A
P 5'
T
фосфатнодезоксирибоз
ний каркас 3'
3'
5'
3'
P
P
G
C
5'
5'
3'
P
P
T
A
5'
3'
3'
3'
3'
Водневі
зв язки
5'
P
5'
Пуринові основи завжди утворюють водневі
зв'язки з піримідиновими.
Експериментально встановлено, що в будь-якій
даній молекулі ДНК концентрація аденіну (A)
дорівнює тиміну (T), а концентрація цитозину
(C) дорівнює гуаніну (G).
Між G і C утворюється три водневі зв'язки,
у той час як між A і T - два водневі зв'язки.
48.
Хроматин. НуклеосомиВ еукаріотичній клітині ДНК існує у
вигляді
нуклеопротеїну,
який
називається
хроматином.
Хроматин складається з ДНК і
основних білків гістонів. Кожна
хромосома представляє собою
одну молекулу ДНК. Довжина
хромосомної
ДНК
становить
приблизно 30-60 мм. Таким чином,
молекула ДНК щільно упакована
так, що може вміщатися в межі
ядра.
Для
упаковки
ДНК
п'ять
типів
Вся ДНК не упакована як одна котушка, але використовуються
вона присутня у вигляді невеликих котушок, гістонів: H1, H2A, H2B, H3 і H4.
відомих як нуклеосоми. Кожна нуклеосома
Нуклеосома (H1a, H2b,
складається з гістонового октамера, який
H3, H4)2
містить по два H2a, H2b, H3 і H4 гістони та
ДНК. Зазвичай ДНК скручена навколо
ДНК
октамера, і вона утворює приблизно два
оберта навколо гістонового октамера двічі.
Кожна нуклеосома об'єднана міжланцюговою
H1 гістон
ДНК та гістоном типу H1.
49.
Механізми реплікації ДНКУ кінці 1950-х років було запропоновано три різні механізми для
реплікації ДНК:
• Консервативна
модель:
обидва
батьківські
ланцюги
залишаються разом після реплікації ДНК.
• Напівконсервативна модель: Подвійна ДНК містить один
батьківський і один дочірній ланцюг після реплікації.
• Дисперсивна модель: Батьківська та дочірня ДНК перемішані в
обох ланцюгах після реплікації.
Консервативна модель
Напівконсервативна модель
Дисперсивна модель
50.
Механізми реплікації ДНКМ. Мезельсон і Ф. Сталь (1957 р)
довели напівконсервативний
механізм реплікації ДНК
Експеримент включав наступні етапи:
вирощування клітин E. Coli на середовищі, що містило як джерело азоту NH4CI з
легким ізотопом (14N);
вирощування клітин E. сoli протягом декількох поколінь на середовищі, що містило
як джерело азоту NH4CI з важким ізотопом (15N);
клітини E. сoli, що містили у своєму складі „повністю важкі” молекули ДНК (15N-ДНК)
перенесли на середовище, в якому був легкий азот (14NH4CI), тоді ДНК клітин
першого покоління мала густину проміжну між щільністю „легких” (14N) і „важких”
(15N) молекул ДНК, тобто складалася наполовину з легких та важких ланцюгів, що
відповідало будові (14N, і 15N-ДНК);
в клітинах другого покоління були виявлені два типи ДНК – з проміжною густиною і
легкою (14N-ДНК).
51.
Реплікація у прокаріотів (1) ініціаціяІніціаціація розпочинається за участі п'яти білків: DnaA, DnaB, DnaC, гіраза та SSB. DnaA
зв'язується з ділянкою ДНК, що називається початком (оріджином) реплікації (oriC). Для
прокаріотів це єдиний сайт, що в основному складається з послідовностей A-T. DnaA (20-50
нуклеотидів) зв'язується з oriC, що призводить до розділення дволанцюгової ДНК.
Helicase
SSB
Helicase
SSB
SSB
SSB
Потім хеліказа або DnaB розділяє ланцюги,
використовуючи енергію ATФ. DnaC утворює
комплекс з DnaB, допомагаючи в розкручуванні
ДНК у ділянці oriC. Коли хеліказа розкручує
ДНК, це формує бульбашку реплікації з
двома вилками реплікації.
Білки, що зв'язують одноланцюгову ДНК (SSB - Single-strand DNA-binding), також
відомі як білки, що дестабілізують спіраль ДНК. SSB також захищають одноланцюгову
ДНК від розщеплення нуклеазами.
При розділенні двох ланцюгів подвійної спіралі утворюютья
суперспіралі перед вилкою реплікації. ДНК гіраза рухається
вперед хелікази і знімає ці суперспіралі.
Остання стадія ініціації реплікації - це приєднання праймера. Оскільки ДНК-полімераза не
може ініціювати синтез комплементарної ДНК, потрібен короткий фрагмент РНК (приблизно
5-50 нуклеотидів) – праймер, що утворюється праймазою (РНК-полімераза, також відома
як DnaG).
52.
Реплікація у прокаріотів (2) елонгаціяДНК-полімерази подовжують новий ланцюг ДНК,
3'
5'
додаючи дезоксирибонуклеотиди до 3'-кінця
праймера для утворення нового ланцюга,
Напрямок
комплементарного матриці. ДНК-полімераза III Топоізомераза
реплікації
основний фермент елонгації в прокаріотів, що
працює тільки в напрямку 5'→3'. Оскільки
Хеліказа
SSB
ланцюги ДНК антипаралельні, то реплікація на них
protein
відбувається трохи відмінно. Один ланцюг ДНК
синтезується неперервно і відомий як «лідуючий»
ДНК
Праймаза
полімераза
ланцюг. Інший ланцюг синтезується у вигляді
ІІІ
фрагментів Оказакі. Його називають відстаючим
ДНК
ланцюгом. Довжина фрагментів коливається від
РНКполімераза
праймер
ІІІ
1000 до 2000 основ. Вони також синтезуються
(затравка)
тільки в напрямку 5'→3'. Проміжки між
фрагментами заповнюються ДНК-полімеразою I.
ДНК лігаза
РНК-праймери видаляються 5'→3'
5'
3'
екзонуклеазною активністю ДНК-полімерази I.
3'
5'
Відстаючий ланцюк (з
Лідуючий ланцюг
ДНК-лігаза об'єднує фрагменти.
фрагментами Оказакі)
Правильність реплікації є найважливішою для існування організму. Крім його
каталітичної функції, ДНК-полімераза III також має функцію перевірки. Вона перевіряє
добудовані нуклеотиди в новоутвореній ДНК. Крім того, ДНК-полімераза виправляє свої
помилки (якщо такі є) і видаляє неправильно розташовані нуклеотидні основи. Іншим
ферментом репарації є ДНК-полімераза II, що бере участь у процесі відновлення ДНК.
53.
Реплікація у прокаріотів (3) механізмВільна 3’-гідроксильна група матриці атакує αфосфатну групу відповідного
нуклеозидтрифосфату (НТФ), що призводить до
відщеплення залишку пірофосфату і утворення
фосфодіефірного зв’язку
Далі вільний 3’- гідроксил
приєднаного нуклеотиду атакує αфосфатну групу наступного НТФ, і
таким чином продовжується
процес полімеризації, який йде у
напрямі 5’ – 3’, антипаралельно
матриці, що закінчується 5’фосфатом
Нуклеофільна
атака
3'→5'-екзонуклеазна активність дозволяє ДНК полімеразі III
"перевіряти" новосинтезований ланцюг ДНК.
54.
Реплікація у прокаріотів (4) термінаціяРеплікація завершується, коли дві реплікаційні вилки, які рухаються в
протилежних напрямках по кільцевій хромосомі, зустрічаються. Ділянки, де
відбувається завершення реплікації, часто є конкретними послідовностями ДНК,
відомими як Ter-сайти. Ці Ter-сайти діють як місця зв'язування для білка,
відомого як Tus (Termination utilization substance).
Коли реплікаційна вилка зустрічає Ter-сайт, білок Tus зв'язується з ним,
утворюючи комплекс, який діє як перешкода для руху ферментів реплікації. Цей
процес допомагає запобігти переміщенню реплікаційних вилок далі і забезпечує
термінацію (завершення) реплікації ДНК.
55. https://www.youtube.com/watch?v=TEQMeP9GG6M
56.
Реплікація у еукаріотів (1) ініціаціяПроцес реплікації ДНК в еукаріотів дуже схожий на прокаріотичний. Відмінності
виникають через набагато більшу складність організації ДНК. Еукаріотичні
хромосоми часто дуже довгі і мають численні oriC, розсіяні по всій кожній
хромосомі. Реплікація також відбувається одночасно на двох ланцюгах, так
само як у прокаріотів: пара реплікаційних вилок стартує в кожному початку
реплікації, і дві вилки рухаються в протилежних напрямках.
Під
час
еукаріотичної
реплікації
одночасно функціонує велика кількість
oriC, припускається, що в ДНК підчас
поділу є від 10 000 до 100 000 оріджинів
реплікації. Це створює значні проблеми
в синхронізації. З іншого боку, кожен
початок повинен ініціюватися лише раз
під час кожного циклу реплікації, щоб
уникнути дублювання сегментів ДНК, які
вже
були
репліковані.
Цього
досягається за допомогою комплексу
білків,
відомого
як
фактор
ліцензування реплікації (RLF), який
зв'язується з ДНК перед кожним циклом
реплікації і видаляється під час
реплікації. Тільки в присутності RLF
дозволяється реплікація ДНК.
57.
Реплікація у еукакаріотів (2) елонгаціяУ реплікації ДНК еукаріот беруть участь такі типи полімераз ДНК полімераз – α, β, γ, δ, і ε.
ДНК-полімераза α складається з 4 субодиниць і
ідентичною за
структурою та властивостями у всіх класів ссавців, причому одна з
субодиниць має праймазну активність. Субодиниця ДНК-полімерази α (М. м.
180 000 Да) каталізує реакцію полімеризації, переважно синтез відстаючого
ланцюга дезоксирибонуклеїнової кислоти.
ДНК-полімераза δ складається з 2 субодиниць і переважно каталізує
синтез лідируючого ланцюга ДНК. Основними ферментами,що відіграють
основну роль у реплікації ДНК в еукаріотів є ДНК - полімерази α і δ, що
проявляють 5’,3’ – полімеразну активність.
Полімерази β та ε беруть участь у репарації ядерної ДНК, а γ-полімераза
відповідає за реплікацію мітохондріальної ДНК.
Відкрита також ДНК-полімераза ε, яка у ряді випадків замінює δфермент, зокрема при репарації ДНК (виправлення порушень ДНК,
помилками реплікації або ушкоджувальними агентами).
58.
Реплікація у еукаріотів (3) термінація5'
3'
3'
5'
Eukaryotic DNA
Telomere
Telomere
Telomere repeats
AGGGTT
AGGGTT
AGGGTT 3'
TCCCAA 5'
Newly synthesized strands with
terminal RNA primer removed
Telomerase
Telomerase extends
the 3'-end of the DNA
AGGGTT
AGGGTT
AGGGTT
TCCCAA 5'
UCCCAA
RNA primer is
synthesized by primase
AGGGTT
AGGGTT
RNA template is part of
the ribonucleoprotein
telomerase
AGGGTT
TCCCAA 5'
AGGGTT
TCCCAA 5'
AGGGTT
UCCCAA
The 3'-end of the RNA
serves as an acceptor for
DNA polymerase
AGGGTT
AGGGTT 3'
Primase
AGGGTT AGGGTT
UCCCAA UCCCAA
RNA primer is removed
DNA polymerase
AGGGTT
AGGGTT
AGGGTT
AGGGTT
TCCCAA
TCCCAA
TCCCAA 5'
Реплікація завжди відбувається в напрямку
5'→3' , а ДНК-полімераза не може синтезувати
новий ланцюг на 5' кінці нового ланцюга.
Іншими словами, невеликий фрагмент
(близько 300 нуклеотидів) на 3' кінці
батьківських ланцюжків не може бути
реплікований. Цей кінець хромосоми
називається теломером. Таким чином, інший
фермент, теломераза, бере на себе цю
роботу реплікації кінця хромосом. Після
звичайної реплікації в цій ділянці залишається
лише один ланцюг; тому він розривається
екзонуклеазами. Якщо немає якогось
механізму для реплікації теломерів, то на
кожному поділі клітини довжина хромосом
буде зменшуватися.
Теломераза діє як зворотна транскриптаза.
Теломераза розпізнає 3' кінець теломеру, і
тоді синтезується невеликий ДНК-ланцюг.
59.
Інгібітори реплікаціїАнтибіотики кінолонового класу, такі як
ципрофлоксацин,
налідиксова
кислота,
інгібують ДНК-гіразу і використовуються для
лікування численних інфекцій, включаючи
ускладнені інфекції сечового тракту та інфекції
нижніх дихальних шляхів, оскільки вони
ефективно блокують реплікацію ДНК. Ці
антимікробні засоби майже не впливають на
ферменти людини.
Сполуки, які інгібують топоізомерази
людини, використовуються як протиракові
засоби, наприклад, адриаміцин, етопозид,
доксорубіцин.
60.
Транскрипція РНК як перша стадія експресії генівГенетична інформація, закодована в ДНК відповідно до центральної догми
молекулярної біології, переноситься на послідовність нуклеотидів РНК, що далі
слугує матрицею для біосинтезу білка (ДНК→РНК→білок). Така послідовність подій,
що забезпечує реалізацію генетичного коду в послідовність амінокислот білка,
називається експресією генів.
Процес копіювання генетичної інформації, під час якого один ланцюг ДНК слугує
матрицею для синтезу РНК, називається транскрипцією. Транскрипція є першим
етапом експресії генів. В процесі транскрипції утворюються молекули інформаційної
або месенджерної іРНК, які транслюються в послідовності амінокислот у білках,
рибосомальні рРНК, транспортні тРНК та додаткові невеликі молекули РНК, які
виконують спеціалізовані структурні, каталітичні та регуляторні функції і не
транслюються, тобто вони є некодуючими РНК (нкРНК).
РНК-копії активних генів, які кодують білки
у еукаріотів називають транскриптон.
Таким чином, транскриптон – це одиниця
транскрипції, що є початковим продуктом
експресії
гена.
Оперон
–
це
функціональна
одиниця
генетичної
інформації
у
бактерій
та
інших
прокаріотів. Він складається з групи генів.
61.
Типи РНКІснують три основних типи РНК, які беруть участь у процесі синтезу білків:
рибосомальна РНК (рРНК) – 50-80%, транспортна РНК (тРНК) 10-20%, і
інформаційна РНК (іРНК) 5-10%.
Крім трьох вищезазначених РНК, в клітинах також присутні інші типи РНК. До
них відносяться гетерогенна ядерна РНК (гяРНК), мала ядерна РНК (мяРНК), та
мала цитоплазматична РНК (мЦРНК).
Type of RNA
Messenger RNA
Abbreviation
mRNA
Heterogeneous
nuclear RNA
Transfer RNA
hnRNA
Ribosomal RNA
Small nuclear RNA
Small nucleolar RNA
rRNA
snRNA
snoRNA
tRNA
Small
cytoplasmic scRNA
RNA
Transfer–messenger
tmRNA
RNA
Function(s)
Transfers genetic information from genes to
ribosomes to synthesize proteins.
Serves as precursor for mRNA and other
RNAs.
Transfers amino acid to mRNA for protein
biosynthesis.
Provides structural framework for ribosomes.
Involved in mRNA processing
Plays a key role in the processing of rRNA
molecules.
Involved in the selection of proteins for export.
Mostly present in bacteria. Adds short peptide
tags to proteins to facilitate the degradation of
62.
Рибосомальна РНКРибосоми - це заводи для синтезу білків. рРНК
знаходяться у співпраці з декількома білками як
компоненти рибосом - складних структур, які служать
місцями для синтезу білків. В прокаріотичних клітинах
існують три різновиди рРНК розмірів (23S, 16S та 5S). У
цитозолі еукаріотів існують чотири види рРНК (28S, 18S,
5.8S та 5S). В сукупності рРНК складають приблизно 80%
від загальної кількості РНК в клітині.
Прокаріотичні рРНК
23S
16 S
рРНК
5S
Еукаріотичні рРНК
28S
18S
5.8S
Рибосоми
5S
63.
Транспортна та інформаційна РНК3' кінець
Місце приєднання CCA
амінокислоти
5'
кінець
Комплементарні
азотисті основи
TΨC плече
Варіабельне
плече
D плече
Антикодонова
петля
Антикодон
тРНК - найменша (4S) з трьох основних видів молекул
РНК. Існує принаймні тип тРНК існує для кожної з 20
амінокислот. Молекули тРНК містять велику кількість
мінорних основ і мають характерні особливості вторинної
та третинної структури. Кожна тРНК служить
"адаптерною" молекулою, яка несе свою конкретну
амінокислоту - ковалентно приєднану до її 3'-кінця - до
місця синтезу білків. Там вона визнає послідовність
генетичного коду на мРНК, яка визначає додавання своєї
амінокислоти до ростучого пептидного ланцюга.
Молекула іРНК складає всього лише близько 5% всієї РНК у клітині, але є найбільш
гетерогенним типом РНК. іРНК несе генетичну інформацію з ядерної ДНК в цитозоль, де
вона використовується для синтезу білків. Якщо мРНК несе інформацію з більше ніж одного
гену, вона вважається поліцистронною. Поліцистронна мРНК є характерною для
прокаріотів. Якщо мРНК несе інформацію лише з одного гену, вона вважається
моноцистронною і є характерною для еукаріот. Окрім областей кодування білків, які
можуть бути трансльовані, мРНК містить некодуючі області на своїх 5'- та 3'-кінцях.
5'untranslated
leader sequence
3'untranslated
leader sequence
GpppКеп
Кодуюча ділянка
іРНК містить довгу послідовність
аденінових нуклеотидів («хвіст поліА») на 3'-кінці ланцюга РНК, а також
-pApApApApA-OH «кеп» на 5'-кінці, що складається з
молекули 7-метилгуанозину.
Полі-A-хвіст
64.
Реплікація VS транскрипціяТранскрипція РНК має подібні риси з
реплікацією ДНК:
Синтез ДНК та РНК відрізняються
наступних аспектах:
1. Як синтез ДНК, так і РНК включає
загальні етапи ініціації, елонгації та
термінації.
2. Полярність 5′–3′: Синтез як DNA,
так і RNA відбувається в напрямку
від 5′ до 3.
3. Великі ініціаційні комплекси:
Обидва процеси передбачають
утворення великих,
багатокомпонентних ініціаційних
комплексів
4. Правила базового парування
Вотсона–Кріка: Аденін (A) утворює
пари з тимініном (T) у DNA, а аденін
(A) утворює пари з урацилом (U) у
RNA. Так само цитозин (C) утворює
пари з гуаніном (G) як у DNA, так і у
RNA.
1. Використання рибонуклеотидів.
2. U замість T як комплементарна
база для A в РНК.
3. Відсутність праймера в РНКсинтезі: Під час синтезу РНК
праймер не використовується.
4. Часткова транскрипція геному: У
клітині лише частини геному
активно транскрибуються в РНК,
тоді як під час реплікації ДНК весь
геном має бути скопійований.
5. Відсутність високоефективної
функції перевірки на помилки
під час транскрипції РНК: Під час
транскрипції РНК відсутня
високоефективна функція
перевірки на помилки, яка є
характерною для реплікації ДНК.
65.
РНК-полімераза прокаріотівУ прокаріотів основний фермент транскрипції – ДНК-залежна РНКполімераза або просто РНК-полімераза, яка складається з двох
однакових α - субодиниць, двох різних β (β1 і β2) - субодиниць, ωсубодиниці і σ-субодиниці. Така форма РНК-полімерази, що містись
6 субодиниць (включно з σ)називається холоферментом. РНКполімераза розрізняє послідовність нуклеотидів, яку називають
ділянкою промотора, тобто початку транскриптону ДНК.
РНК-полімераза
створює
РНК
комплементарну до матричного ланцюга ДНК.
РНК синтезується з 5'-кінця до 3'-кінця,
антипаралельно матричному ланцюгу ДНК за
правилом комплементарності.
фосфатнодезоксирибоз
5' ний каркас
Пари нуклеотидів
A
P 5'
U
фосфатнорибозний
каркас 3'
3'
5'
3'
Розрізняють з некодуючий або матричний та
кодуючий ланцюги. ДНК. Кодуючий ланцюг
ДНК
–
ланцюг
ДНК,
ідентичний
за
послідовністю до синтезованої РНК (є
комплементарним до матричного ланцюга
ДНК). Тобто транскрипція відбувається на
некодуючому ланцюгу. Для деяких генів
кодуючим може бути один з ланцюгів, для
інших генів – інший.
P
P
G
C
5'
5'
3'
P
P
T
A
5'
3'
3'
3'
3'
ДНК
Водневі
зв язки
5'
РНК
P
5'
66.
Транскрипція РНК у прокаріотів (1) ініціаціяЗв'язування ферменту РНК-полімерази з ДНК є передумовою для початку
транскрипції. Конкретна ділянка на ДНК, де здійснюється зв'язування ферменту,
відома як промоторна ділянка.
Послідвності прокаріотичних
промоторів, що розпізнаються
δ-субодиницею РНКполімерази
-35
Послідовність
ДНК
3'
~19 пар нуклеотидів
T T GA CA
5'
-40
-35
-30
-25
-20
T ATAAT
-15
Початок
транскриапції
ТАТАблок
-10
~7 base pairs
-5
+1
3'
+5
5'
Промотор прокаріотів може містити такі послідовності, які визнаються
сігма-факторами прокаріотичної РНК-полімерази:
•Послідовність '-35' - це консенсусна послідовність (5'-TTGACA-3'),
розташована приблизно за 35 основами ліворуч від сайту початку транскрипції.
•Pribnow box (TATA блок): холоензим РНК-полімерази переміщується і закриває
другу консенсусну послідовність (5'-TATAAT-3'), розташовану приблизно за –10,
яка є місцем початкового розгортання ДНК (розкручування). Розгортання
короткого відрізку (приблизно 14 основ) перетворює закритий комплекс на
відкритий, відомий як транскрипційна бульбашка.
67.
Транскрипція РНК у прокаріотів (2) елонгаціяПісля того, як промоторна область
розпізнана
холоензимом,
місцеве
розгортання спіралі ДНК продовжується за
допомогою РНК-полімерази. Після синтезу
8-9 основних пар РНК σ-субодиниця
вивільняється
і
РНК-полімераза,
що
залишається називається кор-ферментом.
РНК-полімераза здійснює транскрипцію із
швидкістю 30-50 азотистих пар в секунду.
ДНК швидко розкручується, і за ферментом
знову звивається. Частина нового ланцюга
РНК є гібридом ДНК-РНК, але потім РНК
вивільняється,
коли
спіраль
знову
формується.
Кодуючий
ланцюг
РНК-полімераза
3' end of RNA
being elongated
Некодуючий
ланцюг
РНК
РНК-ДНК
гібридна
спіраль
АМФn1
n1АТФ
2+ ; ДНК-матриця Р
Mg
ГМФn2 + (n +n +n +n )ФФ
n2ГТФ
Н
1 2 3 4
н
РНК-полімераза
ЦМФn
n3ЦТФ
3
К
УМФn4
n4УТФ
Подібно
до
ДНК-полімерази,
РНК-полімераза
використовує
нуклеозидтрифосфати як субстрати та вивільняє пірофосфат кожного разу, коли
нуклеозидмонофосфат додається до ростучого ланцюга. Як із реплікацією,
транскрипція завжди відбувається в напрямку 5'→3'. На відміну від ДНКполімерази, РНК-полімеразі не потрібен праймер і не вона має функції перевірки
(репарації).
68.
Транскрипція РНК у прокаріотів (3) термінаціяDNA coding strand
AGCCСGCNNNNNGCGGGCTTTT
TCGGGCGNNNNNCGCCCGAAAA
DNA template strand
Nascent RNA
Етап подовження одноланцюгового ланцюга РНК
триває до досягнення
сигналу термінації.
Термінація може бути спонтанною або залежною
від участі білка, відомого як фактор ρ (ро).
AGCCСGCNNNNNGCGGGCUUUU
Hairpin
U
UU
A=U
G C
C G
C G
C G
Newly synthesized
G C
RNA folds to form a
C G
hairpin that is
N N
NN
important in chain
N
termination
ρ-Незалежна
термінація
(спонтанна)
спостерігається у більшості прокаріотичних генів,
коли у новосинтезованій РНК утворюється
послідовність, яка є самокомплементарною, що
зумовлює утворення «шильок» або паліндромів.
Останні
дестабілізують
РНК-полімеразу
та
зумовлюють її дисоціацію.
• ρ-Залежна термінація це вимагає участі додаткового білка, ро (ρ), який є
гексамерною аденозинтрифосфатазою (АТФазою) із хеліказною активністю. ρ
зв'язується із цитозин-багатим "сайтом розпізнавання ро" біля 3'-кінця
новосинтезованої РНК і, використовуючи свою АТФазну активність, рухається по
РНК, поки не досягне РНК-полімерази. АТФ-залежна хеліказна активність ρ
розриває гібридну спіраль РНК-ДНК, що призводить до вивільнення РНК.
69. https://www.youtube.com/watch?v=1b-bRVgqof0
70.
Транскрипція РНК у еукаріотівСинтез РНК в еукаріотів — це набагато складніший процес, ніж у прокаріотів
В еукаріотів існує три різних РНКполімерази, які знаходяться в ядрі :
• РНК-полімераза I відповідає за
синтез
попередників
великих
рибосомальних РНК.
• РНК-полімераза
II
синтезує
попередники мРНК та малих ядерних
РНК.
• РНК-полімераза III бере участь у
формуванні
тРНК
та
малих
рибосомальних РНК.
5'
3'
3'
5'
РНК
полімераза ІІ
РНК
полімераза І
5'
Рибосомальні
РНК
РНК
полімераза ІІІ
3'
Інформаційна
РНК
Транспортна
РНК
Крім трьох РНК-полімераз, які знаходяться в ядрі, в еукаріотів також існує
мітохондріальна РНК-полімераза. Остання схожа на прокаріотичну РНКполімеразу за структурою та функцією.
71.
Транскрипція РНК у еукаріотів (ініціація)Сайти-промотори в еукаріотів є ділянками, де РНК-полімераза II розпізнає
послідовність ДНК для ініціації транскрипції. Існують два важливих типа промотора:
• Hogness box (або TATA box): Ця послідовність майже ідентична Pribnow box в
прокаріотів, розташована приблизно за 25 нуклеотидів лівіше від початку синтезу
мРНК.
• CAAT box: Цей другий сайт визнання знаходиться між 70 і 80 нуклеотидами від
місця початку транскрипції.
Sequences within the eukaryotic
promoter region that are
recognized by RNA polymerase II
5'
СAAT
box
GGCCA A TC T
Hogness
box
T AT AAT
45 to 55 base pairs
25 base pairs
3'
DNA
3'
-70
-60
-50
-40
-30
-20
-10
+1
+5
5'
Молекулярні події, необхідні для ініціації транскрипції в еукаріотів, є складними і загалом
включають три етапи:
1. Хроматин, що містить послідовність промотора, стає доступним транскрипційним
ферментам та білкам.
2. Зв'язування факторів транскрипції (TF) з послідовностями ДНК в області
промотора.
3. Стимуляція транскрипції енхансерами.
Фактори транскрипції взаємодіють з промоторними областями. У людини виявлено приблизно
шість факторів транскрипції (TFIID, TFIIA, TFIIB, TFIIF, TFIIE, TFIIH). Припускається, що ці
фактори зв'язуються один з одним і, в свою чергу, з ферментом РНК-полімеразою.
72.
Інгібітори транскрипціїα-Аманітин виробляється блідою поганкою. Він
інгібує РНК-полімеразу III. Прокаріотичні ферменти
не піддаються впливу цього отруйного речовини. Це
відповідає за випадки отруєння грибами по всьому
світу. Викликає біль у травному тракті, блювоту,
діарею та нудоту.
Рифаміцин і Рифампіцин є антибіотиками.
Вони блокують транскрипцію, інгібуючи
утворення першого фосфодіестерного зв'язку.
Афлатоксин — це грибок, який
росте на вологих земляних
горіхах і виробляє афлатоксин,
який інгібує транскрипцію.
Актіноміцин інгібує
транскрипцію, заважаючи
розкручуванню ДНК.
73.
Постранскрипційна модифікаціяУ еукаріотів формуються всі три типи РНК у формі попередників, які
перетворюються в функціональні молекули РНК завдяки посттранскрипційній
модифікації - процесингу. Зазвичай ці модифікації відбуваються в ядрі.
Молекула іРНК синтезується у великій формі попередника, відомого як гетерогенна
ядерна РНК або гяРНК. Процесинг іРНК включає три стадії:
1.Кепування на 5' кінці: До 5'-кінця додається ГДФ який метилюється, утворюючи
«кеп».
2.Поліаденування на 3'-кінці: До 3'-кінця приєднується полі(A)-хвіст. Полі (A)
полімераза (PAP) відповідальна за додавання полі(A)-хвоста на 3'-кінці пре-mRNA.
3.Сплайсінг: Деякі частини гяРНК не містять генетичної інформації і відомі як інтрони.
Інші частини гяРНК, які містять генетичну інформацію, відомі як екзони. Сплайсінг
видаляє інтрони та об'єднує екзони для формування функціональної іРНК
5' flanking region
Transcribed region
Promoter
CAAT box
GC boxes
DNA 5'
-110
-40
Intron
TATA
box
Cap
site
TATATAA
PyAPy
-30
-20
hnRNA
Protein
start
site
ATG
Left
splice
site
AGGT
Right
splice
site
AGGT
Protein
stop
signal
TGA
Poly (A)
addition Polyadenylation
site
signal
AATAAA
+1
AUG
cap
Spliced
mRNA
AUG
cap
Protein
N
UGA
UGA
Poly(A)
Poly(A)
C
Сплайсінг вимагає спеціальних
білків та малих ядерних РНК або
мяРНК,
що
складається
приблизно з 100 нуклеотидів.
Склад мяРНК комплементарний
кінцям інтронів, їх взаємодія
призводить до утворення петель.
В результаті цього об'єднуються
суміжні екзони. Завершується
видалення петлі і об'єднання
екзонів.
74. https://www.youtube.com/watch?v=O0wouZGmXwI
75.
Регуляція експресії генів прокаріотівта еукаріотів на рівні транскрипції
На рівні транскрипції, еукаріотичні клітини використовують різноманітні
механізми для регуляції експресії генів.
Енхансер - це коротка (50–1500 пар основ) ділянка ДНК, яку можуть
зв'язувати білки (активатори) для активації транскрипції конкретного гена.
Ці білки зазвичай називають транскрипційними факторами. Енхансери є цисдіючими, тобто вони можуть розташовуватися на відстані до 1 000 000 пар основ
від гена, вліво чи вправо від місця промотора. У людини є сотні тисяч енхансерів,
і вони зустрічаються як у прокаріотах, так і в еукаріотах..
Сайленсер - це послідовність ДНК,
здатна зв'язуватися з факторами
регуляції транскрипції, які називають
репресорами. ДНК містить гени, що
слугують матрицею для іРНК. Коли
білок-репресор зв'язується з областю
сайленсера
ДНК,
РНК-полімераза
перешкоджає
транскрипції
послідовності ДНК в РНК. Таким чином,
сайленсери запобігають експресії генів.
Аттенюатор - це умовний транскрипційний термінатор, який використовується для
регулювання експресії біосинтетичних оперонів у бактерій.
76. https://www.youtube.com/watch?v=ZlTRpIvasQs
77.
Контроль експресії генів на рівні гістонівта НГБ
1. Конденсація ДНК:
Прокаріоти:ДНК вільно доступна для РНК-полімерази та регуляторних білків.
Еукаріоти: ДНК щільно упакована в нуклеосоми, обгорнута гістонами. Ділянки ДНК можуть
бути тісно згорнуті в гетерохроматин та недоступні для РНК полімерази.
2. Нуклеосоми та Гістони:
Еукаріоти: ДНК утворює нуклеосоми, обгорнуті гістонами, які взаємодіють між собою.
Щільно упакована ДНК називається гетерохроматином, яка не піддається транскрипції.
Хвости гістонів можуть бути модифіковані ацетилюванням, що впливає на ступінь
агрегації нуклеосом та експресію генів.
3. Ацетилювання (модифікаці) гістонів:
Ацетилювання: Додає ацетильні групи гістонам.
Деацетилювання: Видаляє ацетильні групи.
Вплив на стан хроматину: Наявність ацетилованих гістонів: Менш щільно упакований
хроматин (еухроматин), доступний для транскрипції. Наявність неацетилованих гістонів:
Щільно упакований хроматин (гетерохроматин), не доступний для транскрипції.
4. Ензими гістон-ацетилтрансфераз (HATs) та гістон-деацетилази (HDACs):
HATs: Додають ацетильні групи до гістонів.
HDACs: Видаляють ацетильні групи з гістонів.
5. Ремоделювання хроматину: Хроматинові ремоделювальні комплекси: Розгортають
нуклеосоми, надаючи доступ до ДНК для транскрипції.
78.
Метилування ДНКМетилування ДНК — це біологічний процес, під час якого метильні групи
додаються до молекули ДНК. Метилування може змінювати активність сегмента
ДНК, не змінюючи його послідовність. Коли воно розташоване в генному
промоторі, метилювання ДНК, як правило, виконує роль у пригніченні
транскрипції генів. У ссавців метилювання ДНК є важливим для нормального
розвитку і пов'язано з рядом ключових процесів, таких як геномний імпринтинг,
інактивація Х-хромосоми, пригнічення транспозонів, старіння та карциногенез.
Метилування ДНК зустрічається у всіх основних групах живих організмів, але рівень
зазвичай більш високий у еукаріотів. У людини метильовано близько 1% ДНК геному.
У соматичних клітинах дорослого організму метилування ДНК зазвичай відбувається в
CpG-динуклеотидах, метилування цитозину в складі інших послідовностей зустрічається в
ембріональних стовбурових клітинах
79.
Рекомбінація ДНКОбмін генетичною інформацією між хромосомами, що включає обмін сегментами
молекул ДНК, відомий як рекомбінація. Під час статевого розмноження у
еукаріот, процес мейозу дозволяє обмін сегментами ДНК між гомологічними
хромосомами. Це створює більшу генетичну різноманітність серед потомства. У
рекомбінації дві молекули ДНК розриваються і з'єднуються одна з одною,
утворюючи перехрест.
NON-HOMOLOGOUS
RECOMBINATION
HOMOLOGOUS
RECOMBINATION
A
B
C
A
B
C
D
R
S
Recognition sequence
a
b
c
P
Crossing over
Crossing over
A
a
a
Q
B
C
b
c
A
a
P
Q
B
Rejoining
C
D
R
S
Rejoining
a
B
C
P
Q
C
D
A
b
c
A
B
R
S
Існують головні два типи рекомбінації:
1.Гомологічна рекомбінація відбувається між двома копіями однієї і тієї ж
хромосоми (як у мейозі) або між двома копіями близьких за гомологією ДНК.
2.Негомологічна рекомбінація вважається включає специфічні білки, які
визнають певні послідовності і контролюють утворення перехрестів між ними.
80. https://www.youtube.com/watch?v=08Q-MVeNeTU
81.
Рекомбінація генів імуноглобулінівV segments (1 to 300)
V1
V2
V3
J segments
V300
J1
J2
J4
C segment
J5
Recombination resulting in deletion
DNA between V and J segments
Mature lightchain gene
V1
V2
V3
V84
J4
J5
C
Transcription
3'
V84
J4
J5
C
Removal of sequences
between J4 and C by
RNA splicing
V84 J4
Germ-line
DNA
C
Імуноглобуліни, що складаються з двох важких
і двох легких поліпептидних ланцюгів, мають
DNA of B
варіабельні
та
константні
ділянки.
lymphocyte
Варіабельна
ділянка,
важлива
для
специфічності антитіл, генерується завдяки
Primary
рекомбінації генетичних сегментів. Є дві
5' transcript
родини легких ланцюгів, каппа і лямбда, кожна
з яких сприяє різноманіттю антитіл.
C
Processed
mRNA
Translation
Light-chain
polypeptide
Variable
region
Рекомбінація забезпечує різноманіття антитіл,
зокрема в класі імуноглобулінів G (IgG).
Constant
region
Protein folding
and assembly
Light-chain
Antibody
molecule
Heavy chain
У недиференційованих клітинах інформація для
поліпептидного ланцюга розділяється на
сегменти V (варіабельний), J (об'єднуючий) та
C (константний). Під час диференціації Влімфоцитів за допомогою спеціалізованої
системи рекомбінації об'єднуються один
сегмент
V
і
один
сегмент
J,
що
супроводжується видаленням проміжного ДНК.
Цей процес
призводить
до
численних
комбінацій V–J, що внесе свій вклад у
різноманіття антитіл.
82.
Ампліфікація генівАмпліфікація генів - процес, при якому кількість копій певного гену збільшується.
Цей явище може виникати в результаті різних фізіологічних процесів, таких як
розвиток, відновлення чи адаптація до змін навколишнього середовища.
У випадку лікування метотрексатом відбувається
зниження росту злоякісних клітин. Проте, з часом деякі
клітини можуть розвинути опір до лікування шляхом
ампліфікації
генів,
пов'язаних
із
синтезом
дигідрофолатредуктази. Це дозволяє клітинам збільшити
вироблення
цього
ферменту,
який
є
мішенню
метотрексату, і тим самим стають менш чутливими до
лікарського засобу.
Ампліфікація гену металотіонеїну (MT) – збільшення
кількості копій цього гену в геномі клітини чи організму.
Металотіонеїни є групою низькомолекулярних білків,
які здатні координувати іони металів, зокрема цинку та
кадмію. Металотіонеїни відіграють роль в захисті клітин
від токсичних впливів металів. Ампліфікація гену
металотіонеїну може виникати в умовах навантаження
організму великим концентраціям токсичних металів.
Цей процес може бути захисною реакцією для
забезпечення додаткового захисту від токсичних
ефектів металів.
83.
Мутації (Геномні, хромосомні, генні)Мутації - це зміни в генетичному матеріалі організму, такі як зміни в
послідовності ДНК чи хромосомної структури. Ці зміни можуть виникати
внаслідок різних чинників (мутагенів) і мати різні наслідки для функцій генів та
фенотипу організму.
Типи мутацій включають:
Генні (точкові) мутації:
• Підстановка (заміна): Заміна однієї основи на іншу в генні.
• Інсерція: Додавання однієї чи кількох додаткових основ в генну
послідовність.
• Делеція: Видалення однієї чи кількох основ з генної послідовності.
• Трансверсія: Заміна одного типу основи іншим (наприклад, з пурина на
піримідин або навпаки).
Хромосомні мутації:
• Дуплікація: Подвоєння частини хромосоми.
• Делеція: Видалення частини хромосоми.
• Інверсія: Перевертання порядку генів чи фрагментів хромосоми.
• Транслокація: Переміщення частини хромосоми на інше місце.
Геномні мутації:
• Поліплоїдія: Збільшення числа хромосом в клітині.
• Гаплоїдія: Зменшення числа хромосом в клітині.
84.
Мутації (міссенс, нонсенс, сайлент)• Сайлент-мутації відбуваються, коли зміна в послідовності ДНК не призводить
до зміни амінокислоти в білку, тобто новий кодон все ще кодує ту саму
амінокислоту. Ці мутації мають тенденцію не мати виявних ефектів на функцію
білка через дегенеративність генетичного коду.
Міссенс-мутації відбуваються,
коли зміна в послідовності ДНК
призводить до того, що кодон
для
однієї
амінокислоти
замінюється кодоном для іншої
амінокислоти. Ця мутація може
призвести до того, що білок
отримує іншу амінокислотну
послідовність,
що
може
вплинути на його функцію або
стабільність.
Сайлент мутація
A G C G T AC C C T A C
Ser
Val
Pro
Tyr
A GC GT TC CC T A C
Ser
Val
Pro
Tyr
Міссенс мутація
A G C G T AC C C T A C
Ser
Val
Pro
Tyr
A G C G T AA C C T A C
Ser
Val
Pro
Tyr
Нонсенс мутація
A G C G T AC C C T A C
Ser
Val
Pro
Tyr
A G C G T AC C C T A G
Ser
Val
Pro
Stop
• Нонсенс-мутації виникають, коли зміна в послідовності ДНК призводить до
утворення стоп-кодону, що призводить до передчасного завершення синтезу
білка. Ця мутація часто призводить до втрати функціонального білка.
85.
МутагенезМутації, які виникають внаслідок дії агентів, що пошкоджують ДНК, відомі як
індуковані мутації. Агенти, які викликають мутації в ДНК, називаються
мутагенами і поділяються на три основні типи: хімічні, радіація та тепло. Навіть
якщо навколо немає небезпечних хімічних речовин чи радіації, мутації все одно
відбуваються, хоча рідше. Це так звані спонтанні мутації. Деякі з них виникають
через помилки в реплікації ДНК. Крім того, ДНК піддається певним спонтанним
хімічним реакціям (змінам) з низькою швидкістю, яка збільшується при
підвищенні температури.
Іонізуюче випромінювання вважається найсильнішим мутагеном, воно руйнує
ковалентні зв'язки, включаючи ті, що знаходяться в ДНК, і є провідною причиною
хромосомних мутацій. Іонізуюче випромінювання має накопичувальний ефект і
великими дозами забиває клітини. Ультрафіолетове випромінювання (254-260
нм) спричинює утворення аномальних димерних зв'язків та виступів в ланцюгах
ДНК.
86.
Репарація УФ-індукованих генних мутаційВідновлення нормальної структури ДНК, порушеної
утворенням димерів тиміну, реалізується послідовною
дією декількох ферментів.
І. Специфічна УФ - ендонуклеаза зв’язується з
місцем
порушення
правильної
двохспіральної
структури ДНК і розрізає пошкоджений ланцюг біля
тимінового димеру.
ІІ. Формування полідезоксирибонуклеотидної
ділянки на фрагмент ДНК, що містить димер;
реакція каталізується ДНК – полімеразою (у
прокаріотів - ДНК –полімераза І) і полягає в приєднанні
мононуклеотидів до вільного 3’ – кінця „ розрізаного”
ланцюга ДНК в напрямку 5’ – 3’.
ІІІ.
Олігонуклеотид
з
тиміновим
димером
відщеплюється 5’ – 3’- екзонуклеазою, а ДНК –
полімераза І виконує репаративну реплікацію, тобто
включає комплементарні дезоксирибонуклеотиди.
ІV. Приєднання 3’ – кінця новосинтезованого
фрагменту фосфодіефірним зв’язком до основного
ланцюга під дією ДНК - лігази. Таким чином,
відновлюється (репарується ) первинна структура ДНК.
TCCT
AG G A
Normal DNA
TCU T
AG G A
Defective DNA
U
Uracil DNA
glycosylase
TCX T
AG G A
Endonucleases
AG G A
DNA polymerase
DNA ligase
TCCT
AG G A
Normal DNA
87.
Пігментна ксеродермаПроцес репарації ультрафіолетових пошкоджень ДНК порушений у хворих
на пігментну ксеродерму, рідкісну спадкову хворобу. Ця патологія
успадковується як автосомальна рецесивна хвороба, при якій шкіра пацієнтів є
дуже чутливою до пошкоджуючої дії сонячного проміння, що може призвести
до раку шкіри. Виявлено декілька варіантів пігментної ксеродерми, зумовлених
дефектами різних ферментів системи репарації. При більш поширеній формі
дефектна УФ- ендоунклеаза.
88. https://www.youtube.com/watch?v=vJYrw8yNBVo
89.
Генетичний кодГенетичний код — набір правил розташування нуклеотидів в молекулі ДНК, що
надає всім живим організмам можливість кодування амінокислотної
послідовності білків за допомогою послідовності нуклеотидів.
• Триплетність — три послідовно
розміщені нуклеотиди (кодон)
кодують одну з 20 амінокислот.
• Безперервність — кодони не
розділяються між собою, тобто
інформація
зчитується
безперервно.
• Наявність
термінальних
кодонів — беззмістовних, або
стоп-кодонів, які не здатні
кодувати амінокислоти.
• Універсальність — єдиний генетичний код є, практично, однаковим в
організмах різного рівня складності
• Однонаправленість - є інформативним тільки в тому випадку, коли зчитується
"зліва направо".
• "Виродженість"- кожна АК кодується не 1 , а декількома кодонами.
90.
Компоненти білоксинтезуючої системи• Амінокислоти. 20 протеїногенних
амінокислот
• іРНК, що містить генетичний код для
синтезу білка. Вона служить матрицею,
яка направляє рибосоми під час
трансляції.
• тРНК. Кожну амінокислоту переносить
конкретна молекула тРНК. Молекули
тРНК транспортують амінокислоти до
рибосоми, забезпечуючи їх правильне
включення в ростучий поліпептидний
ланцюг.
• Рибосоми є складною молекулярною
системою синтезу білка.
• Джерела енергії. Енергія у вигляді АТФ
та ГТФ, необхідна для різних етапів
синтезу білка.
• Ферменти та Білкові Фактори
залучені в етапах ініціації, елонгації та
термінації синтезу поліпептидного
ланцюга.
91.
Активація амінокислот. АРСазиНеобхідною умовою синтезу білка є наявність в системі не вільних, а так званих
активованих амінокислот. Активація вільних амінокислот здійснюється за
допомогою специфічних ферментів - аміноацил-тРНК-синтетаз - у
присутності АТФ. Цей процес протікає в дві стадії: на першій стадії біосинтезу
білка, який відбувається в цитозолі клітини, 20 різних амінокислот приєднуються
ефірним зв’язком до відповідної тРНК. Ці процеси каталізуються 20 різними
аміноацил-тРНК синтетазами.
92.
Етапи трансляції (1) ініціаціяДля того щоб розпочати процес трансляції, нам потрібні
декілька ключових складових: рибосоми, іРНК, тРНК із
стартовою амінокислотою (практично завжди для еукаріотів
це метіонін - Met), фактори ініціації трансляції IF. Під час
ініціації ці компоненти повинні з'єднатися в точно визначений
спосіб. Разом вони формують комплекс ініціації – молекулярну
структуру, необхідну для початку синтезу нового білка.
У клітинах еукаріотів, ініціація трансляції відбувається
наступним чином: спочатку тРНК з метіоніном приєднується до
малої субодиниці рибосоми. Разом вони зв'язуються з 5'-кінцем
іРНК, розпізнавши кеп-залишок з 5' кінця. Потім вони
"пересуваються" вздовж іРНК у напрямку 3', зупиняючись, коли
досягають стартового кодону (зазвичай це перший AUG).
В еукаріотів відомо близько 10 білкових факторів ініціації (еlF-2elF-10). еlF забезпечують розпізнавання ділянки на молекулі
мРНК, до якої приєднується метіоніл-тРНК, зв’язуючись з
вільною малою субодиницею рибосоми і перешкоджають
асоціації малої і великої субодиниць без молекули мРНК;
сприяють зв’язуванню ініціаторної метіоніл-тРНК з комплексом
30S субодиниць і мРНК, контролюють об’єднання субодиниць
субодиниць після того, як на першій субодиниці вже присутні
ініціюючі кодони мРНК та метіоніл-тРНК
93.
Етапи трансляції (2) елонгаціяПерша тРНК (з метіоніном) зв'язана з іРНК пересувається
по рибосомі до P-сайту (пептидильного). Поруч, в сайті A
(аміноацильному),
з’являється
новий
кодон.
Для
включення аміноацил-тРНК в А-сайт використовується енергія
гідролізу молекули ГТФ на ГДФ і неорганічний фосфат. Сайт A
слугує "посадочним майданчиком" для наступної тРНК,
комплементарної відповідному кодону іРНК.
Коли відповідна тРНК звязується з А-сайтом дві сусідні
амінокислоти взаємодіють з утворенням пептидного зв'язку
за участі пептидилтрансферази. На цьому етапі Met з
першої тРНК передається на амінокислоту другого тРНК на
A-сайті. Таким чином утворюється дипептид, де з кінця
розташований метіонін.
Після того, як утворено пептидний зв'язок, іРНК на один
кодон просувається через рибосому (транслокація).
Транслокація також потребує енергії гідролізу молекули
ГТФ. До транслокації задіяний фактор еЕF-2. Зсув іРНК
дозволяє першій, порожній тРНК вийти через сайт E
("вихід"). Також новий кодон з'являється на сайті A і цикл
повторюється.
94.
Етапи трансляції (3) термінаціяТрансляція закінчується в процесі, який
називається
термінацією.
Термінація
відбувається, коли стоп-кодон (нонсенс-кодон) в
іРНК (UAA, UAG або UGA) потрапляє на сайт A.
Стоп-кодони впізнаються факторами термінації або
релізинг-факторами. Рилізінг-фактор еRF розпізнає
всі три стоп-кодони та індукує звільнення
синтезованого поліпептиду діючи на
пептидилтрансферазу. Після того, як нонсенс-кодон
мРНК займає своє місце в А-сайті рибосоми, до
нього приєднується не тРНК, оскільки відсутні
відповідні антикодони тРНК, що розпізнають цей
термінальний сигнал, а один з релізинг-факторів, що
блокує подальшу елонгацію і зумовлює вивільнення
новосинтезованого поліпептидного ланцюга.
Вважають, що кодони термінації та релізинг-фактори індукують зміну
специфічності пептидилтрансферазної активності таким чином, що вона
каталізує перенесення пептидного ланцюга швидше до молекули води,
викликаючи гідроліз, ніж до аміногрупи амінокислоти.
95. Антибіотики – інгібітори трансляції
96. Антибіотики – інгібітори трансляції
Дифтерійнийтоксин,
що
виробляється
клітинами
Corinebacterium diphteriae– білок,
побудований
з
одного
поліпептидного
ланцюга,
в
організмі
людини
розщеплюється на два фрагменти. А –
фрагмент є ферментом АДФ –
рибозилтрансферазою, каталізує реакцію АДФ-рибозилювання
еЕF-2, за рахунок перенесення
АДФ – рибозильного залишка з
НАД на фактор елонгації еЕF-2.
Модифікований таким чином
еЕF-2 втрачає свою здатність
приймати участь у транслокації
рибосоми
і
трансляція
припиняється. Фрагмент В не
має ферментативної активності і
не токсичний, але необхідний
для проникнення фрагменту В
всередину клітини.
97. https://www.youtube.com/watch?v=qIwrhUrvX-k
98.
Дякую Вамза увагу!

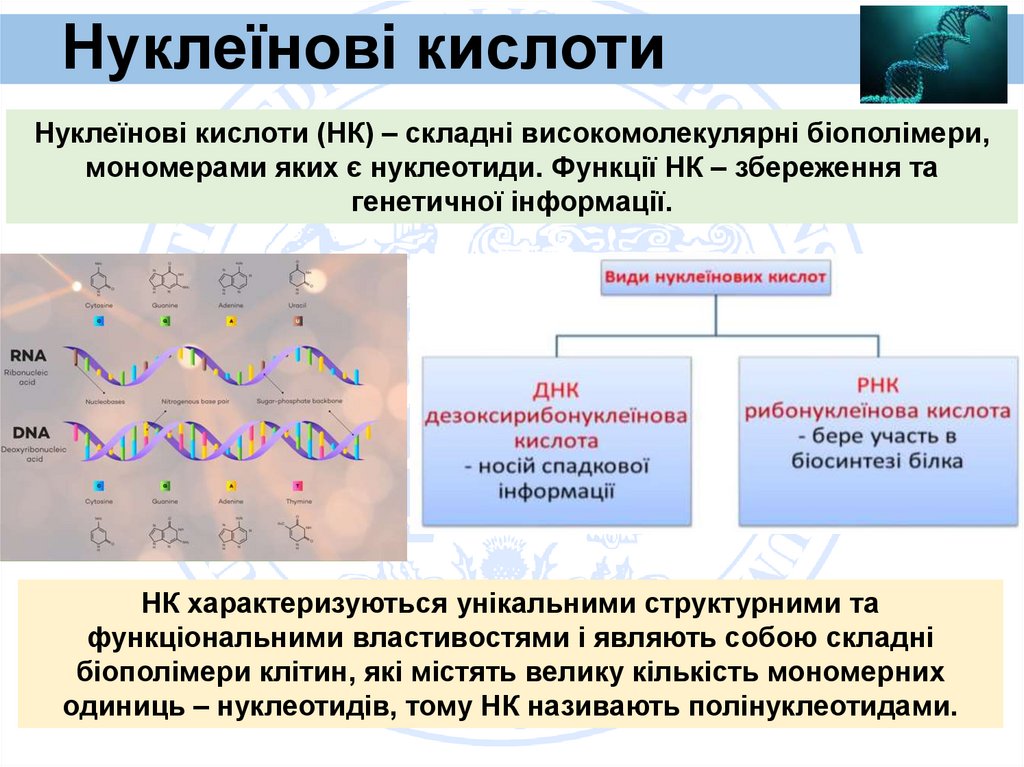
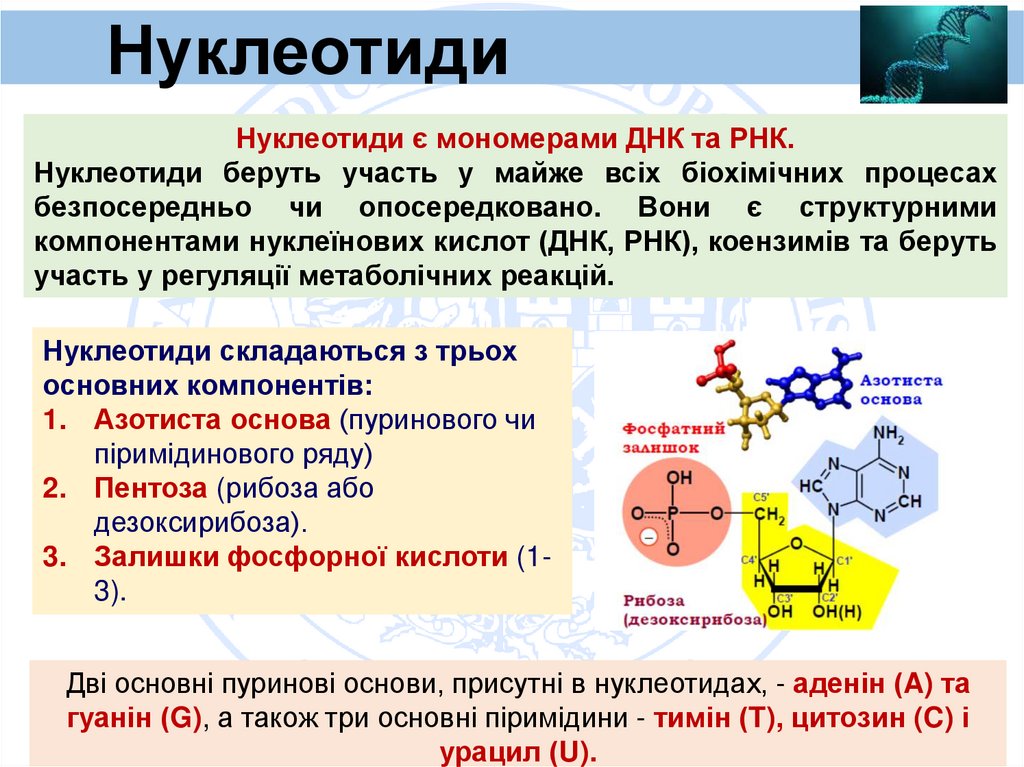
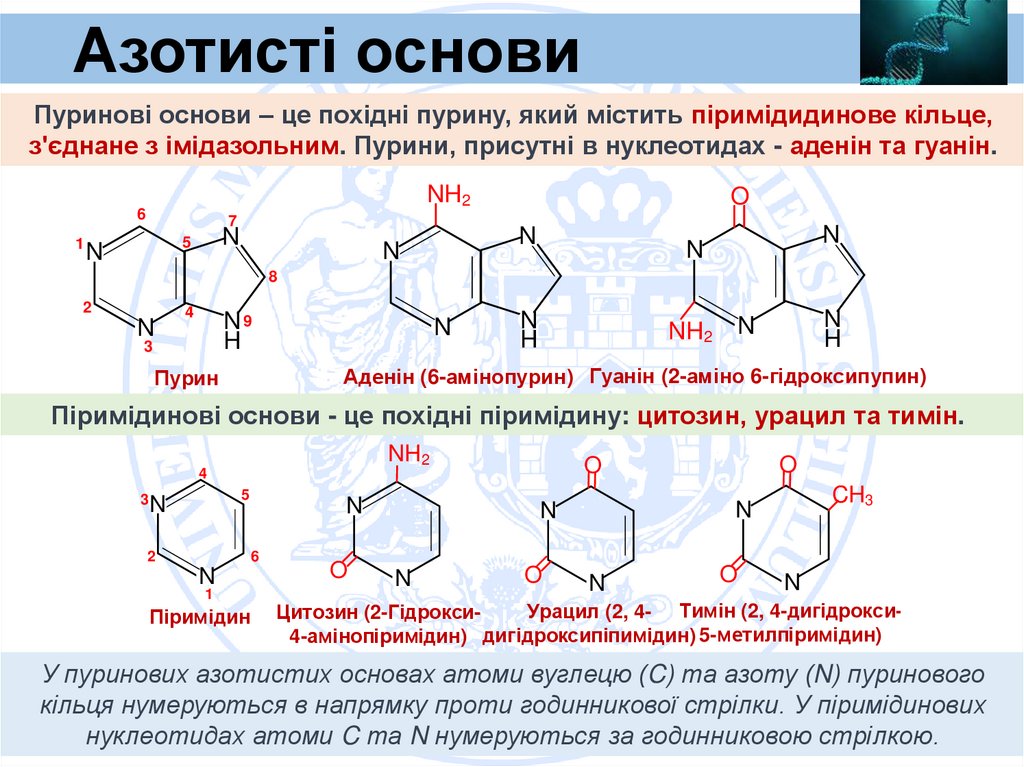
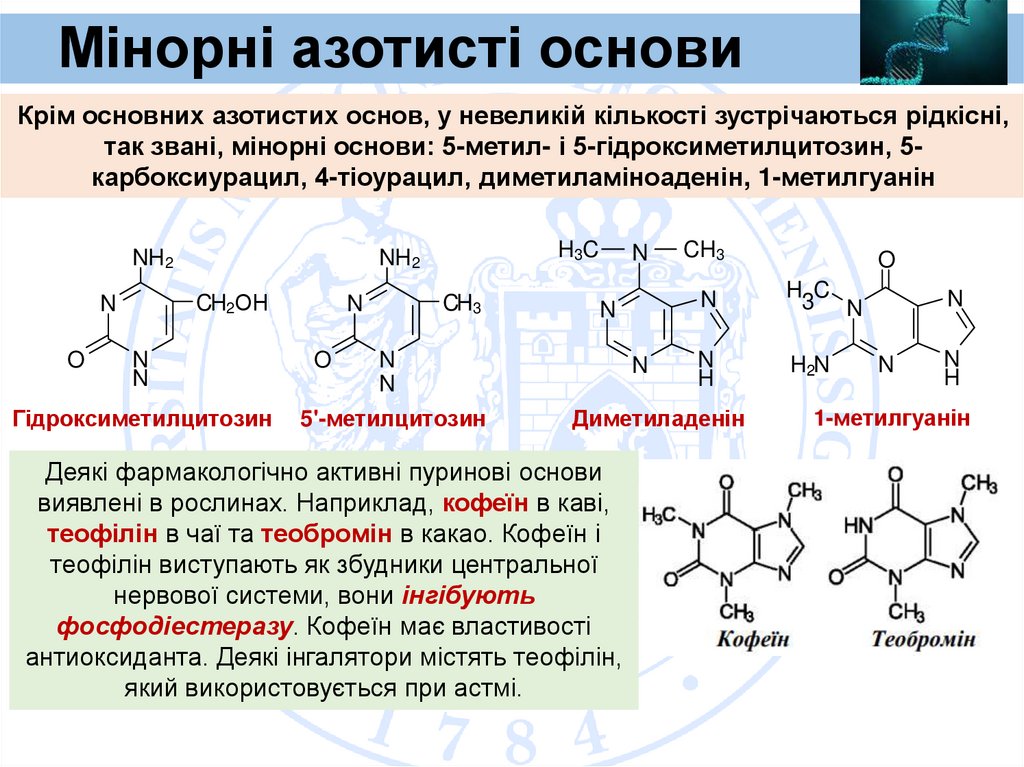
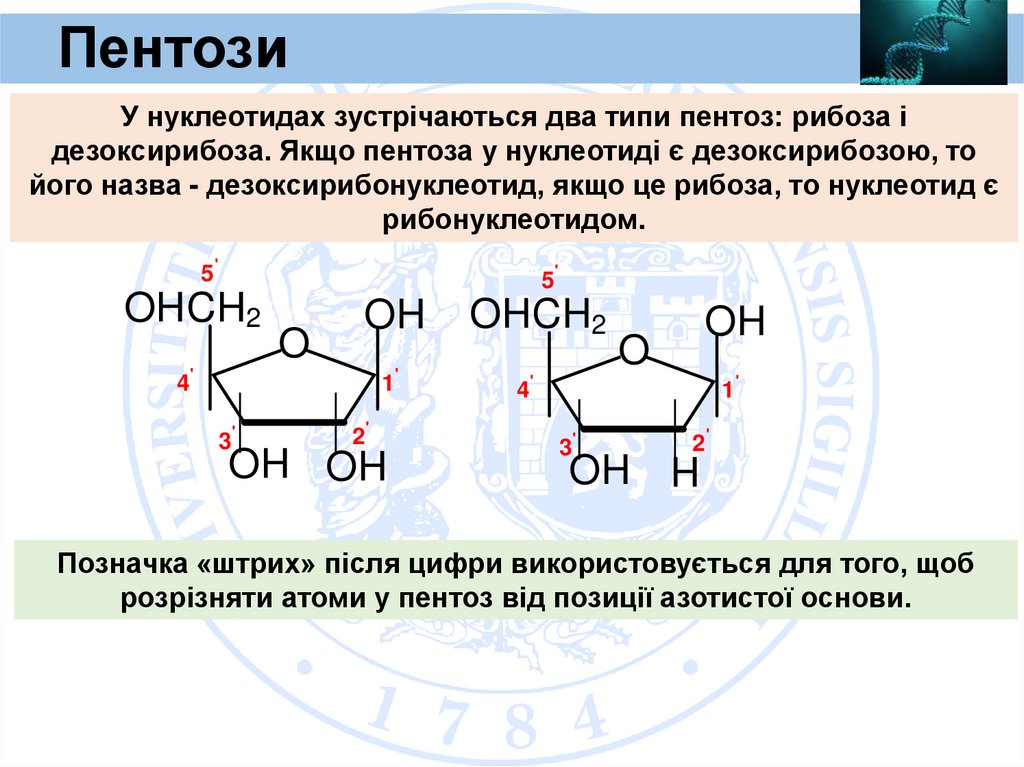
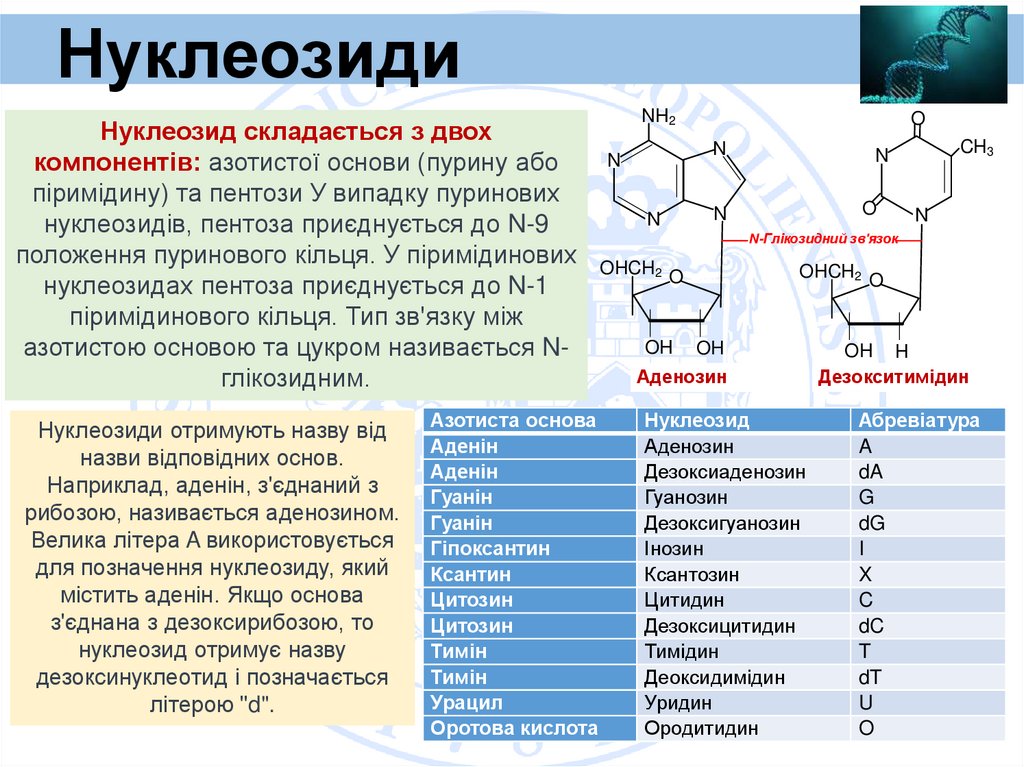
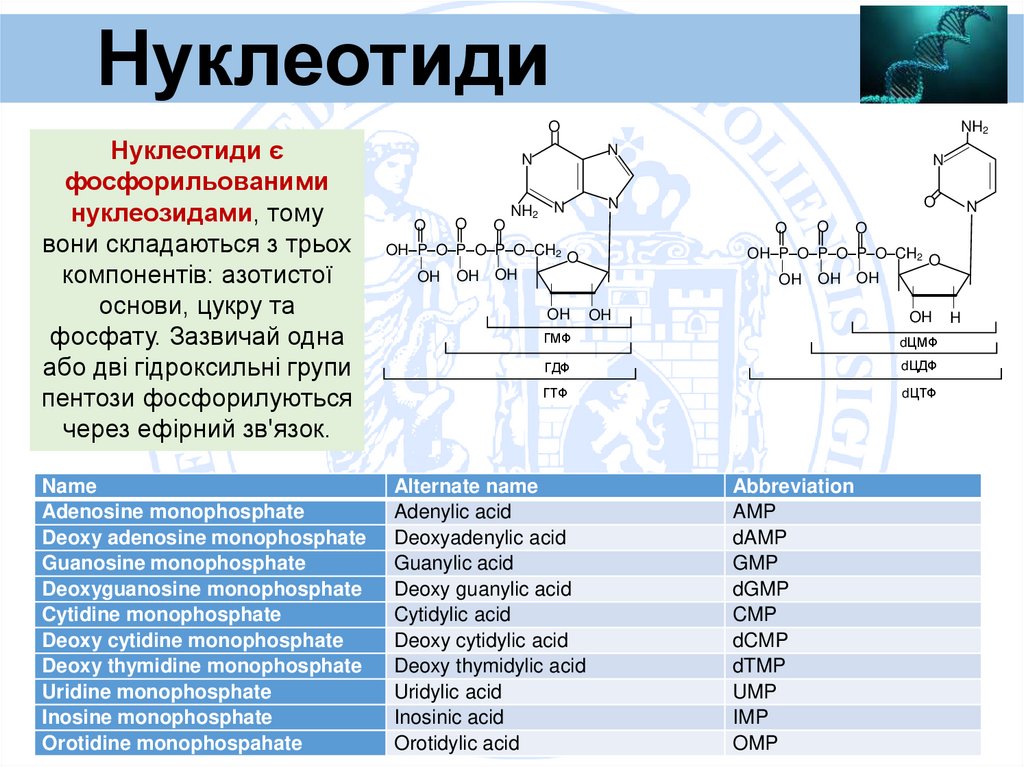
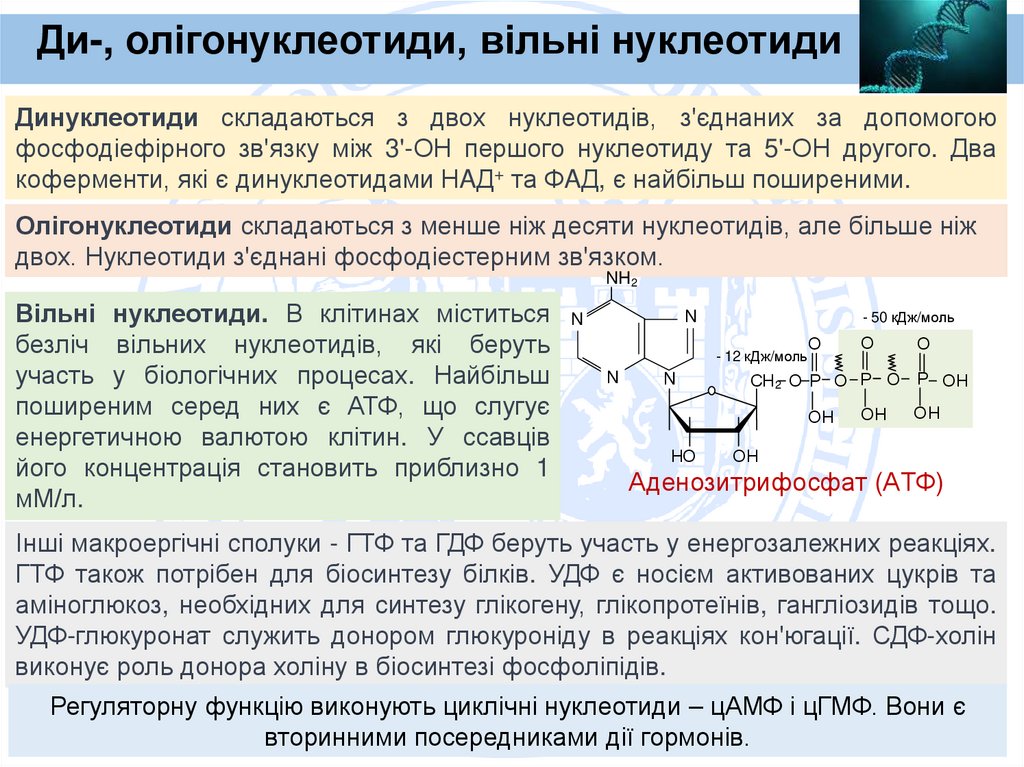
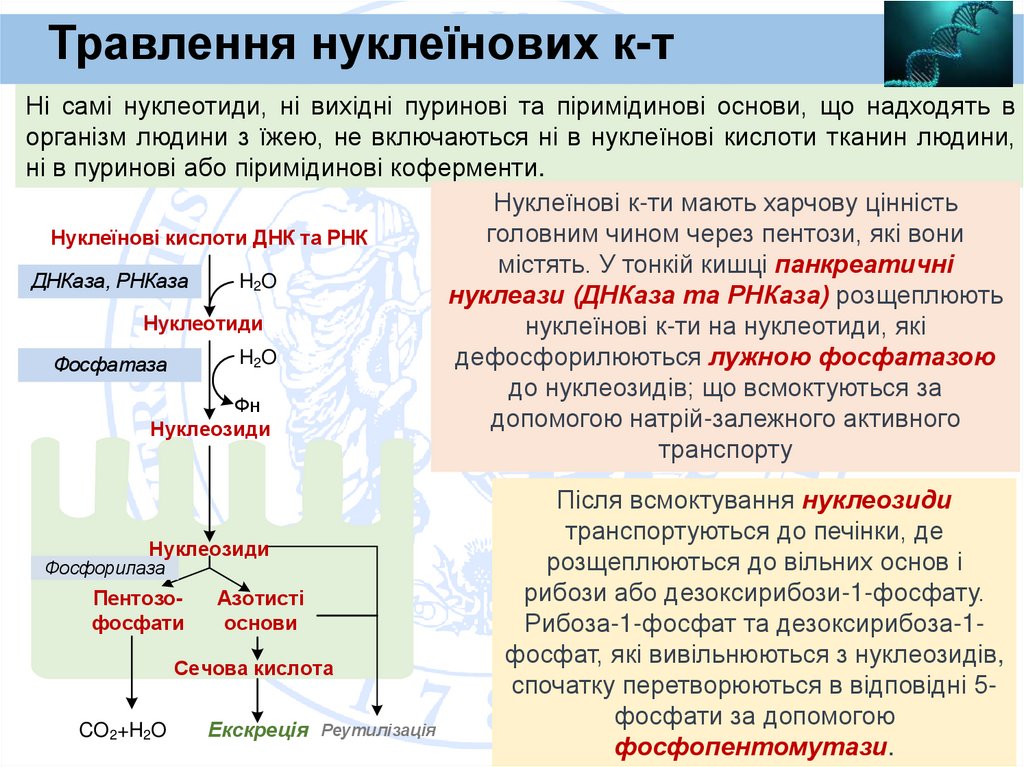
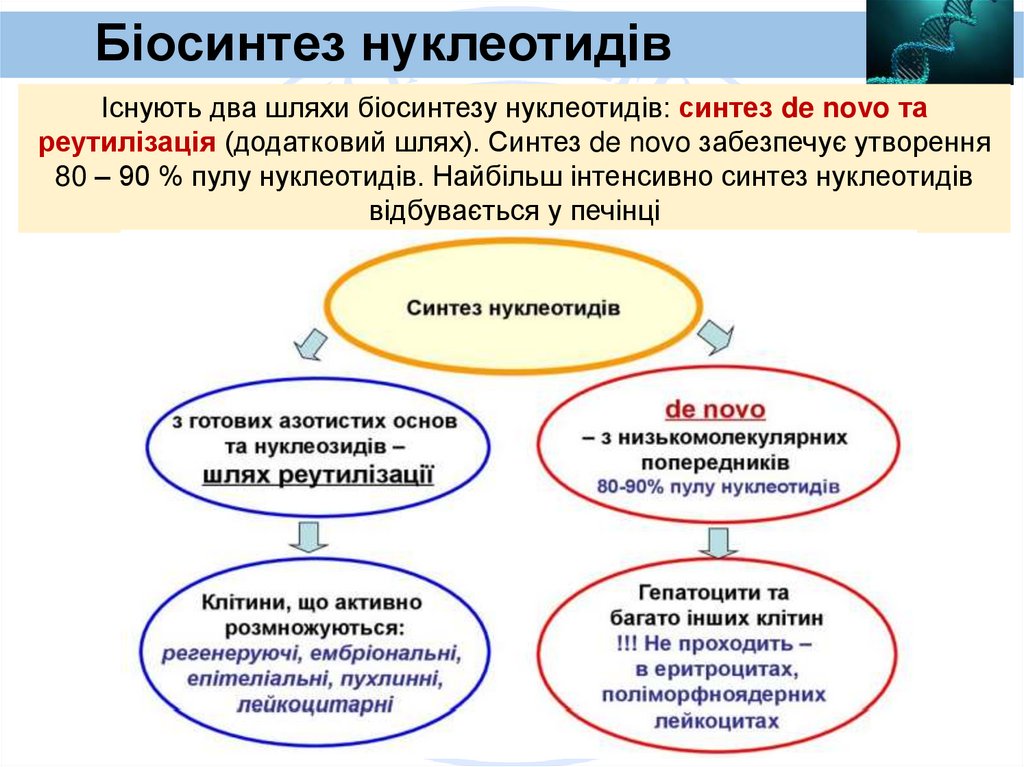
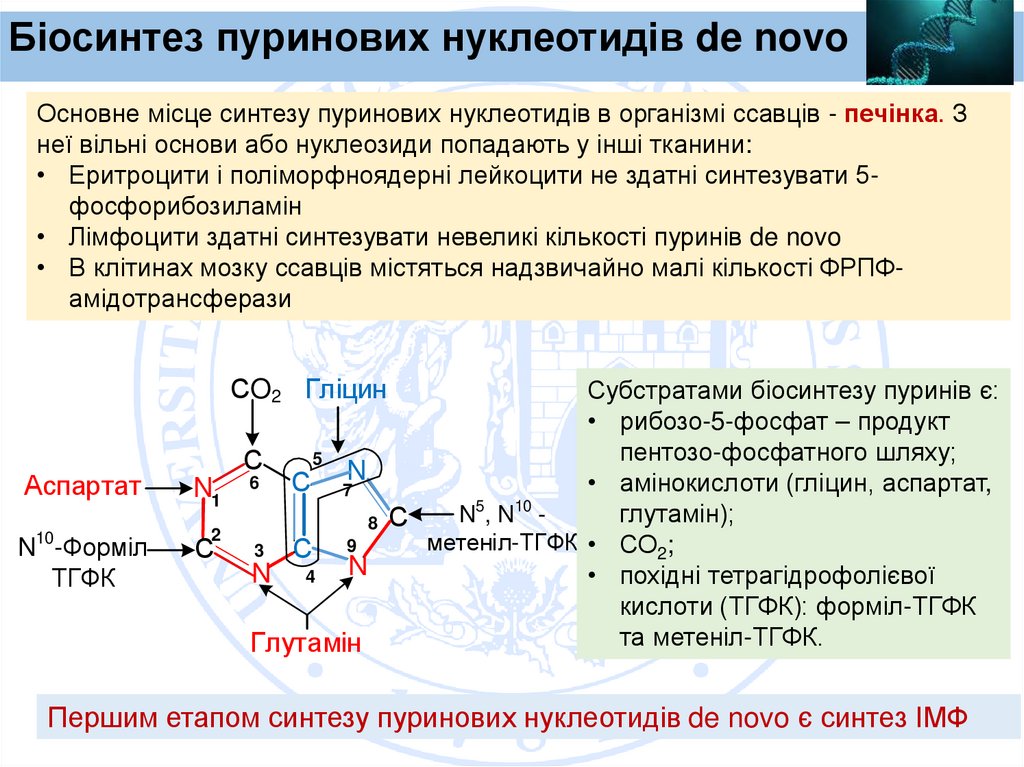
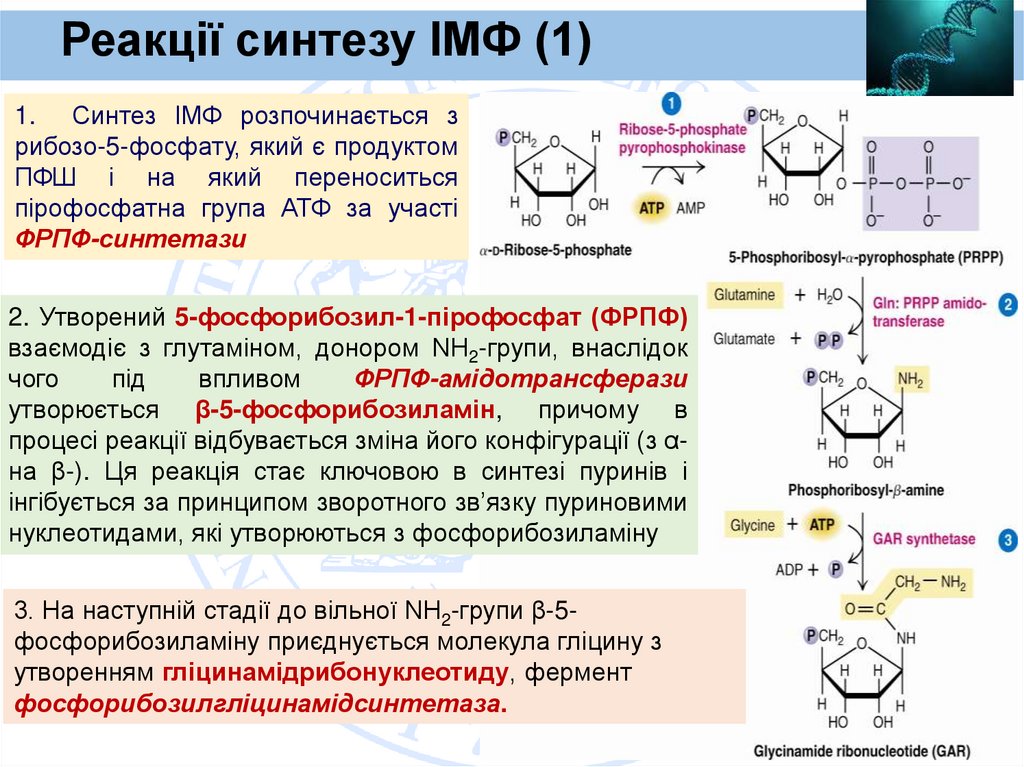
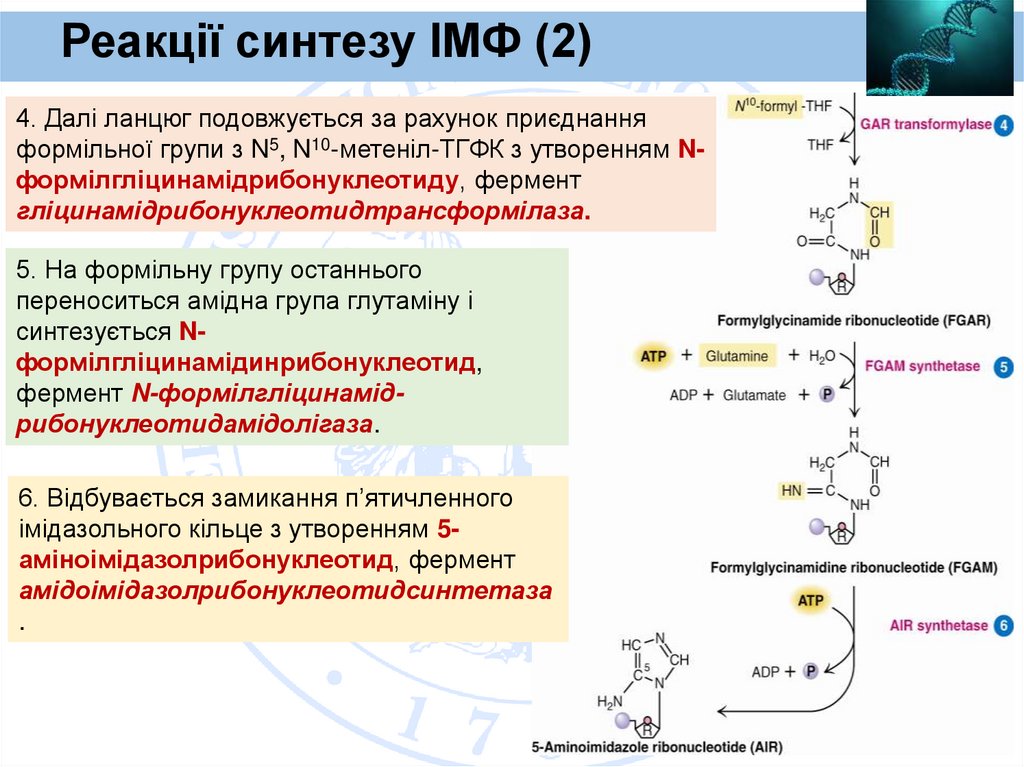
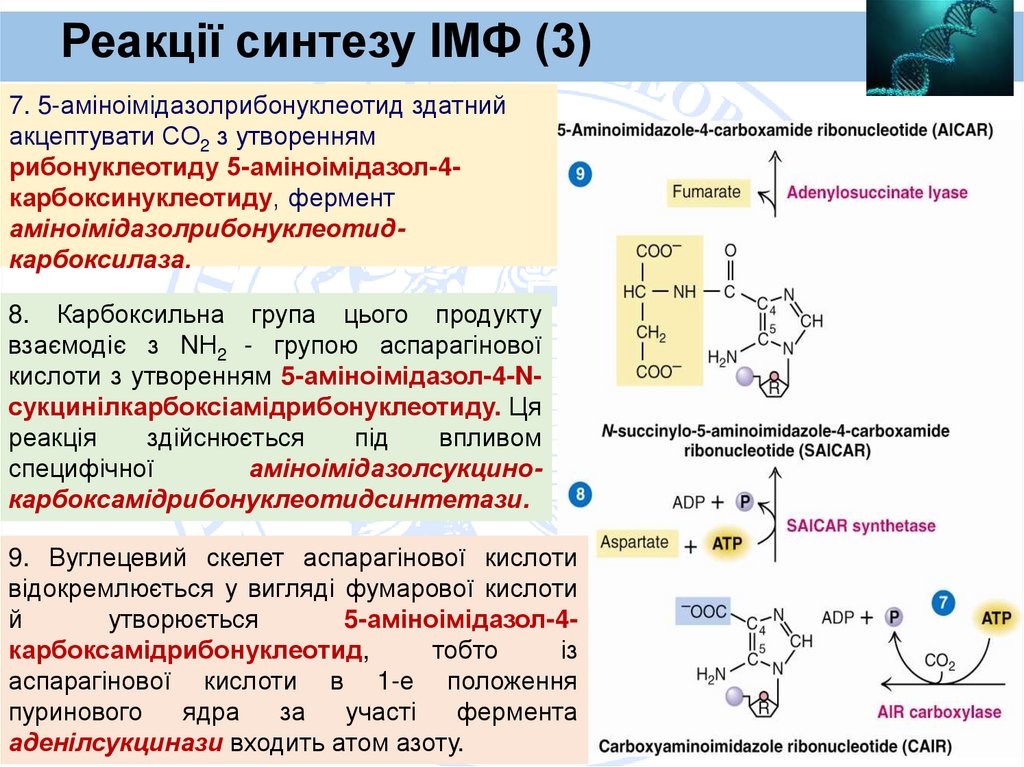
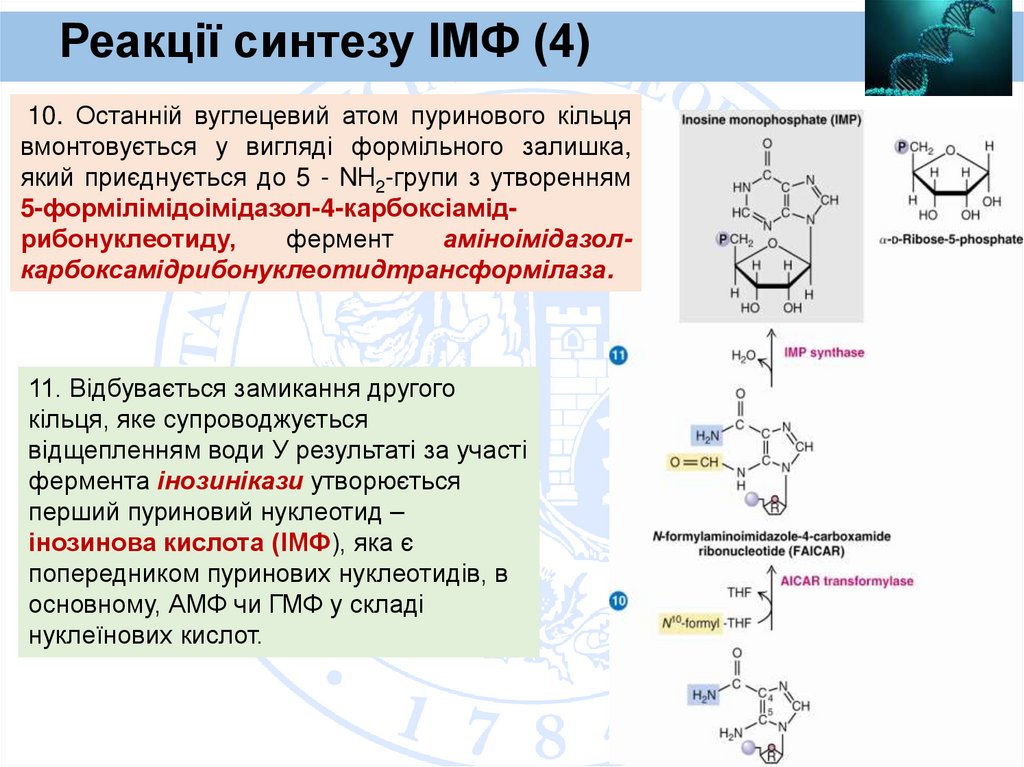
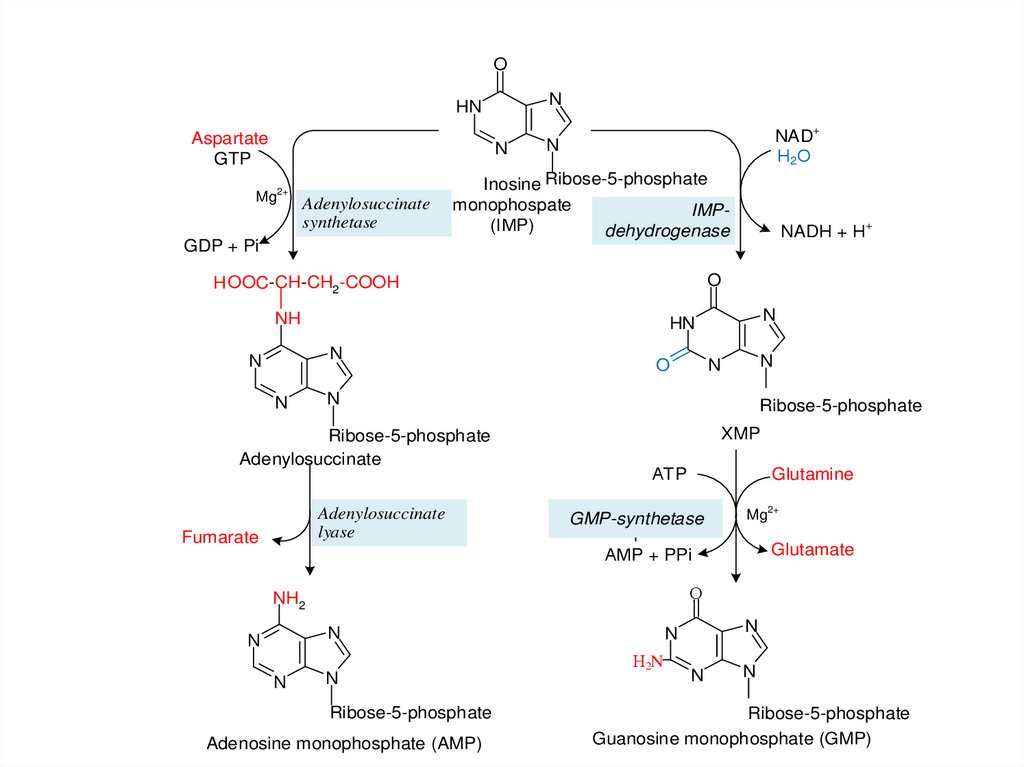
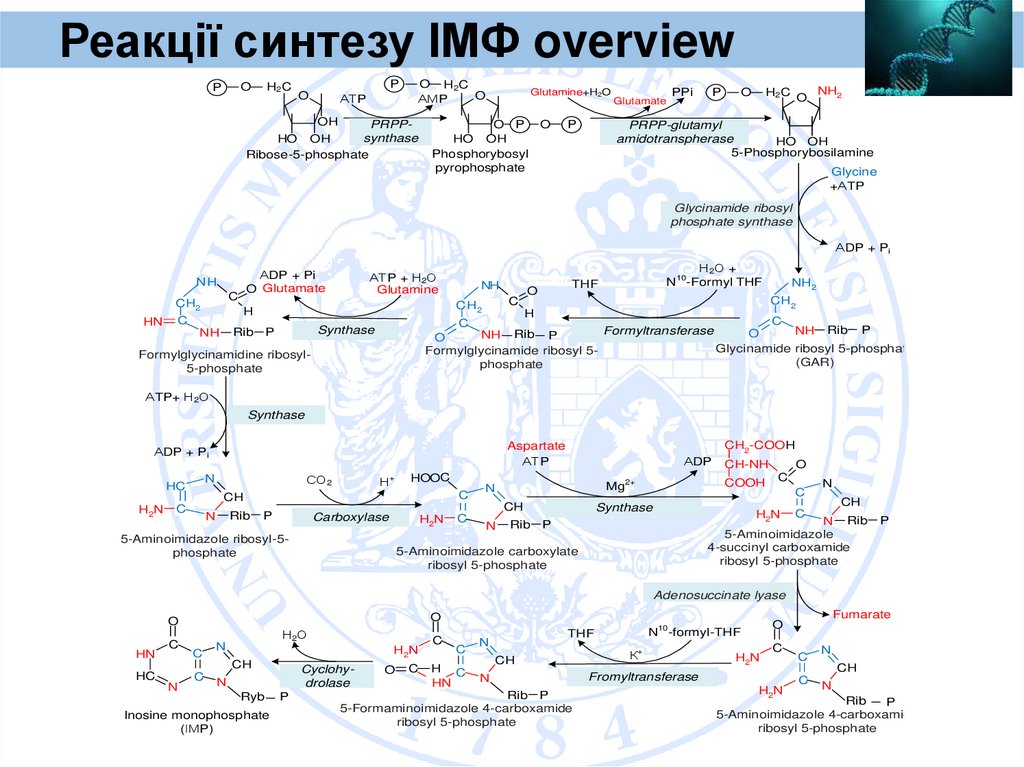
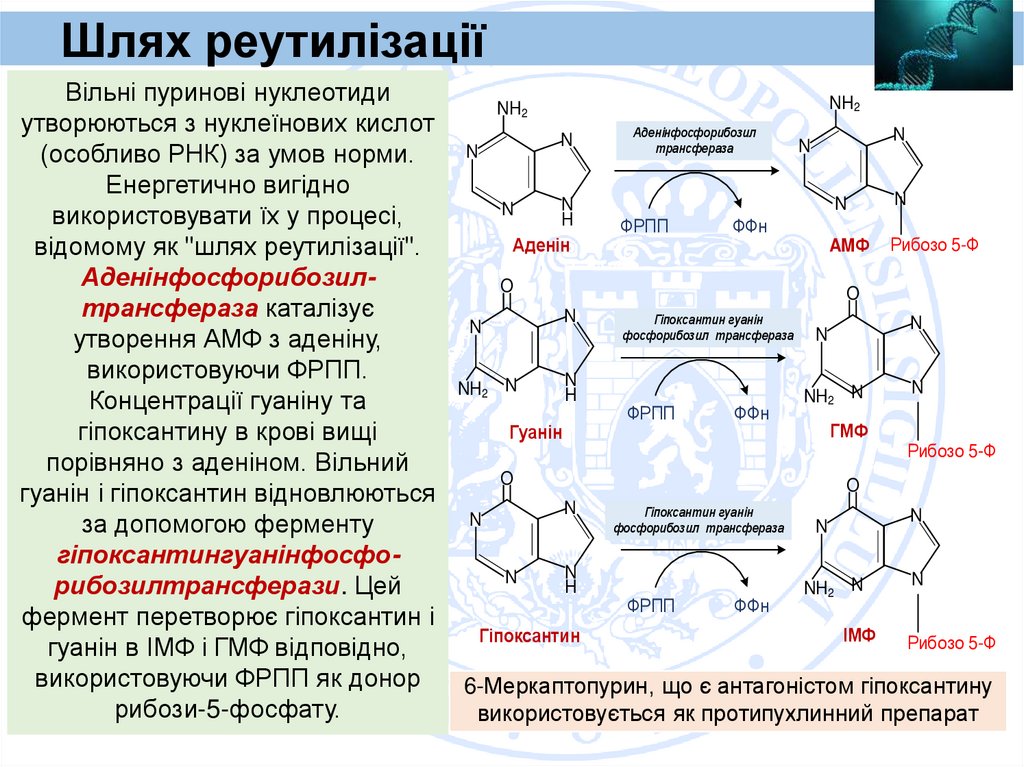
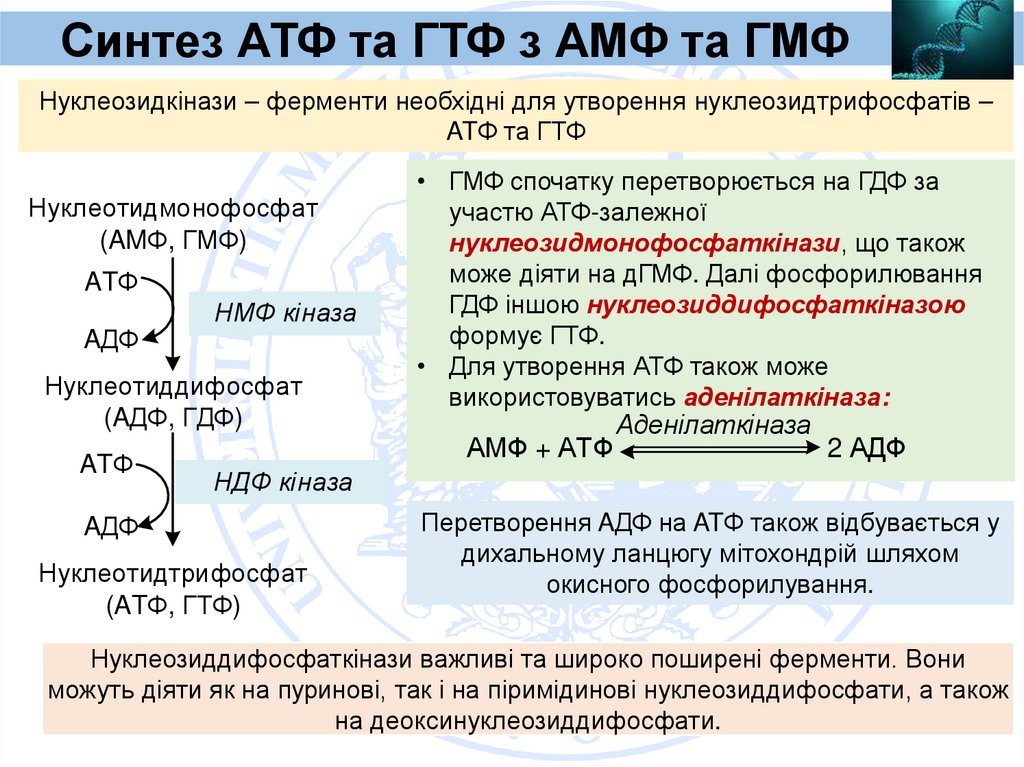
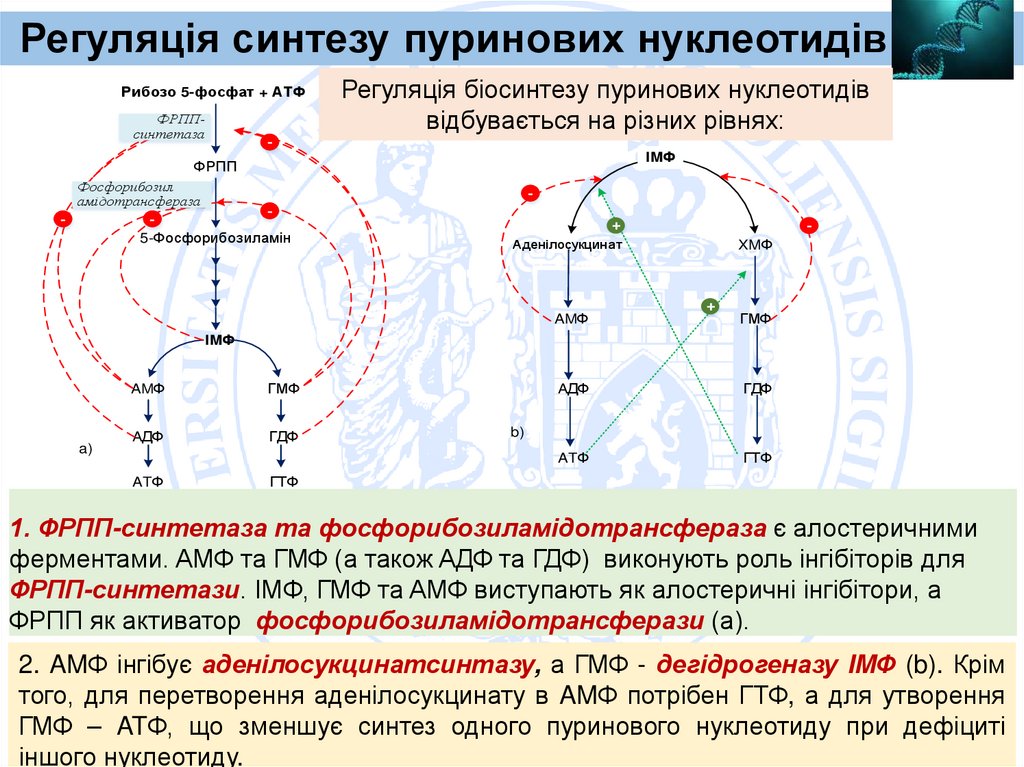
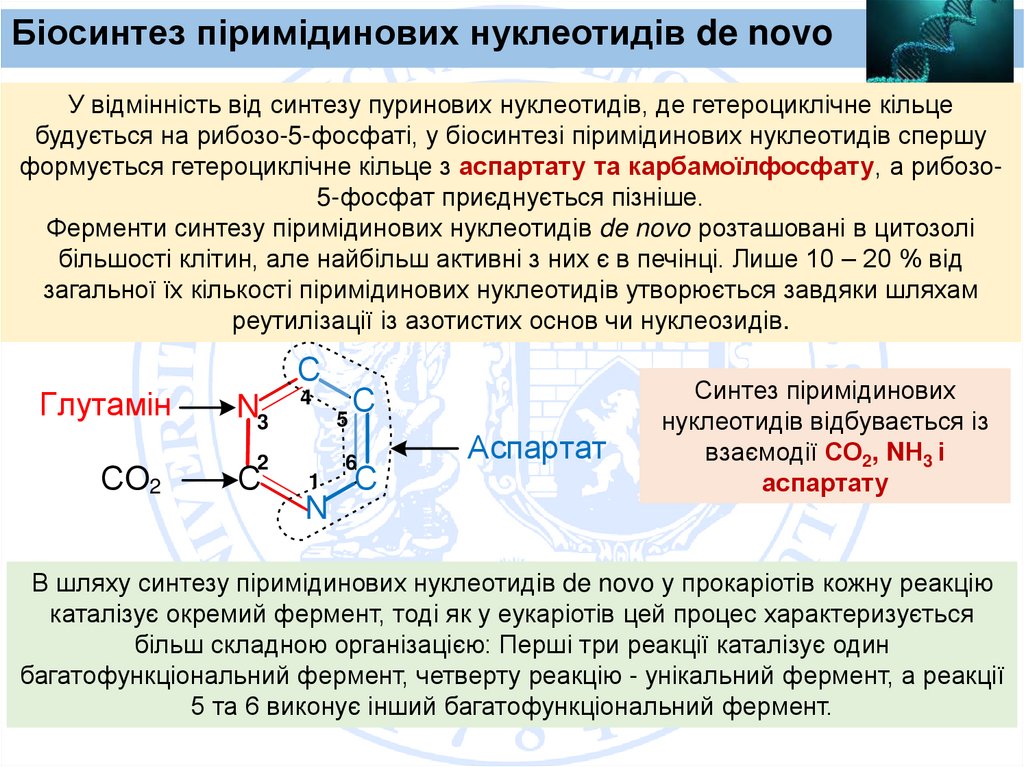

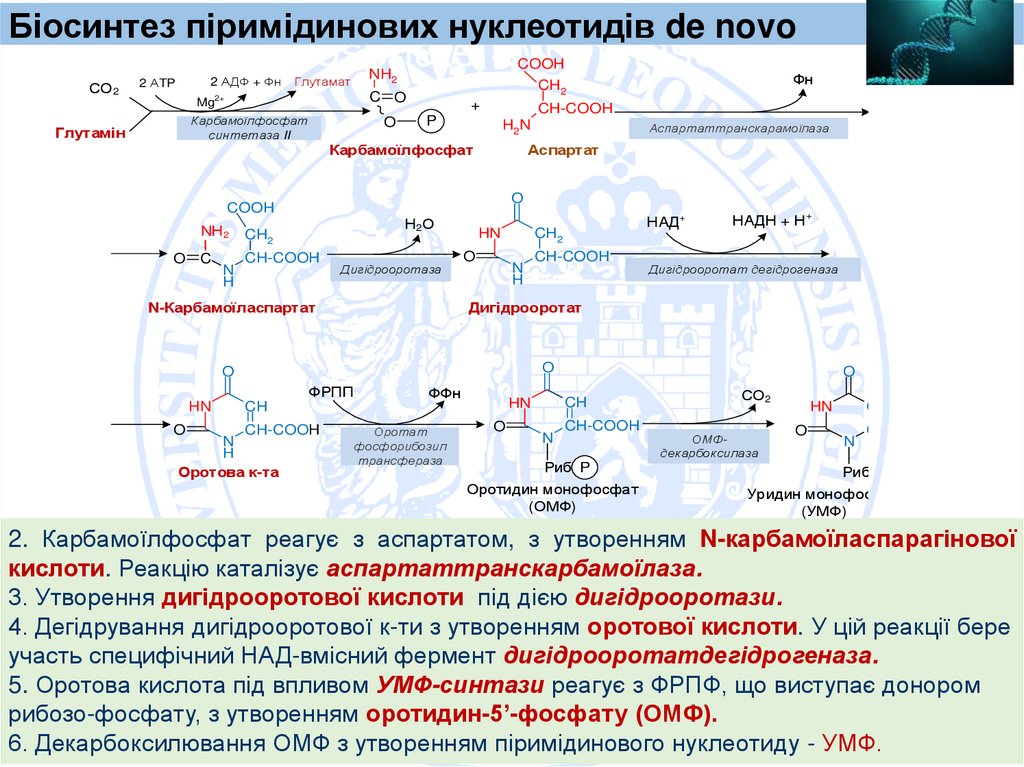
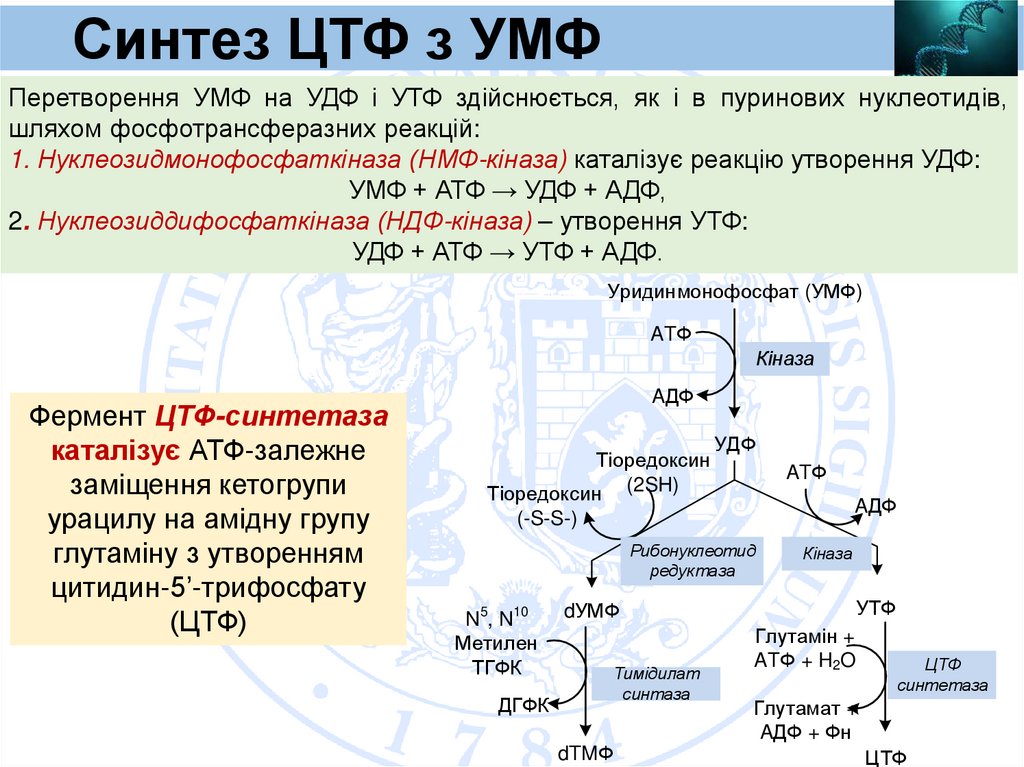
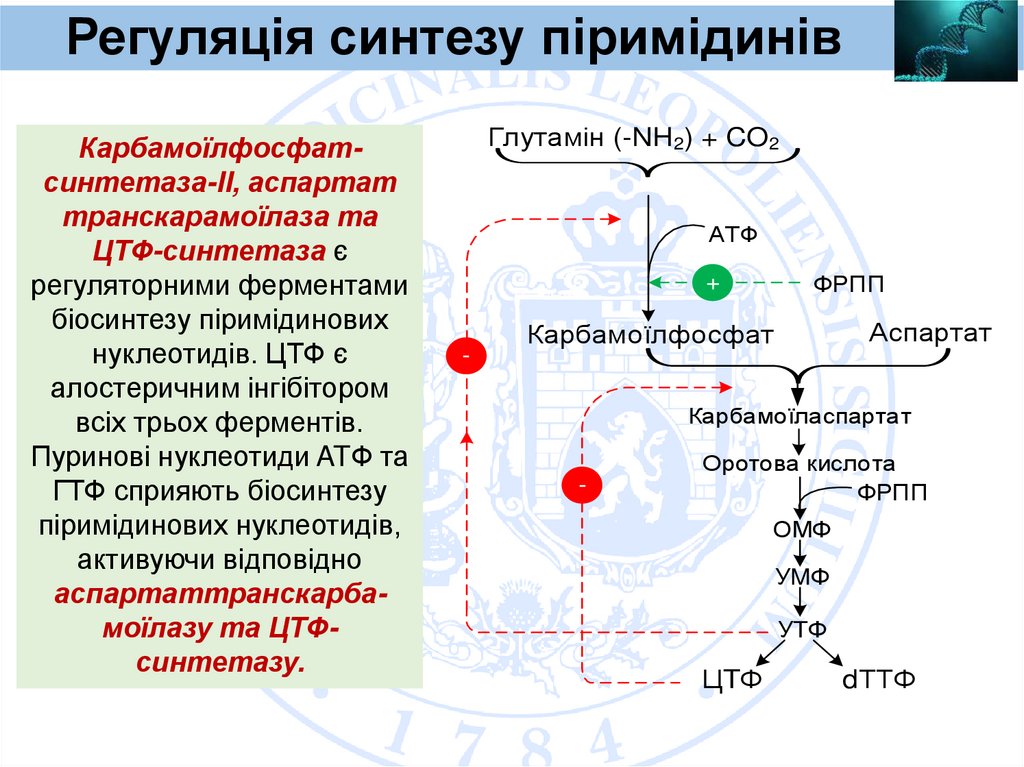
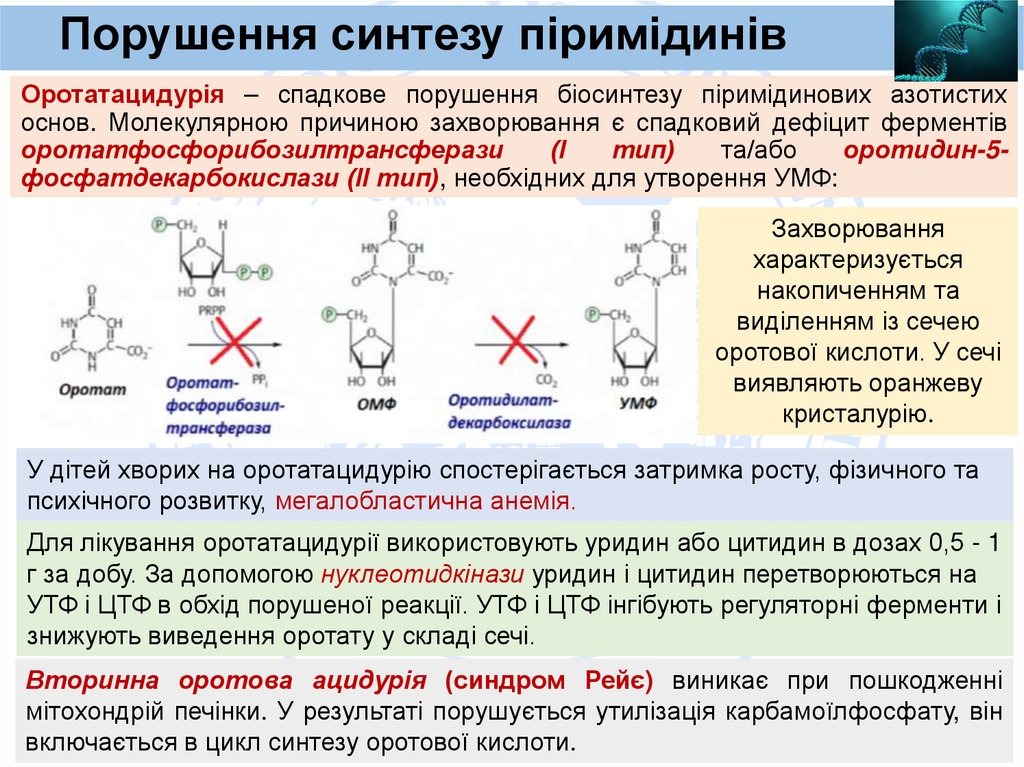
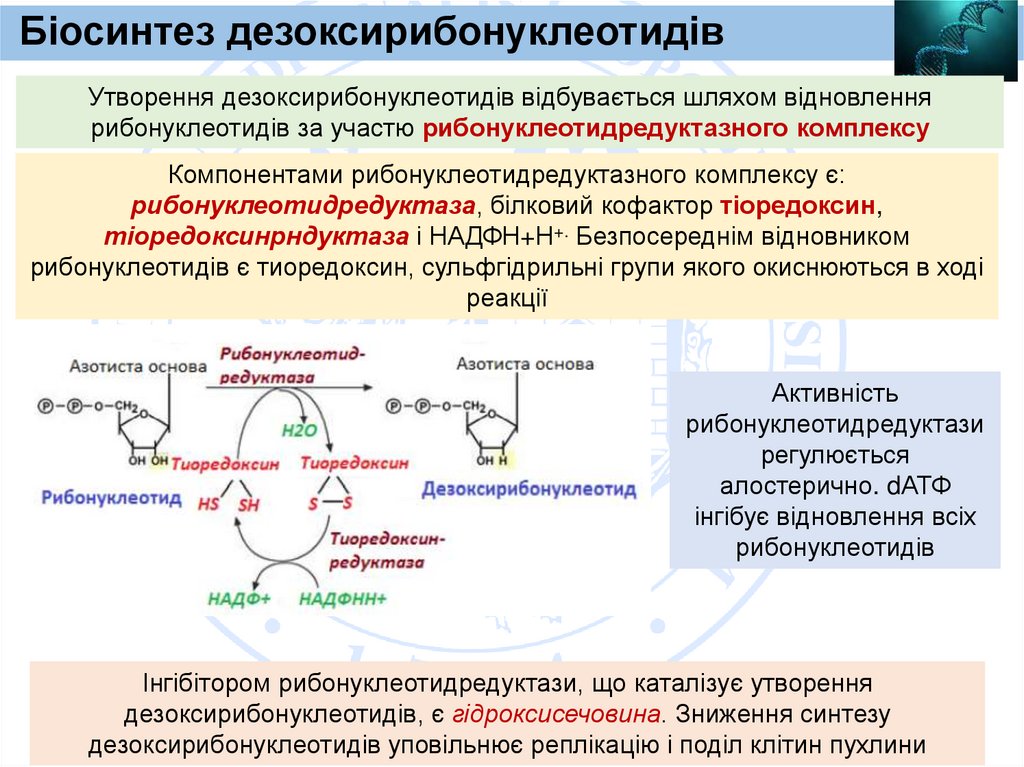
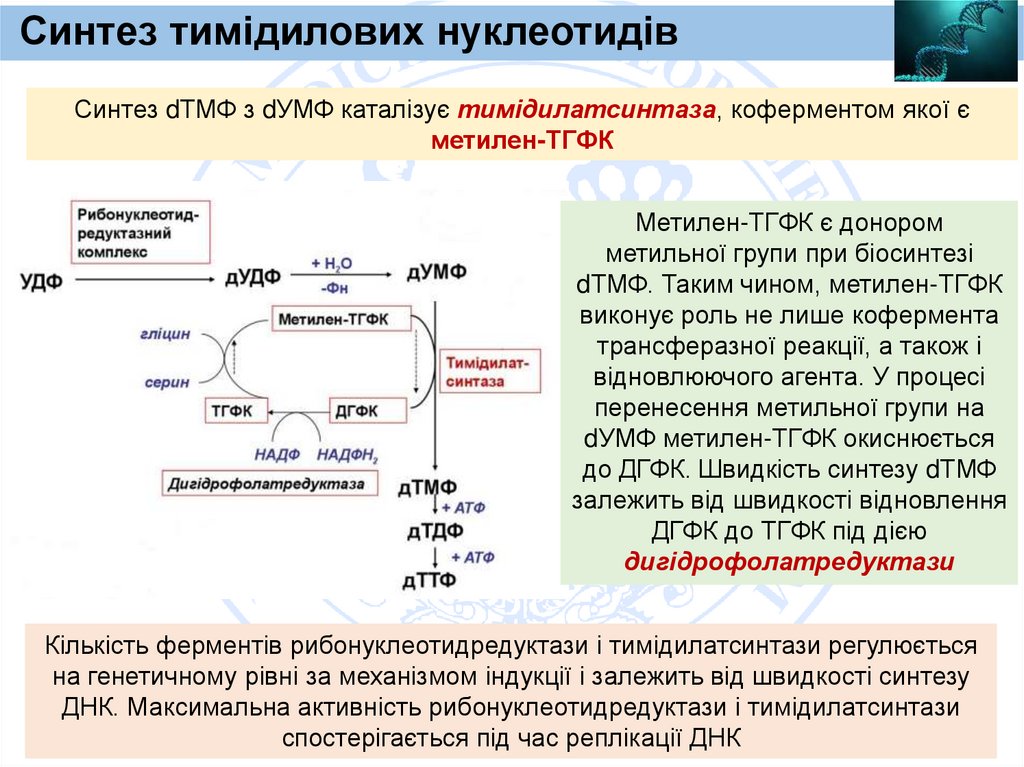
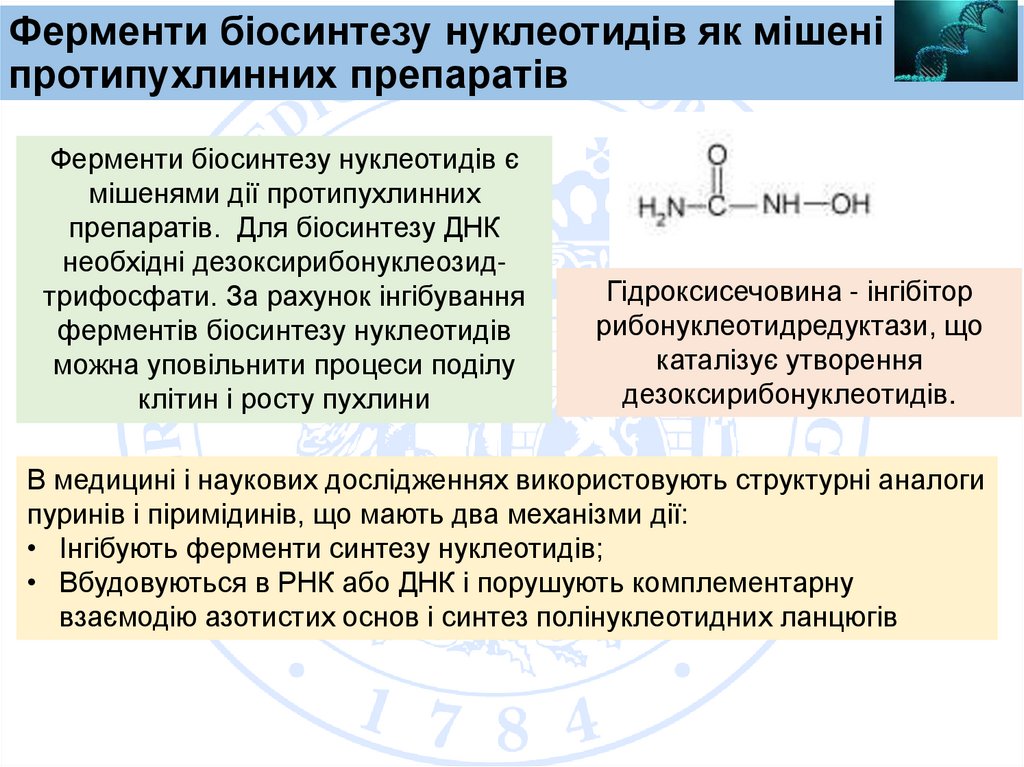
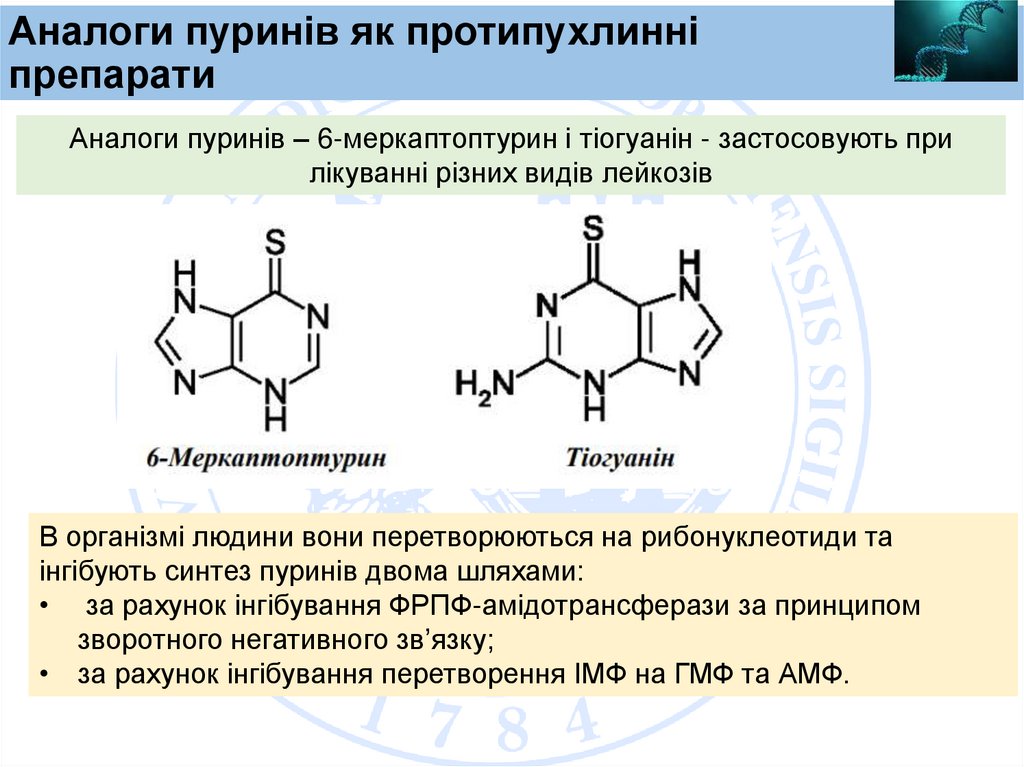
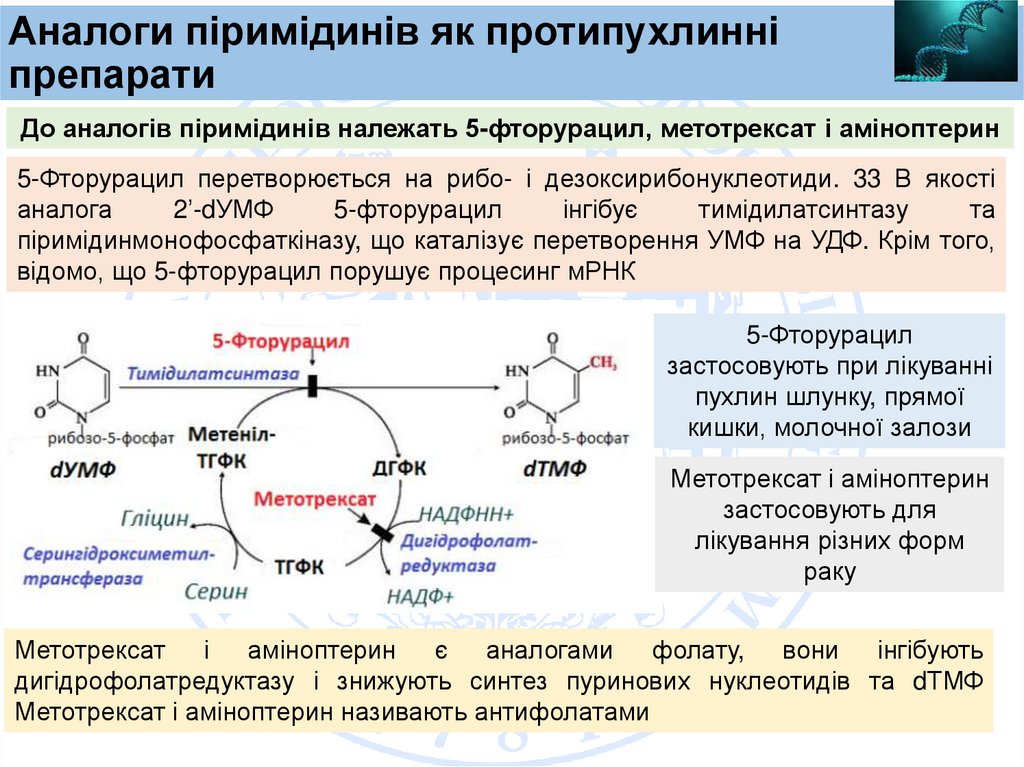
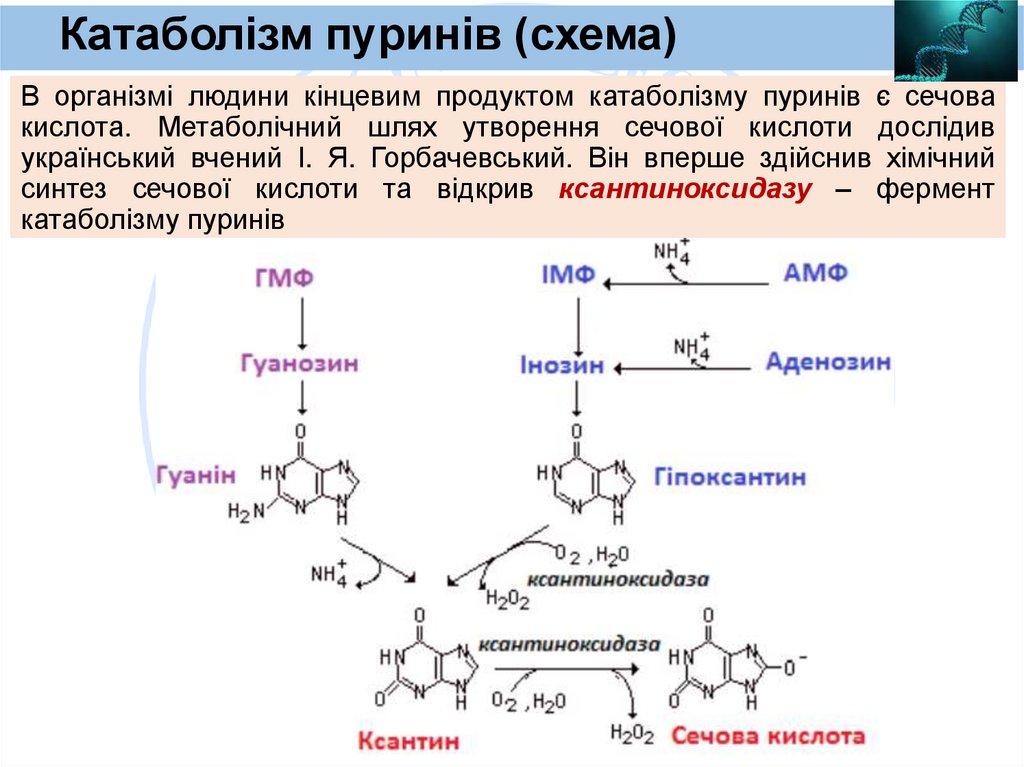
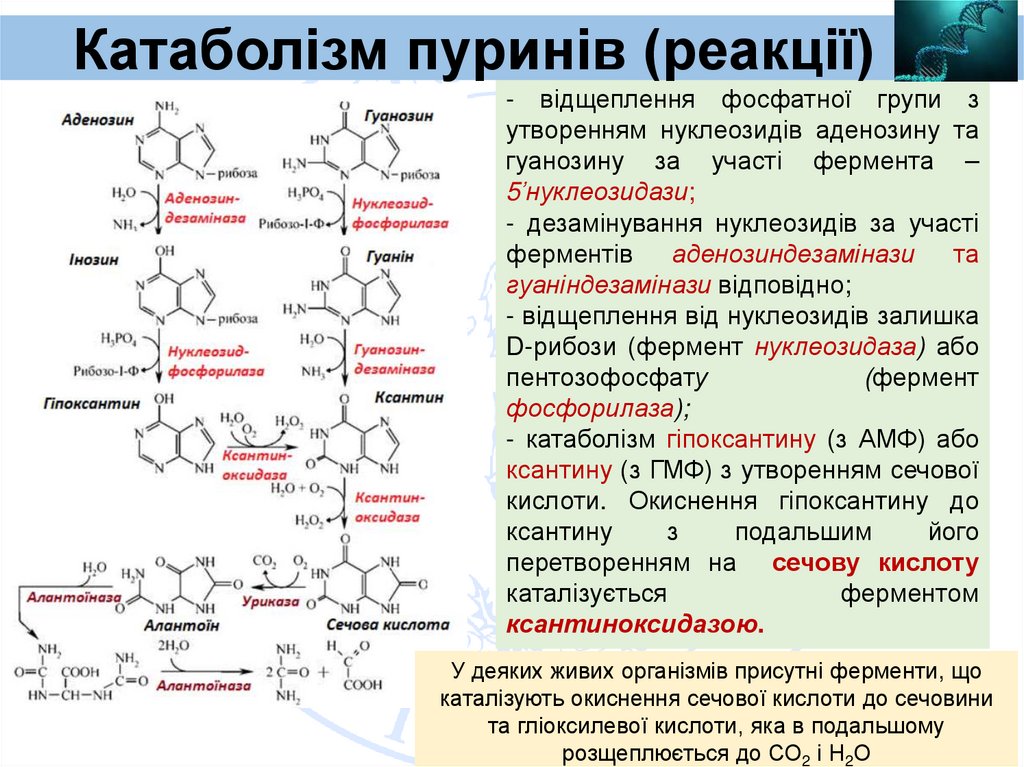

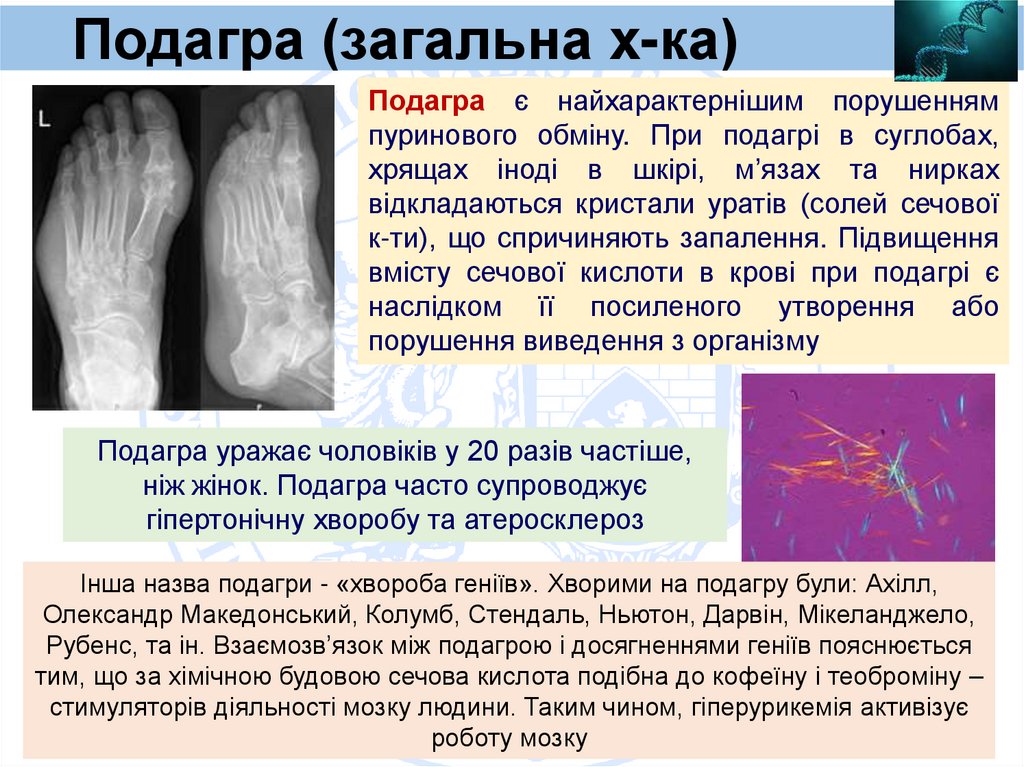

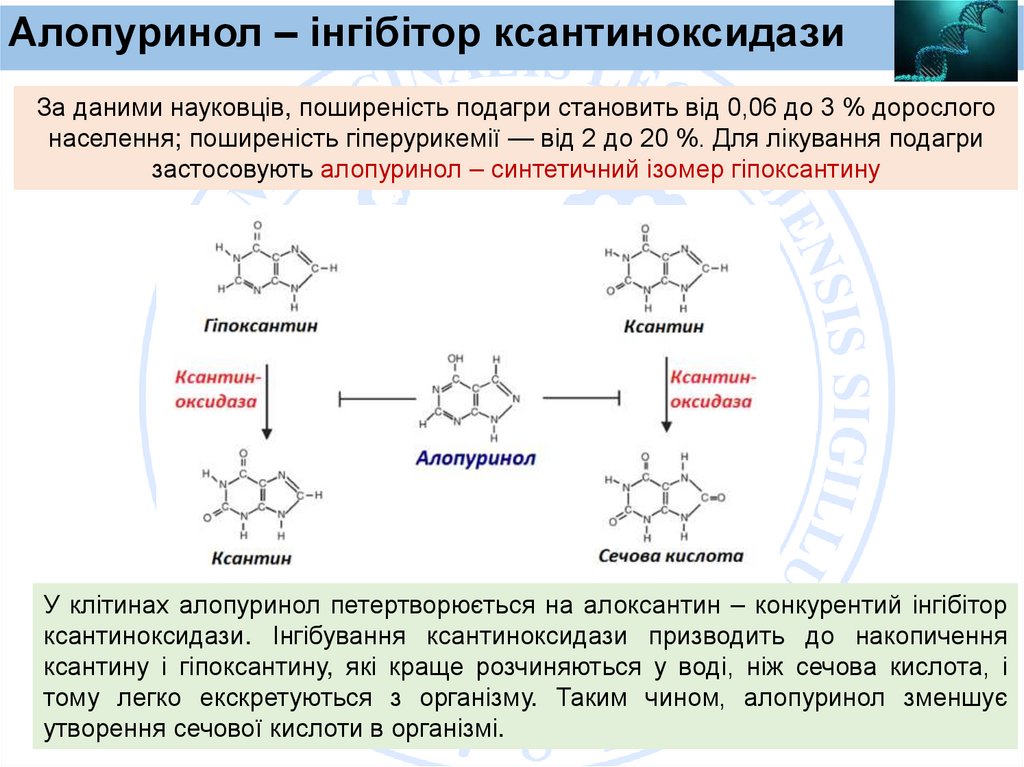

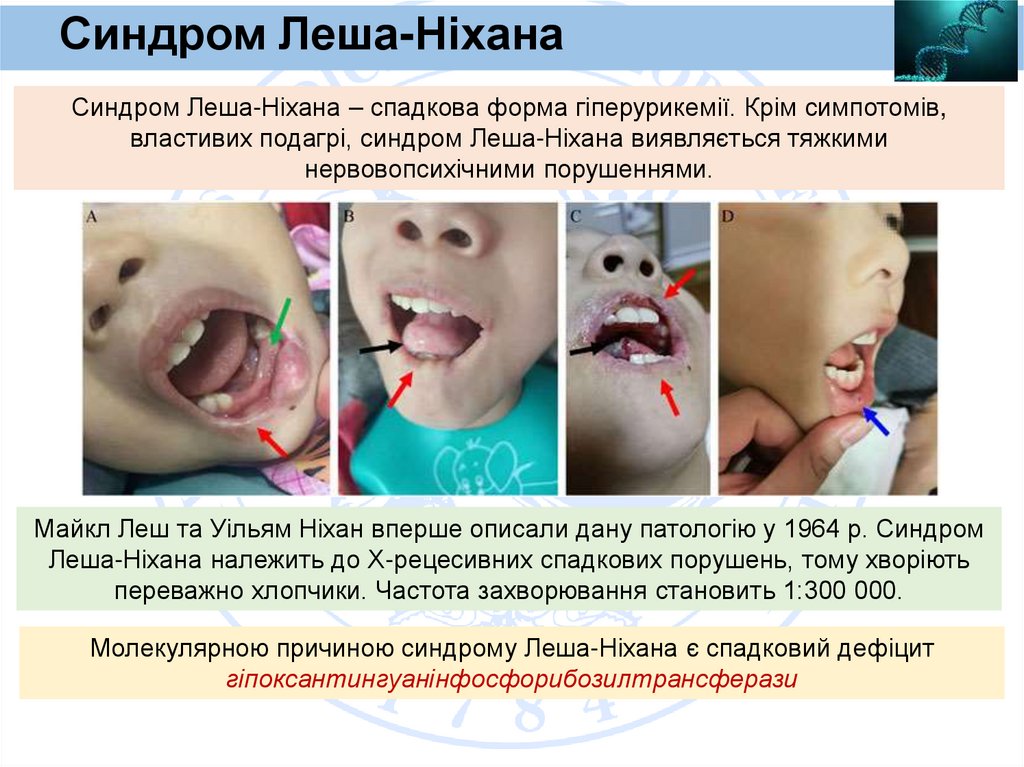
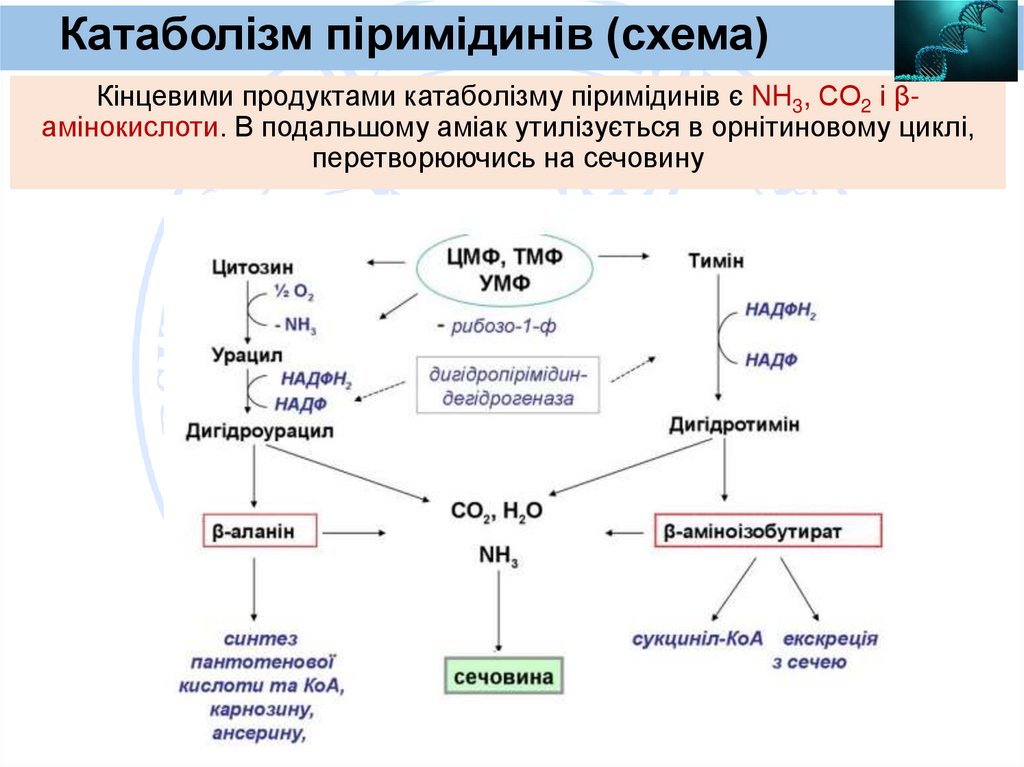
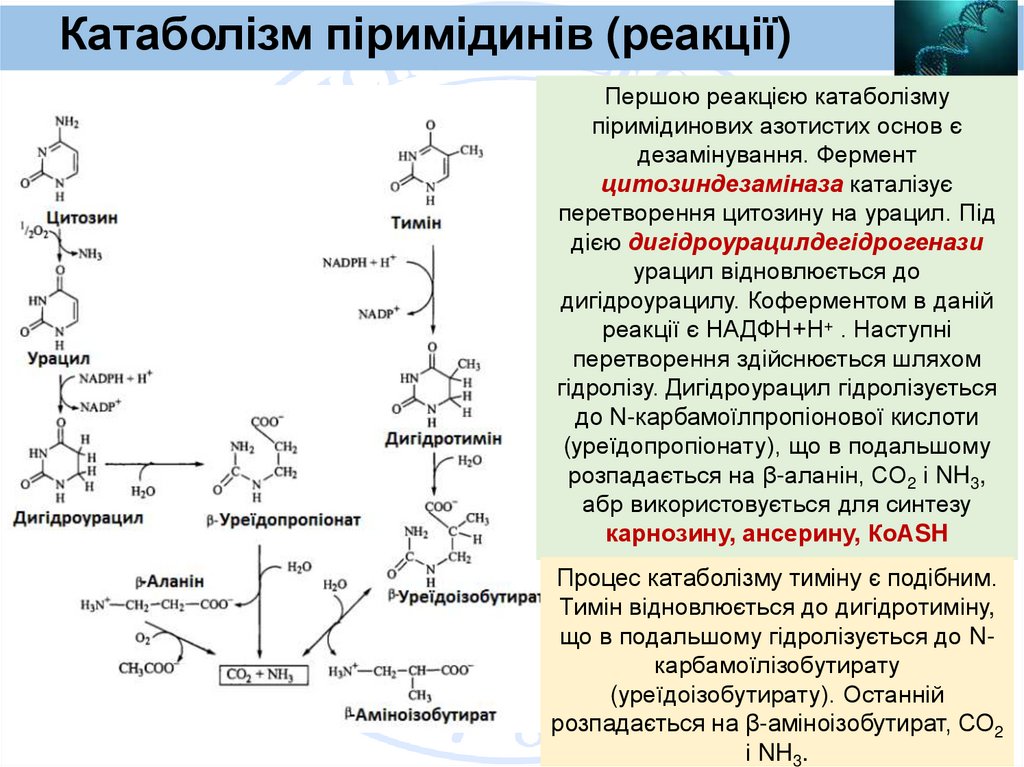
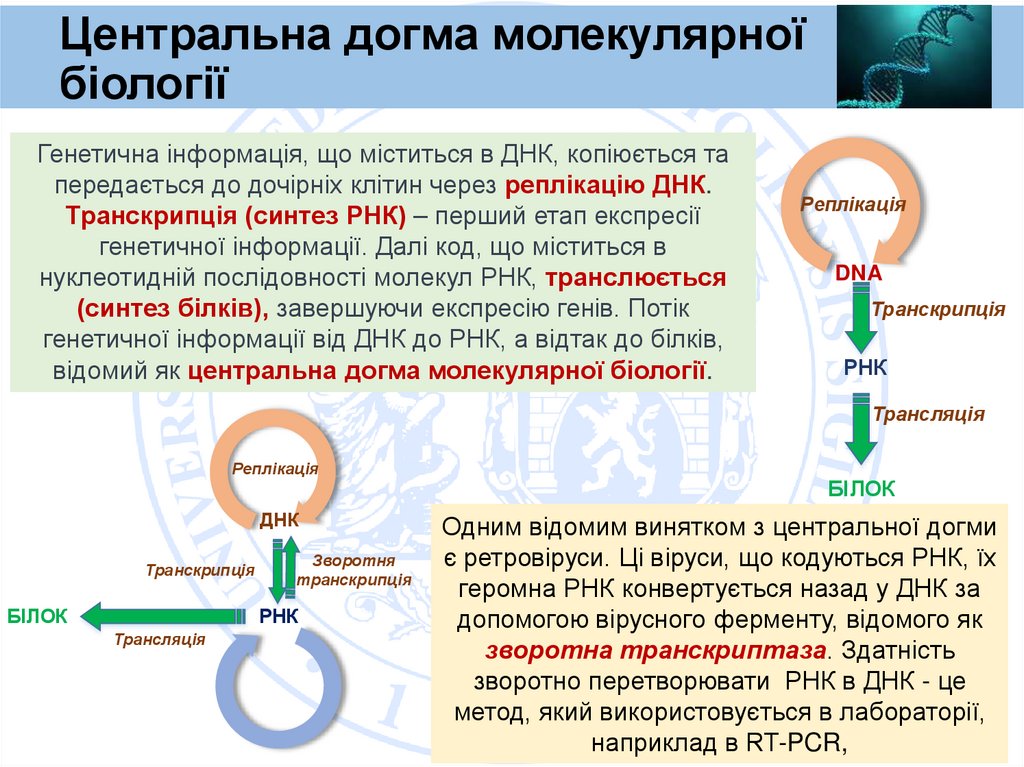
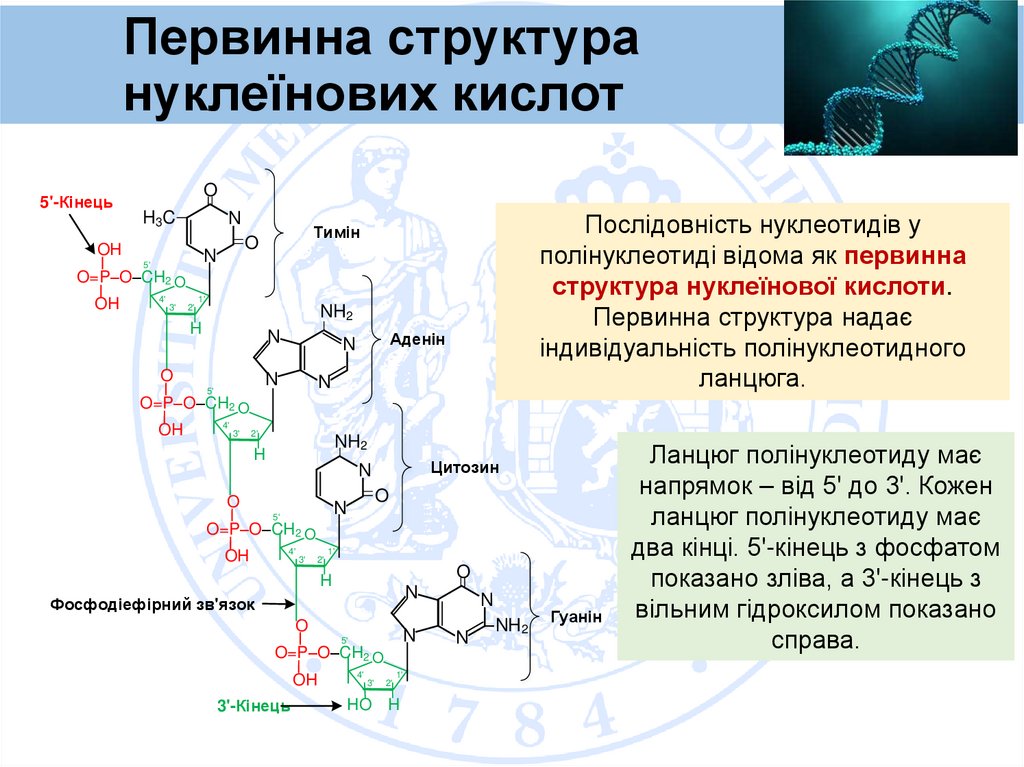
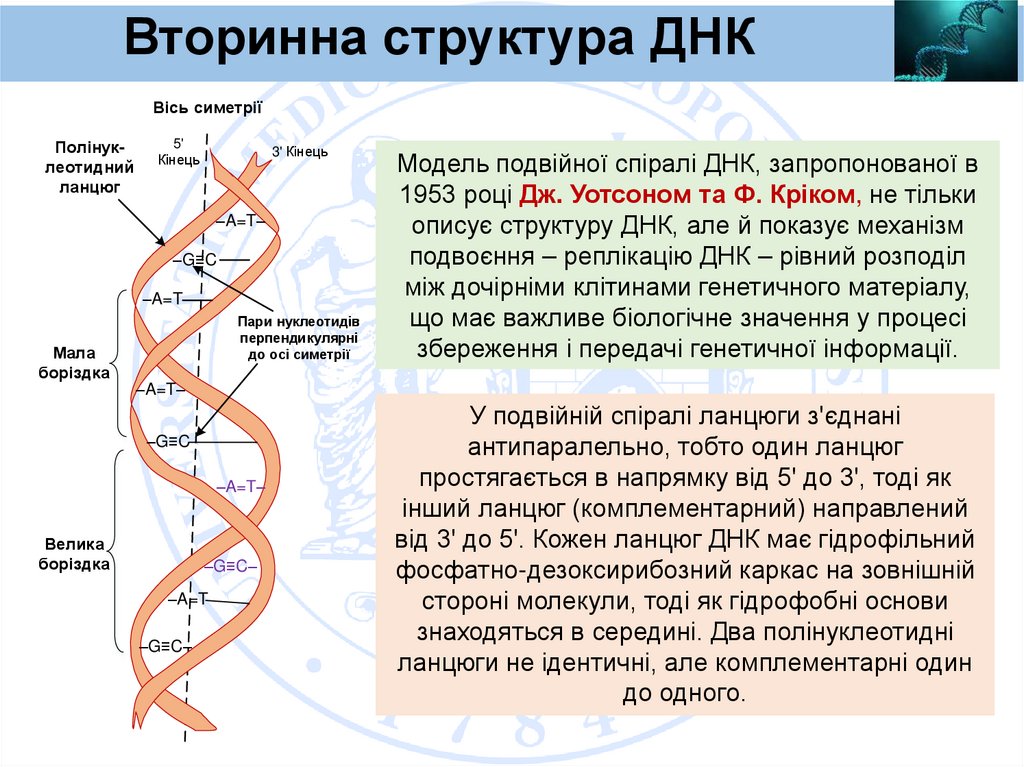

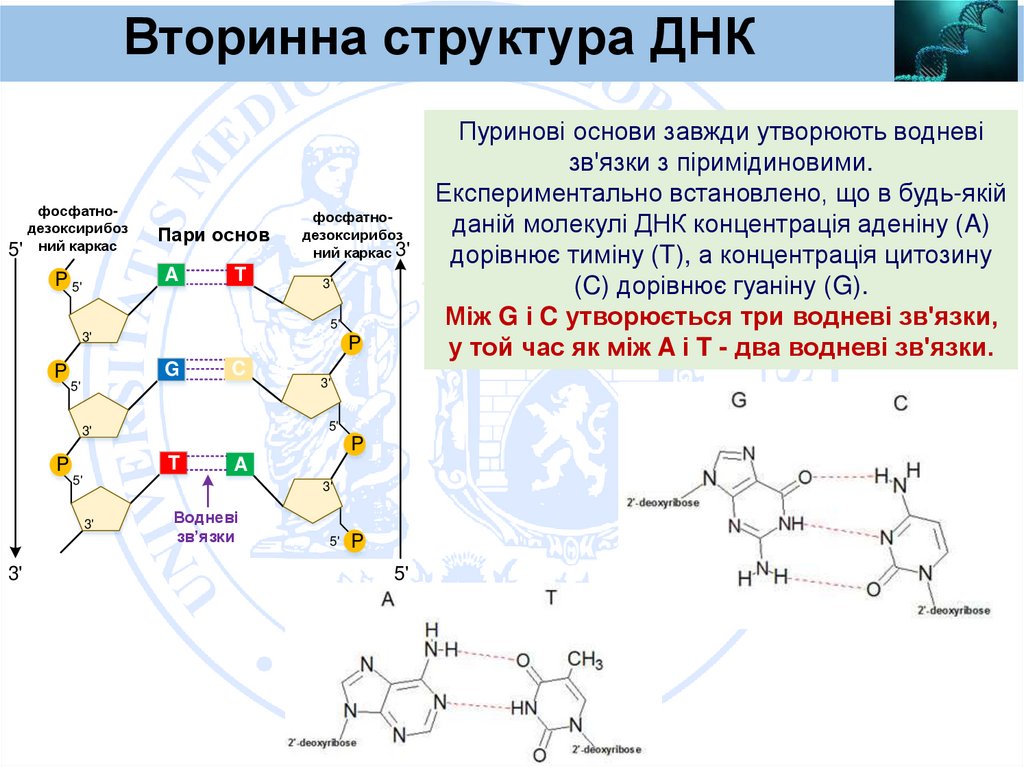
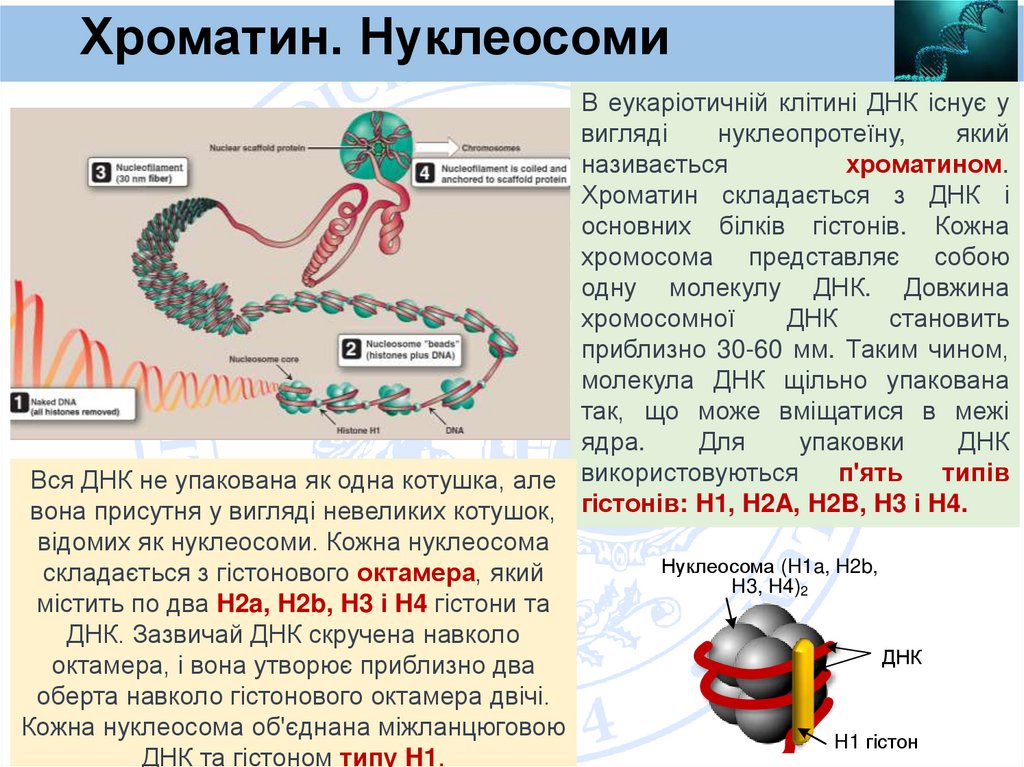
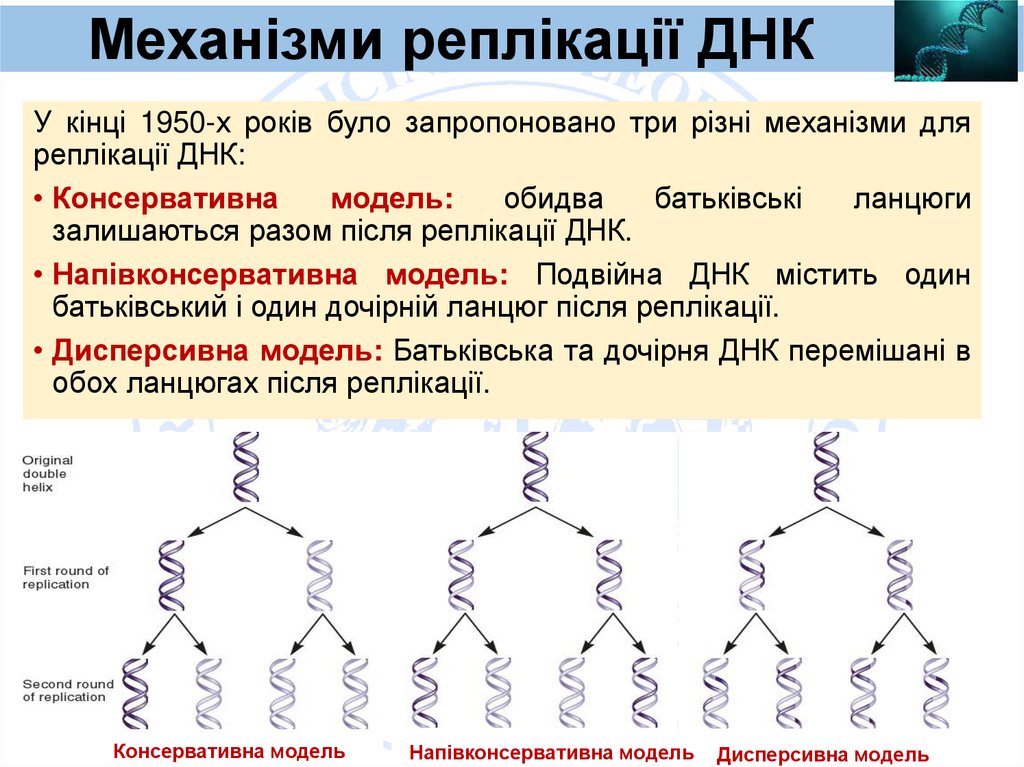
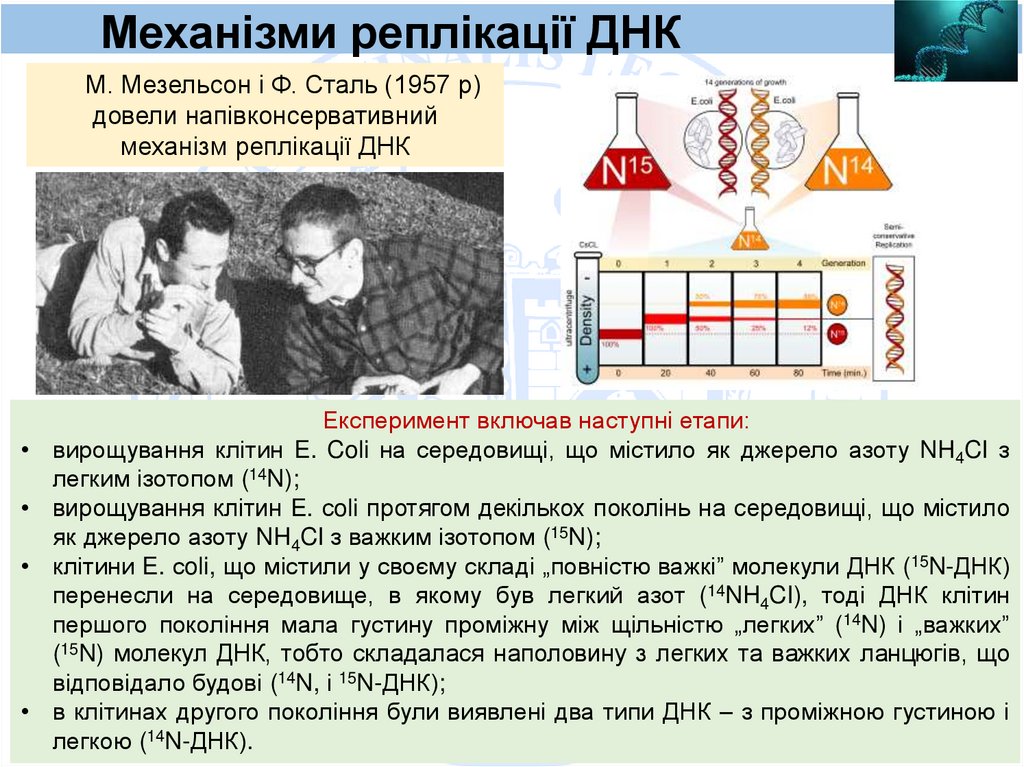
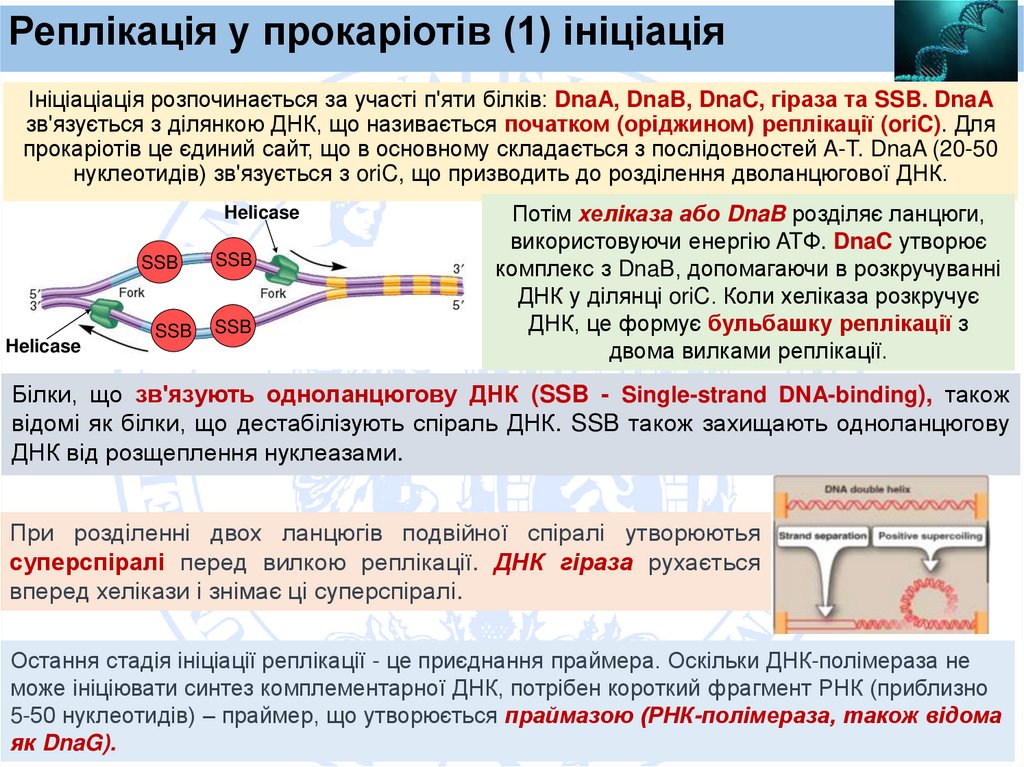
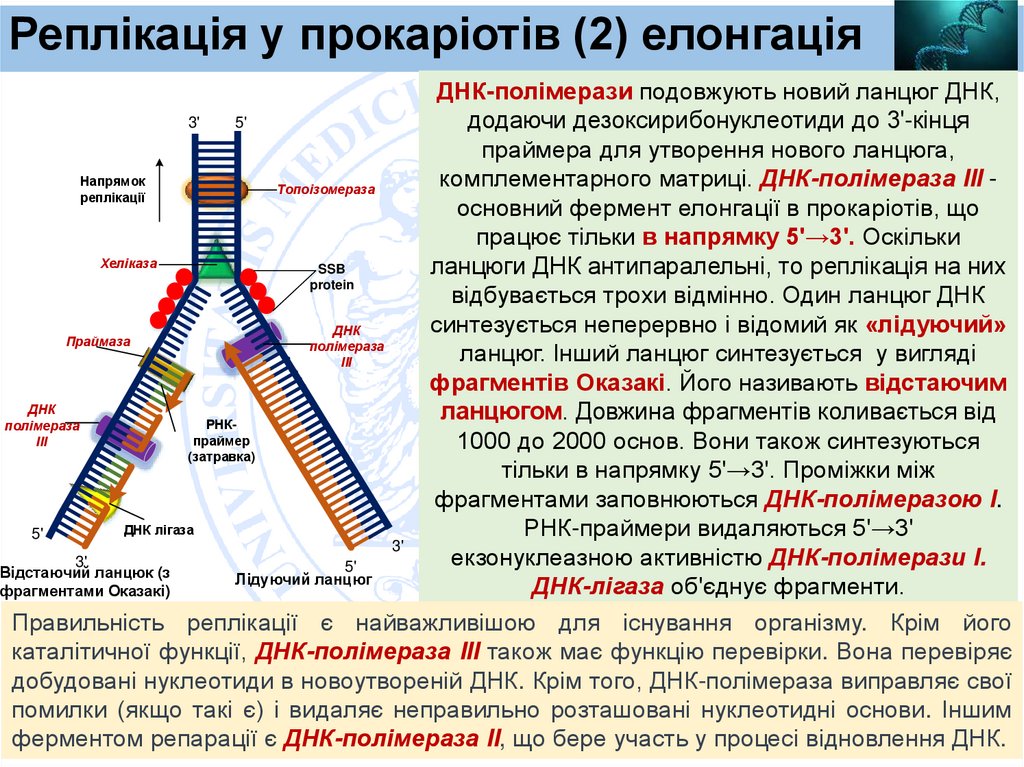
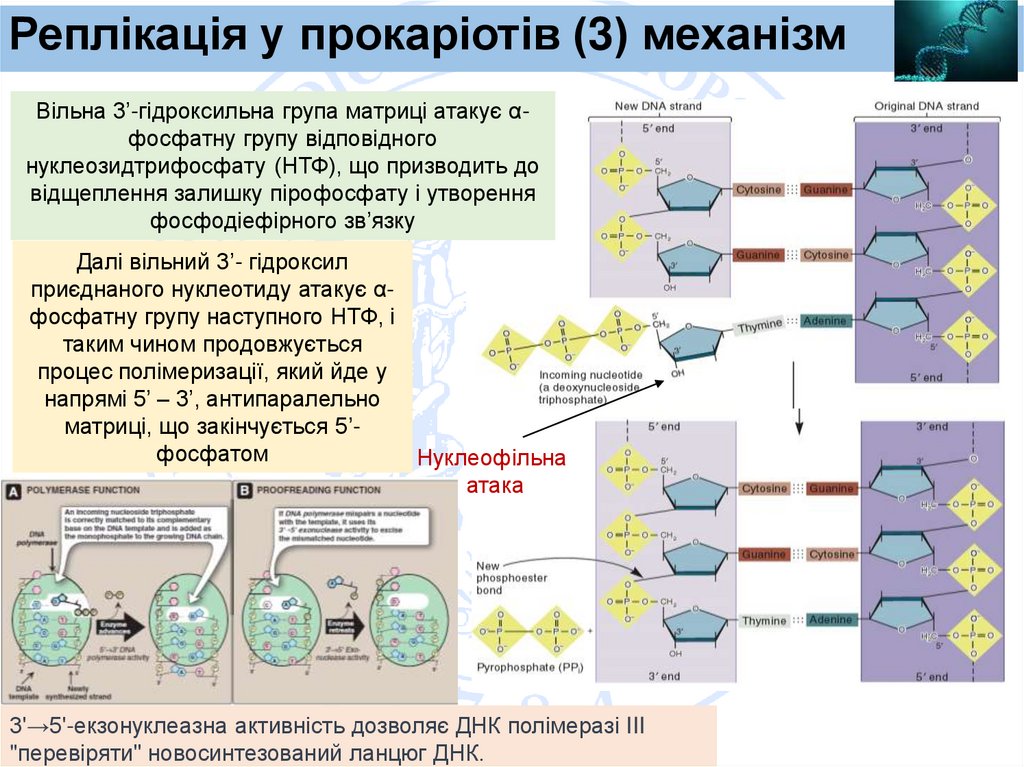
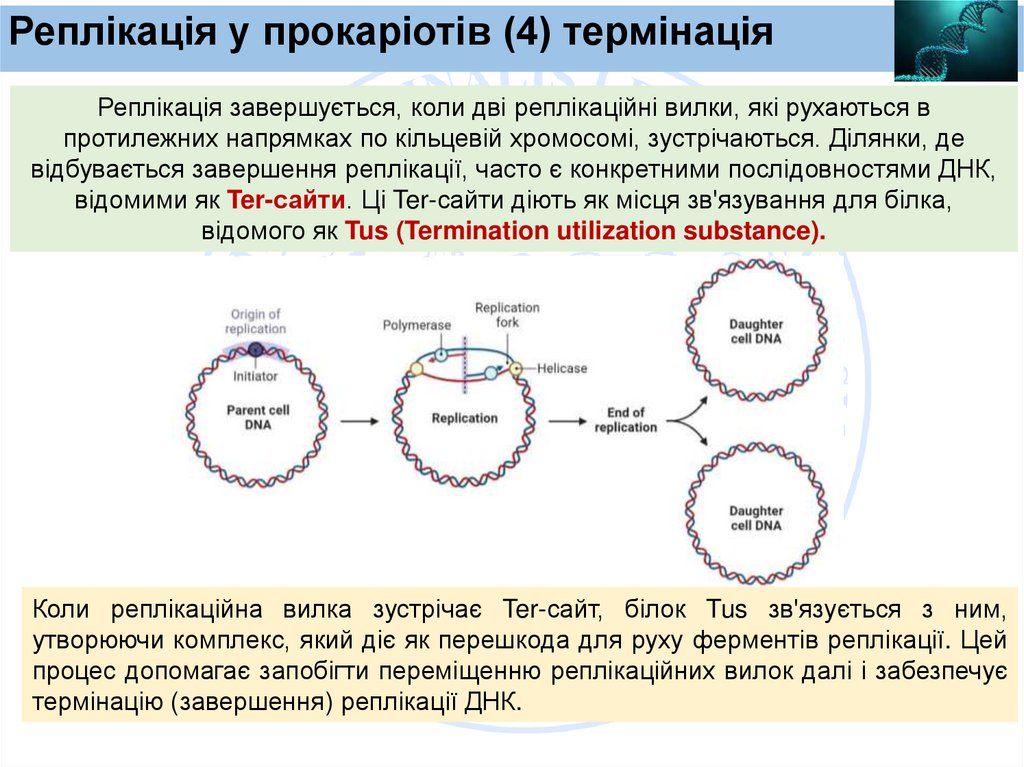
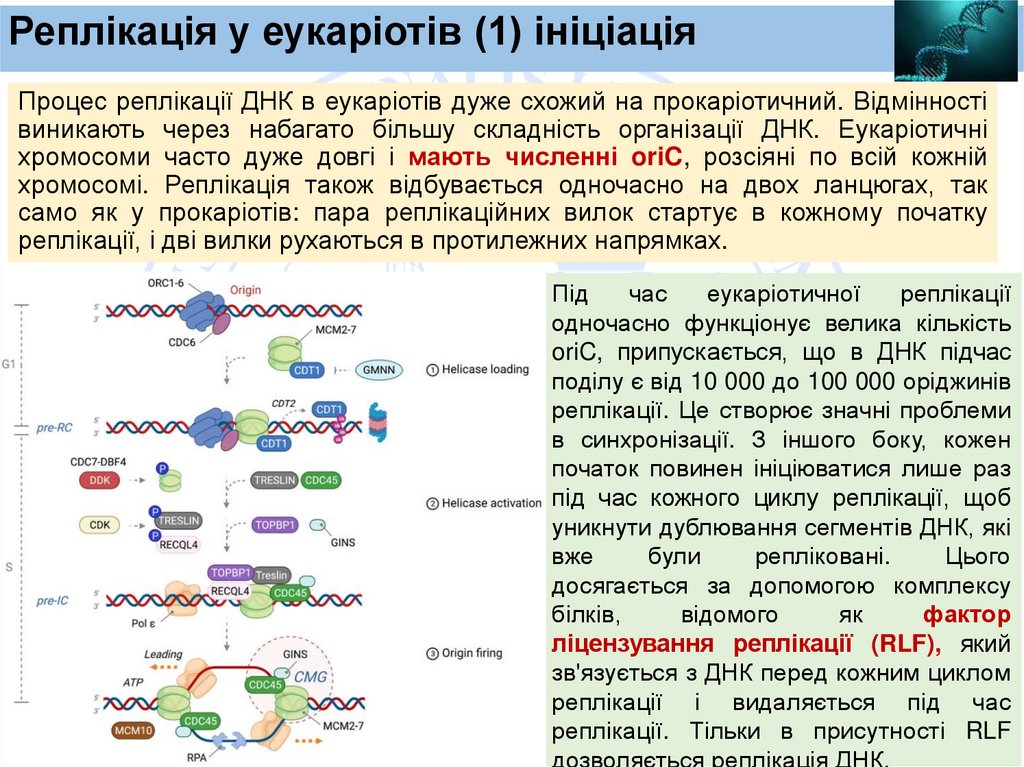

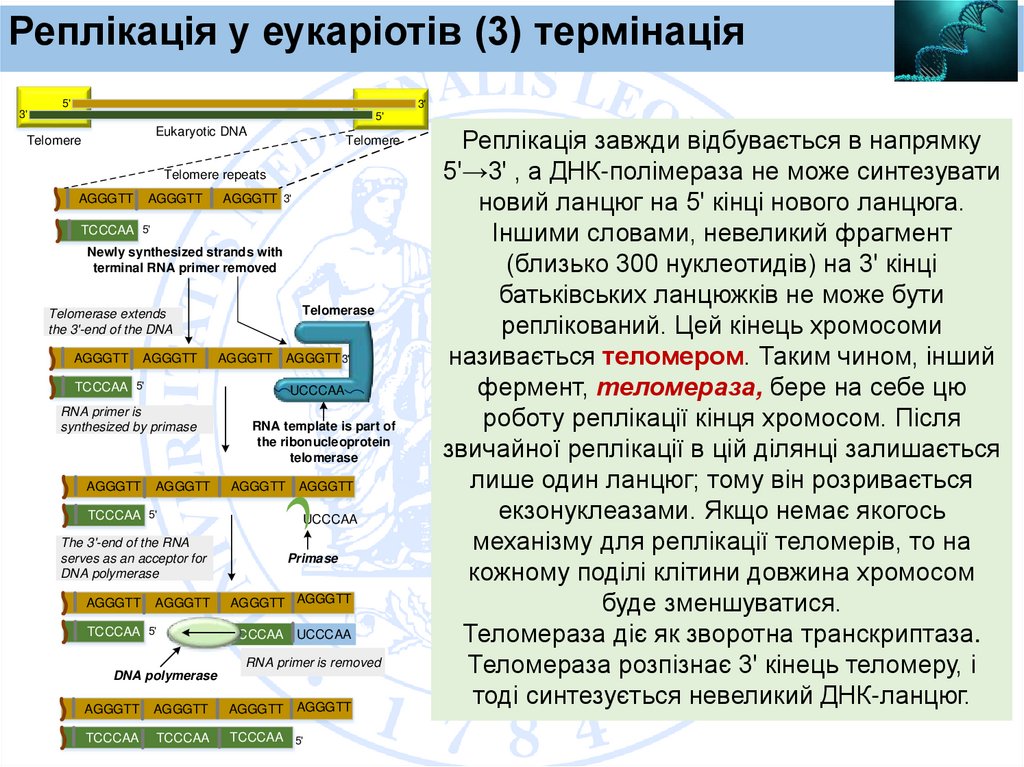

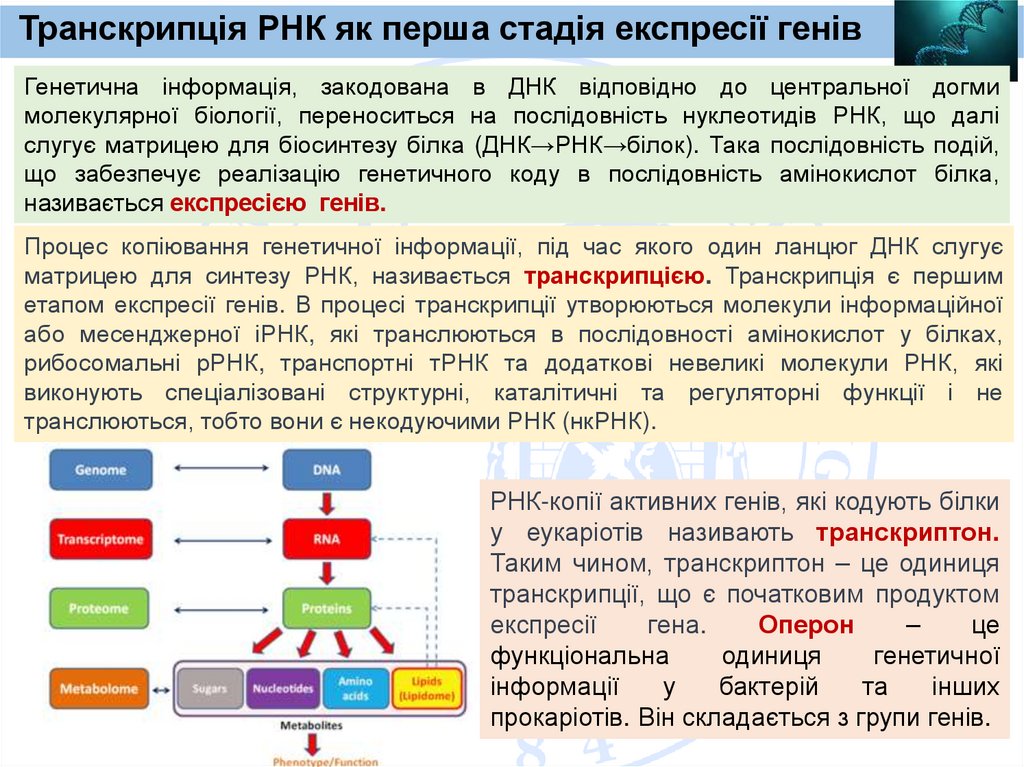
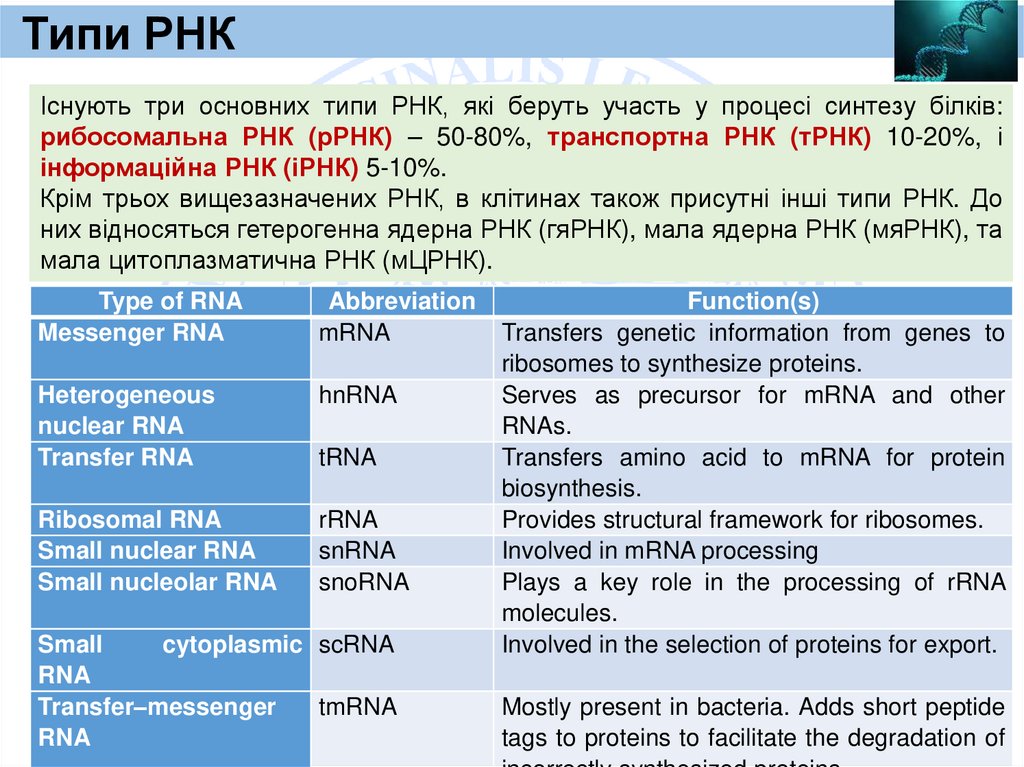
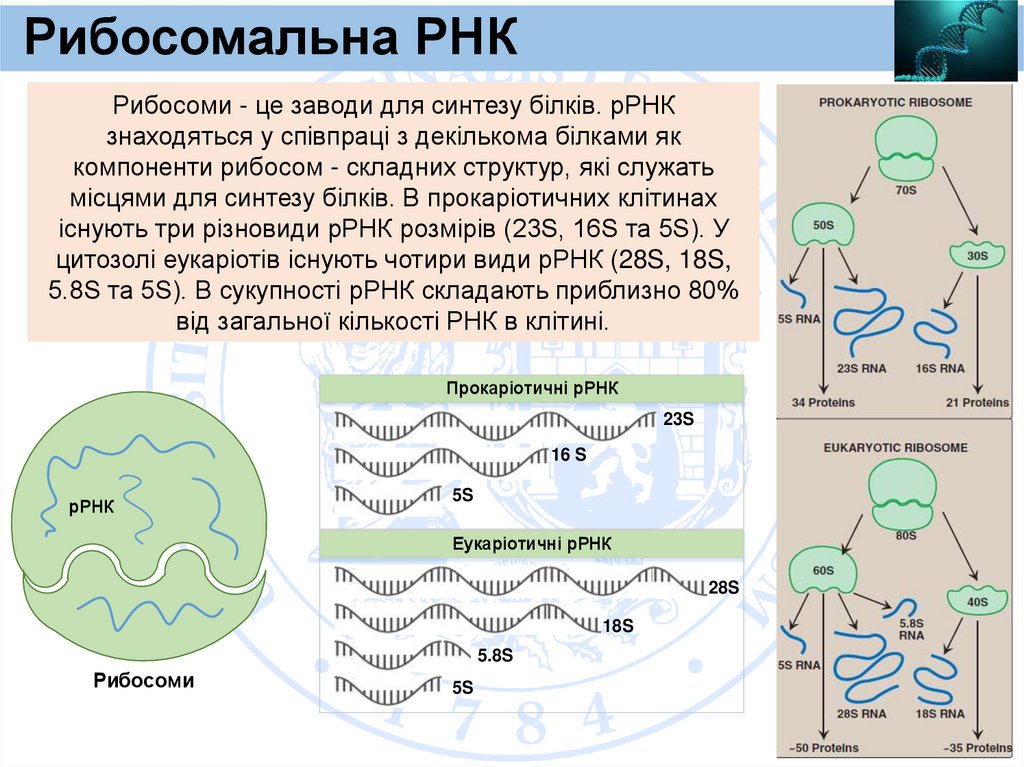
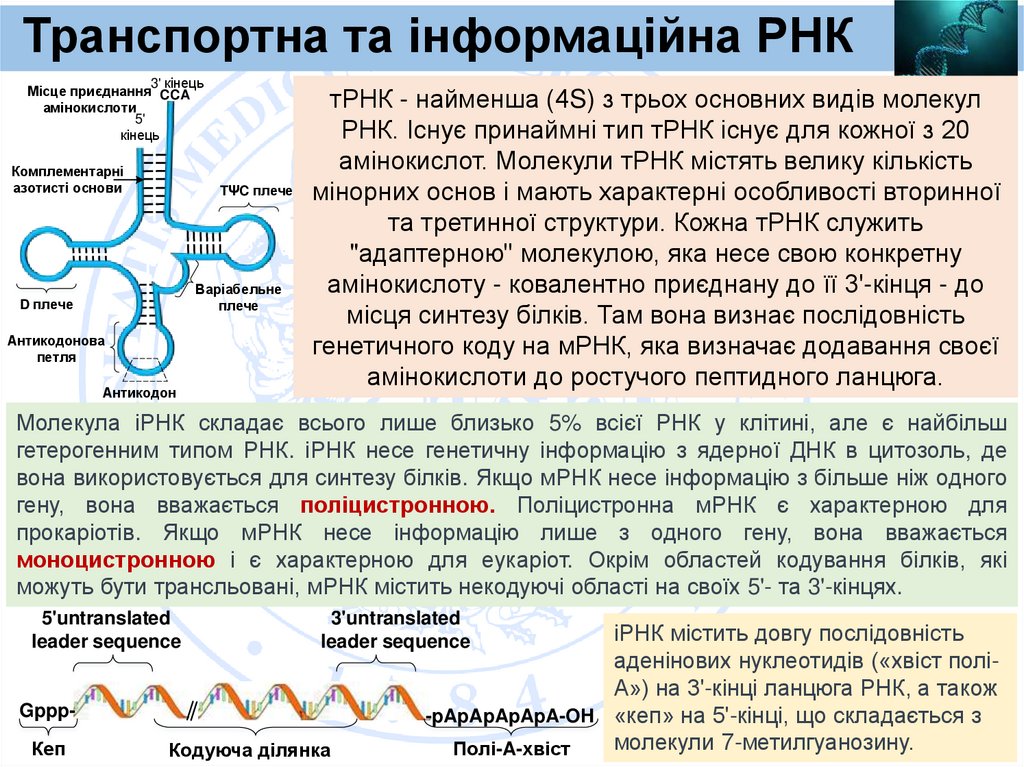

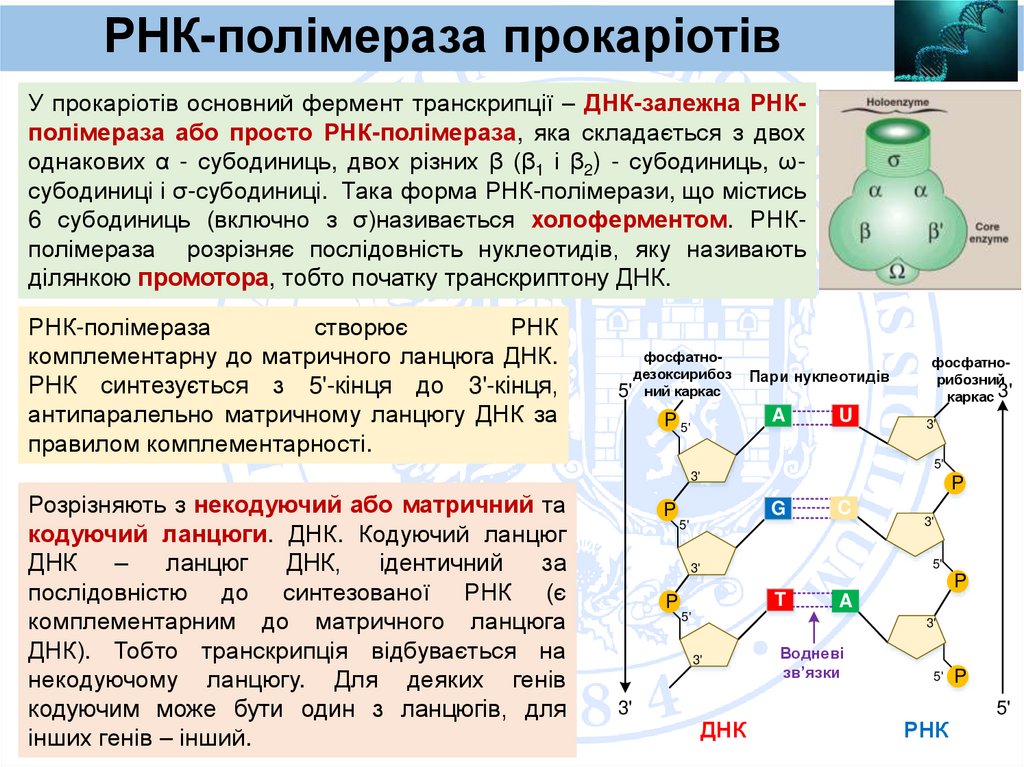
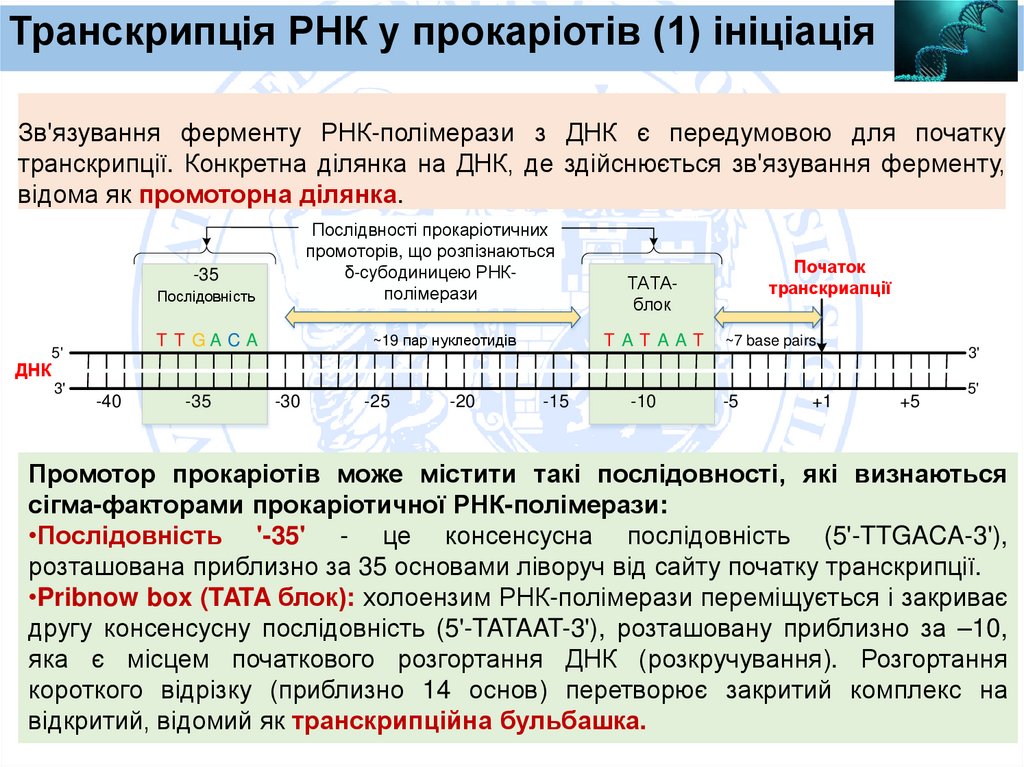
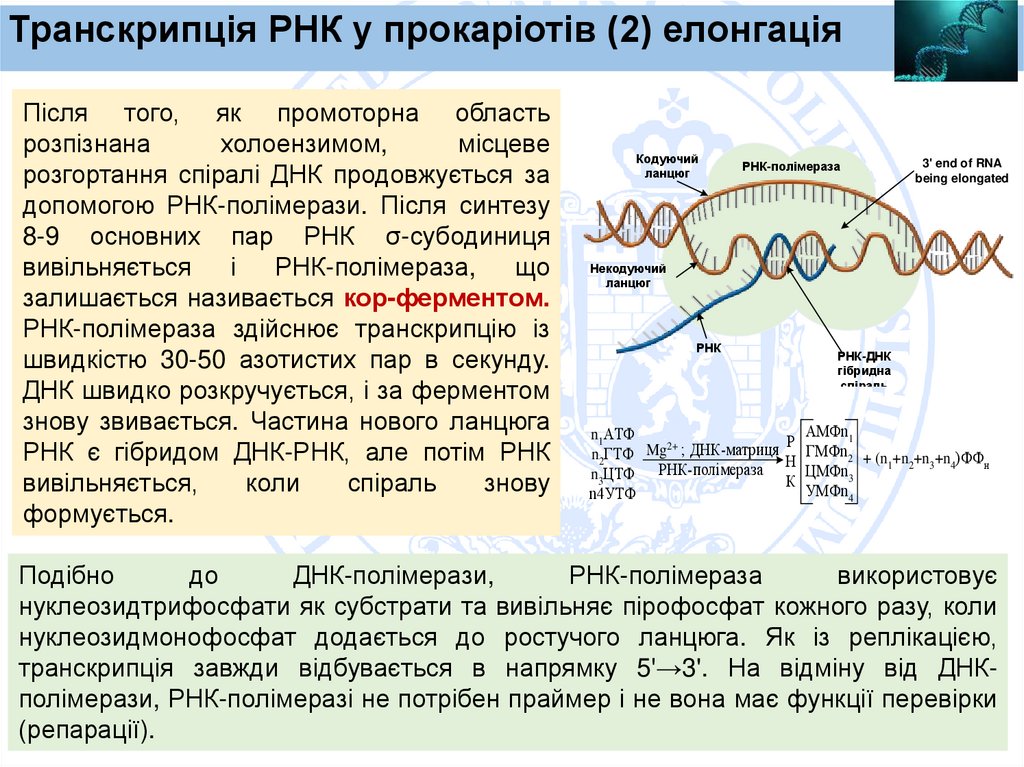


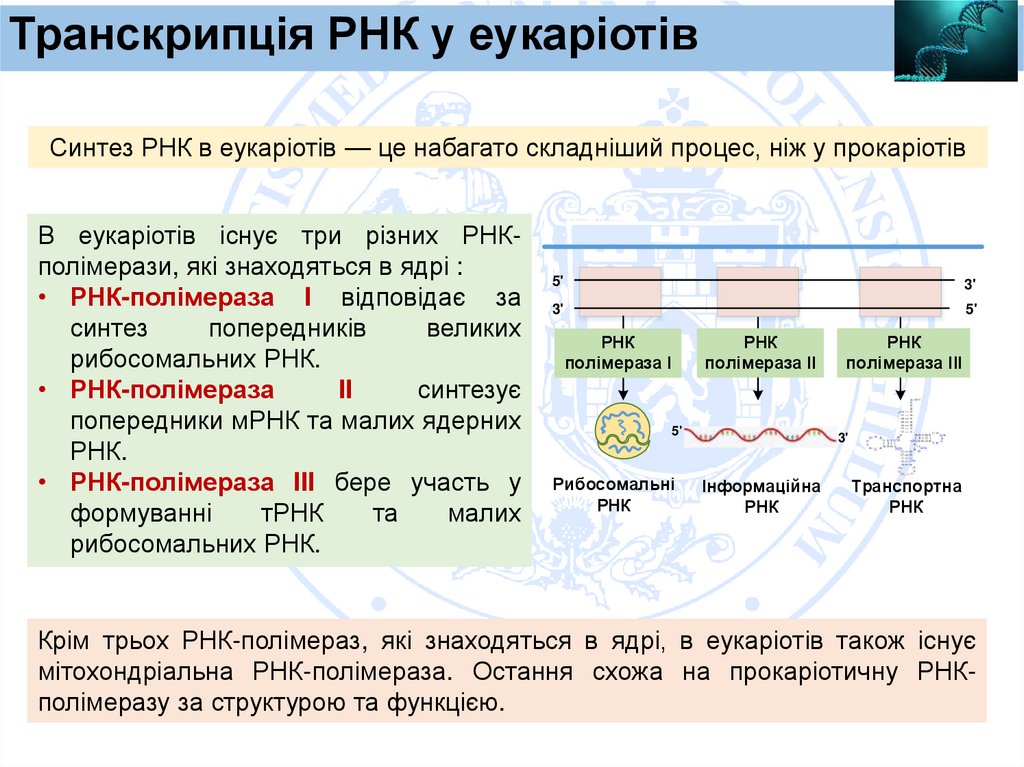
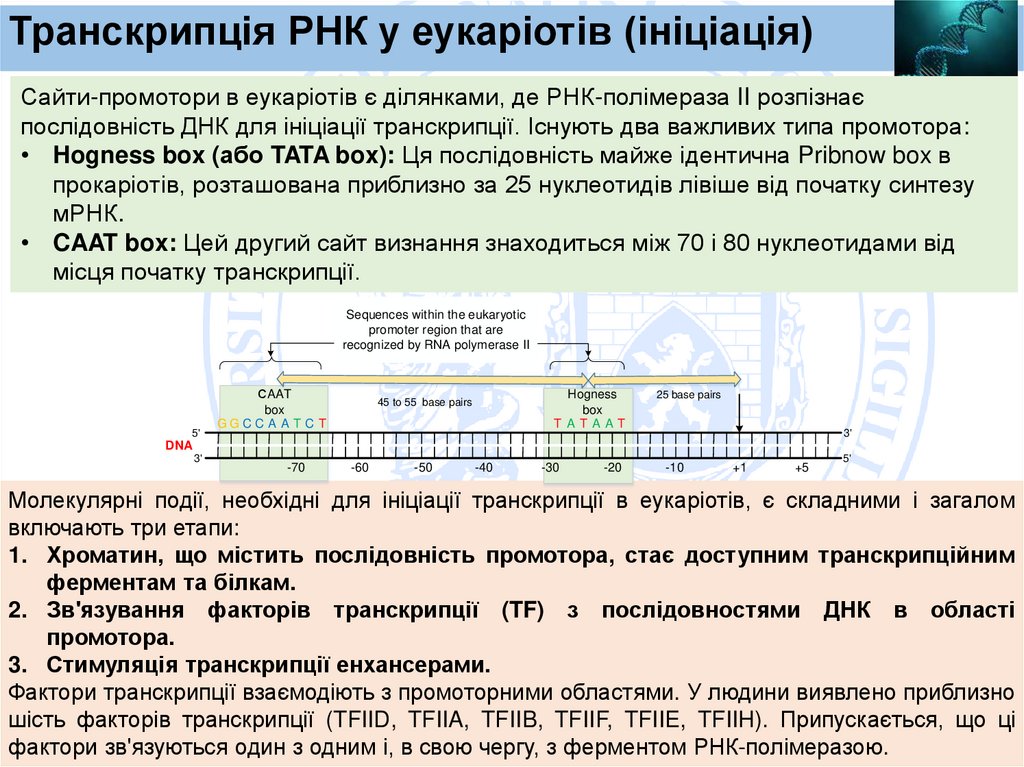


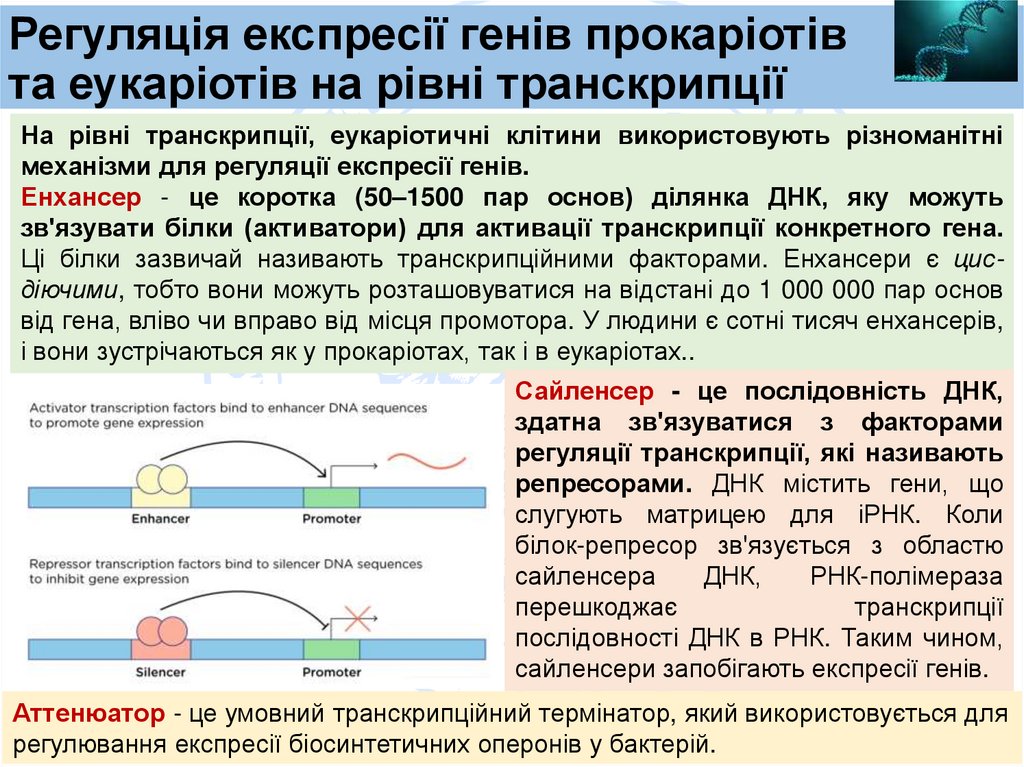

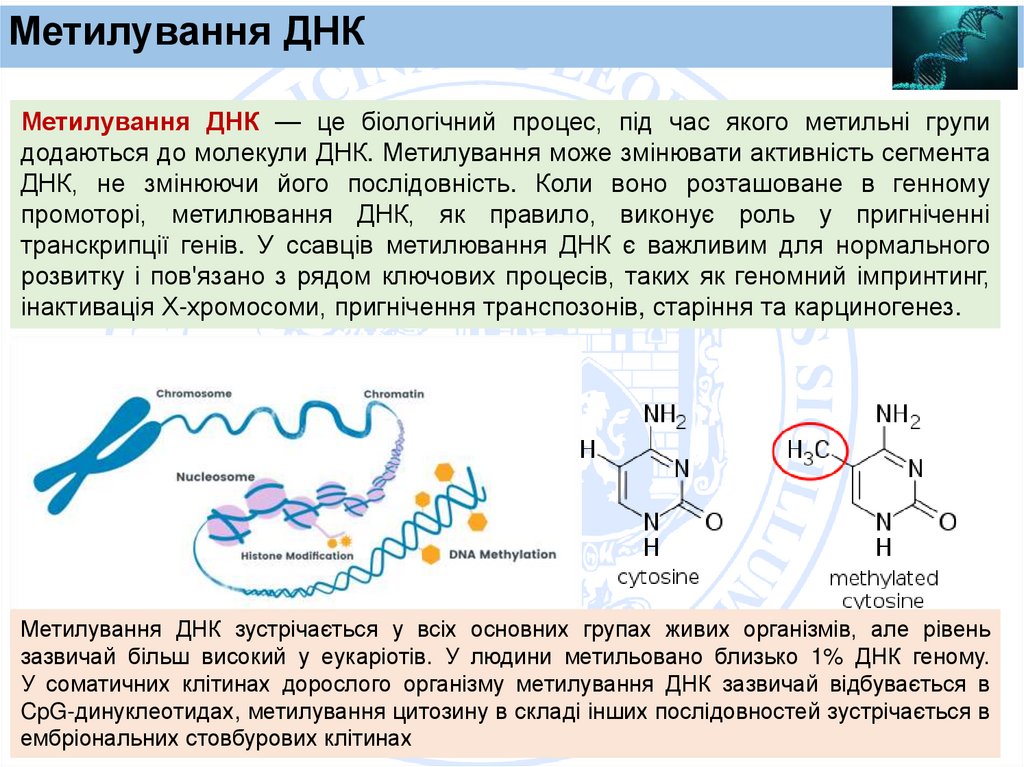
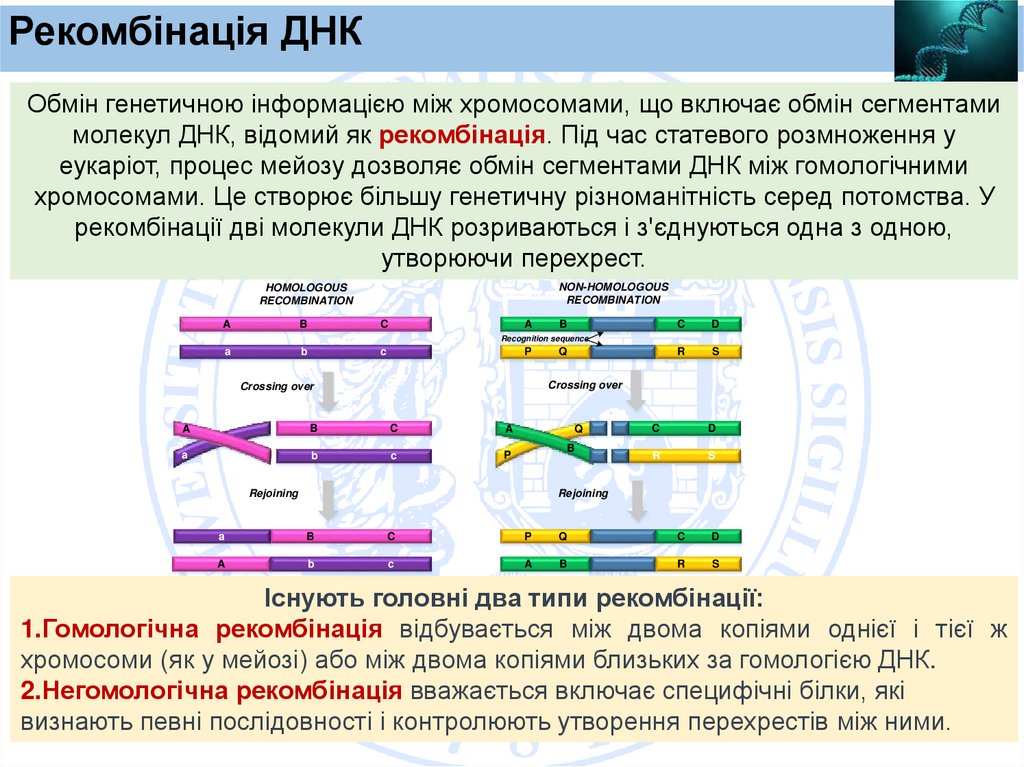

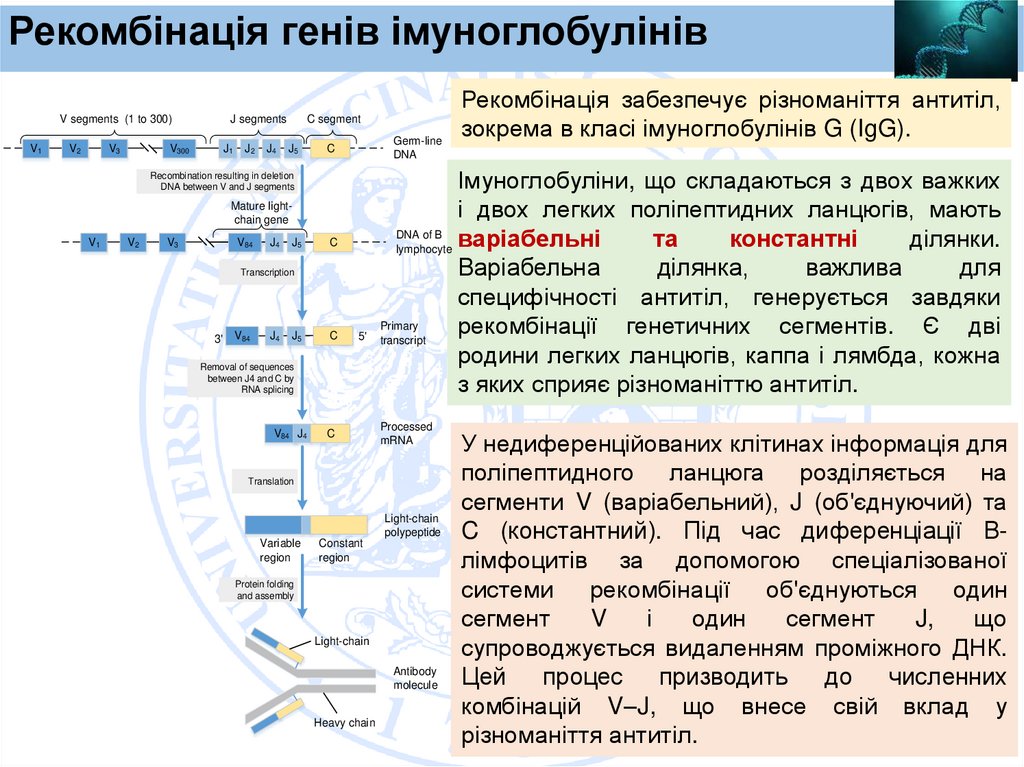


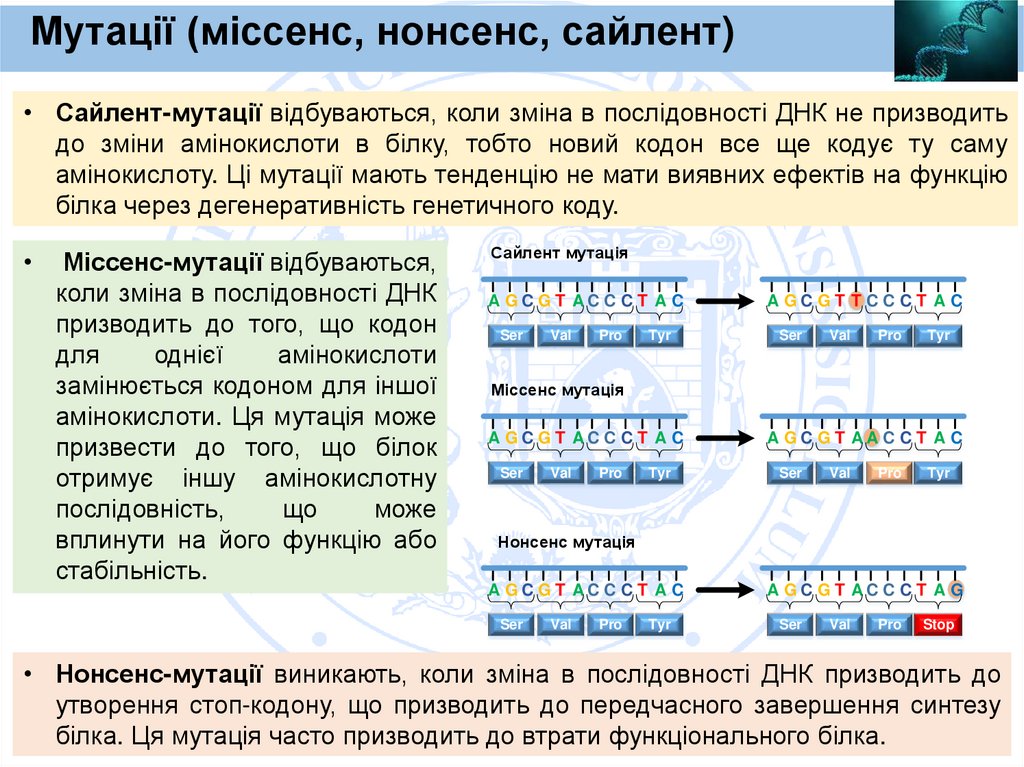
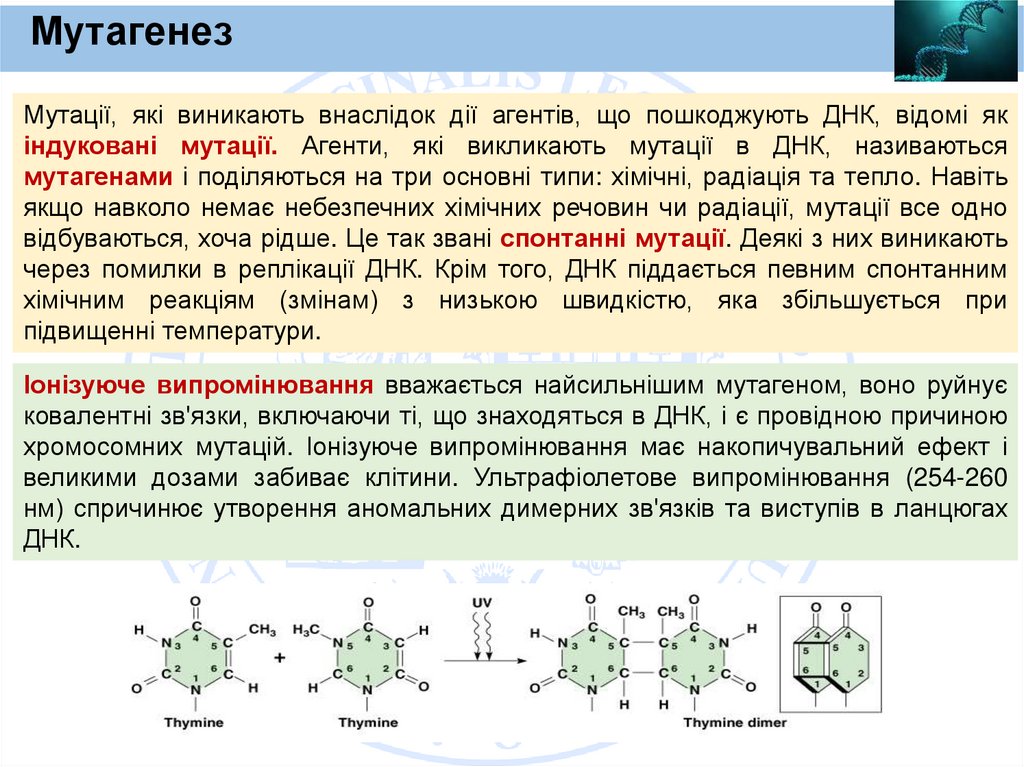
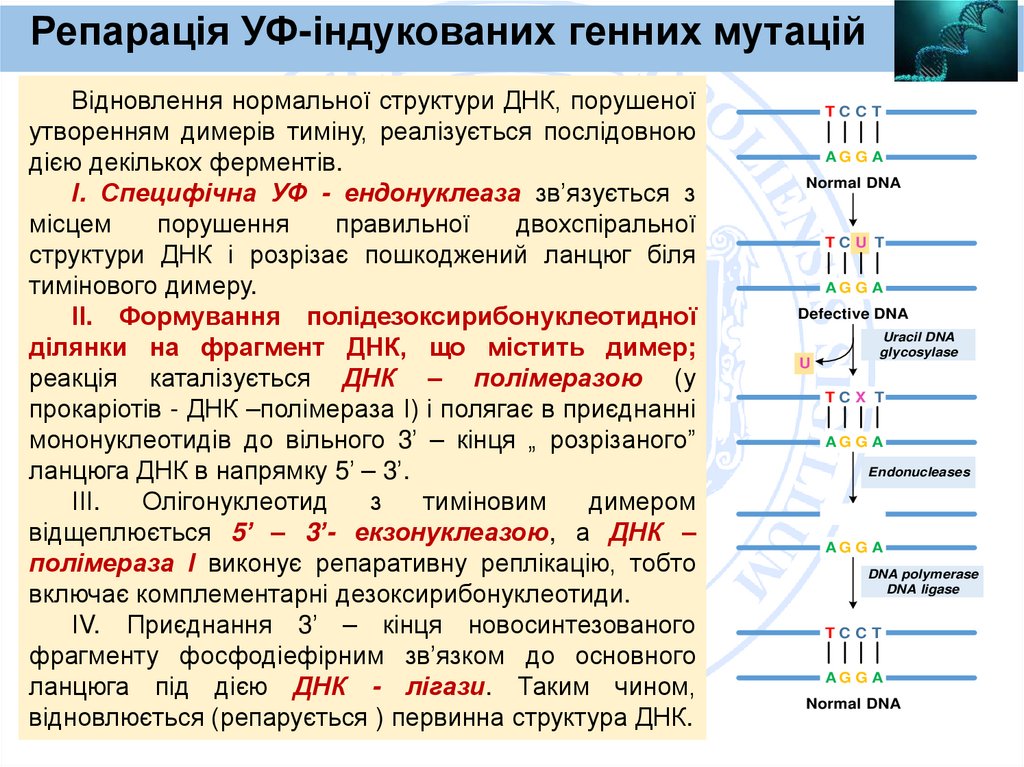
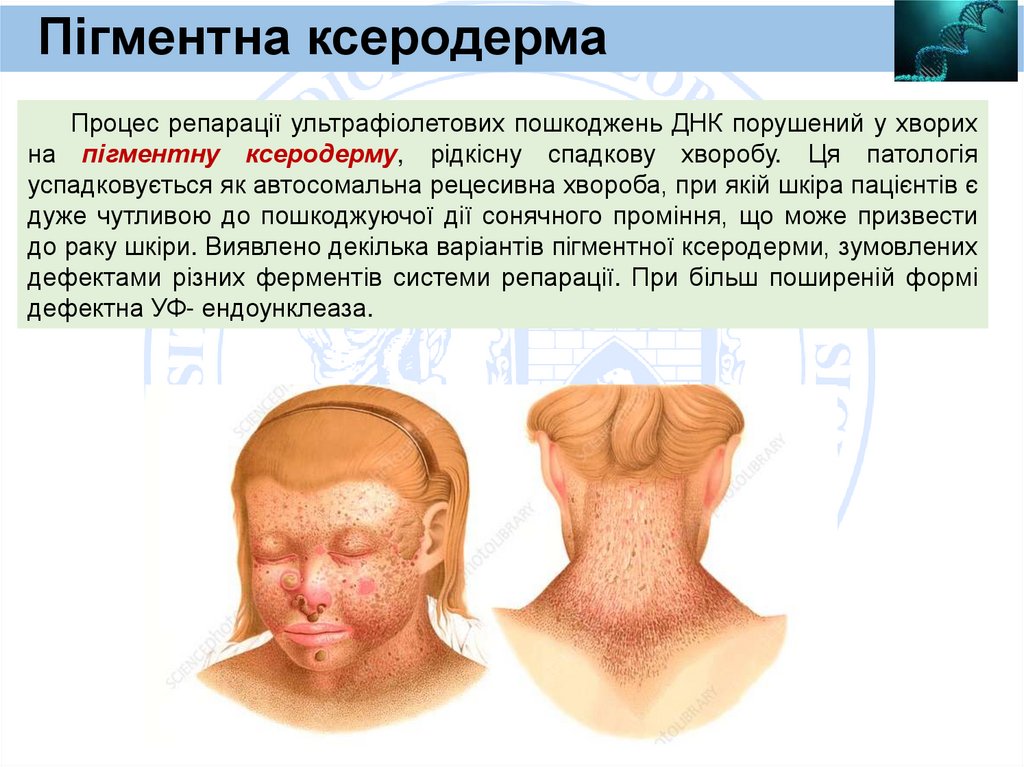

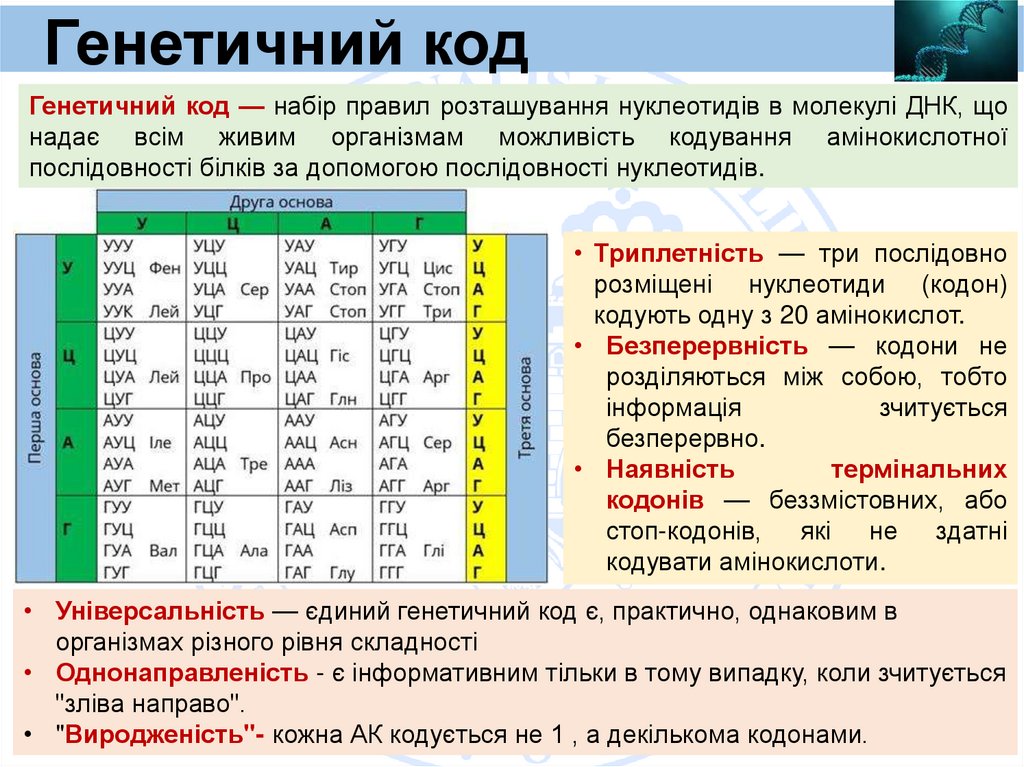
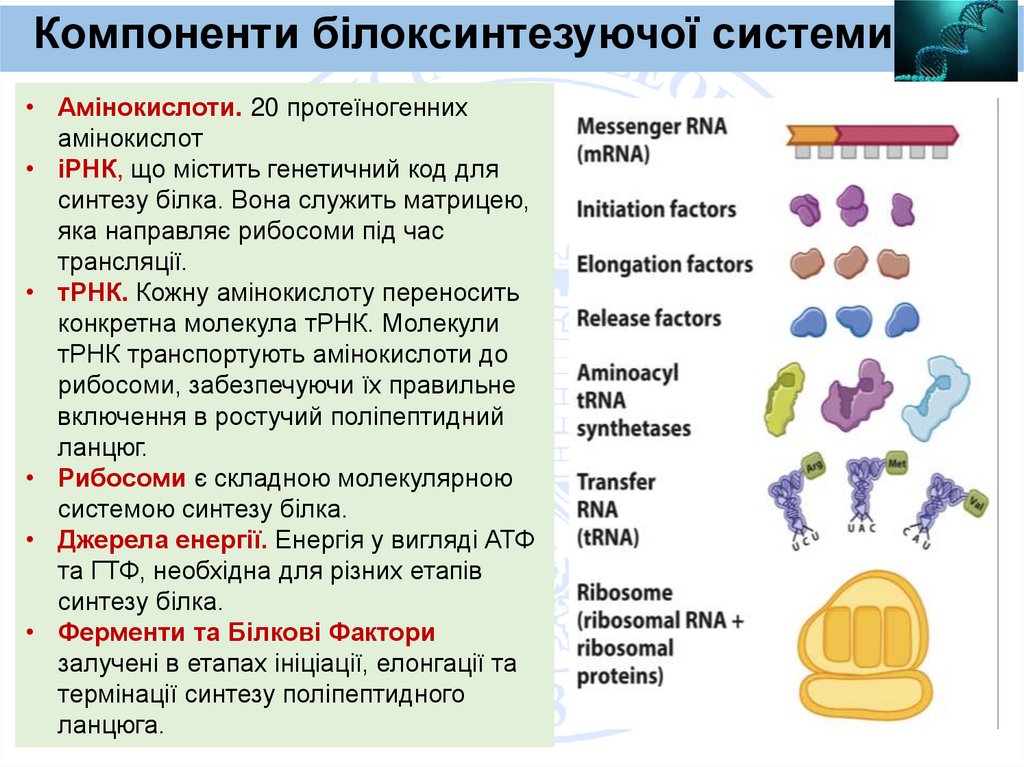
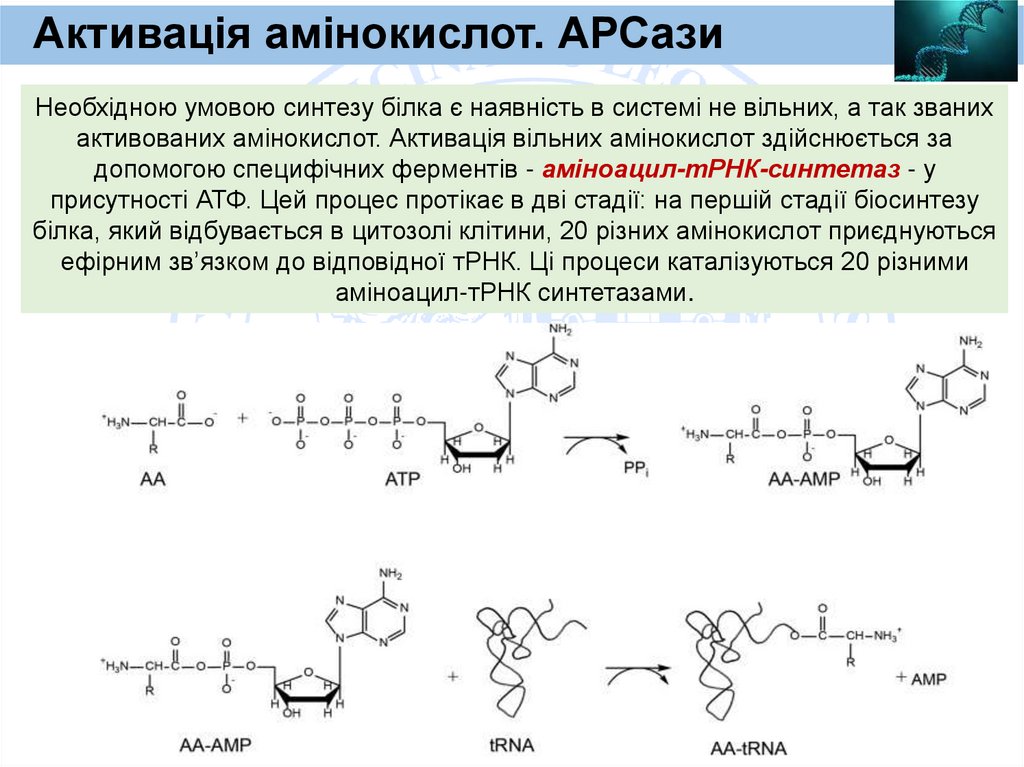

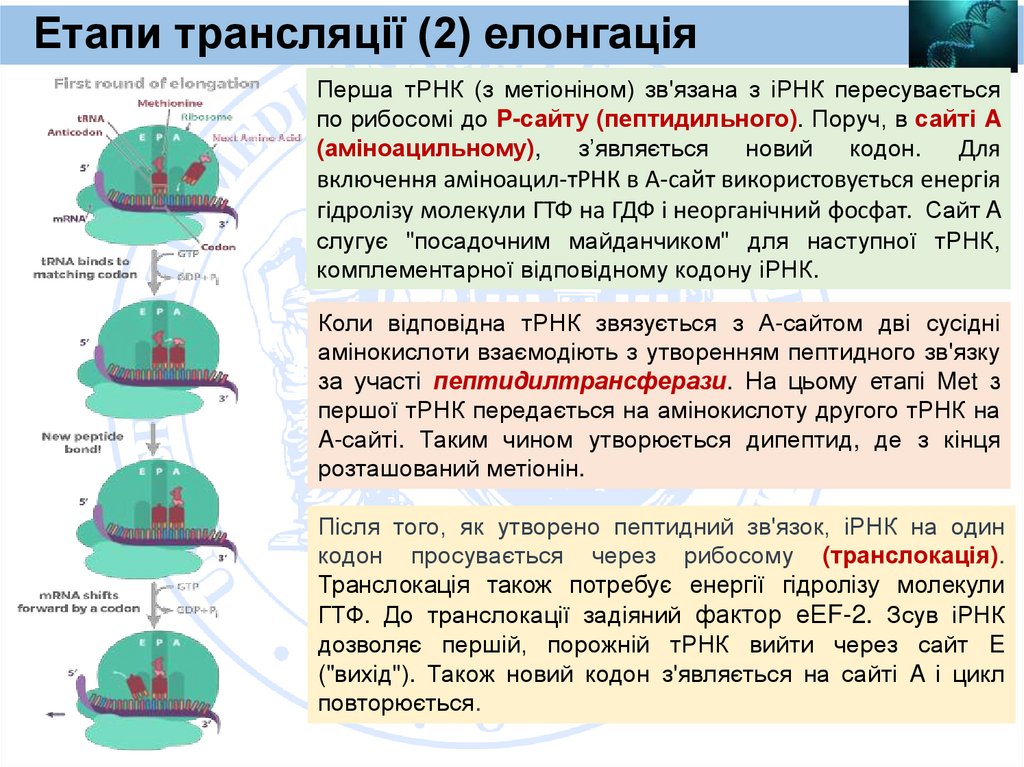
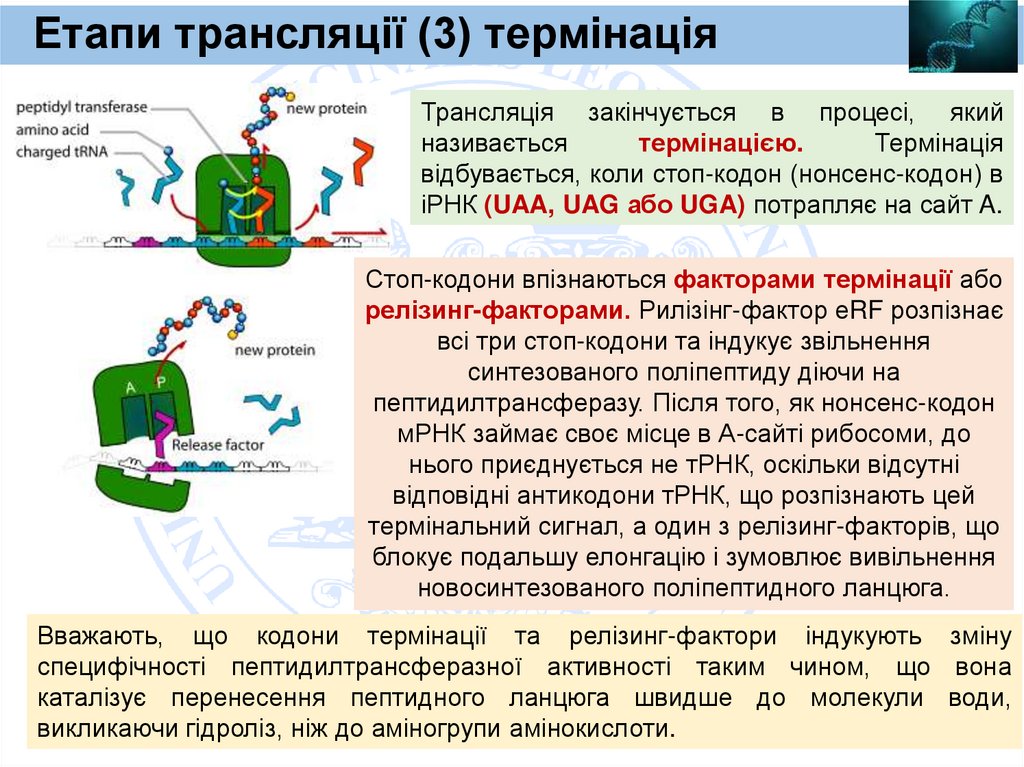
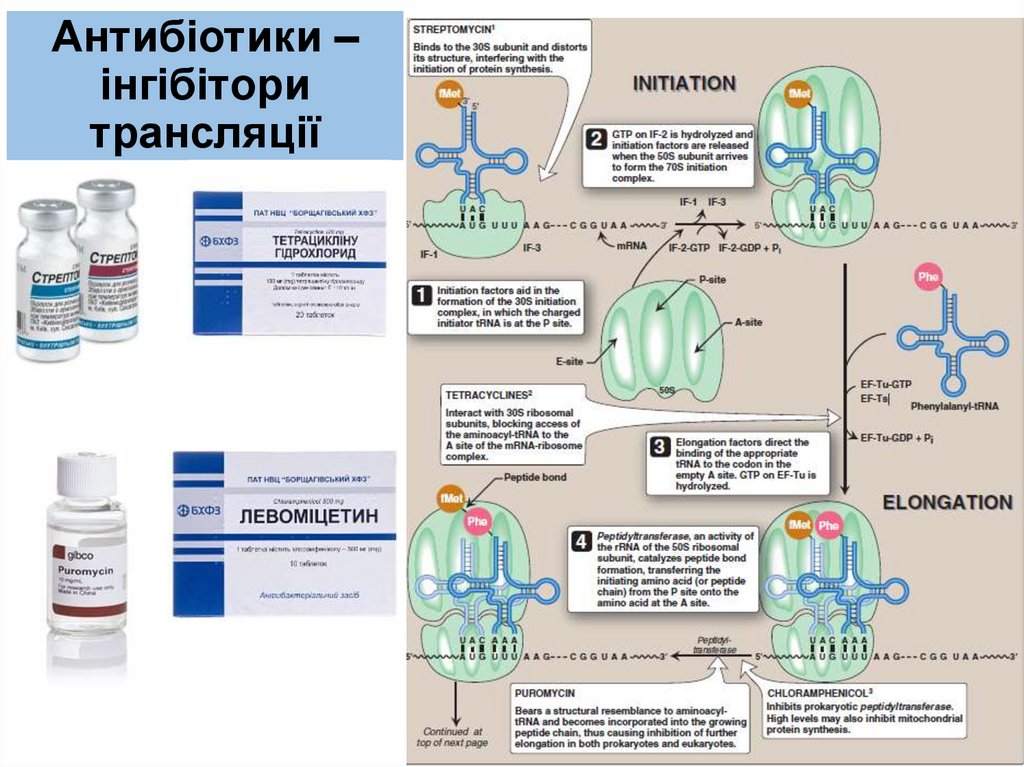
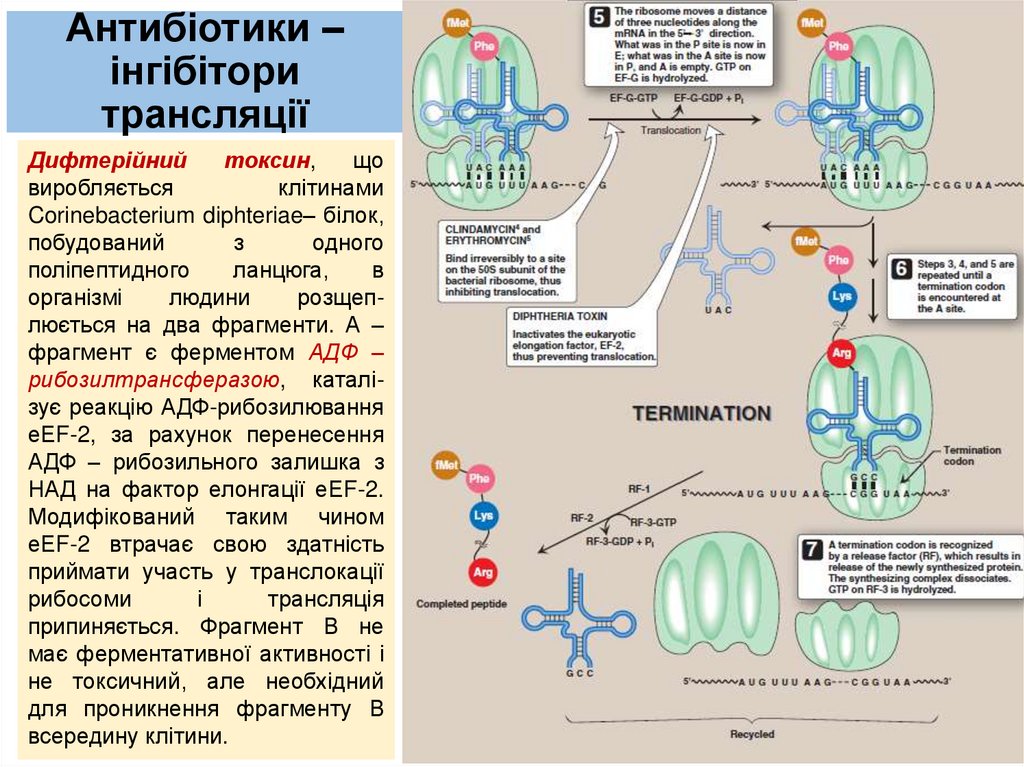


 biology
biology