Similar presentations:
Спирты
1.
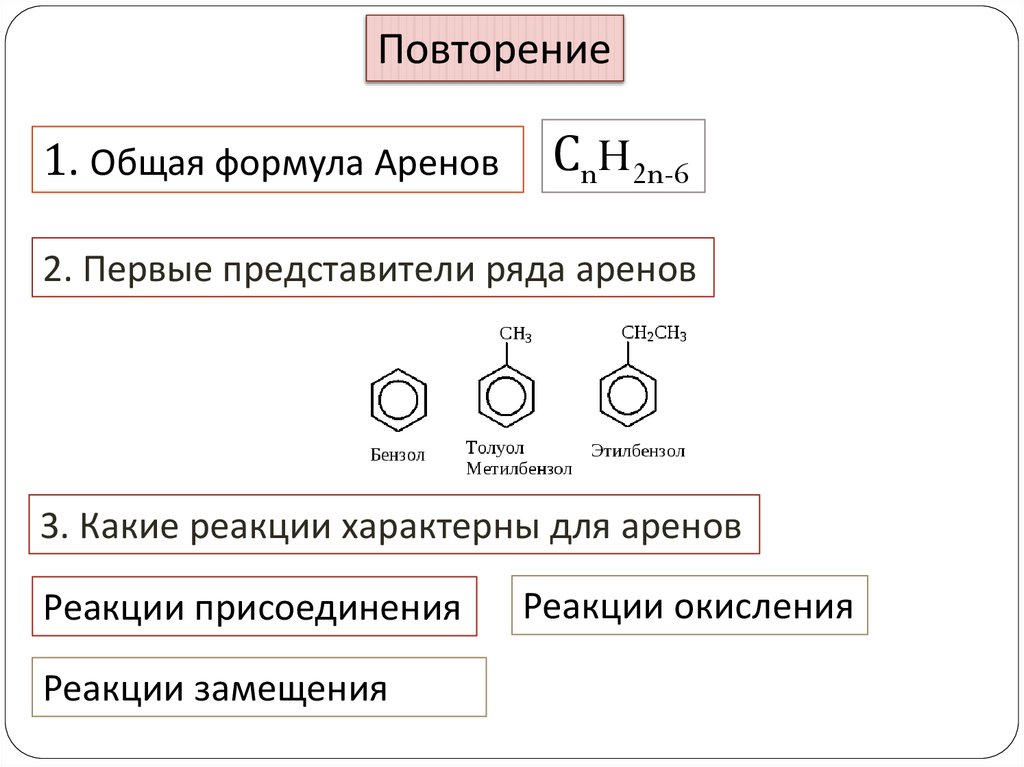
Повторение1. Общая формула Аренов
СnH2n-6
2. Первые представители ряда аренов
3. Какие реакции характерны для аренов
Реакции присоединения
Реакции замещения
Реакции окисления
2. Спирты и фенолы
3.
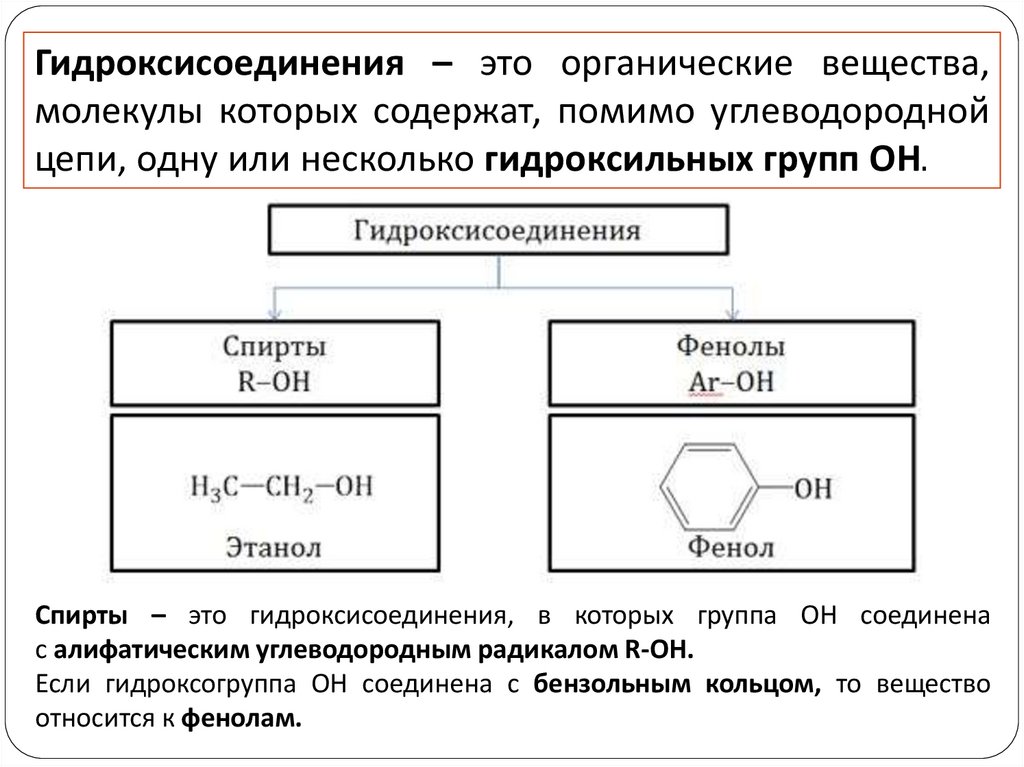
Гидроксисоединения – это органические вещества,молекулы которых содержат, помимо углеводородной
цепи, одну или несколько гидроксильных групп ОН.
Спирты – это гидроксисоединения, в которых группа ОН соединена
с алифатическим углеводородным радикалом R-OH.
Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество
относится к фенолам.
4.
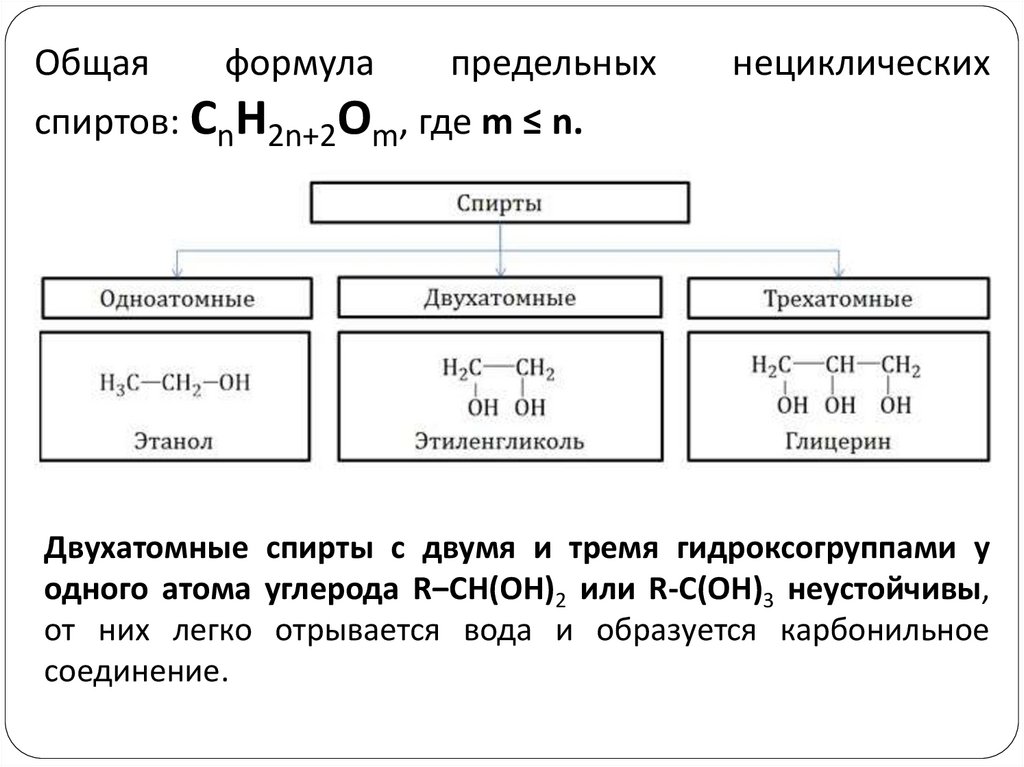
Общаяформула
предельных
спиртов: CnH2n+2Om, где m ≤ n.
нециклических
Двухатомные спирты с двумя и тремя гидроксогруппами у
одного атома углерода R‒CH(OH)2 или R-C(OH)3 неустойчивы,
от них легко отрывается вода и образуется карбонильное
соединение.
5.
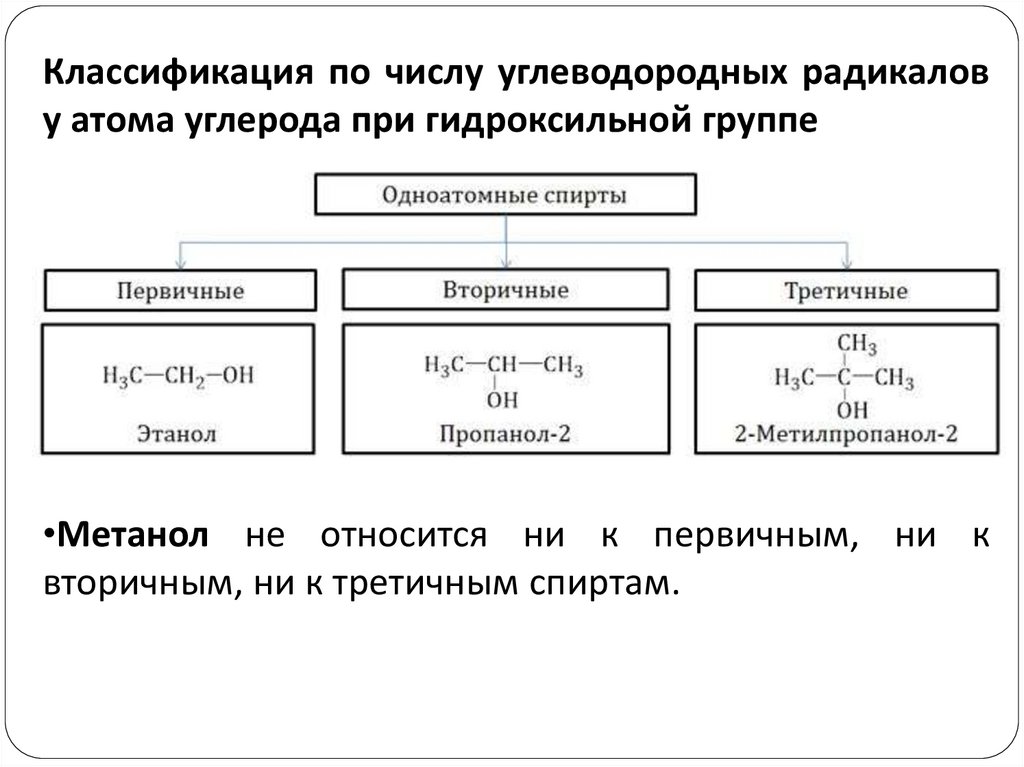
Классификация по числу углеводородных радикалову атома углерода при гидроксильной группе
•Метанол не относится ни к первичным, ни к
вторичным, ни к третичным спиртам.
6.
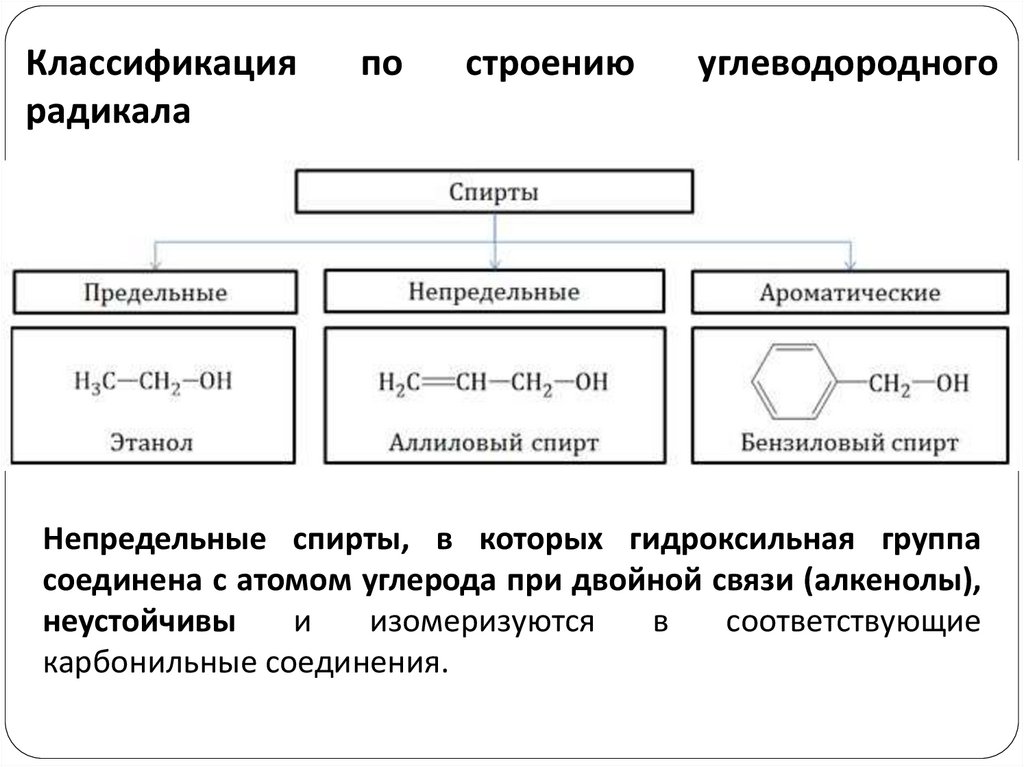
Классификациярадикала
по
строению
углеводородного
Непредельные спирты, в которых гидроксильная группа
соединена с атомом углерода при двойной связи (алкенолы),
неустойчивы
и
изомеризуются
в
соответствующие
карбонильные соединения.
7.
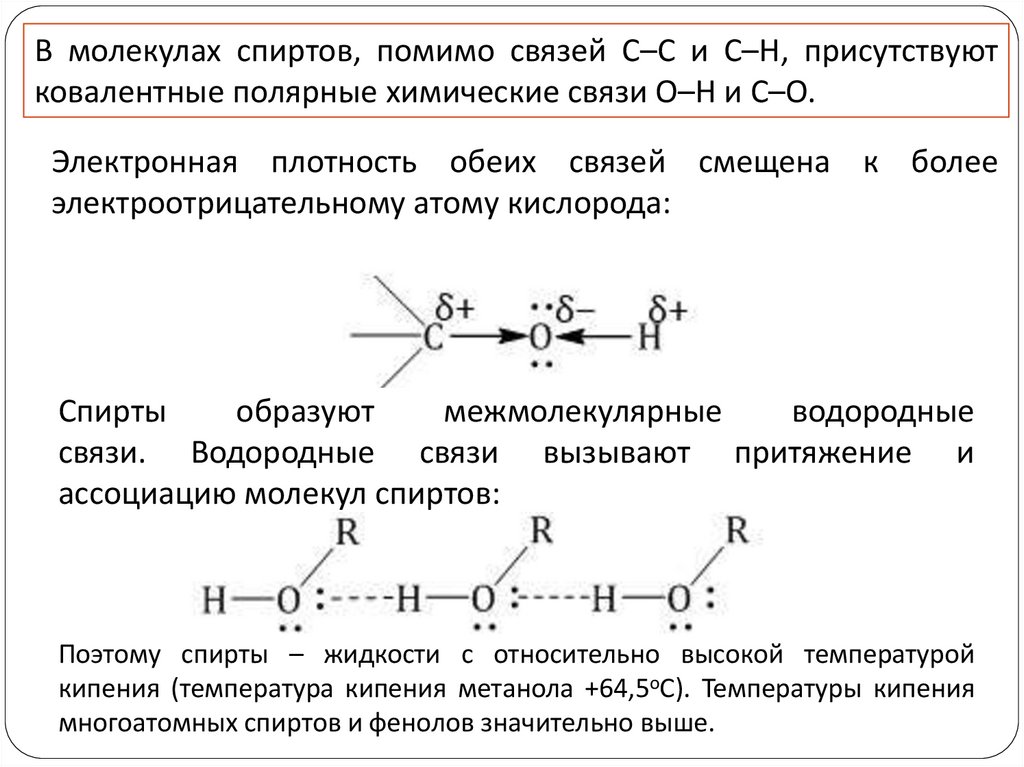
В молекулах спиртов, помимо связей С–С и С–Н, присутствуютковалентные полярные химические связи О–Н и С–О.
Электронная плотность обеих связей смещена к более
электроотрицательному атому кислорода:
Спирты
образуют
межмолекулярные
водородные
связи. Водородные связи вызывают притяжение и
ассоциацию молекул спиртов:
Поэтому спирты – жидкости с относительно высокой температурой
кипения (температура кипения метанола +64,5оС). Температуры кипения
многоатомных спиртов и фенолов значительно выше.
8.
Номенклатура спиртовПо
систематической
номенклатуре
к
названию
углеводорода добавляют суффикс
«-ОЛ» и цифру,
указывающую номер атома углерода, к которому
присоединена гидроксильная группа.
Нумерация ведется от ближайшего к ОН-группе конца цепи.
По радикально-функциональной номенклатуре названия
спиртов составляют от названий углеводородных радикалов,
соединенных с группой ОН, с добавлением слова «спирт».
СН3ОН – метиловый спирт, С2Н5ОН – этиловый
спирт и т.д.
9.
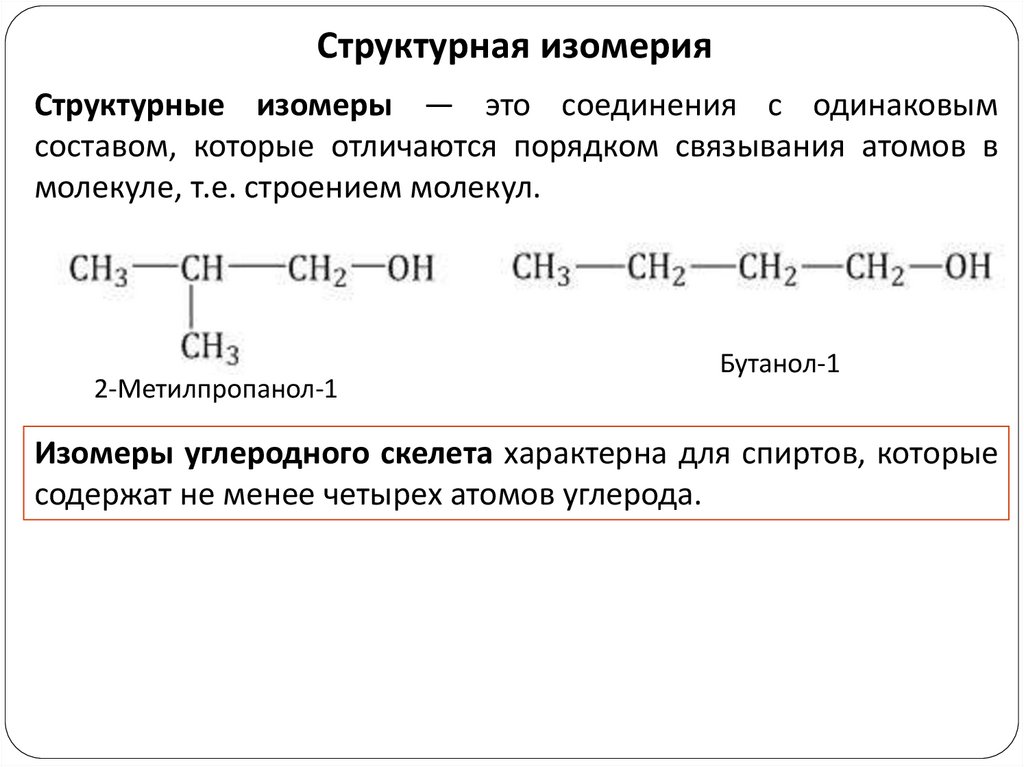
Структурная изомерияСтруктурные изомеры — это соединения с одинаковым
составом, которые отличаются порядком связывания атомов в
молекуле, т.е. строением молекул.
2-Метилпропанол-1
Бутанол-1
Изомеры углеродного скелета характерна для спиртов, которые
содержат не менее четырех атомов углерода.
10.
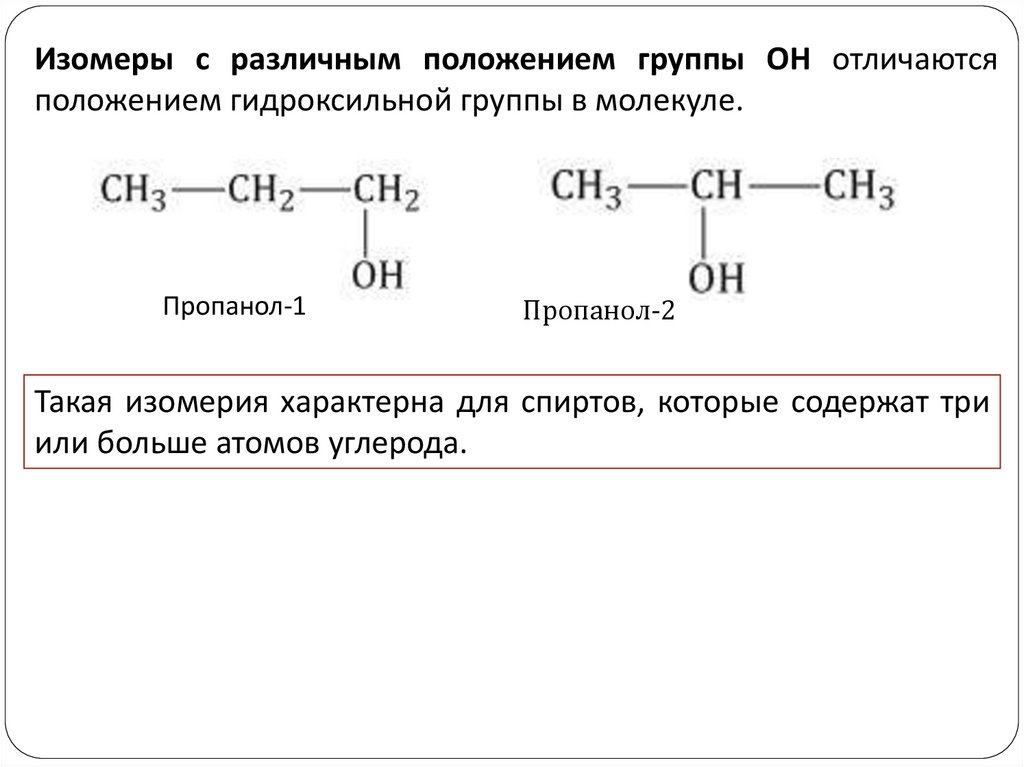
Изомеры с различным положением группы ОН отличаютсяположением гидроксильной группы в молекуле.
Пропанол-1
Пропанол-2
Такая изомерия характерна для спиртов, которые содержат три
или больше атомов углерода.
11.
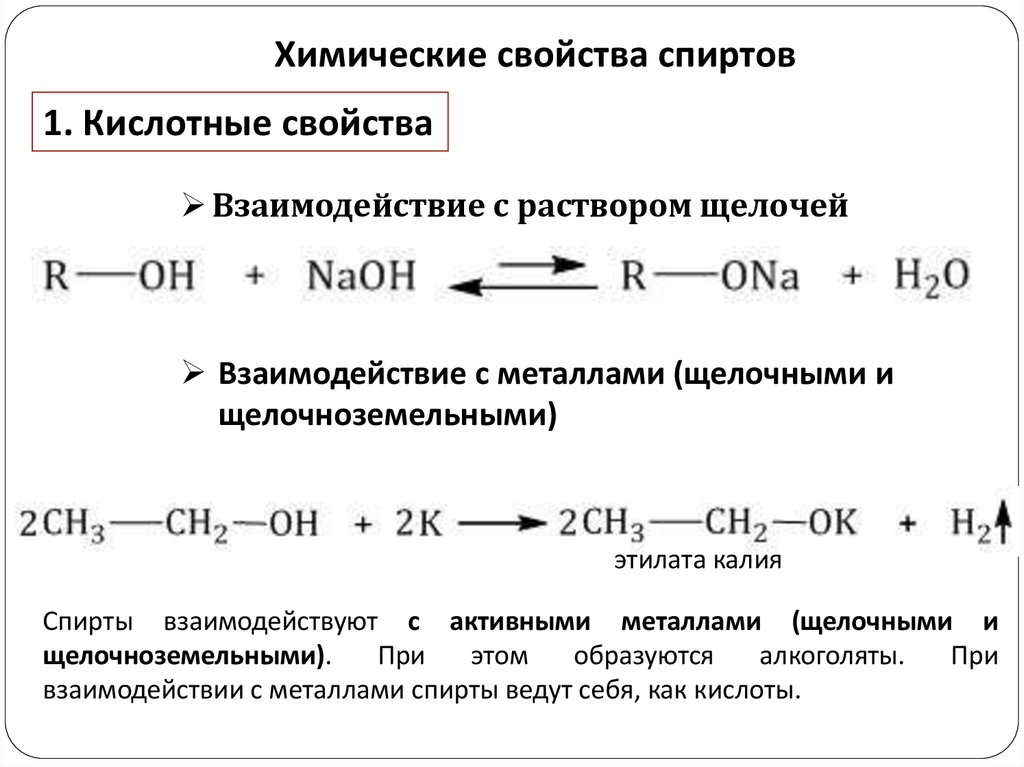
Химические свойства спиртов1. Кислотные свойства
Взаимодействие с раствором щелочей
Взаимодействие с металлами (щелочными и
щелочноземельными)
этилата калия
Спирты взаимодействуют с активными металлами (щелочными и
щелочноземельными).
При
этом
образуются
алкоголяты.
При
взаимодействии с металлами спирты ведут себя, как кислоты.
12.
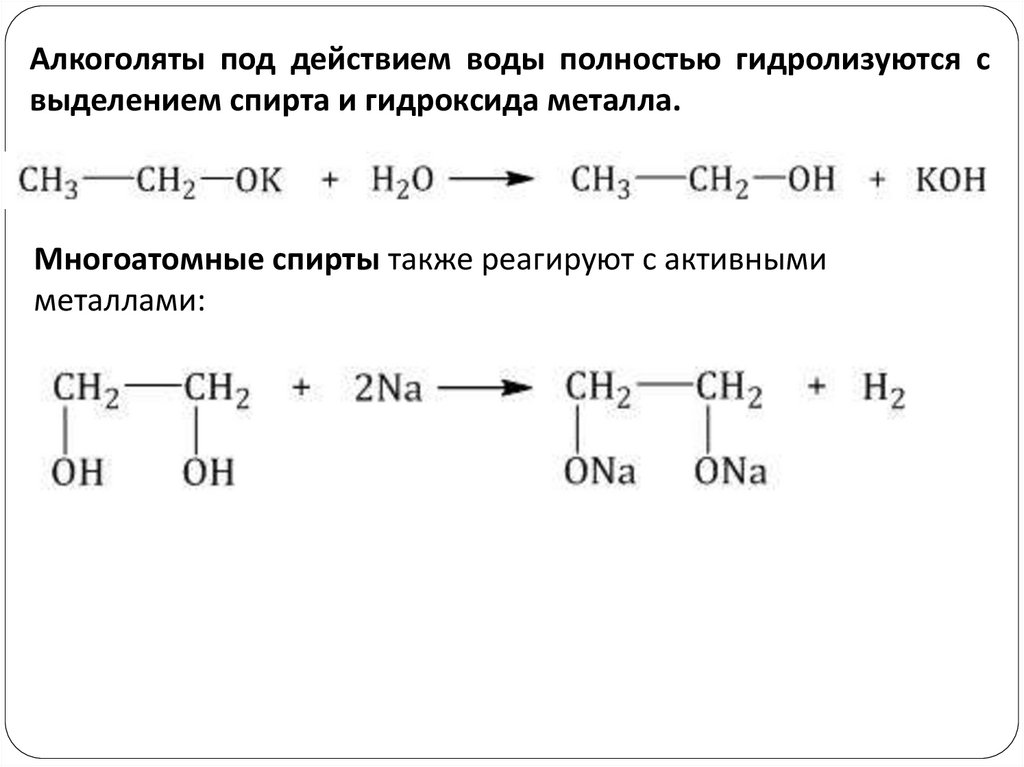
Алкоголяты под действием воды полностью гидролизуются свыделением спирта и гидроксида металла.
Многоатомные спирты также реагируют с активными
металлами:
13.
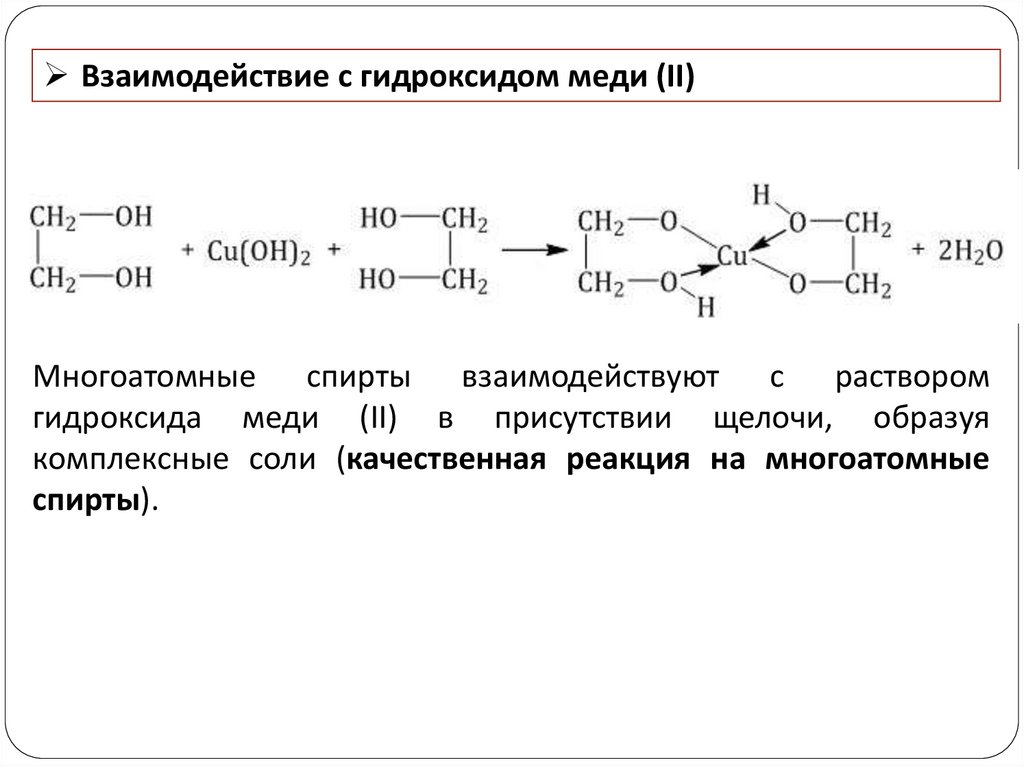
Взаимодействие с гидроксидом меди (II)Многоатомные спирты взаимодействуют с раствором
гидроксида меди (II) в присутствии щелочи, образуя
комплексные соли (качественная реакция на многоатомные
спирты).
14.
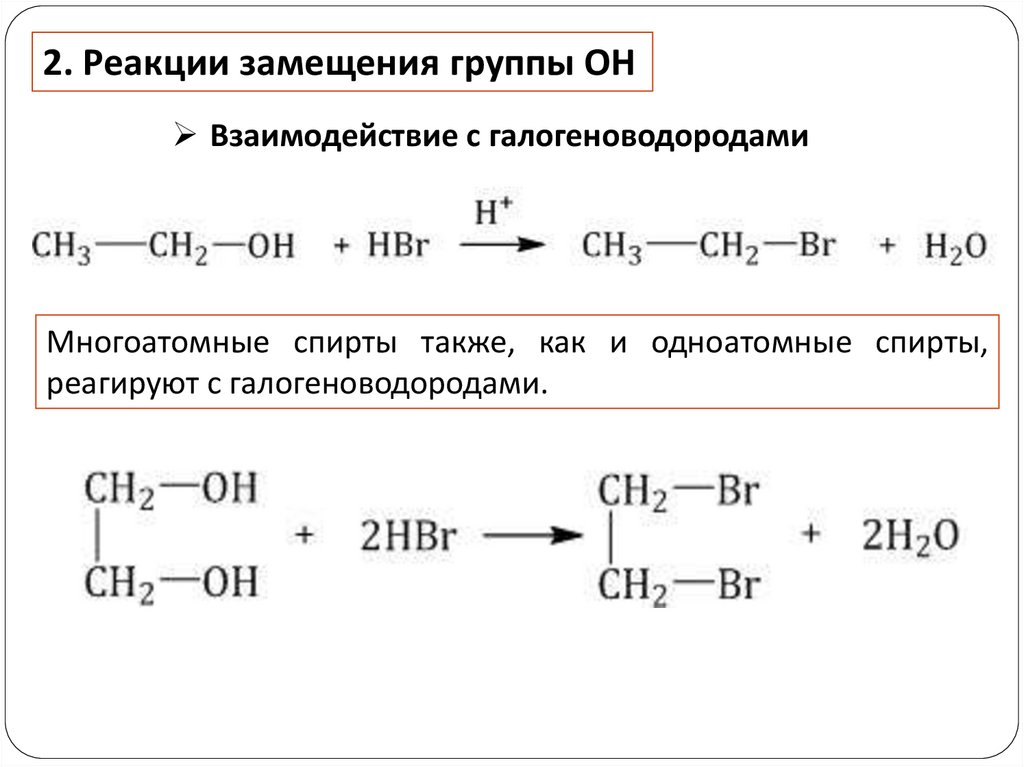
2. Реакции замещения группы ОНВзаимодействие с галогеноводородами
Многоатомные спирты также, как и одноатомные спирты,
реагируют с галогеноводородами.
15.
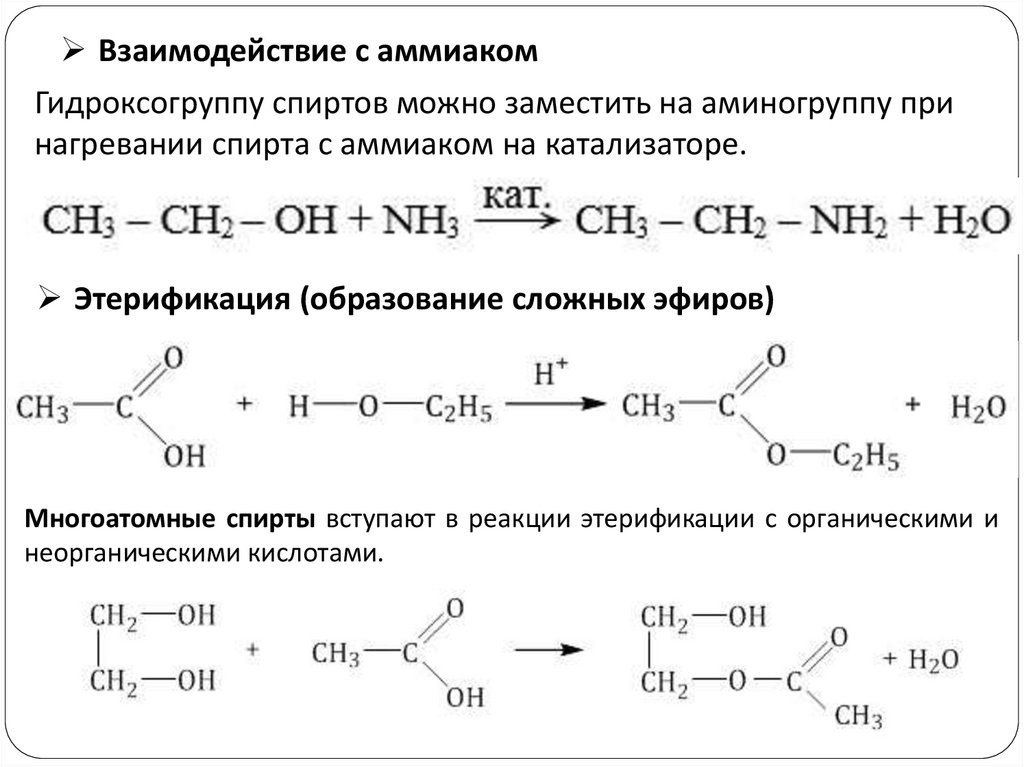
Взаимодействие с аммиакомГидроксогруппу спиртов можно заместить на аминогруппу при
нагревании спирта с аммиаком на катализаторе.
Этерификация (образование сложных эфиров)
Многоатомные спирты вступают в реакции этерификации с органическими и
неорганическими кислотами.
16.
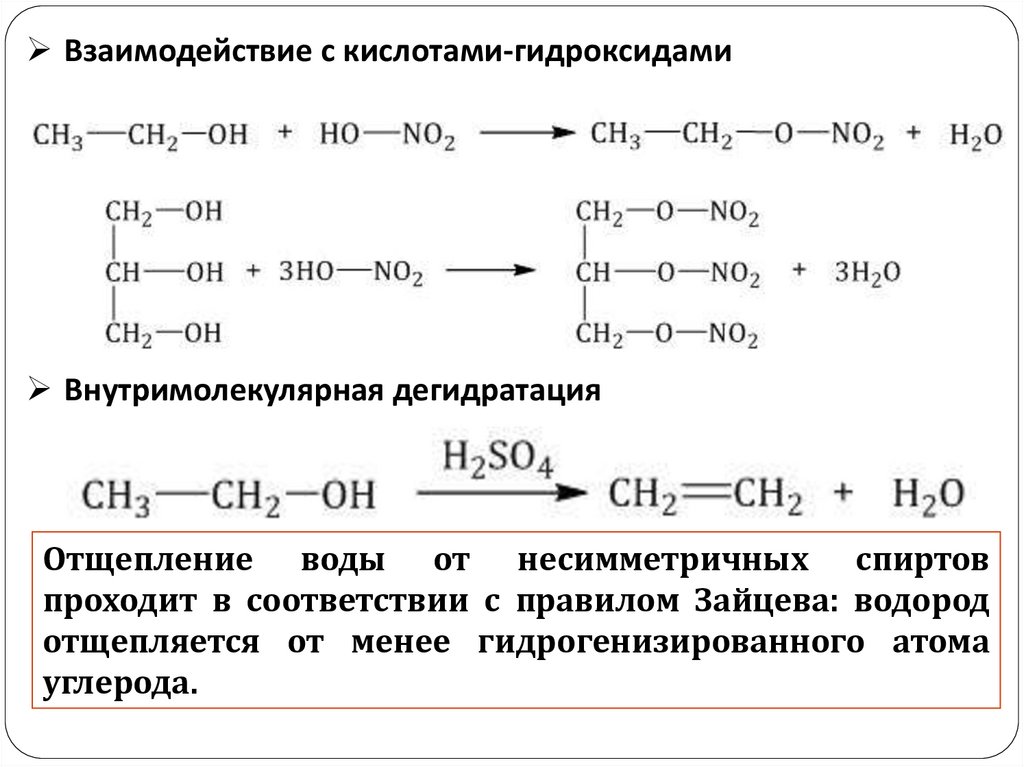
Взаимодействие с кислотами-гидроксидамиВнутримолекулярная дегидратация
Отщепление воды от несимметричных спиртов
проходит в соответствии с правилом Зайцева: водород
отщепляется от менее гидрогенизированного атома
углерода.
17.
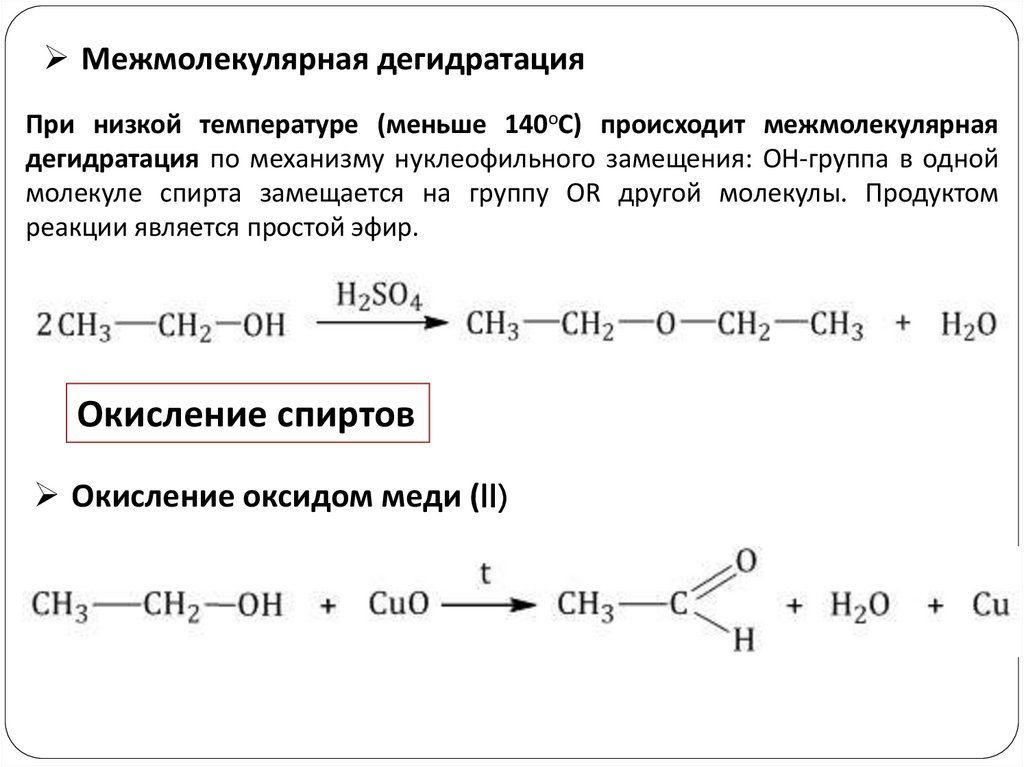
Межмолекулярная дегидратацияПри низкой температуре (меньше 140оС) происходит межмолекулярная
дегидратация по механизму нуклеофильного замещения: ОН-группа в одной
молекуле спирта замещается на группу OR другой молекулы. Продуктом
реакции является простой эфир.
Окисление спиртов
Окисление оксидом меди (II)
18.
Окисление кислородом в присутствии катализатораCпирты можно окислить кислородом в присутствии
катализатора (медь, оксид хрома (III) и др.). Первичные
спирты окисляются до альдегидов, вторичные до
кетонов, а метанол окисляется до метаналя.
19.
Жесткое окислениеПри жестком окислении под действием перманганатов или
соединений хрома (VI) первичные спирты окисляются до
карбоновых кислот
вторичные спирты окисляются до кетонов
метанол окисляется до углекислого газа.
20.
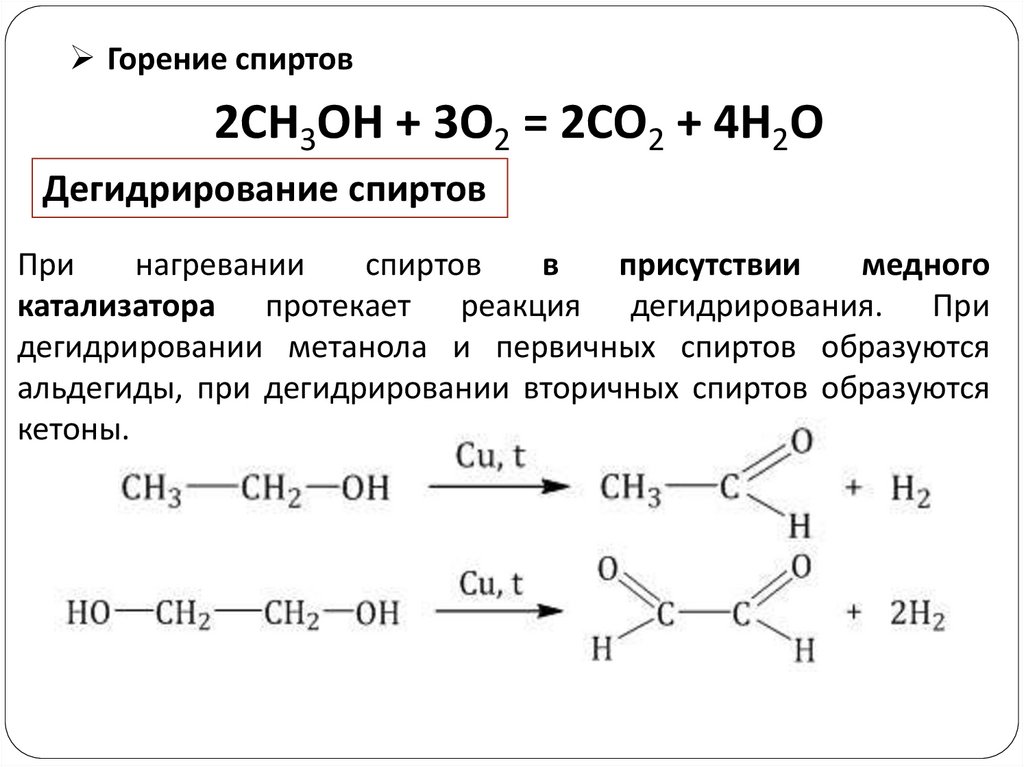
Горение спиртов2CH3OH + 3O2 = 2CO2 + 4H2O
Дегидрирование спиртов
При
нагревании
спиртов
в
присутствии
медного
катализатора протекает реакция дегидрирования. При
дегидрировании метанола и первичных спиртов образуются
альдегиды, при дегидрировании вторичных спиртов образуются
кетоны.
21.
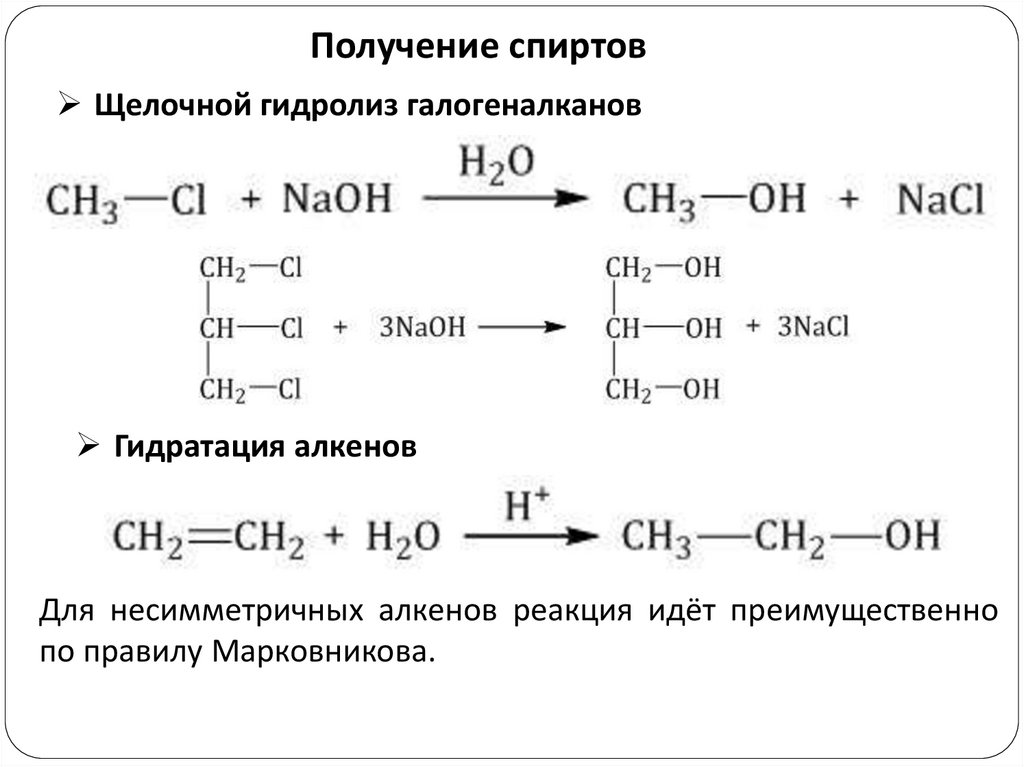
Получение спиртовЩелочной гидролиз галогеналканов
Гидратация алкенов
Для несимметричных алкенов реакция идёт преимущественно
по правилу Марковникова.
22.
Окисление алкеновперманганата калия
холодным
водным
раствором
Промышленное получение метанола из «синтез-газа»
CO + 2H2 ⇄ CH3OH
Каталитический синтез метанола из монооксида
углерода и водорода при 300-400°С и давления 500 атм в
присутствии смеси оксидов цинка, хрома и др.





 chemistry
chemistry








