Similar presentations:
Спирты
1.
СпиртыАйрапетян Л.Р.
2021 г
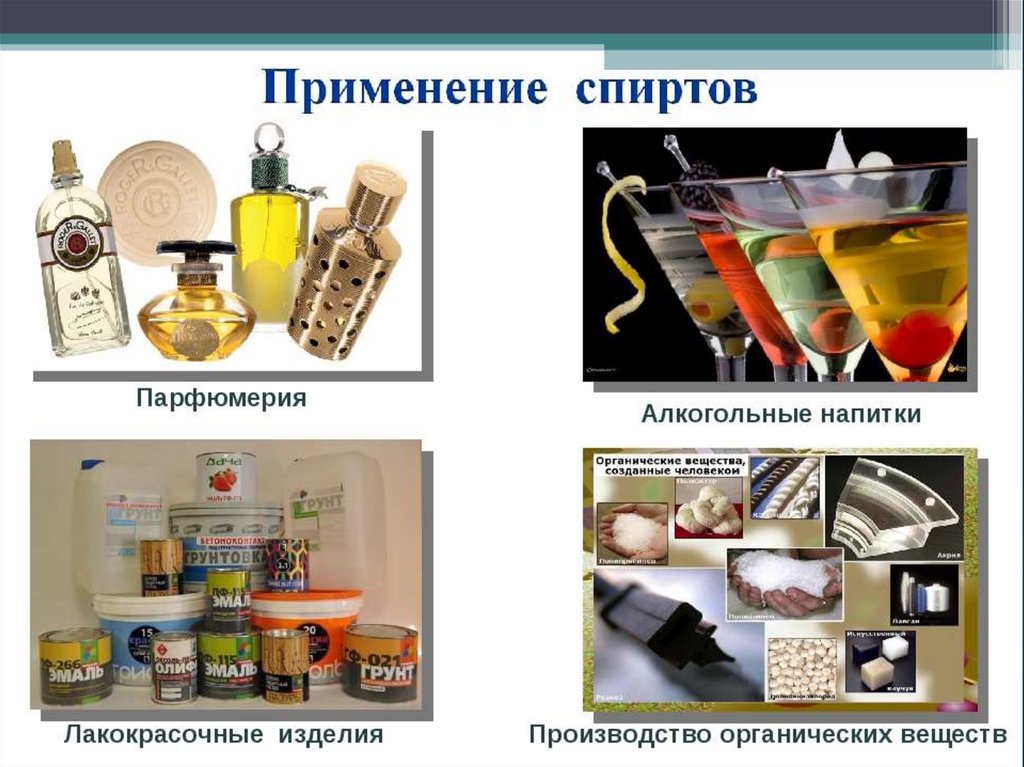
2. Применение
Этилового спирта- Производство синтетического каучука
- Материал для получения медикаментов, духов,
лаков, красителей
- Получают уксусную кислоту и др. вещества
- Растворитель лекарственных препаратов
- Дезинфицирующее средство
- Используют для приготовления экстрактов и настоек
- Спиртные напитки
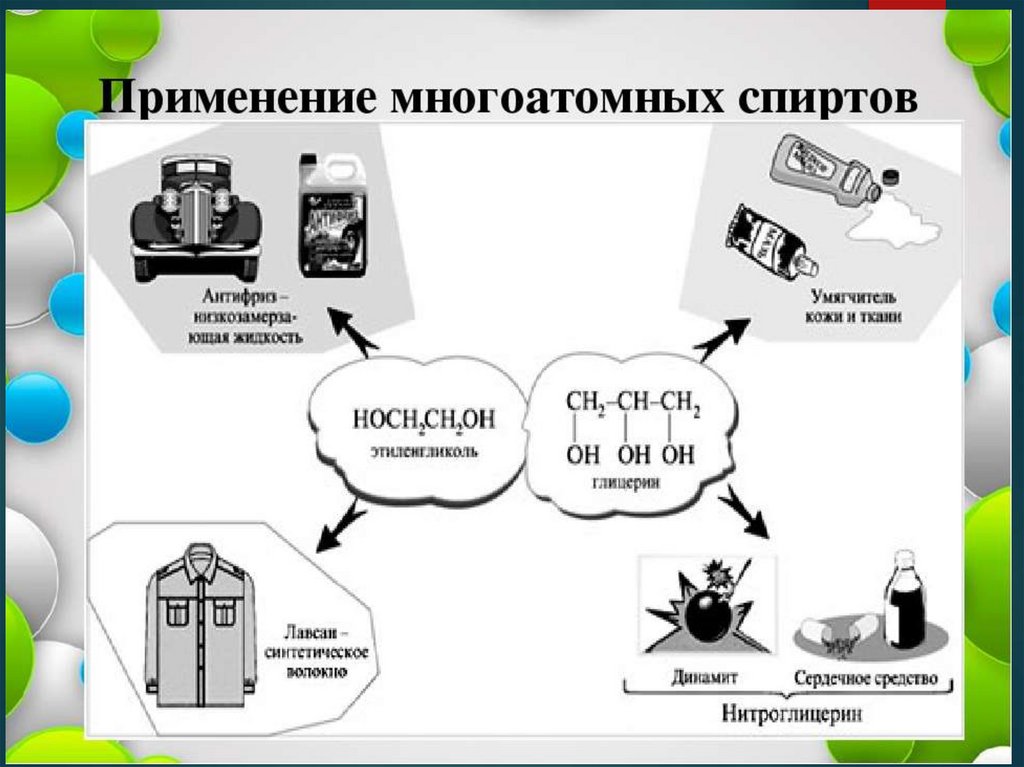
3. Применение
Глицерина- для получения нитроглицерина, из которого производят
динамит, бездымный порох и другие взрывчатые
вещества, применяемые в мирных целях и военном деле,
используют в качестве незамерзающих растворов в
различных двигателях, тормозной и нагревающей
жидкости, для охлаждения стволов орудий.
- для приготовления экстрактов чая, кофе, имбиря и
других растительных веществ, которые измельчают,
увлажняют и обрабатывают глицерином, нагревают и
извлекают водой для получения экстракта, содержащего
около 30 % глицерина.
- при производстве безалкогольных напитков. Глицерин
используют при получении горчицы, желе и уксуса.
4. Применение
Глицерина- при обработке семян и сеянцев. Разбавленные
растворы глицерина помогают прорастанию овса и
других злаков.
Глицерин находит широкое применение в медицине и
производстве фармацевтических препаратов. Глицерин
обладает антисептическими свойствами, поэтому его
применяют для предотвращения заражения ран.
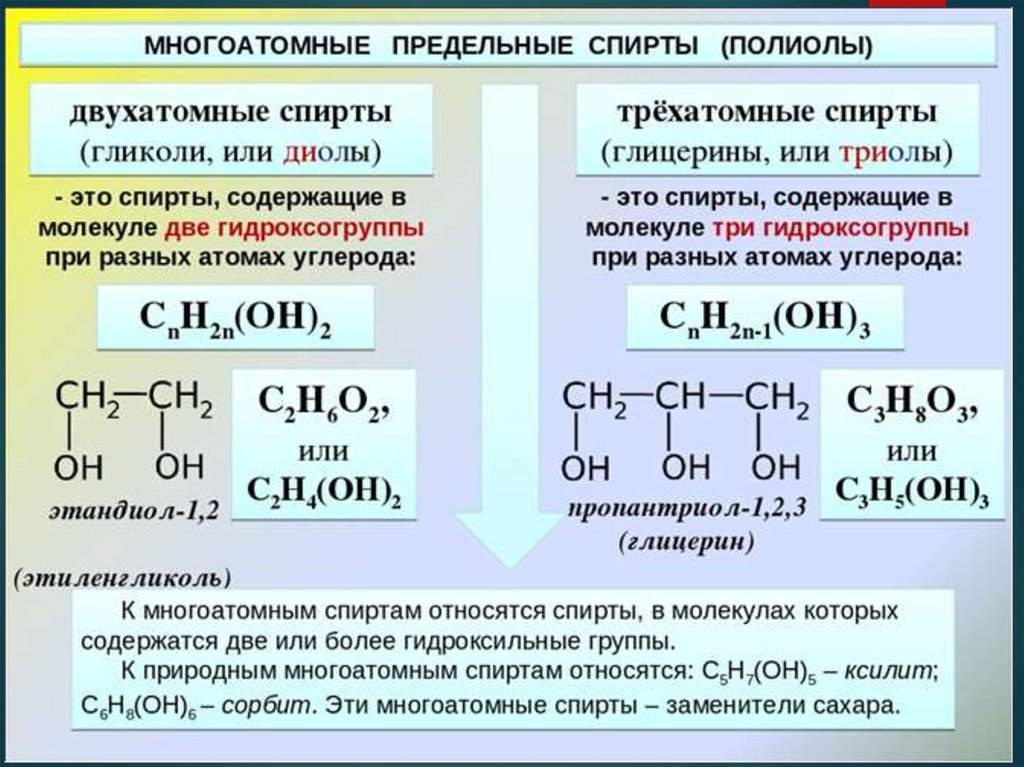
Этиленгликоля
- производство пластмасс
- производство антифриза – незамерзающей жидкости
- производство синтетического волокна - лавсан
- сырье в органическом синтезе
5.
6.
7. Одноатомные спирты
Предельные одноатомные спирты - этопроизводные предельных углеводородов, в
молекуле которых один атом водорода
замещён на гидроксильную группу.
Общая формула: CnH2n+1OH
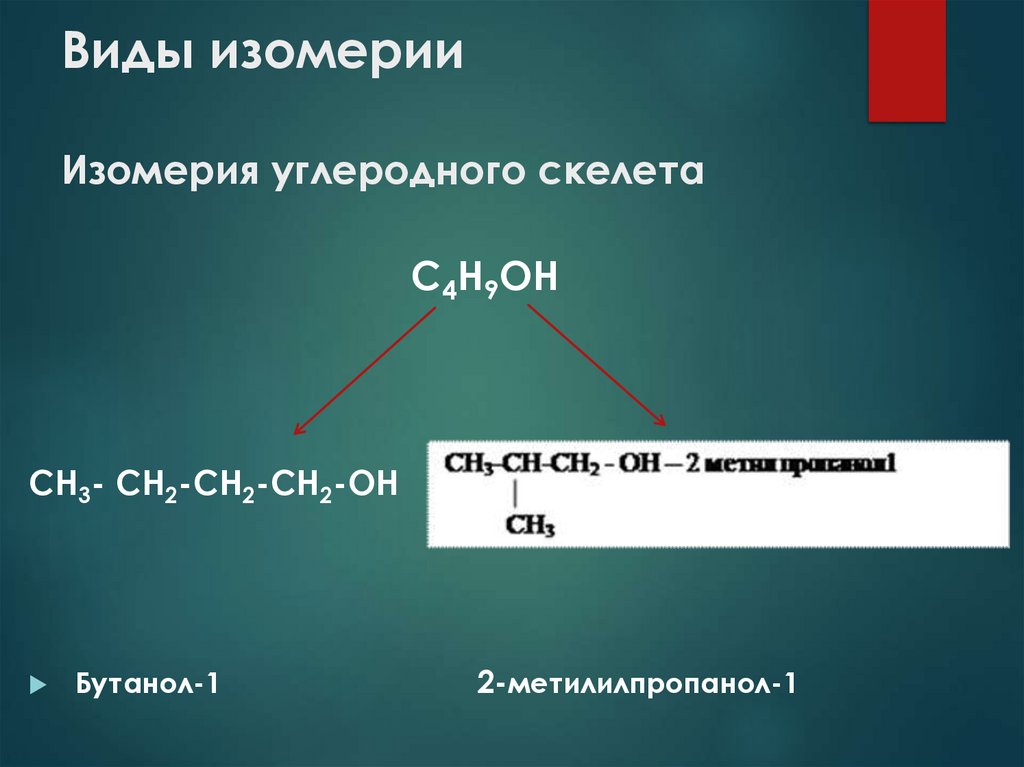
8. Виды изомерии Изомерия углеродного скелета
С4Н9ОНСН3- СН2-СН2-СН2-ОН
Бутанол-1
2-метилилпропанол-1
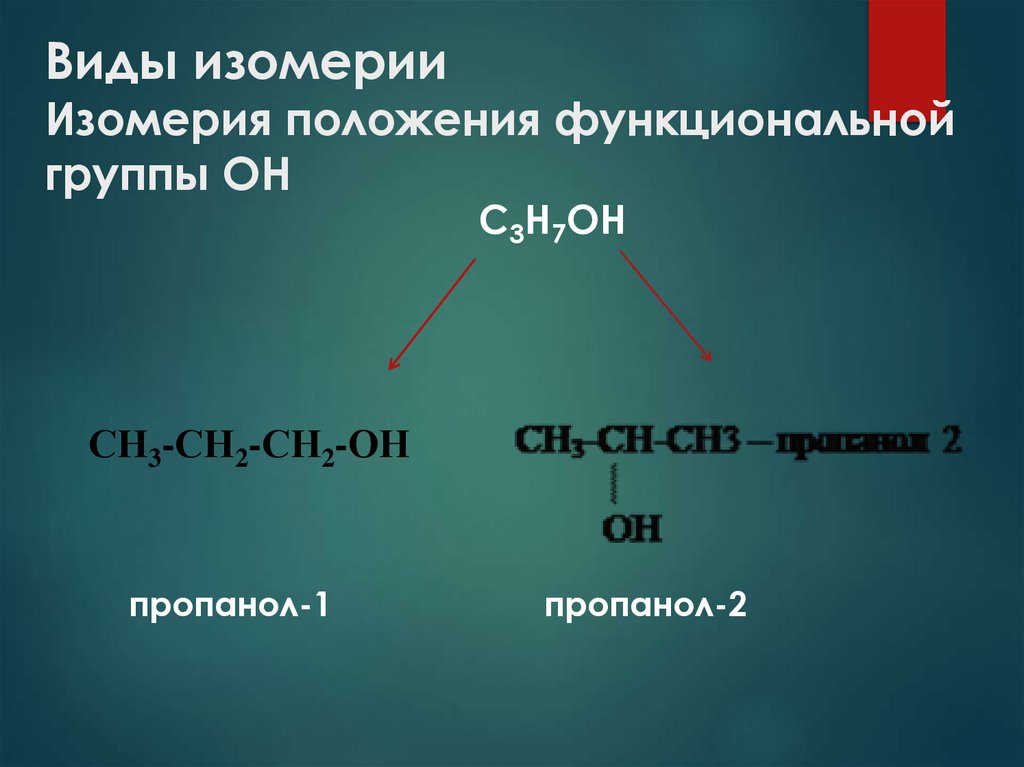
9. Виды изомерии Изомерия положения функциональной группы ОН
С3Н7ОНСН3-СН2-СН2-ОН
пропанол-1
пропанол-2
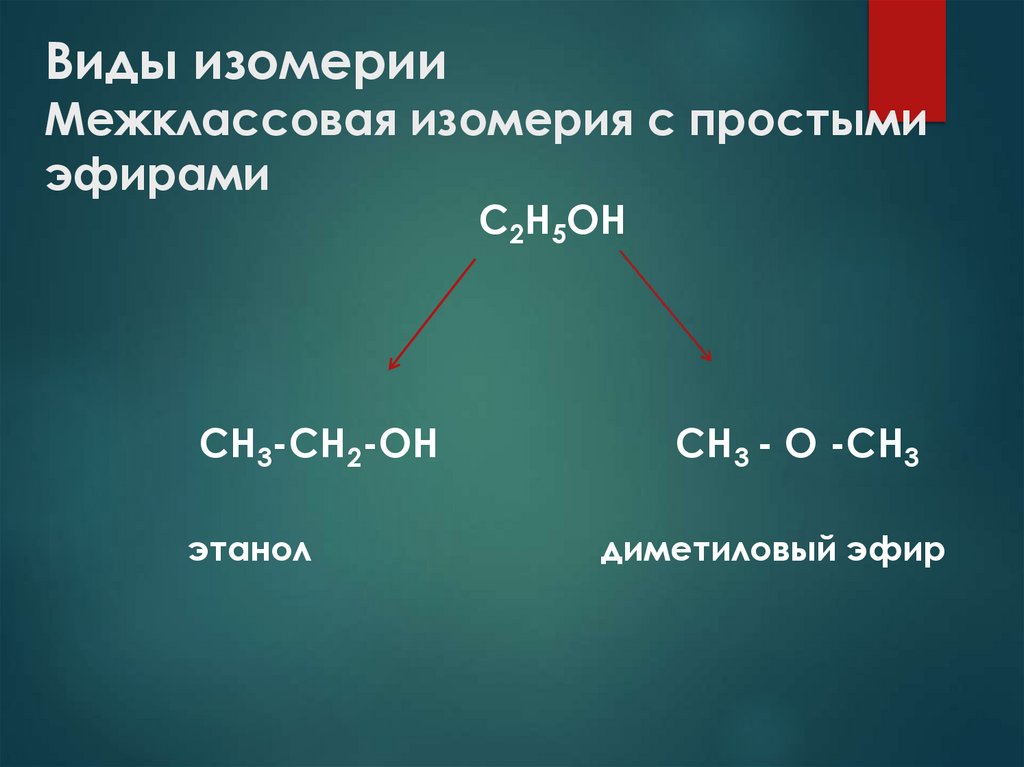
10. Виды изомерии Межклассовая изомерия с простыми эфирами
С2Н5ОНСH3-CH2-OH
этанол
СH3 - O -CH3
диметиловый эфир
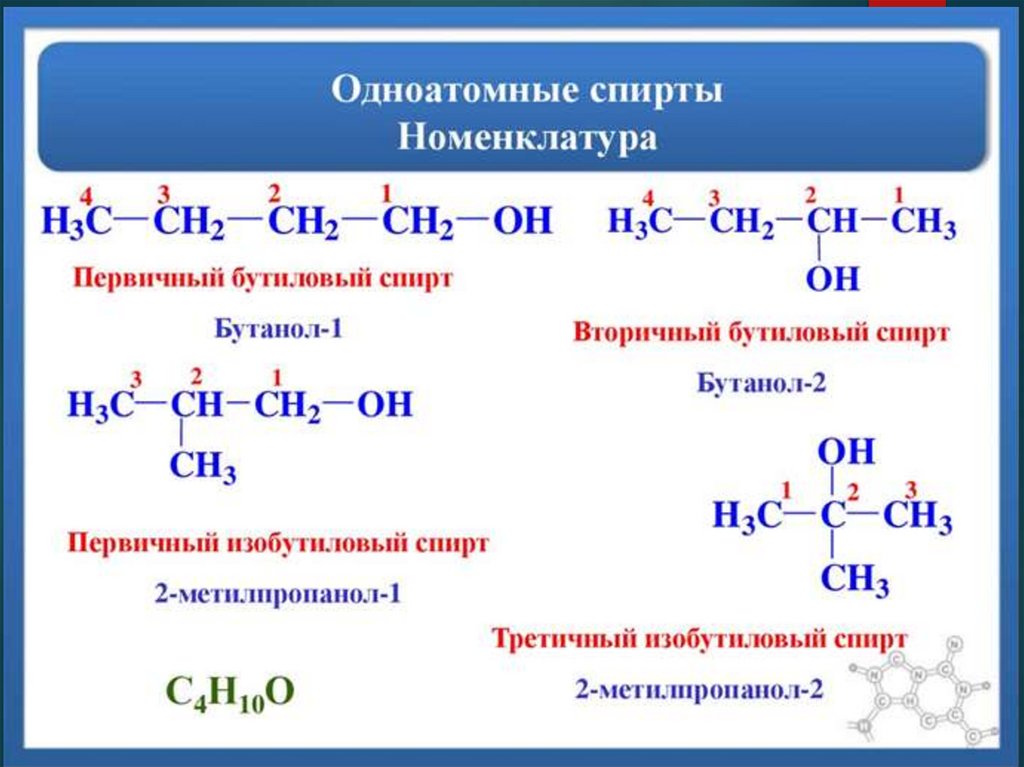
11. Номенклатура
12. Номенклатура
13. Химические свойства
1. Со щелочными и щелочно-земельнымиметаллами:
2C2H5OH + 2К → 2С2Н5ОК + Н2 этилат калия
2. Горение: C2H5OH+3O2 →2CO2+ 3H2O
3. C галогеноводородами:
C2H5OH+HBr → C2H5Br+H2O
4. C кислотами (образуются сложные эфиры)
реакция этерификации:
C2H5OH+СH3COOH →CH3COOC2H5
14. Химические свойства
5.Окисление:5.1.Cпирты можно окислить оксидом меди (II) при
нагревании (качественная реакция). При этом медь
восстанавливается до простого вещества. Первичные
спирты окисляются до альдегидов, вторичные до
кетонов, а метанол окисляется до метаналя.
Этанол окисляется оксидом меди до уксусного
альдегида
C2H5OH+CuO →CH3COH+H2O+Cu
Пропанол-2 окисляется оксидом меди (II) при
нагревании до ацетона
CH3- CHOH -CH3+CuO →CH3 –CO- CH3 +H2O+Cu
15. Химические свойства
5.2.Cпирты можно окислить кислородом вприсутствии катализатора (медь, оксид хрома (III) и
др.). Первичные спирты окисляются до альдегидов,
вторичные до кетонов, а метанол окисляется до
метаналя.
При окислении пропанола-1 образуется пропаналь
Пропанол-2 окисляется кислородом при нагревании
в присутствии меди до ацетона.
16. Химические свойства
5.3. При жестком окислении под действием перманганатов илисоединений хрома (VI) первичные спирты окисляются до
карбоновых кислот, вторичные спирты окисляются до кетонов,
метанол окисляется до углекислого газа.
При взаимодействии метанола с перманганатом калия в
серной кислоте образуется углекислый газ
5CH3OH+6KMnO4 + 9H2SO4 → 5CO2 +3K2SO4+6MnSO4 + 19H2O
При взаимодействии этанола с перманганатом калия в серной
кислоте образуется уксусная кислота
5C2H5OH + 4KMnO4 + 6H2SO4 → 5CH3COOH + 2K2SO4 + 4MnSO4 +
11H2O
При взаимодействии изопропанола с перманганатом калия в
серной кислоте образуется ацетон
5CH3- CHOH-CH3+4KMnO4+6H2SO4 →5CH3 –CO-CH3 +2K2SO4 +
4MnSO4 +11H2O
17. Химические свойства
6. Спирты взаимодействуют и с неорганическимикислотами, например, азотной или серной.
При взаимодействии этанола с азотной кислотой
образуется сложный эфир этилнитрат:
18. Химические свойства
7.1. Внутримолекулярная дегидратацияПри высокой температуре (больше 140оС)
происходит внутримолекулярная дегидратация и
образуется соответствующий алкен.
Из этанола под действием концентрированной
серной кислоты при температуре выше 140 градусов
образуется этилен:
В качестве катализатора этой реакции также
используют оксид алюминия.
Отщепление воды от несимметричных спиртов проходит в
соответствии с правилом Зайцева: водород отщепляется от
менее гидрогенизированного атома углерода.
19. Химические свойства
В присутствии концентрированной серной кислотыпри нагревании выше 140оС из бутанола-2 в
основном образуется бутен-2:
20. Химические свойства
7.2. Межмолекулярная дегидратацияПри низкой температуре (меньше 140оС)
происходит межмолекулярная дегидратация по
механизму нуклеофильного замещения: ОН-группа в
одной молекуле спирта замещается на группу OR
другой молекулы. Продуктом реакции является
простой эфир.
При дегидратации этанола при температуре до
140оС образуется диэтиловый эфир:
H2SO4
2СН3-СН2-ОН ----→ СН3-СН2-О-СН2-СН3 + Н2О
21. Химические свойства многоатомных спиртов
1. Многоатомные спирты также реагируют сактивными металлами:
2. Многоатомные спирты взаимодействуют с раствором
гидроксида меди (II) в присутствии щелочи, образуя
комплексные соли (качественная реакция на
многоатомные спирты).
При взаимодействии этиленгликоля со свежеосажденным
гидроксидом меди (II) образуется ярко-синий раствор гликолята
меди:
22. Химические свойства многоатомных спиртов
При взаимодействии глицерина со свежеосажденнымгидроксидом меди (II) образуется раствор глицерата
меди:
3.Многоатомные спирты также, как и одноатомные
спирты, реагируют с галогеноводородами.
Этиленгликоль реагирует с бромоводородом:
23. Химические свойства многоатомных спиртов
4. Многоатомные спирты вступают в реакции этерификации сорганическими и неорганическими кислотами.
Этиленгликоль реагирует с уксусной кислотой с образованием
ацетата этиленгликоля:
5. Спирты взаимодействуют и с неорганическими кислотами,
например, азотной или серной.
Глицерин под действием азотной кислоты образует тринитрат
глицерина (тринитроглицерин):
24. Получение
1. Щелочной гидролиз галогеналкановПри взаимодействии галогеналканов с водным раствором
щелочей образуются спирты. Атом галогена в
галогеналкане замещается на гидроксогруппу.
При нагревании хлорметана с водным раствором
гидроксида натрия образуется метанол
Глицерин можно получить щелочным гидролизом 1,2,3трихлорпропана:
25. Получение
2. Гидратация алкеновГидратация (присоединение воды) алкенов протекает в
присутствии минеральных кислот. При присоединении
воды к алкенам образуются спирты.
При взаимодействии этилена с водой образуется
этиловый спирт.
Для несимметричных алкенов реакция идёт преимущественно
по правилу Марковникова.
При взаимодействии пропилена с водой образуется
преимущественно пропанол-2.
26. Получение
3. Гидрирование карбонильных соединенийПрисоединение водорода к альдегидам и кетонам
протекает при нагревании в присутствии катализатора.
При гидрировании альдегидов образуются первичные
спирты, при гидрировании кетонов — вторичные спирты, а
из формальдегида образуется метанол.
При гидрировании этаналя образуется этанол
27. Получение
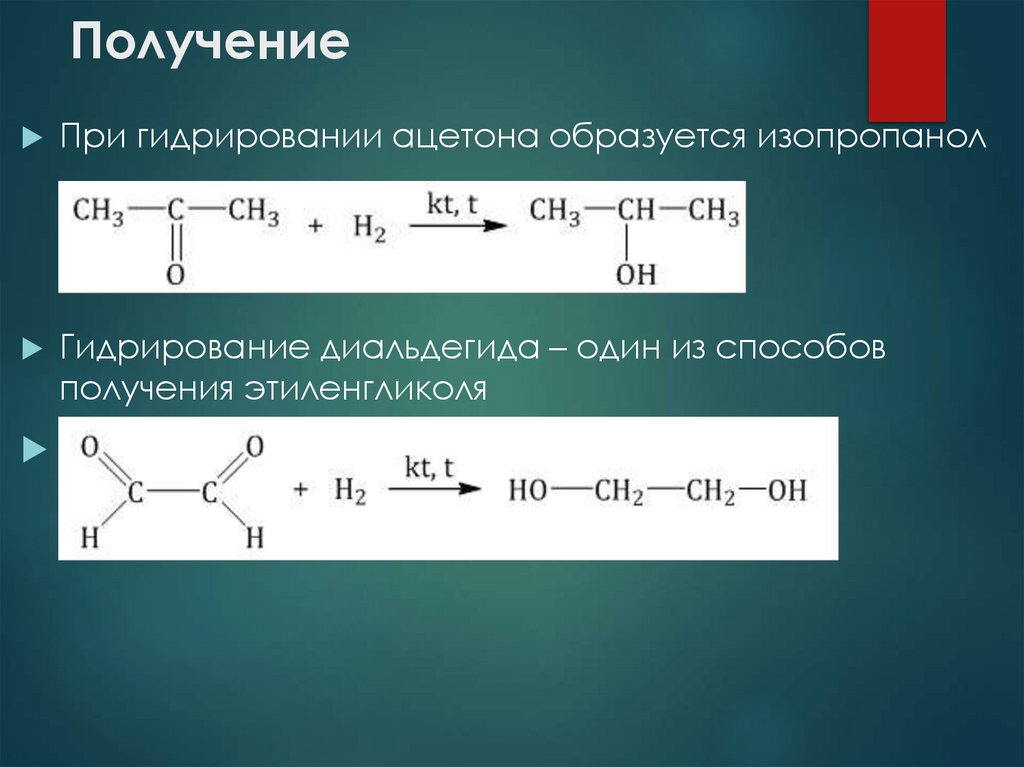
При гидрировании ацетона образуется изопропанолГидрирование диальдегида – один из способов
получения этиленгликоля
28. Получение
4. Окисление алкенов холодным водным растворомперманганата калия
Алкены реагируют с водным раствором перманганата
калия без нагревания (0oC). При этом образуются
двухатомные спирты (гликоли).
3R-CH=CH2+2KMnO4 + 4H2O → 3R-CHOH-CH2OH
+2KOH+2MnO2
5. Промышленное получение метанола из «синтез-газа»
Каталитический синтез метанола из монооксида
углерода и водорода при 300-400°С и давления 500 атм в
присутствии смеси оксидов цинка, хрома и др.
Сырьем для синтеза метанола служит «синтез-газ» (смесь
CO и H2), обогащенный водородом: CO + 2H2 ⇄ CH3OH
29. Получение
6. Получение этанола спиртовым брожением глюкозыДля глюкозы характерно ферментативное брожение, то
есть распад молекул на части под действием ферментов.
Один из вариантов — спиртовое брожение.
7. Гидролиз жиров – способ получения многоатомных
спиртов
Под действием кислоты жиры гидролизуются до глицерина
и карбоновых кислот, которых входили в молекулу жира.
При гидролизе тристеарата глицерина образуется
глицерин и стеариновая кислота
30. Получение
6. Получение этанола спиртовым брожением глюкозыДля глюкозы характерно ферментативное брожение, то
есть распад молекул на части под действием ферментов.
Один из вариантов — спиртовое брожение.
7. Гидролиз жиров – получение многоатомных спиртов
Под действием кислоты жиры гидролизуются до глицерина
и карбоновых кислот, которых входили в молекулу жира.
При гидролизе тристеарата глицерина образуется
глицерин и стеариновая кислота
31. Получение
7. Гидролиз жиров – получение многоатомных спиртовПри щелочном гидролизе жиров образуется глицерин и
соли карбоновых кислот, входивших в состав жира.
При щелочном гидролизе тристеарата глицерина
образуется глицерин и соль стеариновой кислоты
(стеарат)
32. Домашнее задание
Прочитать § 10.1. Вопросы и задания 2-5 стр.19633. литература
1. О.С. Габриелян, И.Г. Остроумов «Химия дляпрофессий и специальностей технического
профиля», Москва, Издательский центр «Академия»,
2018.
2. О.С. Габриелян, Г.Г. Лысова «Химия: тесты, задачи и
упражнения», Москва, Издательский центр
«Академия», 2018.

























 chemistry
chemistry








