Similar presentations:
Химические свойства и способы получения простых веществ неметаллов
1.
Химические свойствапростых веществ
неметаллов
2.
Н2 - водородСпособы собирания: вытеснением воды, воздуха
• газ без цвета и запаха
• t кип = -253 оС
• плохо растворим в воде
• сильный восстановитель
Получение водорода:
1. Взаимодействие активных металлов с кислотами - неокислителями:
Zn + 2HCl → ZnCl2 + H2↑
2. Взаимодействие алюминия (или цинка) с водными растворами щелочей:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
3. Электролиз воды и водных растворов щелочей и солей:
2H2O → 2H2↑ + O2↑
2NaCl + 2H2O → H2↑ + Cl2↑ + 2NaOH
4. Пропускание паров воды над раскалённым углём при 1000°C:
C + H2O ↔ CO + H2
5. Конверсия метана при 900°C:
CH4 + H2O ↔ CO + 3H2
*Методы (1,2) используют в лаборатории, (3-5) - в промышленности.
3.
Химические свойства водорода:*При обычных условиях малоактивен (реагирует только с F, Na, K, Li, Ca, Ba)
1. С неметаллами:
• H2 + O2 → H2O
*Гремучий газ - взрывчатая смесь, состоящая из 2 объемов водорода и 1
объема кислорода при поджигании взрывается.
• H2 + S → H2S (при 150-250 °С)
• H2 + N2 → NH3 (p; t°)
• H2 + Г2 → HГ (t°)
• H2 + CO2 → CH4 + H2O (kat; 200 оС)
• H2 + С → СH4 (Fe; 600 оС)
2. С щелочными и щелочноземельными металлами:
H2 + 2Li → 2LiH
H2 + Ca → CaH2
3. С оксидами металлов (метод получения малоактивных металлов Pb, Mo, W, Ni, Cu и др.
из их оксидов):
H2 + СuO → Cu + H2O (t°)
4.
Галогены:F2, Cl2, Br2, I2
Получение кислорода:
1. Электролиз растворов и расплавов галогенидов: 2NaCl + 2H2O = Cl2 + H2 + 2NaOH
2KF = 2K + F2 (единственный способ полученияя F2)
2. Окисление галогенводородов:14HBr + K2Cr2O7 = 2KBr + 2CrBr3 + 3Br2 + 7H2O
2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2 + 8H2O – Лабораторный способ получения хлора
MnO2 + 4HHal = MnHal2 + Hal2 + 2 H2O – Лабораторный - для получения хлора, брома, иода
3. Промышленный способ – окисление хлором (для брома и йода):
2KBr + Cl2 = 2KCl + Br2
2KI + Cl2 = 2KCl + I2
4. Вытеснение менее активных галогенов более активными галогенами: CaI2 + Cl2 = CaCl2 + I2
5.
Химические свойства:1. С металлами: 2K + Cl2→2KCl
Mg + Cl2→MgCl2
2. С неметаллами:
• с водородом: H2 + Cl2 → 2HCl
• с серой: S + F2 = SF6
S +Cl2 = SCl2
*с I2 не реагирует!!!
• с фосфором: P + F2 = PF5
P + Cl2 = PCl3 / PCl5
P + Br2 = PBr3 / PBr5
• фтор реагирует с графитом при t > 900oC: F2 + C = CF4
3. Взаимодействие со щелочами на холоду:
2NaOH + Cl2 → NaCl + NaClO + H2O
4. Взаимодействие со щелочами при нагревании:
6NaOH + 3Cl2 → 5NaCl + NaClO3 + 3H2O
5.Вытеснение менее активных галогенов из галогенидов:
2KBr + Cl2 → 2KCl + Br2
6. С водой: H2O + Cl2 ↔ HCl + HClO (хлорная вода)
6.
О2 - кислородПолучение кислорода:
1. Лабораторные способы:
• электролиз воды: 2H2O = 2H2 + O2
• разложение оксида ртути (II): 2HgO = 2Hg + O2
• разложение перманганата калия:
2KMnO4 = K2MnO4 + MnO2 + O2
• разложение перекиси водорода (в присутствии МnO2):
2H2O2 = 2H2О + O2
• разложение хлората калия (бертолетовой соли):
2KClO3 = 2KCl + 3O2
• разложение нитратов активных металлов:
2KNO3 = 2KNO2 + O2
2. Промышленный способ: из воздуха охлаждением
• газ без цвета и запаха
• t кип = -183 оС
• мало растворим в воде
• сильный окислитель
• проявляет высокую
реакционную способность
7.
Химические свойства кислорода:1. Сильный окислитель, взаимодействует практически со всеми элементами,
образуя оксиды.
*Как правило, реакция окисления протекает с выделением
тепла и ускоряется при повышении температуры.
реакции, протекающие при комнатной температуре:
4Li + O2 → 2Li2O
и
2Sr + O2 → 2SrO
2. Окисляет соединения, которые содержат элементы с не максимальной степенью
окисления:
2NO + O2 → 2NO2
3. Образует пероксиды со степенью окисления атома кислорода, формально равной −1.
*пероксиды получаются при сгорании щелочных металлов в кислороде:
2Na + O2 → Na2O2
4. Взаимодействие пероксидов с кислородом при повышенных давлении и температуре:
*в надпероксидах кислород формально имеет степень окисления −½
Na2O2 + O2 → NaO2
K, Rb и Cs реагируют с кислородом с образованием надпероксидов:
K + O2 → KO2
8.
Особые реакции:С фосфором:
• при недостатке О2 3O2 + 4P = P4O6
• при избытке О2 5O2 + 4P = P4O10
С Сероводородом:
• в водном растворе или при недостатке О2
О2 + 2H2S = 2H2O + 2S
• горение
3О2 + H2S = 2H2O + 2SO2
11O2 + 4FeS2 = 2Fe2O3 + 8SO2
O2 + H2O + 2NO2 = 2HNO3
4Fe(OH)2 + O2 + H2O = 4Fe(OH)3
9.
Фториды кислорода1. Дифторид кислорода, OF2, получают пропусканием фтора
через раствор щелочи:
2F2 + 2NaOH → 2NaF + H2O + OF2
2. Монофторид кислорода (Диоксидифторид), O2F2,
нестабилен, степень окисления кислорода +1. Получают из
смеси фтора с кислородом в тлеющем разряде при
температуре −196 °C:
F2 + O2 → O2F2
10.
S - сераПолучение серы:
1. Промышленный метод – выплавление из
руды с помощью водяного пара.
2. Неполное окисление сероводорода (при
недостатке кислорода)
2H2S + O2 = 2S + 2H2O
3. Восстановление сернистого газа
SO2 + C = S + CO2
SO2 + CO = S + 2CO2
*Реакция Векенродера
2H2S + SO2 = 3S + 2H2O
• неметалл желтого цвета
• t пл = 119,3 оС
• нерастворима в воде
• сильный восстановитель
• вступает в реакции
диспропорционирования
11.
Химические свойства серы:При нагревании непосредственно реагирует со многими простыми веществами,
кроме инертных газов, N, Se, Te, Au, Pt, Ir, I2
1. С металлами → сульфиды: Na + S = Na2S
*При комнатной t реагирует только с ртутью.
2. C водородом при t=150-200оС: Н2 + S = H2S
3. С кислородом (в кислороде t=280оС, на воздухе t= 360оС).
Образуется смесь оксидов: S + O2 = SO2 и
2S + O2 = 2SO3
4. С фосфором и углеродом (при нагревании без доступа воздуха):
2P + 3S = P2S
2S + C = CS2
5. C фтором и другими галогенами, кроме I2:
S + F2 = SF6
S + Cl2 = SCl2
6. Со сложными веществами (ведет себя как восстановитель)
S + 6HNO3 = 6NO2 + Н2О + H2SO4
S + 2H2SO4(конц) = 3SO2 + 2H2O
7. Реакция диспропорционирования (при взаимодействии со щелочами):
3S + 6KOH = K2SO3 + 2K2S + 3H2O
8. С водяным паром: 3S + 2H2O = SO2 + 2H2S
12.
N2 - азот• газ, без цвета, без запаха и вкуса.
• при охлаждении до -196о превращается в
бесцветную жидкость
• малорастворим в воде
• в обычных условиях малоактивен
• в ОВР вступает при нагревании
Получение азота:
1. Разложение нитрата аммония при нагревании
NH4NO3 = N2 + H2O
2. Взаимодействие смеси водных растворов нитрbта натрия и хлорида аммония
NaNO2 + NH4Cl = N2 + NaCl + 2H2O
3. В промышленности – из воздуха (различие в температурах кипения азота и кислорода)
13.
Химические свойства азота:1. Взаимодействует с металлами при нагревании, образуя нитриды:
3Mg + N2 → Mg3N2
*С литием реагирует при комнатной температуре, медленно:
6Li + N2 → 2Li3N
2. С кислородом и фтором азот проявляет восстановительные свойства (реакция протекает
при температуре электрической дуги >1200оС):
N2 + O2 → 2NO – Q
3. С водородом при температуре 400оС и давлении 200 атм. В присутствии катализатора –
Fe
3H2 + N2 → 2NH3
4. С другими неметаллами при высоких температурах:
2B + N2 → 2BN
*Не взаимодействует с водой, кислотами и щелочами
*С галогенами и серой на прямую не реагирует, но галогениды и
сульфиды могут быть получены косвенным способом
14.
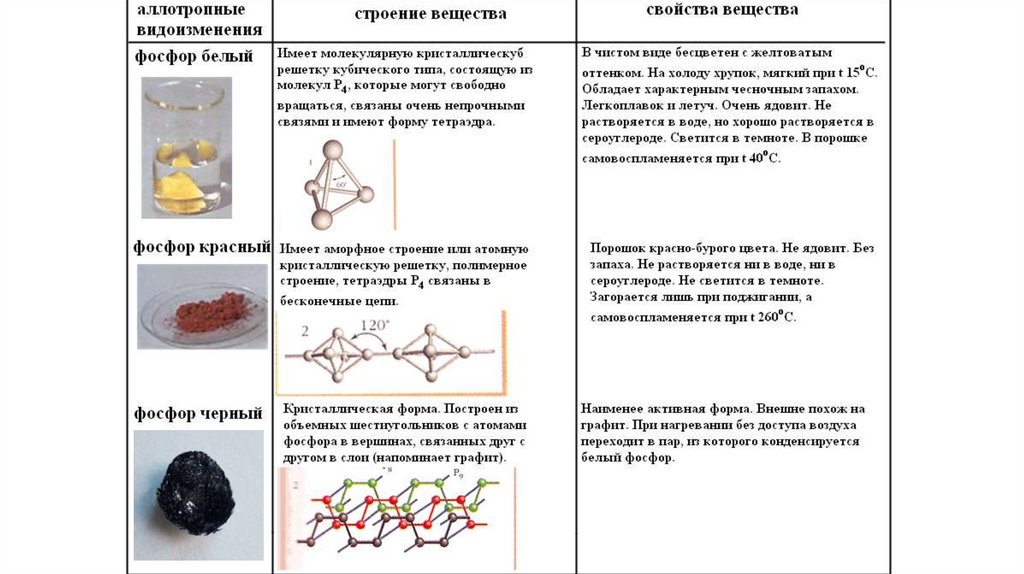
Р - фосфор• неметалл, существующих в нескольких
аллотропных модификациях
• t пл белого фосфора = -183 оС
• t пл красного фосфора = -183 оС
• t пл черного фосфора = -183 оС
Получение фосфора:
красный и черный фосфор получают из белого.
белый фосфор получают восстановлением фосфата кальция (сплавление в
электрической печи):
Ca3(PO4)2 + 3SiO2 + 5C → 3CaSiO3 + 5CO↑ + 2P↑
15.
16.
Химические свойства фосфора:1. Реакции с кислородом при нагревании:
4P + 5O2 →2P2O5 (при недостатке кислорода: 4P + 3O2 → 2P2O3)
2. С галогенами и серой:
2P + 3Cl2 → 2PCl3
2P + 5Cl2 → 2PCl5
2P + 5S →P2S5
галогениды фосфора легко разлагаются водой:
PCl3 + 3H2O → H3PO3 + 3HCl
PCl5 + 4H2O → H3PO4 + 5HCl
3. С азотной кислотой:
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO↑
4. С металлами образует фосфиды:
3Li + P → Li3P
2P + 3Mg →Mg3P2
*фосфид магния легко разлагается водой
Mg3P2 + 6H2O → 3Mg(OH)2 + 2PH3↑ (фосфин)
5. Диспропорционирует в щелочах:
P4 + 3NaOH + 3H2O → PH3↑ + 3NaH2PO2
6. С бертолетовой солью при ударе взрывается, воспламеняется: KClO3 + P = P2O5 + KCl
7. Красный фосфор реагирует с водой: 2P + 8H2O = 2H3PO4 + 5H2 (800oC; kat)
17.
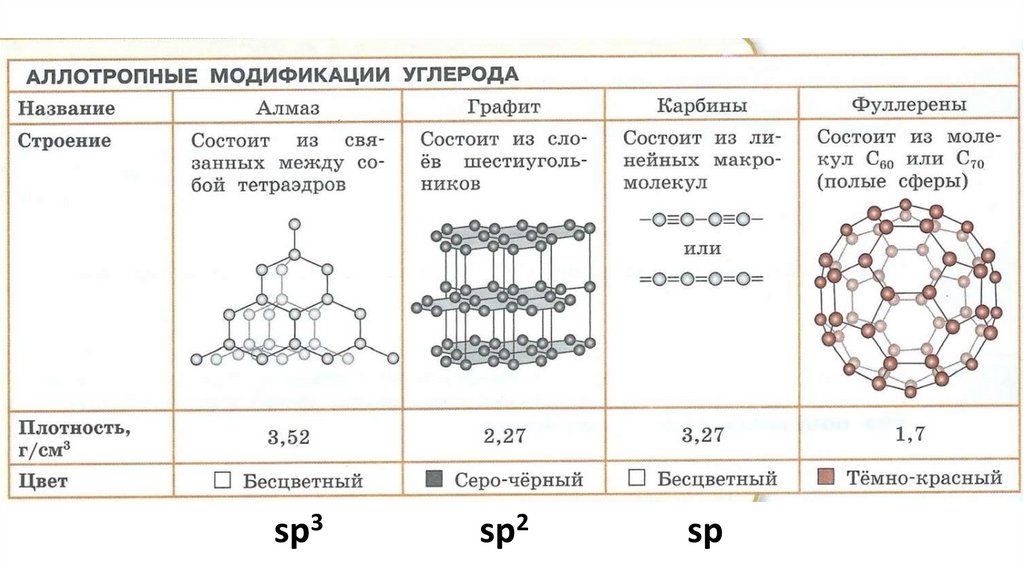
С - углеродАлмаз
t =2000 C без доступа воздуха
Графит
t =3000 C,Р=50 тыс. атм.,
катализатор Ni
Алмазы, полученные искусственным путём из графита, мелкие,
невысокого качества. Их используют в основном для технических целей,
а под названием фиониты – для ювелирных украшений.
Получение углерода:
При разложении древесины без доступа воздуха и при обугливании органических
соединений
С6Н12О6 = 6С + 6 Н2О (H2SO4 конц.)
18.
sp3sp2
sp
19.
Химические свойства углерода:Углерод - малоактивен, на холоде реагирует только со фтором;
химическая активность проявляется при высоких температурах.
1. С кислородом (при t°): C + O2 → CO2 (углекислый газ)
*при недостатке кислорода наблюдается неполное сгорание:
2C + O2 → 2CO (угарный газ)
2. С галогенами и серой: С + 2F2 → CF4
3. С водяным паром (при 1200°): C + H2O → СO + Н2 (водяной газ)
4. С оксидами металлов (при t°): C + 2CuO → 2Cu + CO2
5. С кислотами – окислителями:
C + 2H2SO4(конц.) → СO2↑ + 2SO2↑ + 2H2O
С + 4HNO3(конц.) → СO2↑ + 4NO2↑ + 2H2O
6. С некоторыми металлами образует карбиды: Ca + 2C → CaC2
7. С водородом: C + 2H2 → CH4
8. С сульфатом бария: 4C + BaSO4 = BaS + 4CO
9. С нитратом калия: 5С + 4KNO3 = 2K2CO3 + 3CO2 + 2N2
20.
Si - кремний• неметалл средней активности
• в расплавленном состоянии очень активен
• t пл = 1420 оС
Получение кремния:
1. В промышленности получают восстановлением кремнезема коксом в электрических
печах при 1500-1700оС
SiO2 + 2C = Si + 2CO
2. В лаборатории получают прокаливанием с магнием или алюминием белого песка
SiO2 + 2Mg = Si + 2MgO
3SiO2 + 4Al = 3Si + 2Al2O3
3. Чистый кремний получают: SiCl4 + 2Zn = Si + ZnCl2
21.
Химические свойства кремния:1. С кислородом: Si +O2 = SiO2
2. С галогенами: Si + Hal2 = SiHal4
3. С неметаллами:
Si + 2S = SiS2
2Si + 2N2 = Si3N4 (>1300оС)
Si + C = SiC (1200-1300оС)
4. С металлами образует силициды: Si + 2Mg = Mg2Si
5. C водой: Si + 2H2O = SiO2 + 2H2
6. Cо щелочами: Si + 2NaOH + H2O = Na2SiO3 + 2H2



















 chemistry
chemistry