Similar presentations:
ФКХ дәріс №!
1.
Қарағанды медициналық универстетіТақырып : Физикалық химия пәні. . Термодинамиканың бірінші
заңы.Жылу эффектісін анықтау.
Дисциплина: Физическлық және
коллоидтық химия
2. Дәріс жоспары
1. Физикалық химияның негіздері2. Химиялық термодинамика. Негізгі
тұ.
3. Термодинамиканың бірінші заңы.
4. Термохимия. Гесс заңы.
5. Жылу эффетісін анықтау.
6. Биоэнергетика.
3.
Физикалық химия нені оқытады?Мысалы, физикалық химия белсенді заттардың ерігіштігін,
кристалдану процестерін және дәрілік заттардың синтезі мен
сақталуымен бірге жүретін термиялық әсерлерді зерттейді.
Процесті зерттеу
Синтездеуден тұрақтандыруға дейінгі дәрілік заттар мен
өндіріс процестерінің қасиеттерін терең түсінеді.
Фармоцевтика үшін маңыздылығы
Синтездеуден тұрақтандыруға дейінгі дәрілік заттар мен өндіріс
процестерінің қасиеттерін терең түсінеді.
.
.
Мысалы, физикалық химия белсенді заттардың ерігіштігін,
кристалдану процестерін және препараттардың синтезі мен
сақталуын сүйемелдейтін жылу әсерлерін зерделейді
.
4. Химиялық термодинамиканың негізгі түсініктері
Термодинамика –энергияның жылу және
жұмыс түріндегі
ауысуымен байланысты
әртүрлі энергия түрлерінің
өзара түрленуін
зерттейтін ғылым.
5.
Негізгі ұғымдар ментерминдер
Термодинамикалық
жүйе
деп
сыртқы
ортадан
интерфейс
арқылы бөлінген денелердің кез
келген жиынтығын айтады, оның
ішінде масса және жылу алмасу
мүмкін болады.
6.
Термодинамиканың негізгітүсініктері
Термодинамика энергияның бip түрден басқа түрлерше ауысу заңдылықтарын зерттейді
Химиялық термодинамика - химиялық реакциялар кезінде байқалатын энергияның бip
түрден басқа түрге айналуын, реакциялардың бағытын және олардың осы жағдайға
өздігінен жүру шегін, сонымен қатар химиялық тепе-теңдіктің болу жағдайларын
анықтайтын ғылым. Термодинамика жүйелерді, олардың ішкі энергиясының өзгерісін
зерттейді
Термодинамикалық жүйе дегеніміз - бір-бірімен әрекеттесу жағдайындағы және өзін
қоршаған ортадан ойша бөлінбеген бірнеше заттардың жиынтығы.
Жүйе - өзін қоршаған ортамен зат алмаспай тек энергиясымен ғана алмасса - жабық, ал
зат алмасуы да орын алса - ашық жүйе деп аталады.
Оқшауланған (изолированный) жүйеде - қоршаған ортамен зат және энергия алмасуы орын
алмайды.
7.
дәрі-дәрмекпен жабылған ампуладаЖүйелердің табиғаты бойынша жіктелуі
қоршаған ортамен өзара әрекеттесу
↔ энергия
массасы
↔ энергия
Жабық жүйе
ашық жүйе
(дәрі
(тірі организм)
дәрмекпен
жабылған
ампула )
Оқшауланған
жүйе
(термос)
8.
Химиялық термодинамиканың негізгі түсініктеріТермодинамикалық параметрлер – жүйенің күйін
анықтайтын физикалық шамалардың жиынтығы:
температура (t), қысым (р), көлем (V).
концентрациясы (c).
Термодинамикалық параметрлердің функционалдық
тәуелділігі күй теңдеуі арқылы өрнектеледі.
Газды жүйелер үшін бұл параметрлер бір-бірімен
Менделеев-Клапейрон теңдеуімен байланысты.:
p·V= n(х)·R·Т,
n(x) =m(x)/M(x) [моль]
R= 8,3 14 Дж · моль-1·К-1
9. Химиялық термодинамиканың негізгі түсініктері
Термодинамикалық параметрлерстандартты шарттарда анықталса
стандартты деп аталады.
Стандартты шарттарға
мыналар жатады:
t=250С немесе
Т= (t0С +273) = 298 К
р= 101,3 кПа = 1 атм
С(х) = 1 моль · дм-3
10. Химиялық термодинамиканың негізгі түсініктері
Термодинамикалық процесс –кем дегенде бір
термодинамикалық параметрдің
өзгеруімен жүретін жүйе күйінің
өзгеруі
11.
Термодинамикалық процесс кезінде күйпараметрлерінің қайсысы тұрақты болып
қалуына
байланысты
келесі
термодинамикалық процестер бөлінеді::
изотермиялық (Т = const),
изобаралық (р = const),
изохоралық(V = const),
адиабатикалық (Q= const).
12. Жүйе күйінің функциялары
Термодинамикада жүйеэнергиясының өзгеруін анықтау
үшін жүйе күйінің
термодинамикалық функциялары
деп аталатын әртүрлі
энергетикалық сипаттамалар
қолданылады.
13.
Термодинамикалық функциялар – бұлтікелей өлшеуге болмайтын және күй
параметрлеріне
тәуелді
айнымалы
шамалар.
Жүйенің
термодинамикалық
функцияларына мыналар жатады:
1. Ішкі энергия (U).
2. Энтальпия (Н).
3. Энтропия (S).
4 Гиббс энергиясы (тегін
энергия) (G).
14. Жүйе күйінің функциялары
1 Ішкі энергия (U)Жүйенің
ішкі
энергиясы
жүйені
құрайтын молекулалардың немесе
атомдардың
қозғалысының
кинетикалық энергиясынан, олардың
өзара әрекеттесуінің потенциалдық
энергиясынан және молекула ішілік
энергиясынан тұрады.
15.
15Ішкі энергия (U):
Ішкі энергияның абсолютті мәнін өлшеу мүмкін емес,
сондықтан оның өсімі өлшенеді: :
Uсистемы = Uсоң - Uбас
U-ның шексіз аз өзгерісі жалпы
дифференциал dU болып табылады.
16.
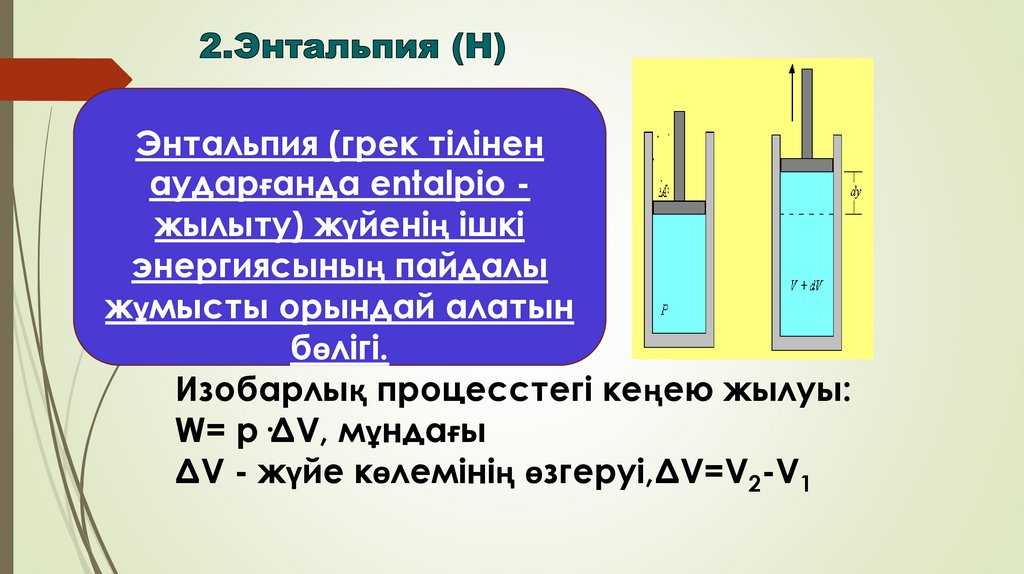
Энтальпия (грек тіліненаударғанда entalpio жылыту) жүйенің ішкі
энергиясының пайдалы
жұмысты орындай алатын
бөлігі.
Изобарлық процесстегі кеңею жылуы:
W= p·ΔV, мұндағы
ΔV - жүйе көлемінің өзгеруі,ΔV=V2-V1
17. Жүйе күйінің функциялары
Энтальпия – жүйефункциясы,
оның
изобарлық
процесте
түсетін жылуға тең.
күйінің
өсімі
жүйеге
Т.к. ΔН=Qр, => ΔН = ΔU + р·ΔV [кДж·моль-1]
Энтальпия жиі жүйенің «жылулық функциясы»
немесе «жылу мөлшері» деп аталады.
18.
Термодинамиканың бірінші заңы:Энергияның сақталу заңы
1 . Энергия жоғалмайды
, жоқтан пайда
болмайды, тек бір
түрден екінші түрге
қатаң эквивалентті
мөлшерде түрленеді.
2. Бірінші текті мәңгілік
қозғалыс машинасы
мүмкін емес.
Энергия жүйесі
Фармацевтикада бұл
жүйенің жалпы
энергиясына ішкі
энергия, жұмыс және
жылу кіреді дегенді
білдіреді.
Формула
Q = ΔU + W
,мұндағы \ΔU — ішкі
энергияның өзгеруі,
Q— жылу, W— жұмыс.
.
Бұл заңды түсіну ф армацевтикалық өндірістегі барлық
энергетикалық процестерді бақылау және оңтайландыру үшін өте
маңызды.
19.
Фармацевтикалық өндірістегі жылу эф ф ектілеріФармацевтикалық препараттардағы реакциялар не эндотермиялық (жылуды сіңіретін),
және экзотермиялық (жылу бөлетін) болуы мүмкін.
реакция түрлері
Мысалы, кейбір антибиотиктердің
синтезі экзотермиялық болуы мүмкін,
ал сублимация немесе лиоф илизация
процестері эндотермиялық.
Өлшеу
Жылу әсерлерін дәл өлшеу үшін
диф ф еренциалды сканерлеу
калориметриясы (DSC) және
диф ф еренциалды термиялық
талдау (DTA) сияқты
калориметриялық әдістер
қолданылады.
20.
Жүйе күйінің фнукцияларыЭкзотермиялық
процесс, ΔН<0
.
Эндотермиялық
процесс, ΔН>0
21.
ТермохимияӨзгерістерді зерттейтін ТД бөлімі
химиялық заттардың ағыны кезіндегі энергия
процестер термохимия деп аталады.
22.
Термохимияның негізі Гесс заңы болып саналады. Кейде оны реакцияжылулары қосындыларының тұрақтылығы туралы заң деп те атайды және ол
былайша тұжырымдалады: химиялық реакциялардың жылу эффектісі
реакцияға қатысатын жэне одан алынатын заттардың табиғаты және күйімен
анықталады да арадағы сатылай жүретін химиялық реакцияларға тәуелсіз,
яғни әуелгі күйден соңғыға ауысу әдісіне де байланысты емес.
Реакциялардағы жылу қосындысының тұрақтылығы туралы заңды 1836-1840
жылдарда жүргізген нақтылы тәжірибелері нәтижесінде Петербург
университетінің профессоры Г. И. Гесс тұжырымдаған.
Жылу эффектісінің шамасы бастапқы заттар мен реакция
өнімдерінің агрегаттық күйіне байланысты болады. Мысалы,
сутектің жануы нәтижесінде газ күйіндегі және сұйық күйдегі
өнімдер алынуы мүмкін. Осыған орай реакцияның жылу
эффектілері әртүрлі болады:
Н2(г) + 1/2О2 = Н2О(с) + 285851 Дж/моль
Н2(г) + 1/2О2. = НгО(г) + 241835 Дж/мол
23. 1-сурет
Гесс заңын көрнекті етіп түсіндіру үшін бастапқы заттар ретінде оттек пен көмірді (тазакөміртектен тұратын болса), ал реакция өнімі ретінде көмірқышқыл газын
қарастырайық (1-сурет).
Сұлбада көрсетілгендей көмірді тікелей СО2-ге дейін тотықтыруға болады. Осы
процесті алдымен көмірді көміртек (II) оксидіне дейін, соңынан көміртек (IV) оксидіне
дейін тотықтыру арқылы сатылап жүргізуге де болады. Екі жағдайда да жүйенің
бастапқы күйі (С, О2 ) мен соңғы күйі (СО2) бірдей.
Алғашқы процестің жылу эффектісі мынаған тең: С + О2 = С О2 + 409,2 кДж
Ал екінші процесс үшін: С + 1/2О2 = СО + 124,3кДж СО + 1/2О2 = СО2 + 284,9кДж
Жалпы қосындысы: 409,2кдж.
24. Гесс заңы
Заттың түзілу энтальпиясы(түзілу жылуы) – бұл заттың
1 мольі қарапайым
заттардан түзілгендегі
реакцияның жылу әсері,
былай белгіленеді:
ΔН(Х) [кДж · моль-1].
Калориметр
25. Гесс заңы
Стандарттыжағдайда
өлшенген
түзілу
энтальпиясы
стандартты
түзілу энтальпиясы деп аталады және
ол анықтамалық шама болып
табылады, былай белгіленеді:
ΔН0(Х) [кДж · моль-1].
Қарапайым заттар үшін стандартты
түзілу энтальпиясы - 0 тең.
ΔН0(қарапайым заттар) = 0
26. Гесс заңының бірінші салдары
Процестің жылу әсері өнімдердің түзілуэнтальпияларының алгебралық
қосындысынан реагенттердің түзілу
энтальпияларының алгебралық қосындысын
(олардың стехиометриялық коэффициенттерін
ескере отырып) алып тастағанға тең.
ΔН0проц. = ∑nΔН0(өнім) - ∑nΔН0(реаг),
ΔН0проц.[кДж ·моль-1].
27.
27CS2(к) +
ΔН0:
87.9кДж/моль
3O2(г) CO2(г) + 2SO2(г)
0 кДж/моль -393.5 кДж/моль -296.8 кДж/моль
Әрбір ΔН⁰ мәні теңдеудегі заттың моль
санына көбейтілуі керек.
28.
ΔН0:CS2(к) +
3O2(г) CO2(г) + 2SO2(г)
87.9кДж/моль
0 кДж/моль
-393.5 кДж/моль -296.8 кДж/моль
ΔН0проц.= ∑nΔН0(өнім.) - ∑nΔН0(реаг.)
ΔН0х.р. = [-393.5 + 2(-296.8)] - [87.9 + 3(0)]
ΔН0х.р. = -1073.4 кДж
Q = –∆Н, яғни термохимиялық реакцияның
жылу әсері термодинамикалық жылу
әсерінің абсолютті мәніне тең, бірақ белгісі
қарама-қарсы болады.
29. Гесс заңы
Жану энтальпиясы (жану жылуы) –заттың 1 мольінің жоғарғы
оксидтерге жану реакциясының
жылу әсері, былай белгіленеді:
ΔHжану(Х) [кДж · моль-1].
Калориметр
30. Гесс заңы
Стандартты жағдайда өлшенген жануэнтальпиясы стандартты деп аталады
және былай белгіленеді: ΔН0жану(Х)
[кДж · моль-1].
31.
Гесс заңының екінші салдары:Химиялық процестің жылу әсері реагенттердің жану
энтальпияларының алгебралық қосындысына тең,
өнімдердің жану энтальпияларының алгебралық
қосындысынан олардың стехиометриялық
коэффициенттерін ескере отырып алынып тасталады.
ΔН0проц. = ∑nΔН0жану(реаг.) -∑nΔН0жану(өнім),
[кДж · моль-1]
32.
Термодинамикалықзерттеу
әдісі
тірі
организмдердегі зат алмасу мен энергияны
зерттеудің ең сенімді тәсілдерінің бірі болып
табылады.
Тірі организмдерде
болатын энергия
түрленістері
биоэнергетиканың
пәні болып
табылады.
33. Тірі жүйелерді ұйымдастыру ерекшеліктері:
Биологиялық жүйелер ашықболып табылады.
Тірі жүйелердегі процестер
ақырында қайтымсыз болады.
Тірі жүйелер тепе- теңдік күйінде
болмайды.
Барлық биологиялық жүйелер
гетерогенді болып келеді.
34.
Түскен энергия мынаған жұмсалады:• Ішкі ағзалардың тыныс алу, қан айналымы, метаболиттерді тасымалдау,
сөлдерді бөлуге және т.б. қызметімен байланысты жұмыс атқаруға;
• Адамның барлық қозғалыстары мен еңбек қызметімен байланысты жұмыс
атқаруға;
• Ішке тартылған ауаны, қабылдаған суды және тағамды жылытуға жұмсалады
35.
Адамның энергияға жұмсайтыншығындары қамтамасыз етіледі:
• Көмірсулар есебінен 55-60%
• Майлар есебінен
20-25 %
• Ақуыздар есебінен 15-20%
36. Гесс заңы
Гесс заңы және оның нәтижелері ғылымидиетологияда қолданылады. Оның көмегімен тағам
өнімдерінің калориялылығы бағаланады.
Калория коэффициенті деп бір грамм заттың
жану реакциясының жылу әсерін, белгісі
қарама-қарсы алынған түрін айтады.
К= - ΔН0жану(Х)
37. Гесс заңы
Негізгі тағам компоненттерінің калориякоэффициенттері мынандай:
К (ақуыз және көмірсулар) = 16,5 – 17,2 кДж ·
г-1,
-1
К (майлар) = 37,7 – 39,8 кДж · г .
Бірінші мәні (16,5 и 37,7) – төменгі шекара.
Екінші мәні (17,2 - 39,8) – жоғарғы шекара.
38. Гесс заңы
Тағамның калориясын есептеу үшінформулалар қолданылады:
Төменгі шекара бойынша:
К = 16,5 m(а) + 16,5 m(к) + 37,7 m(м) [кДж]
Жоғарғы шекара бойынша:
К = 17,2 m(а) + 17,2 m(к) + 39,8 m(м) [кДж]
39. Гесс заңы
Тамақ өнімдерінің калориялығы туралы мәліметтернегізінде жынысына, жасына, еңбек сипатына
байланысты халықтың әртүрлі азаматтары үшін
оларды тұтынудың ғылыми негізделген нормалары
жасалады.
Бұл деректерді орташа мәндер ретінде пайдалана
отырып, дәрігер әр пациент үшін тағамдық заттарды
жеке тұтыну нормаларын жасайды
Ересек адамның тәуліктік тұтыну мөлшері:
Ақуыздар-80-100 г.
Майлар-60-70 г.
Көмірсулар-370-450 г.
40. Гесс заңы
Адамның күнделікті энергияға дегенқажеттілігі:
1. Орындықта отырып жеңіл жұмыс
жасағанда-8400-11700 кДж (2000-2800 ккал).
2.Орташа және қарқынды бұлшықет
жұмысы кезінде -12500-15100 кДж (3000-3600
ккал).
3. Ауыр физикалық жүктемелер кезінде16700-20900 кДж (4000-5000 ккал).
41.
Фармацевтикалық үдерістегіэнергия
Дәрі-дәрмек өндірісінің әр кезеңі
энергетикалық өзгерістермен қатар жүреді.
Жылу балансын түсіну — сапа мен
тиімділікті бақылаудың кілті.
Мысалы : белсенді заттардың еруі
Жылудың сіңірілуін немеет бөлінуін
бақылаймыз, бұл ерітіндінің тұрақтылығына
тікелей әсер етеді.
Жылу балансы
Еріту және кристалдану кезінде жылу балансын
диаграммасы осы процестерді
визуализациялауға көмектеседі
Маңызы
Термикалық әсерлерді дәл білу сапаны бақылау
және араластырудан кептіруге дейінгі барлық
технологиялық операцияларды оңтайландыру
үшін қажет.
42.
Термодинамиканың бірінші заңының өндіріс технологиясымен байланысыЖылу балансын ескере отырып, өндірістік
процестерді оңтайландыру өнімнің сапасын
едәуір жақсартуға және шығындарды азайтуға
мүмкіндік береді.
Кептіру және түйіршіктеу
Температура мен ылғалдылықты бақылау
белсенді заттардың бұзылуын болдырмау үшін
өте маңызды.
Таблетка жасау
Таблетка жасау кезінде бөлінетін қысым мен
жылу таблеткалардың беріктігіне және белсенді
заттың тұрақтылығына әсер етуі мүмкін.
Энергияны үнемдеу
Жылу режимдерін оңтайландыру энергия
тұтынуды азайтуға және сапалы өнім
шығаруды арттыруға әкеледі.
43.
НазарларыңызғаРахмет!








































 physics
physics








