Similar presentations:
Решение задач 1
1. Решение задач
Количество вещества. Моль.Молярная масса.
Молярный объём
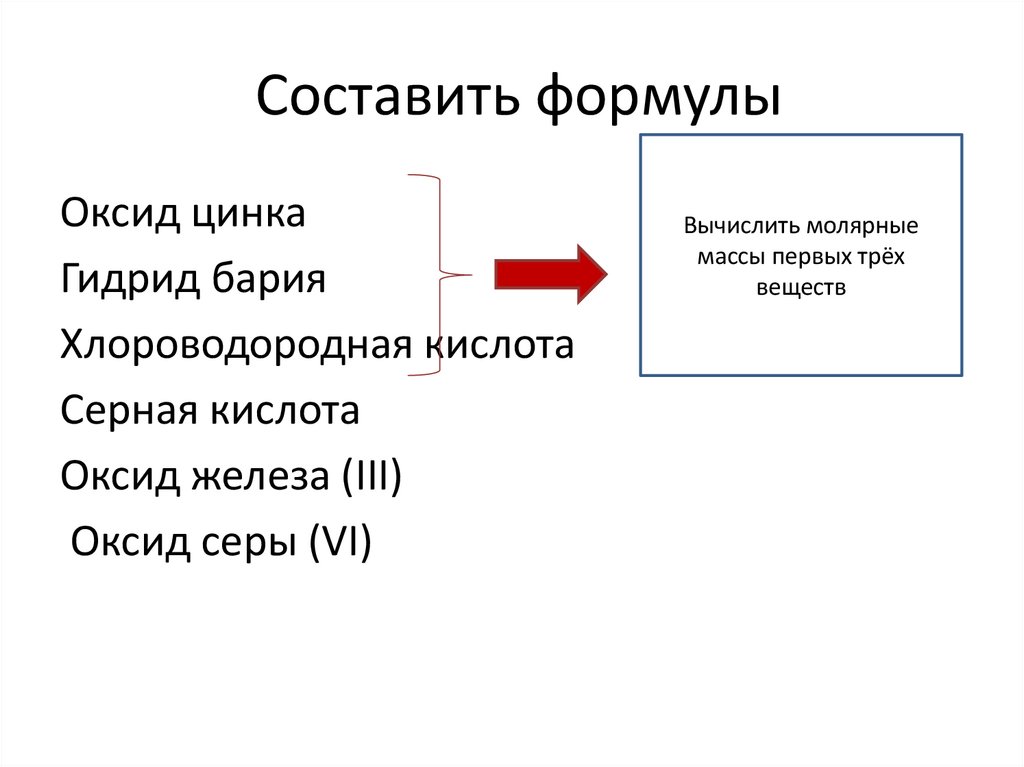
2. Составить формулы
Оксид цинкаГидрид бария
Хлороводородная кислота
Серная кислота
Оксид железа (III)
Оксид серы (VI)
Вычислить молярные
массы первых трёх
веществ
3. МОЛЬ – ЭТО ТАКОЕ КОЛИЧЕСТВО ВЕЩЕСТВА, В КОТОРОМ СОДЕРЖИТСЯ 6 ∙1023 ЧАСТИЦ (молекул или атомов) ЭТОГО ВЕЩЕСТВА.
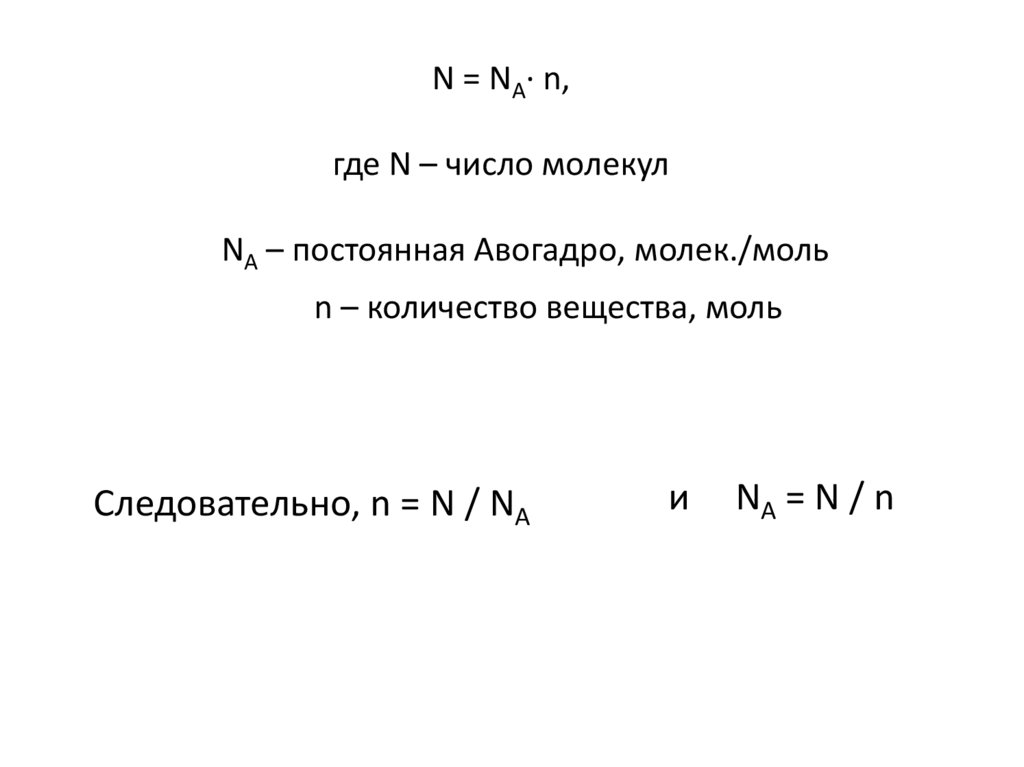
4. N = NA∙ n, где N – число молекул NA – постоянная Авогадро, молек./моль n – количество вещества, моль
Следовательно, n = N / NAи
NA = N / n
5. МАССА 1 МОЛЬ ВЕЩЕСТВА НАЗЫВАЕТСЯ ЕГО МОЛЯРНОЙ МАССОЙ, обозначается М и измеряется в г/моль.
6.
1 моль Fe весит 56гМ(Fe) = 56 г/моль
1 моль S весит 32г
M(S) = 32 г/моль
1 моль Na Cl весит 59г
M(NaCl) = 59 г/моль
1 моль CuSO4 весит 160г
M(CuSO4) = 160 г/моль
7.
n=m/Mи, следовательно, m = n ∙M
и M = m/n
8.
Задача 1.Найти массу 24 ∙1023 молекул озона.
Задача 2.
Сколько молекул содержится в 111г
оксида кальция CaO ?
9.
1. Сколько молекул кислорода содержится в 2 моль его?Какой объём будет иметь это количество кислорода?
2. Какую массу имеют 5 кмоль водорода?
Сколько молекул водорода содержится в этом его количестве?
3. Сколько весят 3∙1020 молекул воды?
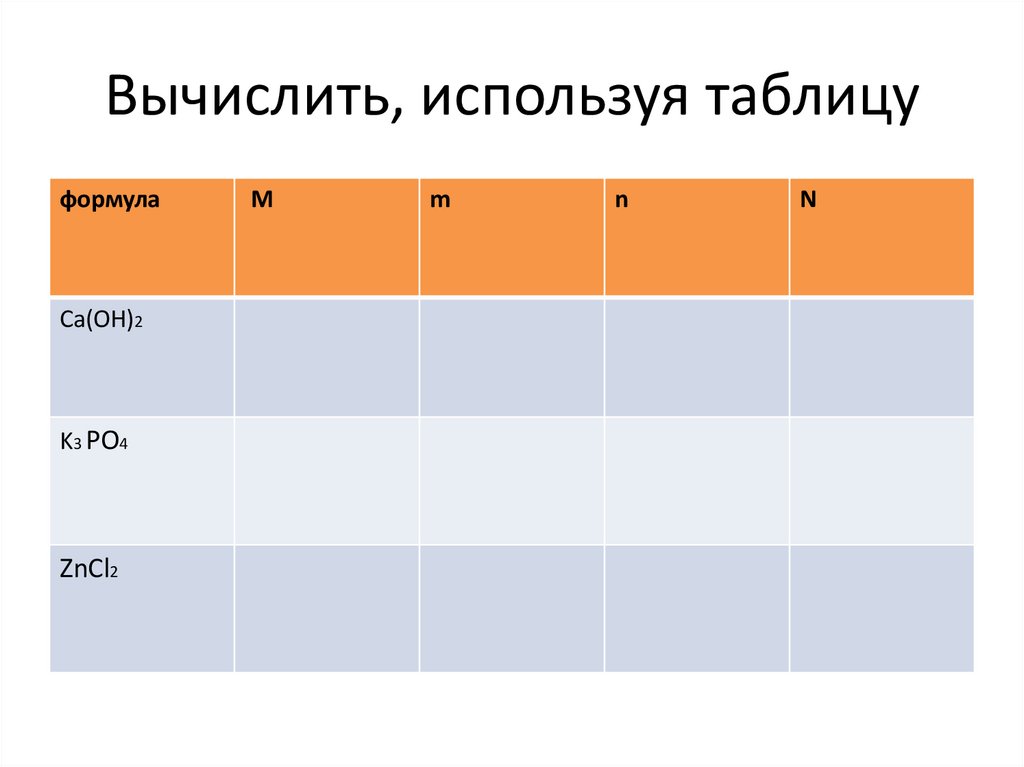
10. Вычислить, используя таблицу
формулаСa(OH)2
K3 PO4
ZnCl2
M
m
n
N
11. В реакцию с серной кислотой вступило 3,5 моль алюминия. Какая масса алюминия потребуется для данной реакции?
Дано:n(Al)=3.5 моль
Найти:
m(Al)-?
Ответ: m(Al) = 94.5г
12. Для получения воды нужно взять 134.4 г кислорода. Какое количество кислорода требуется для реакции?
Дано:m(O2)=134.4 г
Решение
Найти:
Ответ: n(O2) =4.2 моль
n(O2) - ?
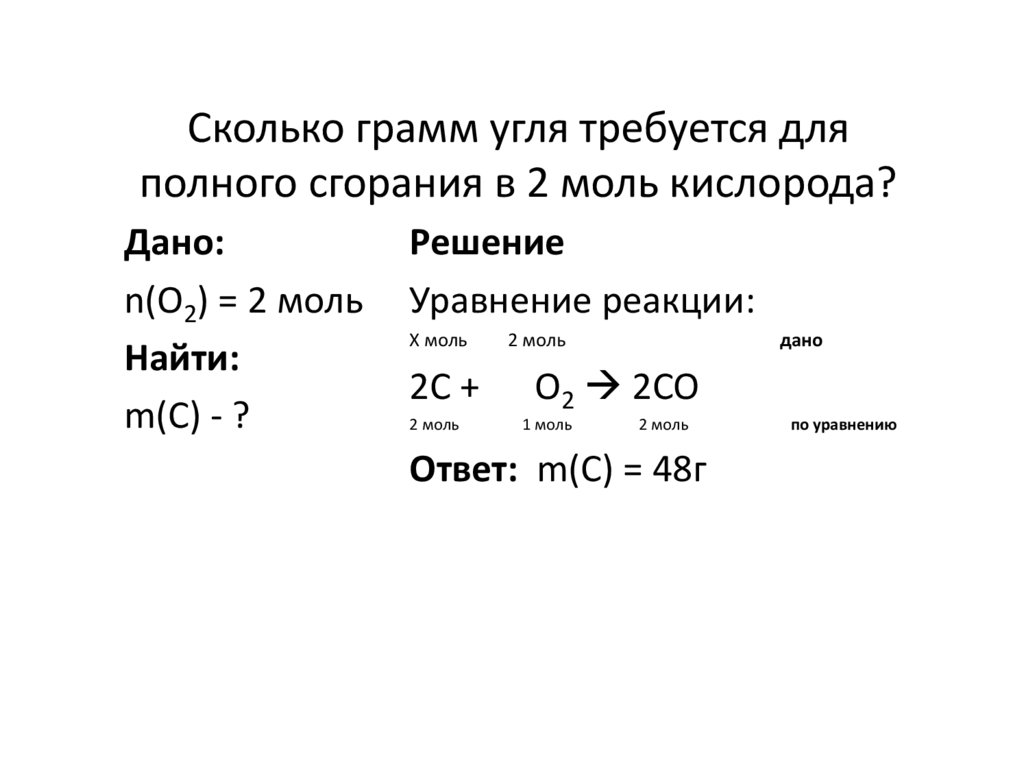
13. Сколько грамм угля требуется для полного сгорания в 2 моль кислорода?
Дано:n(O2) = 2 моль
Найти:
m(C) - ?
Решение
Уравнение реакции:
Х моль
2C +
2 моль
2 моль
дано
O2 2CO
1 моль
2 моль
Ответ: m(C) = 48г
по уравнению
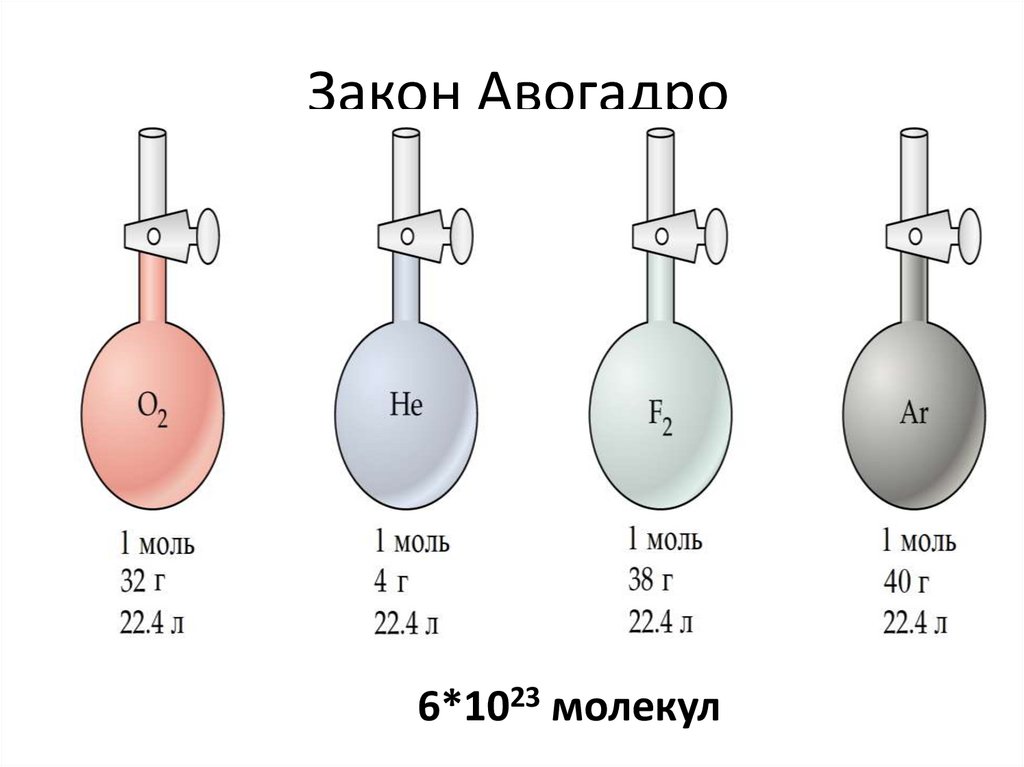
14. Закон Авогадро
В начале 19в итальянский учёный Амедео Авогадропроводил множество опытов с газами, измерял их
объёмы, температуры, высчитывал количество молекул.
Однажды, взвешивая одинаковые объёмы двух газов, он
высчитал, что они содержат одинаковое число молекул
(хотя масса была разной)
Так, 22,4л кислорода содержали 6*1023 молекул газа
Столько же молекул содержалось в 22,4л водорода, азота,
озона и т.д.
Оказалось, что 1 моль любого газа при одинаковых
условиях (нормальные условия = 0оС и 1атм) занимает
22,4л
15. Закон Авогадро
6*1023 молекул16. Закон Авогадро
Новая величина была названа «молярным объёмом»Vm= 22,4 л/моль и работает для всех газов, взятых
при н.у. (нормальных условиях)
Закон: «В равных объёмах различных газов при
одинаковых условиях содержится одинаковое число
молекул»
Так, в 1л кислорода O2 столько же молекул, сколько в
1л водорода H2 Сколько?
22,4л - содержится 6*1023 молекул
1л - х молекул
X=?
17. ФОРМУЛА
V = Vm * nКакой объём занимает 5 моль кислорода? 3
моль хлора Cl2?
V(O2) = 22,4 л/моль * 5 моль = 112 л
V(Cl2) = 22,4 л/моль * 3 моль = 67,2 л












 chemistry
chemistry








