Similar presentations:
Количественные отношения в химии
1. Практическое занятие 3. Количественные отношения в химии. Основные количественные законы в химии и расчеты по уравнениям
химических реакций. Моль как единицаколичества вещества. Молярная масса.
Законы сохранения массы и энергии. Закон
Авогадро. Молярный объем газов.
Относительная плотность газов. Расчеты
по уравнениям химических реакций с
использованием массы, объема
(нормальные условия) газов, количества
вещества
2.
Какие физические величиныможно использовать для
определения меры
веществ?
В каких единицах
измеряются эти физические
величины?
3.
Лкг
Л
М
4.
1 карат = 0,2 г1 баррель нефти
=158,988 л
5.
Порции6. Можно ли найти число частиц в порции вещества?
?7.
В основе всех количественных химических расчетов лежатнесколько основных законов химии.
1. Закон сохранения массы (материи) (Ломоносов-Лавуазье,
1756; 1785 гг).
Современная формулировка этого закона такова: «Масса
реагентов равна массе продуктов реакции». Общая масса
участников реакции остается неизменной.
Масса вещества в системе СИ измеряется в килограммах, в химической практике –
в мг, г, в химической технологии – в тоннах (т).
2. Закон постоянства состава (Пруст, 1799)
«Всякое чистое вещество независимо от способа его получения
всегда имеет постоянный качественный и количественный
состав».
3. Закон кратных отношений (Дальтон, 1803 )
«Если два элемента образуют несколько соединений, то массы
одного элемента, приходящиеся на одну и ту же массу атомов
другого элемента, относятся между собой как небольшие целые
числа»
8.
4.Закон простых объемных отношений (ГейЛюссак,1808)«Объемы вступающих в реакцию газов
относятся друг к другу, а также к объемам
образующихся газообразных продуктов реакции,
как небольшие целые числа.»
Например, в реакции синтеза хлороводорода из
элементов, протекавшей по уравнению:
1 моль 1 моль 2 моль
Н2 +
Сl2 = 2НС1
22.4 л 22.4 л 2 ∙ 22.4 л
один объем водорода реагирует с одним объемом хлора
и образуется два объема хлороводорода (при
одинаковых условиях) V(Н2) : V(Сl2) :V(НС1) = 1 : 1 : 2.
9.
Закон Авогадро: в равных объёмах различных газов приодинаковых условиях (температуре и давлении) содержится
одинаковое число молекул. (1811 г, итальянский учёный Амедео
Авогадро)
Следствия из закона Авогадро:
Следствие 1. Моль любого газа при нормальных условиях
занимает один и тот же объем, равный приблизительно 22,4 л.
Этот объем называется молярным объемом и обозначается Vm
Vm= 22,4 л/моль = 22,4 м3/кмоль.
Следствие 2: Отношение масс одинаковых объёмов различных
газов при одинаковых условиях равно отношению их молярных
масс (поскольку в равных объёмах газов при одинаковых условиях
содержится одинаковое число молекул и, следовательно,
одинаковое число молей)
Это отношение называется относительной плотностью D
( или d) одного газа по другому.
D – показывает во сколько раз один газ тяжелее или легче
другого и является безразмерной величиной.
10.
Например,DO2 (газа)= Mr(газа)/Mr(O2)=Mr(газа)/32;
DH2 (газа)= Mr(газа)/Mr(H2)=Mr(газа)/2;
Dвоздуха (газа)= Mr(газа)/Mr(воздуха)=Mr(
газа)/29
11.
12.
Моль от французского слова «moles»множество1 Моль – это количество вещества,
в котором содержится 6,02 ∙1023 частиц
13.
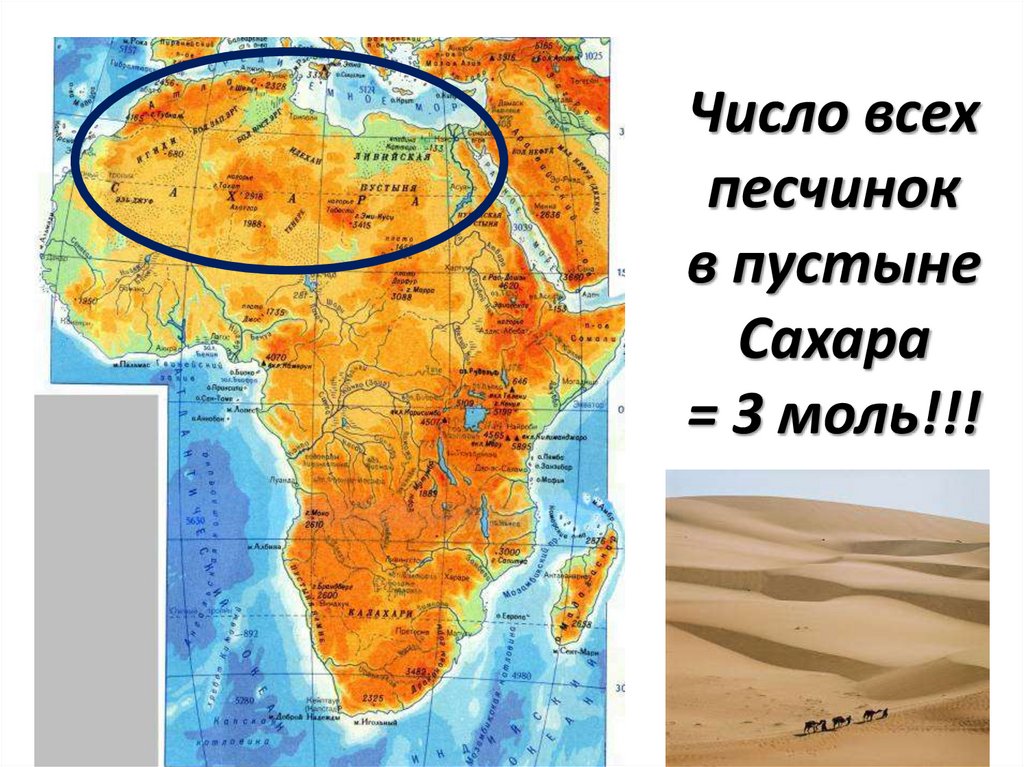
Число всехпесчинок
в пустыне
Сахара
= 3 моль!!!
14.
15. Число Авогадро больше числа всех капель воды на Земле
Н2 О16. Количество вещества
Обозначение:ν (ню), или n
Единица измерения:
моль
17.
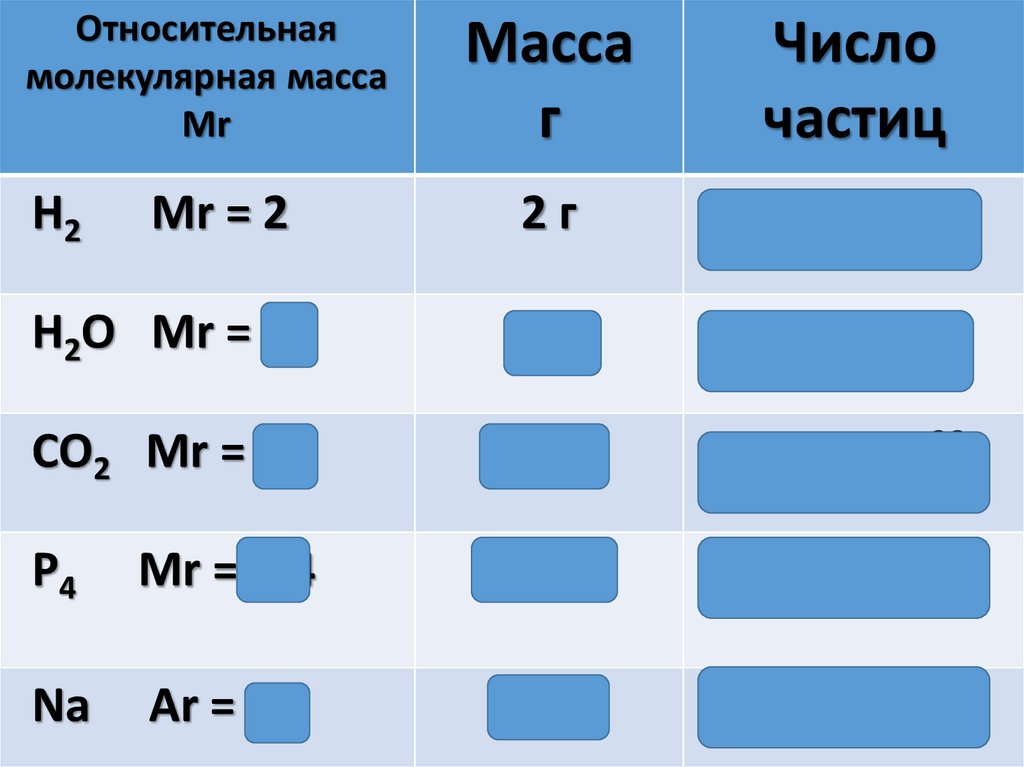
Относительнаямолекулярная масса
Mr
Масса
г
Число
частиц
Mr = 2
2г
6,02 ∙1023
H2O Mr = 18
18 г
6,02 ∙1023
CO2 Mr = 44
44 г
6,02 ∙1023
P4
Mr =124
124 г
6,02 ∙1023
Na
Аr = 23
23 г
6,02 ∙1023
H2
18.
1 моль вещества – 6,02∙1023частицСколько частиц содержат 3 моль вещества?
3 ∙ 6,02∙1023 = 18,06∙1023
Сколько частиц содержат 0,5 моль вещества?
0,5 ∙ 6,02∙1023 = 3,01∙1023
19.
В общем виде:N = n ∙ NA
N – число частиц
n – количество вещества
NA – число Авогадро
20.
Молярная масса (М) –это суммарная масса всех
частиц, входящих в 1 моль
вещества.
[ Mr = M ]
Mr(H2O)= 18
M(H2O)= 18 г/моль
21. Можно ли найти массу, зная количество вещества?
22.
n = m/Mm=n∙M
23.
Что тяжелее:1 моль атомов кислорода
или 1 моль атомов фосфора?
Почему?
M(O) = 16 г/моль
M(P) = 31 г/моль
24.
Задача.Найти массу 3 моль атомов серы
Дано
n (S) = 3моль
M(S) = 32 г/моль
Найти m(S)
Решение
m=n∙M
m = 3 ∙ 32 = 96 (г)
Ответ: m(S) = 96 г
25.
Равные массы, но разныеобъемы, потому что ....
m = V∙ ρ
26.
1 моль любого газа (н.у.)занимает объем 22,4 л
Vm = 22,4л/моль
27.
n = V/VmV = n ∙ Vm
28.
m= n ∙ MV=n∙V
N = n ∙ NA
m
Выучить!!!
29.
Сколько ложек сахарного пескавы кладете в чашку чая?
Рассчитайте:
1) какое количество сахарозы
вы выпиваете с чаем;
2) сколько молекул сахарозы (C12H22O11)
содержится в этом количестве, если
в 1 чайной ложке
примерно 5 г сахарозы.
30.
Пример 1. Найдите количество вещества воды, котороенаходится в 200 г воды.
Дано: m(H2O) = 200г
Решение: n = m/M
Найти : n(H2O)
M(H2O) = 1*2 + 16 = 18г/моль
n = 200 г/18 г/моль = 11,1 (моль)
Ответ: n = 11,1 моль
Пример 2. Найдите массу 5 моль кислорода (О2).
Решение:
Дано: n( О2) = 5 моль
Преобразуем формулу:
Найти: m(O2)
m = n*M
М(О2) = 2*16=32 г/моль
m(O2) = 5 моль *32г/моль = 160 г
Ответ: m(O2) = 160 г
1) Найдите количество вещества, которое находится в 10 г
водорода Н2.
2) Найдите массу 5 моль мела СаСО3
31.
Алгоритм решения задач по химическим уравнениямСпособ 1. «По количеству вещества»
1шаг:Прочитай задачу. Определите массу кислорода необходимого для сжигания 8 грамм магния.
2 шаг: Запиши дано задачи, найти, молярные массы веществ, используя соответствующие
обозначения.
m (Мg)=8 г
m (02)=?
M (Мg) = 24г/моль
M (02) = 32г/моль
3 шаг: Составь уравнение реакции: 2Мg + 02 = 2 Мg0
4 шаг: Найди количество известного вещества по формуле
n=m:М
n(Мg)= m (Мg): M(Мg)= 8г:24г/моль= 0,33 моль
5 шаг: Поставь полученное количество вещества над формулой вещества, над формулой
неизвестного поставь х
0,33 моль
х моль
2Мg
+
02
= 2Мg0
6 шаг: Под формулами веществ запиши количество вещества необходимых для реакции:
0,33 моль
х моль
2Мg
+
02 = 2МgО
2 моль
1 моль
7 шаг: Составь пропорцию и реши ее:
0,33 моль - х моль
2 моль - 1 моль х=0,167 моль
8 шаг: Найди массу неизвестного вещества по формуле m=М· n
m (02)= М (02) · n (02) = 0,167 моль ·32 г/моль=5,344 г
9 шаг: Запиши ответ: масса кислорода 5,344 г.
32.
Способ 2. «По массе вещества»1 шаг: Прочитай задачу. Определите массу кислорода необходимого для сжигания 8 грамм магния.
2 шаг: Запиши дано задачи, найти, молярные массы веществ, используя соответствующие
обозначения.
m (Мg)=8 г
m (02)=?
М (Мg) = 24г/моль
М(02) = 32г/моль
3 шаг: Составь уравнение реакции 2Мg + 02 = 2 МgО
4 шаг: Над формулой известного вещества записать массу, над формулой неизвестного вещества
поставить х г.
8г
хг
2Мg + 02 = 2 МgO
5 шаг: Под формулами веществ, о которых идет речь, записать массы веществ, рассчитанные по
формуле m= M· n, где n- коэффициент перед формулой вещества:
8г
хг
2Мg + 02 = 2 МgO
48 г
32 г
6 шаг: Составь пропорцию и решите ее:
8г-хг
48 г - 32 г m(02)=х = 5,34г
7 шаг: Запиши ответ: масса кислорода 5,34 г
33.
Задачи1.Определите массу железа необходимого для
получения 43,5 г хлорида железа (ІІІ).
2.Определите массу углекислого газа, который
образуется при сгорании 36 г угля (углерода).
3.Определите, какая масса кальция
понадобится для получения оксида кальция,
массой 140 г.
Ca +O2 → CaO
34.
4. Какой объем водорода (н.у.) выделится, еслив реакцию вступает 4 моль алюминия с серной
кислотой. Al + H2SO4 →Al2(SO4)3+H2
5. Вычислите, какое количество вещества
магния необходимо взять для полного его
соединения с 4 г серы? Mg + S→ MgS
6. Какой объем водорода (н.у.) выделится, если
в реакцию вступает 54 г алюминия с серной
кислотой. Al + H2SO4 →Al2(SO4)3+H2
35.
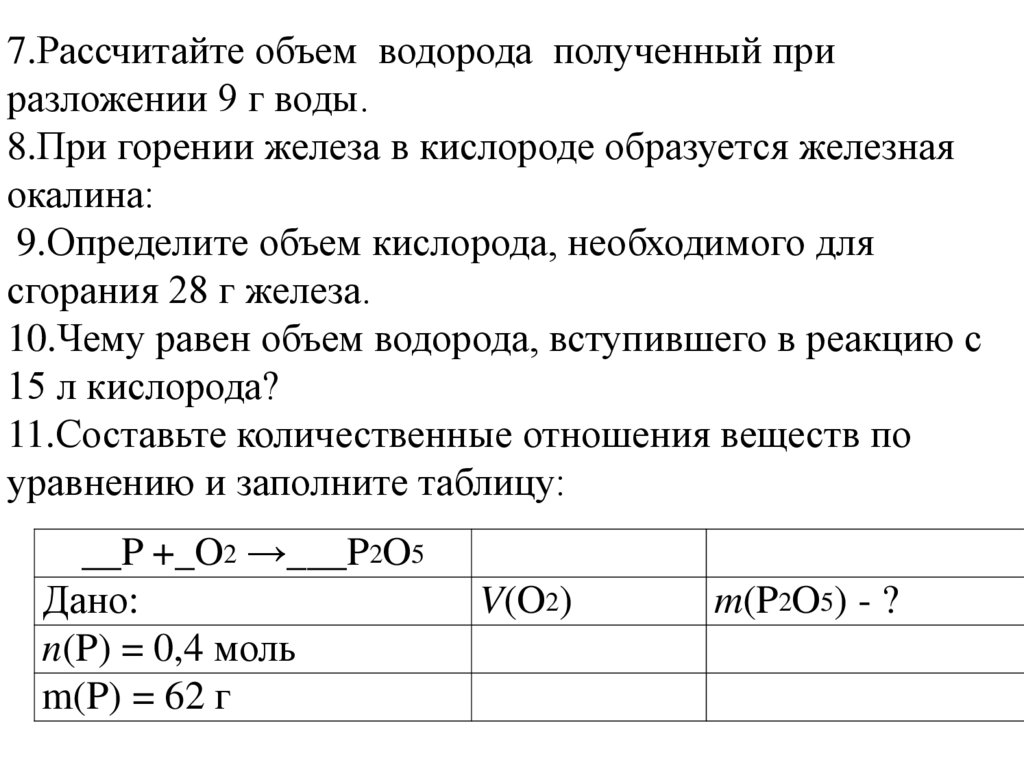
7.Рассчитайте объем водорода полученный приразложении 9 г воды.
8.При горении железа в кислороде образуется железная
окалина:
9.Определите объем кислорода, необходимого для
сгорания 28 г железа.
10.Чему равен объем водорода, вступившего в реакцию с
15 л кислорода?
11.Составьте количественные отношения веществ по
уравнению и заполните таблицу:
__P +_O2 →___P2O5
Дано:
n(P) = 0,4 моль
m(P) = 62 г
V(O2)
m(P2O5) - ?
36.
Относительной плотностью газа называютотношение молярных масс (плотностей) двух
газов. Она показывает, во сколько раз одно
вещество легче/тяжелее другого.
D = M (1 вещества) / M (2 вещества).
37.
38.
Относительная плотность газа по водородуравна 8. Требуется рассчитать молярную
массу газообразного вещества.
Решение
Газ с такой молярной массой — метан CH4.
Ответ: 16 г/моль
39.
Найдите относительную плотность газа N2 по воздуху?Дано:
N2
М(воздуха) = 29
Решение:
Dвоздуха (N2)= Mr(N2)/Mr(воздуха)=Mr(N2)/29.
Mr(N2) = 2·Ar(N) = 2· 14 = 28 г/моль
Dвоздуха (N2)=
Mr(N2)/Mr(воздуха)=Mr(N2)/29=28/29= 0,97
Найти:
Dвоздух - ?
Ответ: газ азот легче воздуха в 0,97
раз Dвоздуха (N2)= 0,97
Задачи для самостоятельного решения
1.Найдите относительную плотность газа О2 по водороду?
2.Найдите относительную плотность газа СО2 по воздуху?
3.Относительная плотность газа этана по водороду равна 15.
Найдите молярную массу этана.
4.Найдите относительную плотность газов по воздуху
следующих газов: О2, Аr.
40.
На территории г. Донецка и Донецкой области существуютхранилища химических веществ, представляющих угрозу жизни и
здоровья человека в случае их утечки в результате техногенной
аварии либо нарушения целостности ёмкости. Это хранилища
аммиака на предприятии «Стирол» в г. Горловке и хлора на
Донецкой фильтровальной станции. Кроме того, опасность
представляет и угарный газ, образующийся при пожаре.
Используя знания, полученные на этом занятии, определите
относительную плотность этих газов по воздуху и дайте
обоснованные рекомендации по поиску укрытия с целью
предотвращения отравления ими населения.
Вывод:
1) При оповещении об утечке хлора прячемся … (на чердаке).
2) При оповещении об утечке аммиака прячемся … (в подвале).
41.
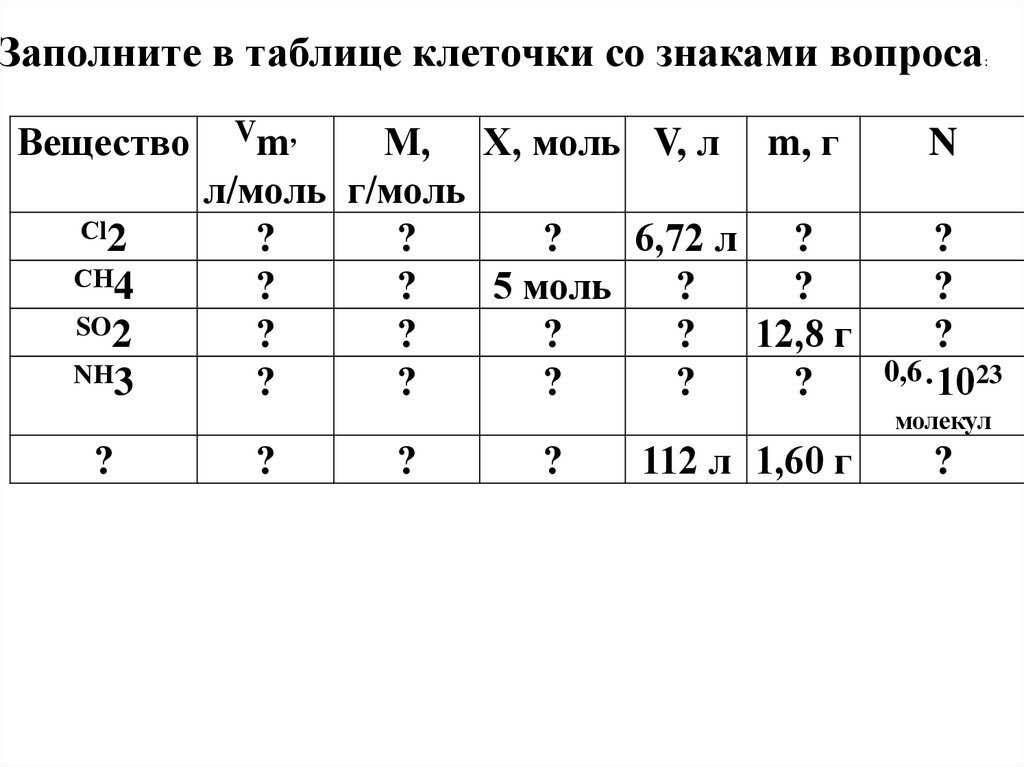
Заполните в таблице клеточки со знаками вопросаВещество
Сl2
СН4
SO2
NH3
М, Х, моль V, л m, г
л/моль г/моль
?
?
?
6,72 л ?
?
?
5 моль
?
?
?
?
?
? 12,8 г
?
?
?
?
?
V m,
:
N
?
?
?
0,6·1023
молекул
?
?
?
?
112 л 1,60 г
?

























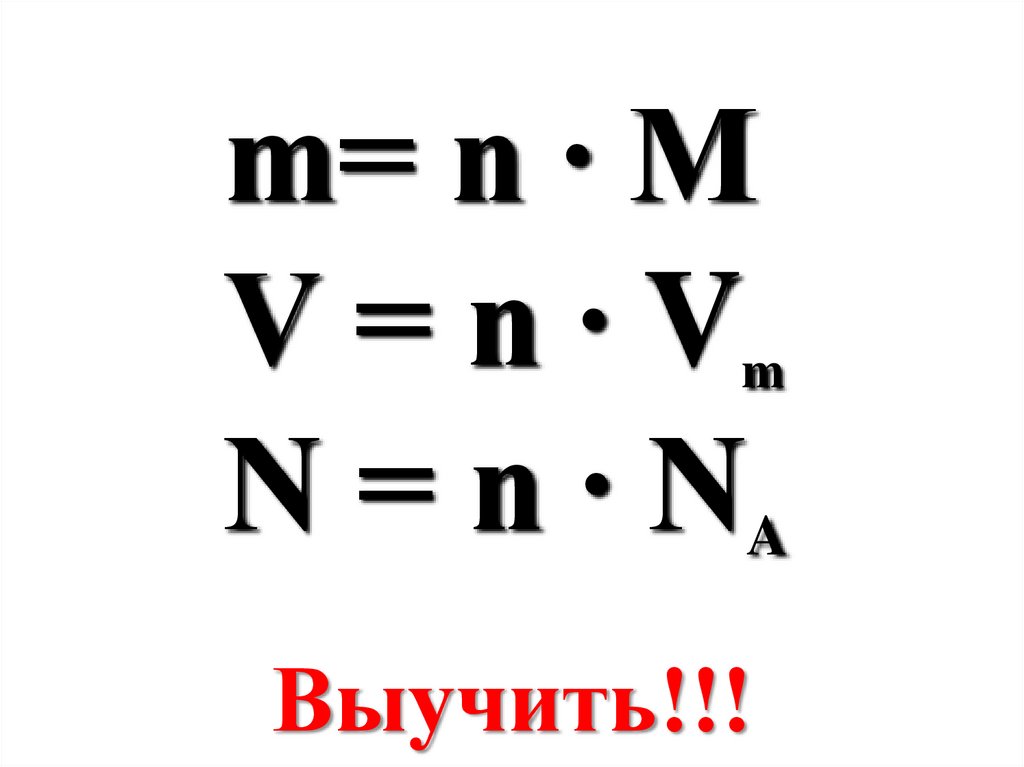












 chemistry
chemistry








